Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión impresa ISSN 0375-0760
Rev Cubana Med Trop vol.64 no.2 Ciudad de la Habana Mayo-ago. 2012
ARTÍCULO ORIGINAL
Evaluación del medio cromogénico CromoCen® ENT para el diagnóstico clínico de Enterococcus
MSc. Marilyn Díaz Pérez,I Lic. Yaidelys Iglesias Torrens,II Dra. C. Raisa Zhurbenko,I Dra. C. Dianelys Quiñones PérezIII
I Centro Nacional de Biopreparados (BioCen). Mayabeque, Cuba.
II Empresa Laboratorios AICA. La Habana, Cuba.
III Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba.
RESUMEN
Introducción: la frecuente incidencia de Enterococcus en los hospitales y su creciente resistencia antimicrobiana a nivel mundial, ha incrementado la necesidad de su vigilancia y control intrahospitalario, por lo que resulta imprescindible contar con medios diagnósticos más sensibles y exactos.
Objetivo: ampliar la evaluación de la funcionalidad del medio cromogénico CromoCen® ENT para el aislamiento e identificación de Enterococcus spp. procedentes de muestras clínicas.
Métodos: se analizaron 150 muestras clínicas (orina, sangre, fecales, exudados vaginales, exudados de lesiones de piel y de catéteres) desde enero hasta abril de 2010, empleando el medio cromogénico y los medios convencionales correspondientes como controles, se evaluó la incidencia de Enterococcus spp. Se identificaron los aislamientos con un conjunto de 12 pruebas bioquímicas. A partir de los datos de la identificación bioquímica se determinaron los indicadores de calidad tanto para el medio CromoCen® ENT como para los medios de referencia.
Resultados: el medio cromogénico promovió el crecimiento de Enterococcus spp. en solo 24 h, lo cual permitió su fácil reconocimiento por la coloración rosada de las colonias. Los indicadores de calidad diagnóstico mostraron valores superiores a 95 %. El mayor porcentaje de aislamientos se obtuvo en las muestras de orina. Enterococcus faecalis resultó la especie mayormente encontrada en el total de las muestras.
Conclusiones: CromoCen® ENT permitió la correcta y rápida identificación de Enterococcus spp. procedentes de diversas muestras clínicas.
Palabras clave: Enterococcus, medio cromogénico, muestras clínicas, aislamientos.
ABSTRACT
Introduction: the frequent incidence of Enterococci at hospitals and their growing antimicrobial resistance worldwide make the in-hospital surveillance and control a pressing need; consequently, it is indispensable to avail of more sensitive and accurate diagnostic means.
Objective: to broaden the evaluation of functionality of CromoCen® ENT chromogenic medium for the isolation and identification of Enterococcus spp. from clinical samples.
Methods: one hundred and fifty clinical samples were analyzed (urine, blood, feces, vaginal smears, skin lesion exudates and exudates from catheters) in the January-April period, 2010 by using the chromogenic medium and the corresponding conventional culture media as controls; the incidence of Enterococcus spp was evaluated. The isolations were identified with 12 biochemical tests. From the biochemical identification data, it was possible to determine the quality indicators for both CromoCen® ENT and the reference media.
Results: the chromogenic medium encouraged the growth of Enterococcus species in 24 hours, allowing their easy recognition due to the pink coloration of the colonies. The diagnostic quality indicator values were over 95 %. The highest percentage of isolates was observed in the urine samples. Enterococcus faecalis was the mostly found species.
Conclusions: CromoCen® ENT allowed quick and accurate identification of Enterococcus spp. from various clinical samples.
Key words: Enterococcus, chromogenic medium, clinical samples, isolates.
INTRODUCCIÓN
Enterococcus es considerado un patógeno nosocomial de gran importancia que puede causar una gran variedad de infecciones en el hombre.1
El sistema de vigilancia mundial de Enterococcus spp. reporta alta incidencia de las enfermedades ocasionadas por estos microorganismos, así como su resistencia creciente a múltiples agentes antimicrobianos.2
Existen varios medios de cultivo para diferentes propósitos, tanto convencionales como cromogénicos o fluorogénicos, específicos para el género Enterococcus; sin embargo, a pesar de ser selectivos para este género, en la mayoría de ellos pueden crecer especies pertenecientes a otros géneros, que muchas veces no pueden diferenciarse de Enterococcus.3
Resulta de vital importancia contar con medios diagnósticos más sensibles y exactos que permitan la identificación rápida y específica de estos microorganismos clínicamente, para prescribir un tratamiento eficaz que logre un efecto bactericida y evitar, de este modo, su transmisión en el ambiente intrahospitalario.
En el Centro Nacional de Biopreparados se desarrolló el medio cromogénico CromoCen® ENT para el aislamiento, recuento e identificación rápida de Enterococcus en muestras clínicas, basado en la detección de la actividad glucosidasa presente en estos microorganismos. Este diagnosticador se evaluó con anterioridad en diferentes muestras clínicas en 3 hospitales de La Habana, con un resultado confiable y en menor tiempo, en comparación con los medios convencionales.4 Estos resultados formaron parte del expediente de registro sanitario de ese medio de cultivo en Cuba.5
El objetivo del presente trabajo consistió en ampliar la evaluación de la funcionalidad del medio cromogénico CromoCen® ENT para el aislamiento e identificación de especies de Enterococcus de diferentes muestras clínicas, procedentes de 4 instituciones hospitalarias de La Habana.
MÉTODOS
Muestras clínicas: se analizaron 150 muestras clínicas, sospechosas de la presencia de Enterococcus, procedentes de las consultas externa e interna de 4 instituciones hospitalarias de La Habana, en el período comprendido desde enero hasta abril de 2010 (tabla).
Los análisis de muestras fecales se incluyeron con el objetivo de evaluar la selectividad del medio en muestras de composición variable y con contaminación polimicrobiana abundante.
Las muestras se inocularon en el medio cromogénico CromoCen® ENT (lote 8011000, BioCen), distribuido en las 4 instituciones y, en paralelo, en los medios convencionales correspondientes empleados como referencia: medio CLED para las muestras de orina, agar sangre para los exudados, agar chocolate para las muestras de exudados vaginales, agar S.S., agar de MacConkey y caldo selenito para las muestras fecales, todos estos medios procedentes de BioCen, Cuba; así como medio tioglicolato (Biolife, Italia) para las muestras de exudados de lesiones, según los procedimientos establecidos para cada tipo de muestra.6,7 La incubación se realizó durante 18 a 24 h a 35 ± 2 ºC y posteriormente se observó el color de las colonias aisladas o la presencia de turbiedad en los caldos.
Identificación presuntiva: posterior a la incubación, se analizaron las características culturales (forma, color, textura, tamaño) de las colonias sobre cada medio y se realizó la descripción detallada de las colonias de interés para su posterior identificación bioquímica. Las colonias que mostraron coloración de rosado claro a oscuro en el medio cromogénico se consideraron típicas y se identificaron como Enterococcus spp., de manera presuntiva; el resto se consideró no típicas.
Identificación confirmativa: en cada muestra analizada y en cada medio de cultivo, donde se observó crecimiento, se seleccionaron aleatoriamente colonias con características típicas del género de interés y colonias con características diferentes a las de estos microorganismos, para su posterior identificación. Se analizaron 169 colonias típicas y no típicas, de ellas, 91 provenientes de CromoCen® ENT y 78 de los medios controles, que se inocularon en el medio agar cistina tripticasa (BioCen) para la identificación; la cual se ejecutó en BioCen por un conjunto de 12 pruebas bioquímicas hasta el nivel de género y en algunos casos hasta especie: catalasa, citocromo oxidasa, crecimiento en 6,5 % de cloruro de sodio, crecimiento a pH 9,6 y a 45 ºC, fermentación de glúcidos (D-sorbitol, D-manitol), dihidrólisis de la arginina, fermentación del piruvato, hidrólisis de la bilis-esculina y crecimiento en el medio Chromocult® para Enterococcus (lote VM194094406, Merck, Alemania).8 La prueba de hidrólisis del PYR (O.B.I.S. PYR, lote 933701, Oxoid, Inglaterra,) se realizó adicionalmente a algunas colonias para su confirmación. Se utilizaron medios de cultivo deshidratados de BioCen y reactivos comerciales de Merck y AppliChem (Alemania).
Procesamiento de los resultados: las colonias rosadas confirmadas como Enterococcus spp. se consideraron como verdaderos positivos (VP) y aquellas con esta misma descripción pero identificadas bioquímicamente como no Enterococcus spp. se consideraron falsos positivos (FP). A partir de los datos de la identificación bioquímica se determinaron, tanto en el medio CromoCen® ENT como en los medios de referencia, la sensibilidad (S), especificicidad (E) y exactitud (ED) diagnósticas para cada tipo de muestra, así como para el total de estas, según las ecuaciones descritas por Havelaar y otros.9
RESULTADOS
Muestras de orina
En 36 de las 83 muestras de orina analizadas se aislaron diferentes especies de Enterococcus, lo que representa 43,4 % respecto a todos los aislamientos. De igual modo, el medio CromoCen® ENT permitió el crecimiento de otros microorganismos grampositivos, que se aislaron en menor proporción, como Staphylococcus spp. y Streptococcus spp., no siendo así para microorganismos gramnegativos como Escherichia coli y Citrobacter spp. que se inhibieron totalmente debido al poder selectivo del medio frente a estos microorganismos.
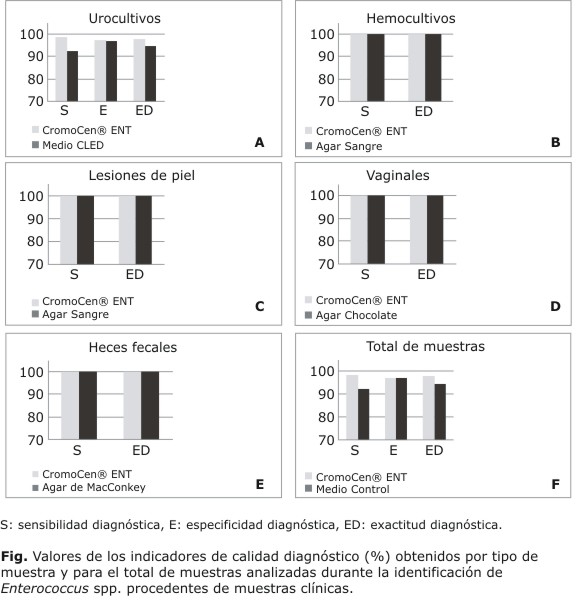
El medio cromogénico mostró elevados valores de los indicadores de calidad diagnósticos para las muestras de orina (S [97,4 %], E [100 %] y ED [98,8 %]), superiores con respecto a los obtenidos en el medio CLED, empleado como control (S [94,1 %], E [97,6 %] y ED [96,0 %]) (Fig. A).
Muestras de sangre
En las 23 muestras de sangre analizadas se obtuvo una incidencia relativamente baja de Enterococcus spp. (4,3 %), porque solo se aisló la especie Enterococcus dispar en una de las muestras.
El medio cromogénico evaluado promovió el crecimiento de otros patógenos grampositivos presentes en estas muestras como Staphylococcus spp. y Micrococcus spp.; también se aislaron otros microorganismos, de coloración blanca, que fueron identificados por las pruebas bioquímicas como no Enterococcus.
La cepa de Micrococcus sp. aislada exhibió una coloración rosada sobre CromoCen® ENT, resultando ser un falso positivo, que pudo descartarse porque el patrón bioquímico que mostró fue diferente al de Enterococcus spp. y se correspondió con las especies Micrococcus roseus o Micrococcus agilis.
Los valores de los indicadores de calidad diagnóstica obtenidos en el medio cromogénico (S [100 %], E [94,1 %]) y ED [94,4 %]) de las muestras de sangre fueron superiores a los alcanzados con el medio control agar sangre (E [100 %) y ED [86,7 %]) (Fig. B).
Muestras de exudados de lesiones de piel
De las 16 muestras de exudados de lesiones de piel ensayadas, 5 resultaron ser positivas para Enterococcus spp., lo que representa 31 % de los aislamientos. En una de estas muestras se detectó la presencia de M. agilis, microorganismo que produjo colonias de coloración rosada sobre el medio cromogénico y que mostró un patrón bioquímico muy diferente al de Enterococcus spp., constituyendo ser otro falso positivo.
Los valores de los indicadores de calidad diagnóstica obtenidos en el medio cromogénico [S (100 %), E (90,9 %) y ED (93,8 %)] y en el medio control agar sangre [S (100 %), E (90,9 %) y ED (92,9 %)] para las muestras de las lesiones de piel resultaron similares (Fig. C).
Muetras procedentes de catéteres
En las 2 muestras de catéteres analizadas no se obtuvo crecimiento microbiano en el medio cromogénico ni en el control agar sangre.
Muestras de exudados vaginales
Aunque solo se estudiaron 4 muestras de exudados vaginales, en todas hubo presencia de Enterococcus spp., que representa 100 % de los aislamientos. Resultó adecuada la utilización del medio cromogénico para estas muestras por promover de manera abundante el crecimiento de este microorganismo y suprimir el crecimiento de los otros acompañantes.
Los valores de los indicadores de calidad diagnóstica para este tipo de muestra resultaron del 100 % para el medio CromoCen® ENT, que resultaron superiores a los obtenidos con el medio control agar chocolate [S (75 %), E (100 %) y ED (85,7 %)] (Fig. D).
Muestras fecales
En 100 % de las muestras fecales analizadas se identificaron especies de Enterococcus.
La sensibilidad y exactitud diagnósticas resultaron ser de 100 % tanto en el medio cromogénico como en el medio control empleado. No fue posible calcular la especificidad diagnóstica porque no se obtuvieron resultados negativos (Fig. E).
Con el medio cromogénico se obtuvieron valores por encima de 95 % de los indicadores de calidad diagnóstica para el total de las muestras ensayadas, que resultaron superiores en todos los casos a los alcanzados con los medios controles (Fig. F).
En la figura se muestran los gráficos de los valores de sensibilidad, especificidad y exactitud diagnósticas (%) obtenidos para cada tipo de muestra ensayada y para el total de estas, con el medio cromogénico y con los respectivos medios controles utilizados.
Para el total de las muestras evaluadas se obtuvieron solo 2 resultados falsos positivos con el medio cromogénico; estos correspondieron a una muestra de sangre y de exudado de lesión de piel, respectivamente. Se obtuvo solo 1 resultado falso negativo correspondiente a una muestra de orina. De igual manera, para el total de las muestras ensayadas con los medios controles, se obtuvieron solo 2 resultados falsos positivos correspondientes a una muestra de orina y de exudado de lesión de piel, respectivamente; sin embargo, a diferencia del medio cromogénico, con estos medios de referencia se obtuvieron 5 resultados falsos negativos, 2 correspondientes a muestras de orina, 2 a muestras de sangre y 1 de exudado vaginal.
DISCUSIÓN
La frecuencia de aislamiento de Enterococcus spp. en muestras de orina obtenida resultó relativamente elevada (43,4 %), específicamente en las instituciones hospitalarias 1 y 4. Estos resultados corroboran lo reportado por Acosta-Gnass en 2005 y es el hecho de que la tasa de infecciones del tracto urinario causadas por Enterococcus spp. aumenta bruscamente.10
En investigaciones realizadas por Brosnikoff y otros, así como Nodarse, se evidenció que las muestras de orina son las más comúnmente analizadas en los laboratorios de diagnóstico microbiológico, siendo consideradas las especies de Enterococcus como segundos o terceros causantes de infecciones en las vías urinarias.11,12
Enterococcus faecalis fue la especie de mayor incidencia en las muestras de orina ensayadas, seguido por Enterococcus avium y Enterococcus faecium, lo cual se corresponde con lo reportado por Nodarse.12 Otras especies de Enterococcus identificadas fueron Enterococcus pseudoavium y Enterococcus seriolicida.
Samra y otros demostraron que los medios cromogénicos tienen similar habilidad para detectar patógenos del tracto urinario que medios convencionales como CLED.13 En el presente estudio, Enterococcus spp. se identificaron correctamente en el medio cromogénico por la coloración rosada de sus colonias, que es el resultado de la acción de la enzima â-glucosidasa, presente en este género, sobre el sustrato cromogénico incluido en la composición, lo cual concuerda con los resultados de otros estudios.14
En el medio cromogénico CromoCen® ENT se detectó fácilmente la existencia de cultivos mixtos como demostró Manafi en estudios previos con otros diagnosticadores con estas características.15
Es de suma importancia que la identificación presuntiva hasta el nivel de género se logró en 18 a 24 h, la cual resultó mucho más rápida que por los procedimientos convencionales.14
Los valores de los indicadores de calidad diagnósticos en las muestras de orina resultaron ser similares a los alcanzados con otros medios cromogénicos que han sido utilizados para este propósito, como el agar CPS ID2 en la identificación de Enterococcus spp. (sensibilidad y especificidad de 97 y 99 %, respectivamente).16
Aunque no es muy común que E. dispar se aísle de la sangre,17 existen reportes recientes del Centro de Vigilancia Nacional de Infecciones Nosocomiales (NNIS) de los EE. UU. que considera a Enterococcus spp. como el cuarto patógeno más común de infecciones nosocomiales del torrente sanguíneo.18
Las especies de M. roseus y M. agilis son las únicas del género Micrococcus capaces de producir un pigmento propio de color rosado.8 En este caso la coloración rosada sobre CromoCen® ENT se debió a la producción del pigmento y no a la utilización del sustrato cromogénico presente en la composición. No se han encontrado reportes de aislamientos de estos microorganismos en la sangre;19 sin embargo, presentan notables semejanzas al género Staphylococcus por pertenecer a la misma familia (Micrococcaceae), y las especies de Staphylococcus son las mayormente encontradas en las muestras de sangre en este estudio, lo que se corresponde con lo hallado por otros autores.14
La presencia de Enterococcus spp. en las muestras de exudados de lesiones de piel fue relativamente elevada, si se tiene en cuenta que Enterococcus spp. no ocupa un lugar tan cimero como Staphylococcus spp. en este tipo de muestra, aunque sí son capaces de provocar infecciones graves en pacientes inmunocomprometidos o formar parte de una infección mixta.20
De igual manera que en las muestras de sangre, la coloración rosada de M. agilis se debió a la producción del pigmento. Este microorganismo se encuentra normalmente en la piel y ante cualquier daño o herida puede convertirse en patógeno y llegar a provocar lesiones graves.19
Los datos obtenidos de las muestras procedentes de catéteres no son suficientes para realizar un análisis de la incidencia de Enterococcus spp. en estos dispositivos, no obstante, aunque hubo poca recopilación de estos durante el período analizado, se plantea que los focos de bacteriemia relacionada con catéteres vasculares son la segunda complicación infecciosa adquirida en las unidades de cuidados intensivos de los hospitales,21 en primera instancia Staphylococcus epidermidis y Staphylococcus aureus, seguidos por E. faecalis y Enterococcus spp., los microorganismos asociados a la bacteriemia.22 Los medios cromogénicos resultan muy ventajosos en estos casos, porque garantizan la identificación presuntiva del género implicado con gran rapidez, en 18 a 24 h, a diferencia de los métodos convencionales que suelen requerir un mayor período de tiempo.14,15
En 3 de las 4 muestras de exudados vaginales, los microorganismos aislados se encontraron asociados a Staphylococcus spp., lo que coincide con lo reportado en anteriores estudios.23 La presencia de Enterococcus spp. en la vagina es considerada normal porque estos microorganismos forman parte de la microbiota indígena del tracto genital femenino, sin embargo, muchos de estos microorganismos han sido considerados patógenos oportunistas en la vaginosis bacteriana, especialmente E. faecalis.24 Se conoce también que los pacientes inmunocomprometidos son propensos a contraer infecciones por estos microorganismos, lo cual puede ser la causa de su presencia en estas muestras, porque estos microorganismos fueron aislados de pacientes embarazadas, estado en el que se corre el riesgo de padecer estas infecciones.25
En un estudio realizado por Guevara Duncan y otros en el año 2000 se encontró que Enterococcus spp. ocupó el segundo lugar en frecuencia de aislamiento en las pacientes con flujo vaginal, luego de Gardnerella vaginalis. Las especies de Enterococcus mayormente encontradas en orden decreciente fueron E. faecalis, Enterococcus durans y E. avium. De igual manera se aislaron otros microorganismos dentro de los que se encuentran E. coli, Staphylococcus spp., microorganismos estos encontrados también en el presente estudio.24
Como las especies de Enterococcus se consideran microbiota normal del tracto gastrointestinal de los humanos era de esperar su presencia en las muestras fecales, que no constituyó un peligro para la salud de estos pacientes.26 El medio cromogénico fue capaz de promover el crecimiento de Enterococcus spp. en todas estas muestras y de suprimir el crecimiento de los microorganismos acompañantes, demostrando con ello el elevado poder selectivo de CromoCen® ENT, porque se conoce que este sitio es densamente poblado por una microbiota bastante diversa.
De manera general, en gran parte de los aislamientos, las especies de Enterococcus encontradas estaban formando parte de cultivos mixtos, lo que está en correpondencia con algunos reportes en los cuales se considera que estos microorganismos se encuentran mayormente asociados a cultivos polimicrobianos.18
Los hallazgos de los autores mencionados con anterioridad sobre la frecuencia de aislamiento de las especies de Enterococcus justifican la selección de los tipos de muestra evaluados en el presente estudio y demuestran la posible aplicación del diagnosticador desarrollado para el análisis clínico.
Los resultados en este estudio permiten afirmar que el medio cromogénico fue adecuado para el aislamiento e identificación de Enterococcus spp. procedentes de muestras clínicas, porque promovió el crecimiento de estos microorganismos en diferentes tipos de muestras en solo 24 h, que permite su reconocimiento por la coloración rosada de las colonias y se obtienen elevados valores de los indicadores de calidad.
La utilización del medio cromogénico, en combinación con la realización de las pruebas rápidas PYR, oxidasa y catalasa, permite el diagnóstico eficaz de estos microorganismos.
REFERENCIAS BIBLIOGRÁFICAS
1. Giridhara PM, Ravikumar KL, Umapathy BL. Review of virulence factors of Enterococcus: An emerging nosocomial pathogen. Ind J Med Microbiol. 2009;27(4):301-5.
2. Girón Matute WI. Antimicrobianos. Rev Fac Cienc Méd. 2008;5(2):70-7.
3. Hartman PA, Reinbold GW, Saraswat DS. Media and methods for isolation and enumeration of the Enterococci. Adv Appl Microbiol. 1966; 8:253-89.
4. Díaz M, Rodríguez C, Zhurbenko R, Hernández E, Muñoz del campo JL, Bello O. Evaluación del desempeño de un nuevo medio de cultivo en la búsqueda de Enterococcus en muestras clínicas. [CD-ROM] Revista CENIC Ciencias Biológicas. 2005;36:Número Especial.
5. Zhurbenko R, Viera Oramas DR, Rodríguez Martínez C, Lobaina Rodríguez T, Díaz Pérez M, San Germán Rodríguez V, et al. Expediente de registro sanitario de diagnosticadores. Perfil: Medios de cultivo cromogénicos y/o fluorogénicos. D0712-14. CECMED; 2007.
6. Murray PR, Rosenthal KS, Faüer MA. Microbiología médica. 5ta ed. en español. Madrid: Elsevier; 2009. p. 213-64.
7. Koneman EW, Allen SD, Janda WM, Schreckenberger PC, Winn WC Jr. Introduction to diagnostic microbiology. Philadelphia: Ed. Lippincott; 1994. p. 121-62.
8. Holt JG, Krieg NR, Sneath PHA, Staley JT, Williams ST. Bergey¢s Manualâ of Determinative Bacteriology. 10ma. ed. Baltimore: Williams & Wilkins; 2004. p. 528.
9. Havelaar AH, Heisterkamp SH, Hoesktra JA, Moojiman KA. Performance characteristics of methods for bacterial examination of water. Wat Sci Tech. 2003;27(3-4):1-13.
10. Acosta Gnass S. Enterococcus. [Internet]. Buenos Aires: Grupo Asesor Control de Infecciones y Epidemiología; 2005. p. 1-15. [citado 19 Dic 2008]. Disponible en: http://www.codeinep.com.ar/control/Enterococcus.pdf
11. Brosnikoff CL, Rennie RP, Shokoples SE, Turnbull LC. Isolation of uropathogens on chromogenic agar versus Standard Dipslides from urine collected with and without Preservative. Atlanta, Georgia:105th General Meeting of the American Society for Microbiology; 2005. p. LR892.
12. Nodarse RV. Susceptibilidad in vitro a vancomicina de cepas de Enterococcus aisladas. Rev Cubana Med Milit. 2005[citado 16 Sept 2011];34(4). Disponible en: http://www.imbiomed.com.mx/1/1/articulos.php?method=showDetail&id_articulo=34494&id_seccion=609&id_ejemplar=3550&id_revista=70
13. Samra Z, Heifetz M, Talmor J, Bain E, Bahar J. Evaluation of use of a new chromogenic agar in detection of urinary tract pathogens. J Clin Microbiol. 1998;36(4):990-4.
14. Merlino J, Siarakas S, Robertson GJ, Funnell GR, Gottlieb T, Bradbury R. Evaluation of CHROMagar orientation for differentiation and presumptive identification of gram-negative Bacilli and Enterococcus species. J Clin Microbiol. 1996;34(7):1788-93.
15. Manafi M. New developments in chromogenic and fluorogenic culture media. Int J Food Microbiol. 2000;60:205-18.
16. Navarro F, Fuentes I, Izquierdo C, Sánchez F, Prats G. Evaluation of chromogenic medium CPS ID2 (bioMérieux) in urine culture. Enferm Infecc Microbiol Clin. 1996;14(4):215-9.
17. Yebenes J, Vidaur L, Serra-Prat M. Preventin of catheter- related bloodstream infection in critically ill patients using a disinfectable, needle-free connector: Arandomized controlled trial. Am J Infect Control. 2004;32(5):2915.
18. Shepp DH, Talavera F, Greenfield RA, Mylonakis E, Cunha BA, editors. Enterococcal Infections [Internet]. 2006 [citado 19 Set 2011]. Disponible en: http://emedicine.medscape.com/article/216993-overview
19. Yang S, Sugawara S, Monodane T, Nishijima M, Adachi Y. Micrococcus luteus teichuronic acids activate human and murine monocytic cells in a CD14- and toll-like receptor 4-dependent manner. Infect Immun. 2001;69(4):2025-30.
20. Delfín Y, Huerta G, Mkiranda M, Pacheco D, Solórzano F. Frecuencia y características clínicas de las infecciones de la piel y tejidos blandos en niños con varicela. Enf Inf Microbiol. 2009;29(3):94-8.
21. Álvarez Lerma F, Olaechea Astigarraga P, Palomar Martínez J, Insausti Ordeñana J, López Pueyo MJ y Grupo de Estudio ENVIN-HELICS. Epidemiología de las bacteriemias primarias y relacionadas con catéres vasculares en pacientes críticos ingresados en servicios de medicina intensiva. Med Intensiva. 2010;34(7):437-45.
22. Raad I, Hanna H, Jiang Y, Dvorak T, Reitzel R, Chaiban G. Comparative activities of daptomycin, linezolid, and tigecycline against catheter-related methilcillin-resistant Stapylococcus bacteremic isolates embedded in biofilm. Antimicrob Agents Chemother. 2007;51(5):1656-60.
23. Quale J, Ladman D, Saurina G, Atwood E, Dijore V, Patel K. Manipulation of a hospital antimicrobial formulary to control an outbreak of Vancomycin-resistant enterococci. Clin Infect Dis. 1996;23(5):1020-5.
24. Guevara Duncan J, Cáceres A, Valencia E. Significado clínico de la presencia de Enterococcus en secreción vaginal. An Fac Med. 2000;61(3-2000):223-6.
25. Strausbaugh LJ. Emerging infections diseases: a challenger to all. Am Fam Physician. 1997;55(1):111-7.
26. Ávila S, Estupiñán S. Calidad sanitaria del agua de la ciénaga Mata de Palma en el Departamento del César, Colombia. NOVA. 2009;7(11):85-91.
Recibido: 21 de diciembre de 2011.
Aprobado: 25 de enero de 2012.
Marilyn Díaz. Centro Nacional de Biopreparados. Carretera a Beltrán km 1½, AP 32600 Bejucal. Mayabeque, Cuba. Correo electrónico: marilyn.diaz@biocen.cu