Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión impresa ISSN 0375-0760
Rev Cubana Med Trop vol.65 no.3 Ciudad de la Habana jul.-sep. 2013
COMUNICACIÓN BREVE
Aislamiento de Mycoplasma spp. a partir de pacientes cubanos VIH-positivos con síntomas respiratorios
Isolation of Mycoplasma spp. from Cuban HIV-positive patients with respiratory symptoms
MSc. Brian A. Mondeja Rodríguez, Dra. C. Carmen Fernández Molina, Dr. C. Islay Rodríguez González, MSc. Nadia María Rodríguez Preval, MSc. María Rosarys Martínez Romero, MSc. Lilian María Mederos Cuervo
Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba.
RESUMEN
Introducción: Mycoplasma y Ureaplasma se asocian como agentes etiológicos de infecciones oportunistas en pacientes VIH-positivos. El diagnóstico microbiológico de las infecciones respiratorias causadas por micoplasmas es un tanto laborioso. La utilización de medios de cultivos específicos y selectivos para estos microorganismos constituye un paso decisivo en esos procederes.
Objetivo: detectar la presencia de Mycoplasma spp. como agente etiológico de infecciones respiratorias en pacientes cubanos inmunocomprometidos.
Métodos: se analizaron 54 muestras de esputos provenientes de pacientes VIH-positivos con síntomas respiratorios, mediante el cultivo bacteriológico en medio SP-4 modificado y la posterior identificación de los aislados por técnicas bioquímicas y moleculares.
Resultados: el 16 % (9/54) de las muestras mostró crecimiento de Mycoplasma spp. Todos los aislamientos se confirmaron como pertenecientes a la clase Mollicutes mediante la reacción en cadena de la polimerasa, sin embargo, ninguno fue capaz de ser identificado mediante los juegos de cebadores ensayados para cada una de las especies estudiadas.
Conclusiones: los resultados brindan evidencias sugestivas de la reemergencia de Mycoplasma spp. como patógeno responsable de manifestaciones respiratorias en los pacientes cubanos VIH-positivos, lo que sugiere la necesidad de tomar en cuenta a estos microorganismos en el momento de indicar los estudios microbiológicos a pacientes con manifestaciones respiratorias.
Palabras clave: Mycoplasma, VIH, infecciones respiratorias, medio SP-4, Mollicutes.
ABSTRACT
Introduction: Mycoplasma and Ureaplasma are recognized as etiologic agents of opportunistic infections in HIV-positive patients. The microbiological diagnosis of respiratory infections caused by mycoplasmas is an arduous task. The use of specific selective culture media for these microorganisms is a decisive step in the procedures to be followed.
Objective: detect the presence of Mycoplasma spp. as an etiologic agent of respiratory infections in Cuban immunocompromised patients.
Methods: 54 sputum samples from HIV-positive patients with respiratory symptoms were analyzed by bacteriological culture in modified SP-4 medium followed by identification of the isolates by biochemical and molecular techniques.
Results: growth of Mycoplasma spp. was observed in 16 % (9/54) of the samples. Polymerase chain reaction confirmed that all isolates belonged to the class Mollicutes. However, none could be identified with the sets of primers assayed for each of the species studied.
Conclusions: results provide evidence suggestive of the reemergence of Mycoplasma spp. as a pathogen responsible for respiratory manifestations in Cuban HIV-positive patients, which points to the need to take these microorganisms into consideration when indicating microbiological examinations to patients with respiratory manifestations.
Key words: Mycoplasma, HIV, respiratory infections, SP-4 medium, Mollicutes.
Mycoplasma y Ureaplasma se asocian como agentes etiológicos de infecciones oportunistas en pacientes VIH-positivos. Las manifestaciones respiratorias causadas por estos microorganismos son desde el punto de vista clínico indistinguibles a las provocadas por otros patógenos. Al contrario de los pacientes inmunocompetentes, Mycoplasma pneumoniae no se asocia a la aparición de infecciones del sistema respiratorio, en su lugar, otras especies consideradas microbiota normal emergen como responsable de esas entidades clínicas.1-3 El diagnóstico microbiológico de las infecciones respiratorias causadas por micoplasmas es un tanto laborioso. La utilización de medios de cultivos específicos y selectivos para estos microorganismos constituye un paso decisivo en esos procederes.4
La incidencia de Mycoplasma spp. en la población VIH-positiva en Cuba se desconoce y muy pocas investigaciones de diagnóstico de enfermedades respiratorias causadas por estos microorganismos se reportan a nivel internacional,5,6 por lo que se hace necesario conocer si Mycoplasma spp. constituye un agente etiológico de estas infecciones en pacientes cubanos VIH-positivos con manifestaciones respiratorias. Es por ello que este estudio está encaminado al aislamiento de micoplasmas presentes en el tracto respiratorio de pacientes cubanos VIH-positivos con manifestaciones respiratorias, mediante el estudio de muestras clínicas utilizando el cultivo bacteriológico y la identificación polifásica de los aislados mediante reacción en cadena de la polimerasa.
Se analizaron 54 muestras de esputos enviadas al Laboratorio Nacional de Referencia e Investigaciones sobre Tuberculosis y Micobacterias del Instituto de Medicina Tropical "Pedro Kourí" (IPK), para su estudio microbiológico durante los meses de septiembre y octubre de 2010. Todas las muestras provenían de pacientes cubanos VIH-positivos con síntomas respiratorios, en los cuales se descartó la presencia de otros microorganismos responsables de infecciones respiratorias agudas bacterianas. Para el aislamiento de Mycoplasma spp. se utilizó una modificación del medio SP-44 en forma líquida y sólida, el cual se denominó SP-4B. Brevemente, para la elaboración del medio líquido se preparó una base nutritiva formada por 7,0 g de base caldo PPLO; 20,0 g de triptona C; 10,6 g de proteosa peptona; 10,0 g de D-glucosa; todos los componentes se disolvieron en 1 230 mL de agua ultrapura y luego se esterilizó a 121 oC durante 20 min. Una vez enfriada la base, se adicionaron los componentes estériles siguientes: 50 mL de medio 199 [10X] (Gibco); 50 mL de medio a-MEM [10X] (Gibco); 70,0 mL de extracto fresco de levadura a 11 % (Sigma); 200 mL de solución de estolato de levadura a 2 %; 340 mL de suero de caballo inactivado; 500 UI/mL de penicilina G; VCN 1X y 0,001 % de rojo fenol. El pH se ajustó a 7,45 7,5 utilizando NaOH 1N. El medio fue ensayado utilizando las cepas de M. genitalium M2288 (subcultivo 15) y M. pneumoniae MAC (subcultivo 15), donadas gentilmente por el doctor Jørgen S. Jensen del Instituto Estatal del Suero (SSI) de Dinamarca.
El cultivo bacteriológico de la muestra se realizó según el procedimiento descrito por Clyde.4 A partir de cada aislamiento en medio líquido se conservaron 6 alícuotas de cultivo primario mediante criopreservación y liofilización.
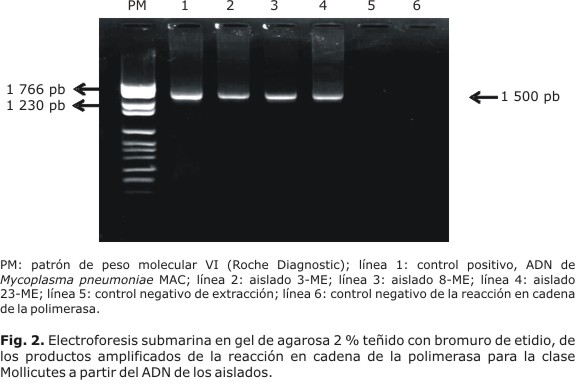
Los aislamientos obtenidos fueron purificados e identificados hasta género mediante los métodos bioquímicos previamente descritos, basados en la sensibilidad a la digitonina, hidrólisis de arginina, fermentación de glucosa, reducción del tetrazolium, hemadsorción de eritrocitos de carnero y formación de biofilm.7 La extracción de ADN se realizó mediante choque osmótico y térmico, a partir de 1 mL de cultivo en medio líquido y como control de extracción se utilizó 1 mL de agua ultrapura estéril.8 La especiación se realizó mediante PCR utilizando los cebadores específicos para la clase Mollicutes y para 7 de las especies de Mycoplasma de origen humano (tabla). Como control positivo se empleó ADN de M. pneumoniae MAC, M. genitalium G37T, M. penetran GTUT, M. fermentans PG18T, M. hominis PG21T, Ureaplasma parvun serotipo 3T y U. urealyticum serotipo 8T. todas estas cepas estaban conservadas en la colección del Laboratorio Nacional de Referencia e Investigaciones sobre Micoplasmas del IPK, como control negativo se empleó agua ultrapura estéril.
Tabla. Cebadores empleados para la identificación de especies de los aislamientos mediante reacción en cadena de la polimerasa simple5,9-12
| Especie | Cebadores | Secuencia | Fragmento (pb) | Gen o Región | Referencias |
| Clase Mollicutes | Moll-1 (F) | AGA GTT TGA TCC TGG CTC AGG A | 1 500 | ARNr 16S | (9) |
| Moll-2 (R) | CGT AGG GAT ACC TTG TTA CGA CT | ||||
| Mycoplasma pneumoniae | Mpne-1 (F) | AAG GAC CTG CAA GGG TTC GT | 277 | ARNr 16S | (10) |
| Mpne-2 (R) | CTC TAG CCA TTA CCT GCT AA | ||||
| Mycoplasma genitalium | MG-45 (F) | TAC ATG CAA GTC GAT CGG AAG TAG C | 427 | ARNr 16S | (11) |
| MG-447 (R) | AAA CTC CAG CCA TTG CCT GCT AG | ||||
| Mycoplasma fermentans | Mfer-1 (F) | GAA GCC TTT CTT CGC TGG AG | 272 | ARNr 16S | (10) |
| Mfer-2 (R) | ACA AAA TCA TTT CCT ATT CTG TC | ||||
| Mycoplasma | Mh-1(F) | TGA AAG GCG CTG TAA GGC GC | 281 | ARNr 16S | (10) |
| Mh-2 (R) | GTC TGC AAT CAT TTC CTA TTG CAA A | ||||
| Mycoplasma penetrans | Mpen-1 (F) | CAT GCA AGT CGG ACG AAG CA | 410 | ARNr 16S | (5) |
| Mpen-2 (R) | AGC ATT TCC TCT TCT TCT TAC AA | ||||
| Ureaplasma | UPS (F) | CAT CAT TAA ATG TCG GCC CGA ATG G | 812 | Región espaciadora | (12) |
| UPSA (R) | TAG AAT CCG ACC ATA TGA ATT TTT A | ||||
| Ureaplasma urealyticum | UUS2 (F) | CAG GAT CAT CAA ATC AAT TCA C | 418 | Región espaciadora | (12) |
| UUA2 (R) | CAT AAT GTT CCC CTT CGT CTA |
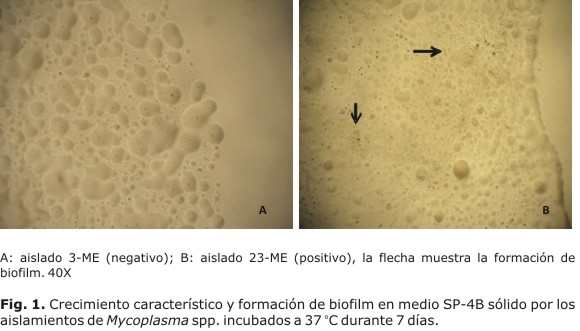
En el cultivo bacteriológico de las muestras de esputo, 16 % (9/54) mostró crecimiento característico de Mycoplasma spp. Estos aislamientos hidrolizaron la arginina, no utilizaron la glucosa ni la urea, ni redujeron el tetrazolium, y la producción de biofilm se detectó en 5 de estos (Fig. 1). Diferentes especies de micoplasmas han sido encontradas causando infecciones en pacientes inmunocomprometidos, siendo algunas de ellas capaces de acelerar la progresión a sida de los pacientes VIH-positivos.1-3
La utilización de un medio altamente nutritivo como el SP-4B, sometido a un exhaustivo y riguroso control de la calidad con cepas de micoplasmas "fastidiosos", permitió un alto porcentaje de recuperación de micoplasmas a partir de las muestras respiratorias. Este medio modificado sustituye el suplemento CMRL-1066 por el medio 199, sin que se evidencien cambios o disminución de la promoción del crecimiento de este, lo que constituye una alternativa asequible para el cultivo de especies de micoplasmas exigentes.13
Todos los asilamientos se confirmaron como pertenecientes a la clase Mollicutes mediante la PCR (Fig. 2), sin embargo, ninguno fue capaz de ser identificado mediante los juegos de cebadores ensayados para cada una de las especies estudiadas. Esto sugiere que esos aislamientos pudieran tratarse de otras especies como M. salivarium, M. orale, M. buccale o M. faucium.14,15
En este sentido, es probable que los síntomas respiratorios en los pacientes infectados con micoplasmas detectados en la presente investigación, sean el resultado de la colonización e infección del tejido pulmonar por estos microorganismos. Eso permite vislumbrar la reemergencia de estos microorganismos como agentes etiológicos importantes, a considerar en el tratamiento y diagnóstico de las infecciones respiratorias en pacientes VIH-positivos.
Futuras investigaciones deben estar encaminadas a la identificación de los aislamientos obtenidos, así como la evaluación de su susceptibilidad antimicrobiana a los antibióticos disponibles en el sistema nacional de salud, que permitan obtener una mayor cantidad de información sobre las especies de micoplasmas presentes en la población cubana, así como la posible resistencia a los tratamientos antimicrobianos tradicionalmente empleados en estos casos.
Los resultados con la utilización de un medio de cultivo modificado, así como la utilización de la PCR para la especiación de los aislamientos de micoplasmas obtenidos, brindan nuevas herramientas para el diagnóstico microbiológico de las infecciones respiratorias en los pacientes cubanos VIH-positivos, lo que se manifiesta en un diagnóstico y tratamiento más certero y racional.
REFERENCIAS BIBLIOGRÁFICAS
1. Lo SC, Hayes MM, Kotani H. Adhesion onto and invasion into mammalian cells by Mycoplasma penetrans: a newly isolated mycoplasma from patients whit AIDS. Mod Pathol. 1993;6:276-80.
2. Waites KB, Talkington DF. Mycoplasma pneumoniae and its role as a human pathogen. Clin Microbiol Review. 2004;17(4):697-28.
3. Totten PA, Taylor-Robinson D, JS Jensen. Genital mycoplasmas. En: Holmes KK, editors. Sexually transmitted diseases. 4ta ed. New York: McGraw Hill; 2011. p. 709-36.
4. Clyde WA. Recovery of mycoplasmas from the respiratory tract. En: Tully J, Rasin S, editores. Methods in mycoplasmology. vol. II. EE. UU.: American Press; 1983. p. 19-26.
5. Cultrera R, Roulland-Dussox D, Romani R, Contini C. Use of PCR to detect mycoplasma DNA in respiratory tract specimens from adult HIV-positive patients. J Med Microbiol. 1998;47:983-86.
6. Cordova CMM, Blanchard A, Cunha RAF. Higher prevalence of urogenital mycoplasma in human inmunodeficiency virus-positive patients as compared to patients whit other sexually transmitted diseases. J Clin Lab Analy. 2000;14:246-53.
7. Poveda J. Biochemical characteristics in mycoplasma identification. En: Miles R, Nicholas R, editores. Mycoplasma protocols. Methods in Molecular Biology. Vol. 104. New York: Human Press; 1998. p. 69-78.
8. Fernández C, Rodríguez NM. Diagnóstico de laboratorio de micoplasmas. En: Llanes R, Fernández C, Rodríguez NM, editores. Manual de técnicas diagnósticas de las infecciones del tracto reproductivo. La Habana: Editorial Ciencias Médicas; 2009. p. 65-75.
9. Deng S, Hiruki C, Robertson JA, Stemke GM. Detection by PCR and differentiation by restriction fragment length polymorphism of Acholeplasma, Spiroplasma, Mycoplasma and Ureaplasma, based upon 16S rRNA genes. PCR Methods Appl. 1992;1:202-04.
10. Van Kuppeveld FJM, Van der Logt JTM, Angulo AF, Van Zoest MJ, Quint WGV, Niesters HGM, et al. Genus and species-specific identification of mycoplasmas by 16S rRNA amplifications. Appl Enviroment Microbiol. 1992;58:2606-15.
11. Jensen JS, Borre MB, Dohn B. Detection of Mycoplasma genitalium by PCR amplification of the 16S rRNA gene. J Clin Microbiol. 2003;41(1):261-6.
12. Kong F, Ma Z, James G, Gordon S, Gilbert GL. Species identification and subtyping of Ureaplasma parvum and Ureaplasma urealyticum using PCR-based assays. J Clin Microbiol. 2000;38:1175-9.
13. Jensen JS, Hansen HT, Lind K. Isolation of Mycoplasma genitalium strains from the male urethra. J Clin Microbiol. 1996;34(2):286-91.
14. Ferreruela RM, Farga MA, Alcaraz MJ, García de Lomas J. The mycoplasma isolates from respiratory specimens. Med Clin. 1991;97(12):449-52.
15. Shankar EM, Rajasekaran S, Rao UA, Paramesh P, Krishnakumar R, Rajan R, et al. Colonization of mycoplasma in the upper respiratory tract of AIDS patients with pulmonary symptoms in Chennai, India. Indian J Med. 2005;122:506-10.
Recibido: 2 de octubre de 2012.
Aprobado: 27 de marzo de 2013.
Brian A. Mondeja Rodríguez. Laboratorio Nacional de Referencia e Investigaciones sobre Micoplasmas, Instituto de Medicina Tropical "Pedro Kourí". Avenida Novia del Mediodía Km 6 ½. AP 601. Marianao 13. La Habana. Cuba. Correo electrónico: bmondeja@ipk.sld.cu