Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión impresa ISSN 0375-0760
Rev Cubana Med Trop vol.66 no.1 Ciudad de la Habana ene.-mar. 2014
ARTÍCULO DE REVISIÓN
Angiostrongylus cantonensis: un parásito emergente en Ecuador
Angiostrongylus cantonensis: an emerging parasite in Ecuador
Dr. Luis Fernando Solórzano Álava,I Dr. Luiggi Martini Robles,I Dra. Hilda Hernández Álvarez,II Dr. Jorge Sarracent Pérez,II Dra. Jenny Muzzio Aroca,I Dra. Lázara Rojas RiveroII
I Instituto de Investigación en Salud Pública. Ecuador.
II Instituto Medicina Tropical "Pedro Kourí". La Habana, Cuba.
RESUMEN
Introducción: en 2008 se notificó por primera vez la presencia de Angiostrongylus cantonensis en Ecuador, así como los primeros casos de una enfermedad emergente causada por sus larvas, la meningitis eosinofilica.
Métodos: se realizó una revisión de la literatura básica y actualizada sobre aspectos generales de Angiostrongylus cantonensis en el mundo y particulares en Ecuador, que incluyó los hallazgos parasitológicos, clínicos y malacológicos relacionados con la enfermedad.
Resultados: se informan los hallazgos iniciales acerca de la aparición del parásito en Ecuador, así como la amplia distribución geográfica de sus hospederos intermediarios en el territorio nacional. Además, se notifican los brotes de meningitis eosinofilica por Angiostrongylus cantonensis y un caso de angiostrongyliosis ocular, informados oficialmente por el Ministerio de Salud Pública.
Conclusiones: Angiostrongylus cantonensis es un parásito emergente en Ecuador, cuyo diagnóstico en la actualidad es clínico y epidemiológico, de ahí la importancia de contar con métodos de laboratorio que lo oriente. Por otra parte, es importante que se promuevan campañas de promoción y prevención de salud que contribuyan a romper la cadena de transmisión de la enfermedad.
Palabras clave: Angiostrongylus cantonensis, meningitis eosinofílica, hospedero intermediario, hospedero definitivo.
ABSTRACT
Introduction: the presence of Angiostrongylus cantonensis and the first cases of eosinophilic meningitis, an emerging disease caused by its larvae, were first reported in Ecuador in the year 2008.
Methods: a review was conducted of the basic and current bibliography on general aspects of Angiostrongylus cantonensis both worldwide and in Ecuador, including parasitological, clinical and malacological findings.
Results: initial findings are reported about the emergence of the parasite in Ecuador, as well as the broad geographic distribution of its intermediate hosts in the national territory. Information is also provided about outbreaks of eosinophilic meningitis due to Angiostrongylus cantonensis and a case of ocular angiostrongylosis, based on official reports by the Ministry of Public Health.
Conclusions: Angiostrongylus cantonensis is an emerging parasite in Ecuador whose diagnosis is currently based on clinical and epidemiological findings. Hence the importance of developing relevant laboratory methods. On the other hand, it is important to foster health promotion and prevention campaigns aimed at stopping the transmission of the disease.
Key words: Angiostrongylus cantonensis, eosinophilic meningitis, intermediate host, definitive host.
SITUACIÓN ACTUAL
Angiostrongylus cantonensis fue descrito la primera vez por Chen (1935), quien lo encontró en pulmones de Rattus rattus y Rattus norvegicus capturadas en Cantón, China1 y se notifica como la causa más frecuente de meningitis eosinofílica en el hombre.2 La infección humana provocada por este parásito fue descrita por primera vez en 1945 por Nomura y Lin, en Taiwán, en el líquido cefalorraquídeo (LCR) de un joven de 15 años.3
Actualmente, este parásito se considera por muchos autores como miembro del subgénero Parastrongylus, el cual incluye un grupo de especies que afectan a roedores de todo el mundo. Se han descrito al menos 20 especies del género Angiostrongylus en roedores, carnívoros, e insectívoros, a nivel mundial; pero solo dos de ellos afectan al hombre: A. cantonensis, que afecta el sistema nervioso central y Angiostrongylus costarricenses, que habita las arterias mesentéricas y causa la angiostrongylosis abdominal en América tropical.4
La meningitis eosinofílica por A. cantonensis se ha notificado principalmente en Tailandia, China, Vietnam, Australia, Nueva Caledonia, Madagascar, Hawai, Tahití, Japón y Egipto.5,6
Aguiar y otros comunicaron oficialmente en 1981 la presencia en Cuba de la meningitis eosinofilica, lo que constituyó la primera notificación en el continente americano.7 Más tarde, la enfermedad o la evidencia del parásito que la produce se informaron en Puerto Rico, 1986;8 República Dominicana, 1992;9 Jamaica, 2002;10 Haití, 2003,11 aunque se sospechaban casos desde 1997;12 Brasil, 2007;13 y por último, en Ecuador, 2008.14
Hasta la fecha se han publicado brotes en Cuba,15 Brasil,16 Jamaica, en turistas americanos que retornaban del Caribe,17 y en turistas europeos que viajaron a zonas endémicas en América.18-20 También se han encontrado evidencias de la existencia de esta parasitosis en Nueva Orleans, tanto en ratas en 198821 como en humanos,22 en animales de vida salvaje,23 en animales domésticos24 y en primates no humanos al sur del país.25
GENERALIDADES SOBRE LA ANGIOSTRONGYLOSIS PROVOCADA POR ANGIOSTRONGYLUS CANTONENSIS
La meningitis eosinofílica se considera una zoonosis parasitaria que afecta a las ratas como huésped definitivo, donde los gusanos adultos hembras y machos se localizan en las arterias pulmonares. Posterior a la cópula, las hembras ponen sus huevos, a partir de los cuales eclosionan larvas de primer estadio (L1) en las ramas terminales de las arterias pulmonares. Estas larvas migran a través de la tráquea, son deglutidas, pasan al tracto gastrointestinal y son eliminadas en las heces. Al ser ingeridas por moluscos (caracoles terrestres y marinos) que son huéspedes intermediarios, experimentan dos mudas hasta convertirse en larvas del tercer estadio (L3), que son la forma infectante para el hombre y otros mamíferos, los cuales al ingerir los caracoles infectados completan el ciclo. Las larvas penetran la pared intestinal y migran a través del sistema circulatorio, y en el transcurso de 2 a 3 días, llegan al cerebro donde mudan dos veces hasta llegar a convertirse en larvas de cuarto (L4) y quinto estadio (L5) (adultos jóvenes). Posteriormente, los parásitos migran a la arteria pulmonar y a las cavidades del corazón derecho, el asentamiento en este último hábitat se produce aproximadamente 4 semanas después de la ingestión de larvas L3.26 La presencia de adultos jóvenes de A. cantonensis en las meninges y en el parénquima cerebral, y cerebelo, provocan una reacción inflamatoria, conocida como meningitis eosinofílica.
Las manifestaciones clínicas más comunes en los pacientes infectados son causadas por la presencia de larvas en el cerebro y se caracterizan por cefalea intensa, rigidez de nuca, manifestaciones oculares, parestesias de diversos tipos, y en 5 % de los pacientes se presenta parálisis facial.27 Algunos autores plantean que la meningitis eosinofílica por A. cantonensis se presenta como una enfermedad aguda que se resuelve espontáneamente en semanas, en otros casos evoluciona de forma severa dejando secuelas irreversibles como la ceguera e incluso, puede provocar la muerte.
La forma más común de diagnosticar la enfermedad se realiza teniendo en cuenta las manifestaciones clínicas. La presencia de eosinófilos en LCR, sangre periférica y el antecedente epidemiológico de vivir en áreas endémicas, acompañado del hábito de ingerir caracoles crudos o mal cocidos que albergan larvas infectantes, así como langostinos, pescados y cangrejos que hayan ingerido caracoles infectados (hospederos paraténicos), orientan en la sospecha diagnóstica. Una forma, menos común, de transmisión de la infección es la ingestión de verduras contaminadas, agua o jugo de frutas.17,28
El diagnóstico de certeza es muy complejo, se realiza mediante la observación de larvas L5 en el LCR, las cuales muy pocas veces se logran visualizar. Las imágenes de resonancia magnética en pacientes con meningitis eosinofilica por A. cantonenis a menudo revelan múltiples engrosamientos nodulares en el tejido cerebral y engrosamientos lineares en las leptomeninges.29
Además de la eosinofília en sangre, detectada en más de 84 % de los pacientes en la evaluación inicial, la medición de inmunoglobulinas intratecales (biosíntesis intratecal de IgE) puede contribuir al diagnóstico.30,31 También se han empleado los métodos de diagnóstico inmunológico desarrollados desde 1980, como los ensayos inmunoenzimáticos (ELISA) para la detección de antígenos y anticuerpos, así como el método de inmunotransferencia.32,33 En los últimos años se han utilizado métodos para detectar ácidos nucleicos en muestras de LCR mediante la reacción en cadena de la polimerasa en tiempo real y la secuenciación, como alternativas para el diagnóstico en casos sospechosos, pero con poco éxito.34,35
Desde el punto de vista clínico, el diagnóstico diferencial debe realizarse fundamentalmente con paragonimiasis, toxoplasmosis, meningitis tuberculosa, neurosífilis, carcinomatosis meníngea y enfermedad de Hodgkin, entre otros.36
En el tratamiento de esta parasitosis se han usado corticosteroides,37 mebendazol con prednisolona,38 y corticosteroides con albendazol.39 El uso de antihelmínticos no es recomendado por algunos autores porque sugieren que podrían exacerbar los síntomas neurológicos debido a la muerte de las larvas presentes en el sistema nervioso central.17 En los casos con angiostrongylosis ocular, el tratamiento es la remoción quirúrgica o la terapia con láser. Si se presentan otras complicaciones como retinitis o neuritis óptica se administran esteroides.40
En relación con los huéspedes intermediarios, se conoce que son numerosas las especies de moluscos (caracoles y babosas) que se han encontrado infectados en forma natural con el parásito, y algunas otras especies de animales que pueden actuar como hospederos paraténicos o de transporte, todo lo cual contribuye a la diseminación del nematodo. Achatina fulica, Pila spp., Pomacea canaliculata son algunos de los principales moluscos intermediarios en el ciclo de vida de A. cantonensis.41
CONTRIBICIÓN AL ESTUDIO DE ANGIOSTRONGYLUS CANTONENSIS EN ECUADOR
En los meses de marzo y abril de 2008 en dos hospitales de la Ciudad de Guayaquil (Hospitales "Luis Vernaza" y "Roberto Gilbert") y en la provincia de Los Ríos, comenzaron a aparecer pacientes con manifestaciones clínicas dadas principalmente por dolor abdominal, náuseas y vómitos severos, constipación intestinal, mialgias, astenia, signos y síntomas neurológicos, tales como cefalea y alteraciones visuales, que evolucionaron con eosinofília tanto en sangre periférica como en LCR. Todos los pacientes, tanto niños como adultos, tenían el antecedente de haber ingerido caracoles crudos. Los hallazgos clínicos y epidemiológicos hicieron sospechar a los infectólogos de que se estaba en presencia de meningitis eosinofílica causada por A. cantonensis.
Hospederos definitivos
A partir de entonces, se dispuso por el Ministerio de Salud que el Subproceso de Parasitología del Instituto Nacional de Higiene y Medicina Tropical "Leopoldo Izquieta Pérez" (INHMT "LIP") (actualmente Instituto de Investigación en Salud Pública-INSPI), iniciara una investigación epidemiológica y parasitológica. El trabajo de terreno se llevó a cabo en mayo de 2008, para lo cual se procedió a la captura de ratas y caracoles de las áreas de donde provenían la mayor parte de los pacientes (Recinto La Ercilia, Cantón Ventanas, Provincia de Los Ríos). Se capturaron 7 ratas, y su sistema cardiopulmonar fue disecado para determinar la presencia de infección. Se recuperaron gusanos adultos de la arteria pulmonar de dos de ellas: R. rattus y R. norvegicus, respectivamente, lo que constituyó el primer registro de la presencia de A. cantonensis en Ecuador14 (Fig. 1 A y B).
Además, el ciclo biológico del parásito se reprodujo en el laboratorio en condiciones muy parecidas a como ocurre en la naturaleza, utilizando larvas de caracoles infectados; lo que permitió recuperar gusanos (en etapas juveniles y adultas) en meninges y sistema cardiopulmonar de las ratas (Fig. 2).
Distribución por provincias de hospederos intermediarios de Angiostrongylus cantonensis
El estudio de la malacofauna en el Ecuador ha permitido identificar los huéspedes intermediarios del parásito, tanto los caracoles dulceacuícolas del género Pomacea spp. originarios del Ecuador, como los terrestres del género Achatina, que son importados.42
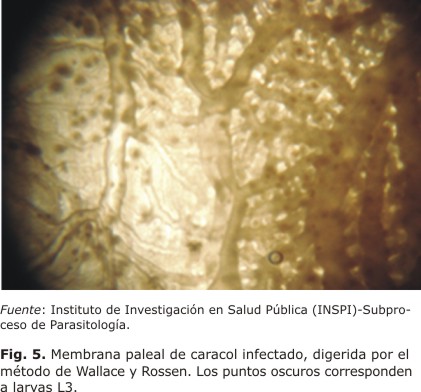
En los primeros estudios con hospederos intermediarios, se recolectaron y examinaron 133 caracoles del género Pomacea, a los cuales se les realizó la disección y extracción de las partes blandas por la técnica de Lobato-Paraense modificada.43 Posteriormente, se procedió a la digestión de los tejidos por medio del método Wallace y Rossen,44 seguido del análisis estereo- microscópico de la membrana paleal; se observaron 122 larvas de tercer estadio L3 en un solo caracol y 4 larvas en otro. La determinación del género y especie de los huéspedes intermediarios se hizo mediante el examen de las características morfológicas y claves taxonómicas. Además, especímenes adultos fueron enviados a Japón, donde el Dr. Hideo Hasegawa de la Escuela de Medicina de Ohita confirmó el diagnóstico basado en las características morfológicas. Asimismo, el Dr. Pedro Morera Villalobos de la Escuela de Medicina de la Universidad de Costa Rica confirmó también la presencia del parásito (Figs. 3, 4 y 5).
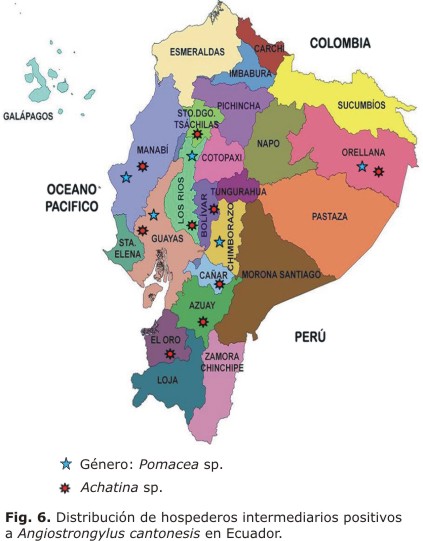
Achatina fulica es una de las especies más importantes y reconocida como huésped intermediario de A. cantonensis. En el Ecuador fue reportada en 2005 en la costa ecuatoriana Atacames,42 es considerada como una especie muy peligrosa por su alta capacidad de reproducción, desplazamiento y potencialmente portadora del parásito. Está presente en 10 de 14 provincias estudiadas en Ecuador, y se considera como la causante de la diseminación a otras especies.
Hasta diciembre de 2012 se estudió un total de 2 784 caracoles, 1 054 del género Pomacea sp. y 1 730 del género Achatina sp., con una positividad total de 11,2 % (tabla).
Se han muestreado 14 provincias en búsqueda del huésped intermediario y en 10 de ellas se ha encontrado el parásito. Las provincias costeras que están situadas a baja altura y clima tropical-subtropical, como Los Ríos, Guayas, Santo Domingo, El Oro y Manab, presentan la mayoría de los huéspedes intermediarios infectados. En la figura 6 se representan las zonas geográficas afectadas.
En Ecuador el consumo de caracoles crudos constituye una práctica nutricional muy antigua, por lo cual hasta el momento se ha identificado como el principal mecanismo de transmisión de la infección; aunque no se deben descartar otros factores de riesgo como su manipulación, así como el uso de la baba del caracol como cosmético. La amplia distribución de los huéspedes definitivos e intermediarios en todo el territorio nacional, es un indicador del riesgo de esta enfermedad de convertirse en un importante problema de salud pública.14
NOTIFICACIÓN DE LA INFECCIÓN POR ANGIOSTRONGYLUS CANTONENSIS EN HUMANOS
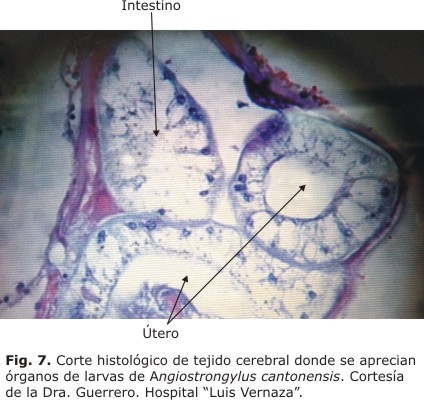
Hasta 2009 se han informado 7 brotes en las provincias de Los Ríos, Santo Domingo de los Tsachilas, Guayas, Manabí y Pichincha, que afectaron a 19 adultos y 7 niños. 45 Se estima que hasta el presente hay más de 87 casos humanos y 3 fallecidos. En un artículo publicado por Guerrero y otros en 2008, se informa la presencia del parásito en el tejido cerebral de uno de los pacientes fallecidos46 (Fig. 7).
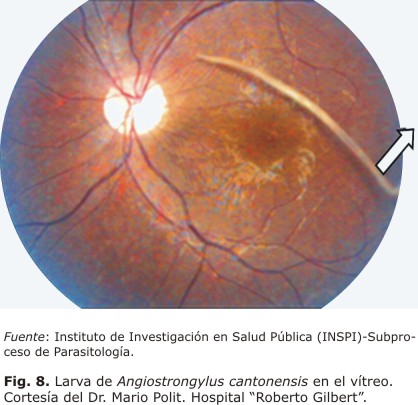
Asimismo, se sospechó la presencia de angiostrongylosis ocular en un paciente de sexo masculino de 15 años de edad, procedente de la provincia de Los Ríos, quien fue ingresado en el Hospital "Roberto Gilbert" por presentar fiebre de una semana de evolución, cefalea, rigidez de nuca, hiperestesias, mialgias, artralgias, disminución de la agudeza visual, diplopía y sensación de ¨flotadores en el ojo izquierdo¨. El paciente fue remitido a la consulta de oftalmología para la valoración del fondo de ojo, informándose la presencia de una larva viva flotando en el vítreo, el nervio óptico de límites normales y a nivel de la mácula, alteración del epitelio pigmentario de la retina con pliegues en la superficie de la retina. Se inició tratamiento con corticoides, medicación antiparasitaria, se realizó vitrectomía vía pars plana por tres puertos y remoción quirúrgica del parásito para su identificación, confirmándose la presencia de una larva (L5) de A. cantonensis (comunicación personal, Dra. Manriquez y Dr. Polit) (Fig. 8).
Fuente: INSPI-Subproceso de Parasitología
CONSIDERACIONES FINALES
A pesar de los estudios realizados en las últimas décadas sobre la infección con A. cantonensis tanto en América como en el mundo, existen muchas cuestiones aún sin resolver, como la falta de métodos eficaces y efectivos para el diagnóstico y el tratamiento de esta zoonosis, así como una posible subestimación del papel que puede desempeñar esta infección parasitaria en la salud pública.
El gran número de ratas y moluscos que pueden ser susceptibles a la infección por A. cantonensis, unido al hábito de ingerir caracoles y moluscos crudos en gran parte de la población, hacen del control de esta enfermedad un problema complejo. No obstante, es posible romper la cadena de transmisión en poblaciones en riesgo de contraer la enfermedad, mediante el desarrollo y la aplicación de métodos de educación sanitaria dirigidos a la prevención en la adquisición de la enfermedad.
Se necesita conocer la prevalencia real de esta enfermedad en el país, porque es evidente el subregistro de casos infectados. Hasta el momento, el diagnóstico de esta enfermedad es clínico y epidemiológico. Resulta importante, por lo tanto, desarrollar e implementar pruebas serológicas que permitan estudiar la prevalencia de la enfermedad en el país, la respuesta inmune en pacientes infectados y el seguimiento de la enfermedad, contar con métodos sensibles que ayuden en el diagnóstico diferencial.
La identificación morfológica del parásito en los huéspedes intermediarios se realiza por microscopia óptica, este es un método tedioso y requiere de vasta experiencia del personal que lo realiza. Desde el punto de vista práctico sería muy conveniente poder contar con métodos basados en la reacción en cadena de la polimerasa para la detección del parásito en el tejido del huésped intermediario, con la finalidad de conocer la real prevalencia del nematodo en estos huéspedes. También se deben implementar los marcadores biológicos para la caracterización genética del parásito, la realización de estos estudios además permitirá determinar qué otros géneros y especies de caracoles pueden estar infectados naturalmente con A. cantonensis, lo cual pudiera constituir otras fuentes de infección para el desarrollo de nuevos casos de meningoencefalitis eosinofílica. El conocimiento de la distribución geográfica de los huéspedes intermediarios, contribuirá al establecimiento de medidas puntuales en esas zonas, lo cual permitirá prevenir la aparición de nuevos registros de casos.
Toda esta importante y necesaria aplicación de nueva tecnología para el diagnóstico y caracterización del parásito, requiere mayor inversión en tiempo, fondos y capacitación, de cuya aplicación y materialización se tendrá como resultado la formación de recursos humanos y el aumento del número de investigaciones científicas en beneficio de toda la comunidad científica internacional.
REFERENCIAS BIBLIOGRÁFICAS
1. Chen HT. Un nouveau nematode pulmonaire, Pulmonema. cantonensis n.g.n. sp., des rats de Canton. Ann Parasitol Hum Comp. 1935;13:312-7.
2. Kliks MM, Palumbo NE. Eosinoiphilic meningitis beyond the Pacific Basin: the global dispersal of a peridomestic zoonosis caused by Angiostrongylus, the nematode lungworm of rats. Soc Sci Med. 1992;34:199-212.
3. Beaver PC, Rosen L. Memorandum on the first report of Angiostrongylus in man, by Nomura and Lin, 1945. Am J Trop Med Hyg. 1964;13:589-90.
4. Morera P, Céspedes R. Angiostrongilosis abdominal. Una nueva parasitosis humana. Acta Méd Costarric. 1971;14:159-73.
5. Rossen L, Laigret J, Bories S. Observations on an outbreak of eosinophilic meningitis on Tahiti, French Polynesia. Am J Hyg. 1961;74:26-42.
6. Brown FM, Mohareb EW, Yousif F, Sultan Y, Girgis NI. Angiostrongylus eosinophilic meningitis in Egypt. Lancet. 1996;348:964-5.
7. Aguiar PH, Morera P, Pascual J. First record of Angiostrongylus cantonensis in Cuba. Am J Trop Hyg. 1981;30:963-5.
8. Andersen E. First report of Angiostrongylus cantonensis in Puerto Rico. Am J Trop Med Hyg. 1986;35:319-22.
9. Vargas M, Gómez Pérez JD, Malek EA. First record of A. cantonensis (Chen,1935). Nematoda: metastrongyloidae in the Dominican Republic. Trop Med Parasitol. 1992;43:253-5.
10. Lindo JF, Waugh C, Hall J, Cunningham-Myrie C, Ashley D, Eberhard ML, et al. Enzootic Angiostrongylus cantonensis in rats and snails after an outbreak of human eosinophilic meningitis, Jamaica. Emerg Infect Dis. 2002;8(3):324-6.
11. Raccurt CP, Blaise J, Durette-Desset MC. Presence of Angiostrongylus cantonensis in Haiti. Trop Med Int Health. 2003;8:423-6.
12. Raccurt CP. Two murine angiostrongyliasis in the Caribbean and their human consequences: a menace for Haiti? Med Trop. 1997;57:412-3.
13. Lima R, Mendonça C, Oliveira C, Lenzi H, Graeff-Teixeira C, Lima W, et al. First record of molluscs naturally infected with Angiostrongylus cantonensis (Chen, 1935) (Nematoda: Metastrongylidae) in Brazil. Mem Inst Oswaldo Cruz. 2007;102:887-9.
14. Martíni L, Gomez E, Muzzio J, Solórzano L. Primer registro de ratas infectadas con Angiostrongylus cantonensis, descripción del primer foco endémico de transmisión natural en Ecuador. Guayaquil, Ecuador: Congreso latinoamericano de Parasitología; octubre 2013.
15. Martínez Delgado JF, González Cortinas M, Tápanes Cruz TR, Ruiz Méndez A. Meningoencefalitis en Villa Clara (Cuba): estudio de 17 pacientes. Rev Neurol. 2000;31:417-21.
16. do Espírito-Santo MC, Pinto PL, da Mota DJ, Gryschek RC. The first case of Angiostrongylus cantonensis eosinophilic meningitis diagnosed in the city of Sao Paulo, Brazil. Rev Inst Med Trop S Paulo. 2013;55:129-32.
17. Slom TJ, Cortese MM, Gerber SI, Jones RC, Holtz TH, Lopez C, et al. An outbreak of eosinophilic meningitis caused by Angiostrongylus cantonensis in travelers returning from the Caribbean. N Engl J Med. 2002;346:668-75.
18. Leone S, De Marco M, Ghirga P, Nicastri E, Esposito M, Narciso PJ. Eosinophilic meningitis in a returned traveler from Santo Domingo: case report and review. Travel Med. 2007;4:407-10.
19. Bärtschi E, Bordmann G, Blum J, Rothen M. Eosinophilic meningitis due to Angiostrongylus cantonensis in Switzerland. Infection. 2004;32:116-8.
20. Rau C, Bialek R, Richter S, Lindner A. Headache after returning from the Dominican Republic. Deutsch Med Wochensch. 2006;131:1656-9.
21. Campbell BG, Little MD. The finding of Angiostrongylus cantonensis in rats in New Orleans. Am J Trop Med Hyg. 1988;38:568-73.
22. Hochberg NS, Blackburn BG, Park SY, Sejvar JJ, Effler PV, Herwaldt BL. Eosinophilic meningitis attributable to Angiostrongylus cantonensis infection in Hawaii: clinical characteristics and potential exposures. Am J Trop Med Hyg. 2011;85:685-90.
23. Kim DY, Stewart TB, Bauer RW, Mitchell, M. Parastrongylus (=Angiostrongylus) cantonensis now endemic in Louisiana wildlife. J Parasitol. 2002;88:1024-6.
24. Costa LRR, McClure JJ, Snider III TG, Stewart TB. Verminous meningoencephalomyelitis by Angiostrongylus (=Parastrongylus) cantonensis in an American miniature horse. Eq Vet Educ. 2000;12:2-6.
25. Duffy MS, Miller CL, Kinsella JM, de Lahunta A. Parastrongylus cantonensis in a nonhuman primate, Florida. Emerg Infect Dis. 2004;10:2207-10.
26. Beaver PC, Jung R, Cupp EW. Beaver's Clinical Parasitology. 9th ed. Philadelphia: Lea & Febiger; 1984. p. 292-4.
27. Tsai HC, Liu YC, Kunin CM, Lee SS, Chen YS, Lin HH, et al. Eosinophilic meningitis caused by Angiostrongylus cantonensis: report of 17 cases. Am J Med. 2001;111:109-4.
28. Tsai HC, Lee SS, Huang CK, Yen CM, Chen ER, Liu YC. Outbreak of eosinophilic meningitis associated with drinking raw vegetable juice in southern Taiwan. Am J Trop Med Hyg. 2004;71:222-6.
29. Jin E, Ma D, Liang Y, Ji A, Gan S. MRI findings of eosinophilic myelomeningoencephalitis due to Angiostrongylus cantonensis. Clin Radiol. 2005;60:242-5.
30. Dorta-Contreras AJ, Noris-García E, Escobar-Perez X, Duenas-Flores A, Mena-Lopez R. IgG subclasses intrathecal synthesis patterns in eosinophilic meningoencephalitis due to Angiostrongylus cantonensis. Neurol. 2003;36:506-9.
31. Padilla-Docal B, Dorta-Contreras AJ, Moreira JM, Martini-Robles L, Muzzio-Aroca J, Alarcón F, et al. Comparison of major immunoglobulins intrathecal synthesis patterns in Ecuadorian and Cuban Patients with Angiostrongyliasis. Am J Trop Med Hyg. 2011;84:406-10.
32. Ben R, Rodriguez R, Agostini AA, Graeff-Texeira C. Use of heterologous antigens for the immunodiagnosis of abdominal angiostrongyliasis by an enzyme-linked immunosorbent assay. Mem Inst Oswaldo Cruz. 2010;105:914-7.
33. Chen MX, Zhang RL, Chen JX, Chen SH, Li XH, Gao ST, et al. Monoclonal antibodies against excretory/secretory antigens of Angiostrongylus cantonensis. Hybridoma. 2010;29:447-52.
34. Qvarnstrom Y, Arambulu da Silva AC, Teem Jl, Hollingsworth R, Bishop H, Graeff-Texeira C, et al. Improved molecular detection of Angiostrongylus cantonensis in mollusks and other environmental samples with a species-specific internal transcribed spacer 1-based TaqMan assay. Appl Environ Microbiol. 2010;76:5287-9.
35. Eamsobhana P, Lim PE, Zhang H, Gan X, Yong HS. Molecular differentiation and phylogenetic relationships of three Angiostrongylus species and Angiostrongylus cantonensis geographical isolates based on a 66-KDa protein gene of A. cantonensis. Exp Parasitol. 2010;126:564-9.
36. Panackel C, Vishad D, Cherian G, Vijayakumar K, Sharma RN. Eosinophilic meningitis due to Angiostrongylus cantonensis. Indian J Med Microbiol. 2006;24:220-1.
37.Chotmongkol V, Sawanyawisuth K, Thavornpitak Y. Corticosteroid treatment of eosinophilic meningitis. Clin Infect Dis. 2000;31:660-2.
38. Chotmongkol V, Sawadpanitch K, Sawanyawisuth K, Louhawilai S, Limpawattana P. Treatment of eosinophilic meningitis with a combination of prednisolone and mebendazole. Am J Trop Med Hyg. 2006;74:1122-4.
39. Chotmongkol V, Kittimongkolma S, Niwattayakul K, Intapan PM, Thavornpitak Y. Comparison of prednisolone plus albendazole with prednisolone alone for treatment of patients with eosinophilic meningitis. Am J Trop Med Hyg. 2009;81:443-5.
40. Sawanyawisuth K, Sawanyawisuth K. Treatment of angiostrongyliasis. Trans R Soc Trop Med Hyg. 2008;102:990-6.
41. Wang QP, Wu ZD, Wei J, Owen RL, Lun ZR. Human Angiostrongylus cantonensis: an update. Eur J Clin Microbiol Infect Dis. 2012;31:389-95.
42. Correoso M. Los moluscos terrestres y fluviales del Ecuador Continental. La Biodiversidad desconocida. Quito, Ecuador: SIMBIOE; 2008.
43. Paraense WL. Lymnaea viatrix a study of topotypic specimens (Mollusca: Lymnaeidae). Rev Brasil Biol. 1976;36:419-8.
44. Wallace GD, Rossen L. Techniques for recovering and identifying larvae of Agiostrongylus cantonensis from molluscs. Malacología.1969;7:427-36.
45. Pincay T, García L, Narváez E, Decker O, Martini L , Moreira JM. Angiostrongyliasis due to Parastrongylus (Angiostrongylus) cantonensis in Ecuador. First report in South America. Trop Med Int Health. 2009;14(Suppl 2):37.
46. Guerrero M. Meningitis eosinofilíca por Angiostrongylus cantonensis. Reporte de caso de autopsia. Medicina. 2007;13(4):313-8.
Recibido: 2 de julio de 2013.
Aprobado: 20 de septiembre de 2013.
Luis Fernando Solórzano Álava. Instituto de Investigación en Salud Pública (INSPI). Guayaquil, Ecuador. Correo electrónico: luisfernando.solorzano@gmail.com