Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión impresa ISSN 0375-0760
Rev Cubana Med Trop vol.66 no.1 Ciudad de la Habana ene.-mar. 2014
ARTÍCULO ORIGINAL
Títulos de anticuerpos neutralizantes en sueros de individuos posconvalescientes con dengue
Neutralizing antibody titers in sera from patients post-convalescing from dengue
Dra. C. Mayling Álvarez Vera,I Dra. Danay Díaz Morejón,II Dra. C. Rosmari Rodríguez Roche,I Lic. Luis Morier Diaz,I Dra. C. María G. Guzmán TiradoI
I Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba.
II Hospital Militar "Carlos J. Finlay". La Habana, Cuba.
RESUMEN
Introducción: la inmunidad del hospedero desempeña un papel importante en determinar el desarrollo de las infecciones por dengue y del cuadro severo de la enfermedad. Sin embargo, otros factores intervienen en el complejo mecanismo de la patogénesis, como la variación entre las cepas virales.
Objetivos: evaluación de la capacidad neutralizante de un grupo de sueros de posconvalescientes frente a 2 cepas de dengue 4 pertenecientes a un mismo genotipo.
Métodos: se emplearon sueros de 68 individuos con un cuadro de fiebre del dengue y 35 con un cuadro clínico de fiebre hemorrágica del dengue.
Resultados: los títulos de anticuerpos neutralizantes en los sueros estudiados fueron bajos y se observó una capacidad neutralizante diferente entre las 2 cepas de dengue 4 del genotipo II. Se observaron diferencias significativas en los títulos de anticuerpos neutralizantes de los sueros procedentes de individuos con infección secundaria y con la forma severa de la enfermedad.
Conclusiones: estos resultados demuestran la complejidad de los anticuerpos neutralizantes, que se producen después de una infección por el virus dengue con diferentes cepas de un mismo serotipo, lo cual conduce a obtener resultados diversos por esta técnica que podría ser la causa de la trasmisión continuada de múltiples cepas de dengue.
Palabras clave: dengue 4, anticuerpos neutralizantes, genotipo, infección primaria y secundaria.
ABSTRACT
Introduction: host immunity plays an important role in determining the development of dengue infections and the severe form of the disease. However, other factors, such as the variation between viral strains, are also involved in this complex pathogenesis mechanism.
Objectives: evaluate the neutralizing capacity of a number of sera from post-convalescing patients against two dengue 4 strains from the same genotype.
Methods: examination was conducted of sera from 68 individuals with dengue fever and 35 with dengue hemorrhagic fever.
Results: neutralizing antibody titers were low in the sera analyzed. Different neutralizing capacity was found between the two dengue 4 strains from genotype II. Significant differences were observed between neutralizing antibody titers in sera from individuals with secondary infection and with the severe form of the disease.
Conclusions: results reveal the complex nature of the neutralizing antibodies produced after a dengue infection with different strains of the same serotype, leading to diverse results by this technique, which could be the cause of the continued transmission of multiple dengue strains.
Key words: dengue 4, neutralizing antibodies, genotype, primary and secondary infection.
INTRODUCCIÓN
La incidencia y distribución geográfica del dengue (DEN) se ha incrementado en los últimos años. El riesgo para el desarrollo de la fiebre hemorrágica del dengue (FHD) es mayor cuando 2 serotipos o más circulan simultáneamente. También se ha propuesto que la infección secundaria por un serotipo diferente al de la infección primaria, constituye un factor de riesgo para el desarrollo de la FHD. Evidencias epidemiológicas y de laboratorio sugieren que quizás los serotipos y las cepas virales pueden constituir un factor de riesgo de importancia. La existencia de determinados factores de riesgo del individuo como el asma, la diabetes y la anemia, entre otros, han sugerido un incremento de su susceptibilidad en el desarrollo de la forma grave.1
Una respuesta inmune efectiva es un punto crítico en la protección contra los virus del dengue. Existen evidencias de que la respuesta de anticuerpos a los genotipos de dengue no necesariamente neutraliza a cepas del mismo genotipo. La respuesta inmune primaria inducida después de infectar los ratones y monos con cepas de DEN-2 pertenecientes a los genotipos Asiático y Americano han mostrado también diferencias en la respuesta de anticuerpos neutralizantes contra cepas de igual y diferente serotipo.2 Estudios realizados utilizando anticuerpos monoclonales han demostrado que cambios en los aminoácidos específicos del Dominio III de la proteína de la envoltura (E) muestran diferencias en la actividad neutralizante, en dependencia de la virulencia de la cepa.3 También se ha demostrado que los anticuerpos monoclonales muestran diferencias en la actividad neutralizante dependiendo de la virulencia de la cepa.
Es reconocido que los epítopes que inducen la formación de anticuerpos neutralizantes son conservados entre cepas pertenecientes a un mismo serotipo. De hecho, la estrategia convencional en el desarrollo de vacunas para dengue se basa en que la respuesta inmune neutralizante dirigida a una cepa protegerá contra todas o la mayoría de las cepas pertenecientes a ese serotipo. La idea de que la variación entre cepas dentro de un serotipo no afecta la capacidad de neutralización, se basa en la observación de que en estudios de corte raramente o nunca se observa reinfección con el mismo serotipo de un simple genotipo. También estudios con otros flavivirus han demostrado que la neutralización es dependiente de las cepas empleadas en la prueba.4
Teniendo en cuenta lo anterior se trazó como objetivo conocer la capacidad neutralizante de un grupo de sueros convaleciente, frente a 2 cepas de virus dengue 4 pertenecientes a un mismo genotipo.
MÉTODOS
Consideraciones éticas
Esta investigación fue aprobada por la Comisión Científica de Microbiología y por el Comité de Ética Médica del IPK. El consentimiento informado se obtuvo de todos los pacientes incluidos en este estudio siguiendo las normas éticas institucionales y regionales.
Muestra de estudio
Se estudiaron 206 muestras de suero colectadas de 68 y 35 individuos con un cuadro clínico de fiebre del dengue (FD) y FHD, respectivamente, clasificados según las Guías para la Prevención y Control del Dengue y la Fiebre Hemorrágica del Dengue en las Américas.5
Los sueros se obtuvieron a los 5-7 días del comienzo de los síntomas (103 sueros de la fase aguda) y entre 18 y 24 meses después de la enfermedad (103 sueros fase convaleciente) durante la epidemia de DEN-4 ocurrida en La Habana en 2006. Se detectó previamente DEN-4 por aislamiento o reacción en cadena de la polimerasa6 y se confirmó la infección por detección de anticuerpos IgM,7 resultados que no forman parte de este trabajo. Todas las muestras de suero fueron almacenadas a - 20 °C hasta su estudio.
Cepas virales
En la tabla 1 se presentan la características de las cepas virales empleadas en el estudio.
Estudios serológicos
Las muestras se colectaron entre los días 5 y 7 días del inicio de la fiebre, se empleó el método de Elisa de inhibición (MEI)8 para determinar la presencia de anticuerpos IgG a DEN así como para clasificar el caso según el tipo de infección primaria o secundaria.8 Las muestras de suero de estos pacientes con título de anticuerpos IgG menor o igual que 20 fueron considerados como un caso de infección primaria, mientras que una muestra de suero con un título de anticuerpos IgG mayor o igual que 1 280 se consideró como un caso de infección secundaria.
Prueba de neutralización por reducción del número de placas (PNRP)
Las muestras convalecientes de los 103 individuos, 35 con FHD y los restantes 68 con FD, se emplearon para la determinación de los anticuerpos neutralizantes a dengue. Para determinar estos se utilizó el método descrito por Morens y otros9 con algunas modificaciones realizadas por Álvarez y otros.10 Brevemente, a partir de un cultivo de células BHK-21 clon 15 con 7 días de siembra, se preparó una suspensión de 2 x 105 células/mL en el medio de crecimiento de estas. A continuación se sembraron 500 uL de la suspensión celular por pocillo, en placas plásticas de 24 pocillos. Las células se dejaron 1 h en incubación a temperatura ambiente. Durante este tiempo se incubaron a 37 °C en incubadora de CO2 a 5 % una mezcla de 100 uL de cada dilución de suero (diluciones en base 10 de cada muestra de suero desde 1/10 hasta 1/1 000) con 100 uL de la dilución de trabajo de las cepas de virus empleadas para dar 10-20 ufp/50 uL en el volumen final. Después de la incubación, se inocularon por triplicado 50 uL de la mezcla virus-suero sobre las células BHK-21 previamente sembradas. Estas se incubaron durante 4 h a 37 °C en incubadora de CO2 a 5 % y a continuación se les añadió 500 uL/pocillo del medio de recubrimiento, consistente en 3 % de carboximetilcelulosa (viscosidad media) en medio MEM con 10 % de suero fetal bovino inactivado (SFBI), antibiótico, glutamina y bicarbonato. Las placas se incubaron en las mismas condiciones durante 6 días para las cepas de virus DEN-4 utilizadas en el estudio. Se tiñeron con una solución de nafthol blue black y ácido acético. Para cada dilución de suero se calculó la media del número de placas y su porcentaje de reducción, aplicando el método de Russell y otros11 para el cálculo del título de anticuerpos .
Análisis y procesamiento de los resultados
Para el análisis de los resultados se utilizaron los paquetes estadísticos SPSS versión 11.5.1 y Epiinfo 2004 versión 3.2. Se calcularon los títulos promedios geométricos (TPG) de anticuerpos neutralizantes a las diferentes cepas. Se realizó la prueba t de Student para la comparación de las medias de los títulos de anticuerpos neutralizantes según los cuadros clínicos de FD y FHD, así como para el tipo de infección (primaria o secundaria). Se consideraron significativas las diferencias, para p< 0,05.
RESULTADOS
El estudio de IgG utilizando el MEI permitió clasificar las 103 muestras agudas con una infección previa a dengue según el tipo de infección en 16 (15,7 %) de infección primaria (15 clasificados como FD y 1 como FHD y 87 (84,3 %) de infección secundaria (34 clasificados como FHD y 53 como FD). Para evaluar los títulos de anticuerpos neutralizantes a 2 cepas de dengue 4 de igual genotipo se emplearon los sueros convalecientes de los individuos estudiados. Estas cepas fueron la DEN-4 187/06 aislada durante la epidemia de DEN en Cuba de 2006 y la DEN-4 TVP, una de las cepas propuestas por la OMS para los ensayos de NRNP en vacunas.12
En este estudio se observó que los títulos de anticuerpos neutralizantes obtenidos a ambas cepas resultaron bajos (tabla 2), siendo inferiores para la cepa DEN-4 187/06. Para la cepa DEN-4 TVP 360 se observa que 32,4 % presenta títulos de anticuerpos neutralizantes superiores a 30, 63,7 % entre 10 y 30, y 23,5 % con títulos inferiores a 10. Para la cepa DEN-4 187/06 solo 20,6 % de los sueros tuvo títulos de anticuerpos neutralizantes superiores a 30, 33,3 % se encontró en el rango comprendido entre 10 y 30, y 46,1 % resultó con títulos de anticuerpos neutralizantes inferiores a 10.
Se seleccionaron los 53 sueros con títulos de anticuerpos neutralizantes inferiores a 10 (18 sueros que no presentaban títulos de anticuerpos neutralizantes a las 2 cepas, más 6 a la cepa DEN-4 TVP 360 y 29 a la cepa DEN-4 187/06) para realizarle la NRNP con una dilución del suero de 5, con el objetivo de determinar si a mayor concentración del suero podía detectarse la presencia de anticuerpos neutralizantes al virus dengue 4. El 31,9 % tuvo anticuerpos neutralizantes para la cepa DEN-4 187/06 y 16,7 % para DEN-4 TVP 360 (tabla 3).
Se compararon los títulos promedios geométricos de anticuerpos neutralizantes encontrados a ambas cepas, según el tipo de infección y el cuadro clínico presentado. Se observaron diferencias significativas entre los títulos promedio geométrico en las muestras colectadas de 18 a 24 meses después del inicio de la enfermedad en individuos con una infección secundaria por el virus DEN-4 para p= 0,001 (Fig. 1).
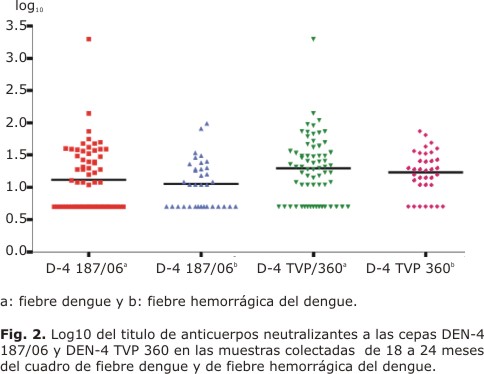
Al analizar la respuesta de anticuerpos neutralizantes a las 2 cepas empleadas, teniendo en cuenta el cuadro clínico, se obtuvieron diferencias significativas con p= 0,008 para las muestras de los individuos con FHD (Fig. 2).
Con el objetivo de buscar una explicación a los resultados, se comparó la secuencia aminoacídica de la proteína E de las cepas de DEN-4 187/06 y DEN-4 TVP 360, y se encontraron 5 cambios en las posiciones E64, E163, E222, E351 y E354 (tabla 4).
DISCUSIÓN
En investigaciones previas se ha demostrado que los anticuerpos neutralizantes inducidos frente a una infección por DEN-4 y detectados empleando el ensayo de NRNP, pueden ser bajos o no detectables. En un estudio realizado por Gromowski y otros no se detectaron anticuerpos neutralizantes a la cepa de DEN-4 703-4 y sí a los restantes serotipos del virus DEN; esto sugiere que los anticuerpos empleados debían estar en una concentración mayor para neutralizar al serotipo.13 Podría ser entonces que se necesite una concentración superior de anticuerpos para neutralizar determinadas cepas virales.
Las diferencias entre las cargas electrostáticas de la superficie del dominio III de la proteína E de los virus DEN-2, DEN-3 y DEN-4, son determinantes importantes en la antigenicidad y otras propiedades biológicas de estos virus.14,15 El DEN-2 contiene una mezcla de cargas positivas y negativas, la superficie del DEN-3 contiene solo cargas negativas, mientras que el DEN-4 es generalmente neutral para unirse a la superficie.16-20 En el caso de DEN-4 se ha planteado como la causa de los bajos títulos de seroconversión y de anticuerpos neutralizantes, en estudios de candidatos vacunales y en formulaciones mono y tetravalentes evaluados en humanos. En una investigación realizada para demostrar la variabilidad de los resultados por la técnica de NRNP, se demostró que los títulos de anticuerpos neutralizantes fueron significativamente bajos cuando se emplearon cepas de DEN-2 y DEN-4 salvaje con pocos pases; en contraste con los títulos elevados encontrados al utilizar la cepa prototipo. Los títulos de anticuerpos neutralizantes también resultaron bajos cuando la infección por el virus DEN-4 fue precedida por los serotipos 1 y 3. Este resultado podría explicarse por las características antigénicas comunes entre el DEN-1 y el DEN-3, así como la poca capacidad de los anticuerpos inducidos frente a estos virus de reconocer de forma cruzada al virus DEN-4.21
El título de anticuerpos neutralizantes a los 4 serotipos del virus DEN obtenidos por NRNP puede ser variable y se ve afectado por el número de pases tanto de las líneas celulares empleadas como de las cepas que se empleen en la técnica, y el uso o no del complemento.21 En el caso del virus DEN-3, al estudiar muestras de sueros de individuos después de casi 2 años de la fase aguda de la enfermedad (infección por DEN ocurrida durante la epidemia de 2001-2002 en Cuba). Álvarez y otros demostraron diferencias significativas entre los títulos de anticuerpos neutralizantes obtenidos frente a varias cepas de DEN-3 de igual genotipo.22
En estudios previos se ha demostrado que determinados residuos de aminoácídos son críticos para el reconocimiento en cada uno de los virus del DEN.14,15 Además se ha planteado que un solo cambio aminoacídico en el sitio reconocido por anticuerpos monoclonales (AcMs) anti-DEN estudiado, es suficiente para impedir el reconocimiento de los epítopes correspondientes por esos AcMs.23,24
En el caso de las cepas de DEN-4 empleadas en esta investigación existieron cambios en la proteína E de una con relación a la otra. Los cambios en las posiciones E64 y E163 son desfavorables, es decir, estos influyen de manera negativa en la estructura de la proteína. Particularmente, el cambio E163 se encuentra muy cercano al sitio de glicosilación E153 (N), región expuesta del dominio I, que es conservado entre todos los flavivirus (Comunicación personal, Rodríguez-Roche, 2009). Estos cambios de aminoácidos pudieran en parte explicar las diferencias encontradas en el título de anticuerpos neutralizantes, en cuanto al tipo de infección y cuadro clínico.
Estos resultados se encuentran en correspondencia con un estudio realizado por nuestro grupo empleando el DEN-4 Dominica (número de acceso al banco de genes: AF 326573.1) y 10 sueros de la muestra seleccionada para la presente investigación, donde se obtuvieron títulos de anticuerpos neutralizantes similares a los encontrados utilizando la cepa DEN-4 TVP 360. Estas 2 cepas no mostraban cambios de aminoácido entre ellas.
Estudios recientes indican que la variación intraserotípica puede conllevar a diferencias en la respuesta neutralizante. Blaney y otros25 después de inmunizar monos con un candidato atenuado caracterizaron la respuesta inmune de estos, usando un panel de virus de los 4 serotipos y de diferentes genotipos de estos. Los resultados mostraron diferencias en los títulos de anticuerpos neutralizantes cuando compararon diferentes genotipos de DEN-3.
Por otra parte, en un estudio de casos pediátricos de dengue en Tailandia, investigadores observaron diferencias significativas en la capacidad de los sueros para neutralizar las cepas de referencia y aislamientos clínicos de DEN-3.26 Guzmán y otros27 han demostrado diferencias en la secuencia aminoacídica entre cepas de DEN-3 con diferencias en la neutralización con sueros humanos y murinos.
Una serie de estudios han demostrado la capacidad de muchos anticuerpos monoclonales de los serotipos DEN-1, DEN-2 y DEN-3 con dependencia del genotipo.4,28,29 También recientemente se han observado diferencias en los títulos de anticuerpos de sueros humanos en 4 a 10 veces, cuando se emplearon virus recombinantes con PrM y E de diferentes genotipos de DEN-3 en el ensayo de neutralización.
Estos resultados demuestran la complejidad de la neutralización para dengue y podrían ser la causa de la transmisión continuada de múltiples cepas de dengue en la región, así como de la trasmisión de este serotipo durante un tiempo. Por otra parte son de una gran importancia para la evaluación de los candidatos vacunales.
REFERENCIAS BIBLIOGRÁFICAS
1. Guzmán G, Kourí G. Dengue haemorrhagic fever integral hypothesis: confirming observations, 1987-2007. Trans R Soc Trop Med Hyg. 2008;102:1-2.
2. Bernardo L, Fleitas O, Pavon A, Hermida L, Guillen G, Guzmán MG. Antibodies induced by dengue virus type 1 and 2 envelope domain III recombinant proteins in monkeys neutralize strains with different genotypes. Clin Vaccine Immunol. 2009 Dec;16(12):1829-31.
3. Falconar AK. Monoclonal antibodies that bind to common epitopes on the dengue virus type 2 nonstructural-1 and envelope glycoproteins display weak neutralizing activity and differentiated responses to virulent strains: implications for pathogenesis and vaccines. Clin Vaccine Immunol. 2008 Mar;15(3):549-61.
4. Brien JD, Austin SK, Sukupolvi-Petty S, O'Brien KM, Johnson S, Fremont DH, et al. Genotype-specific neutralization and protection by antibodies against dengue virus type 3. J Virol. 2010;84:10630-43.
5. PAHO. Dengue and dengue hemorrhagic fever in the Americas: guidelines for prevention and control. Scientific publication no.548. Washington: PAHO; 1994.
6. Rosario D, Álvarez M, Díaz J, Contreras R, Rodríguez R, Vázquez S, et al. Polymerase chain reaction for rapid detection and serotyping of dengue virus in clinical samples. Rev Panam Salud Publica. 1998 Jul;4(1):1-5.
7. Vázquez S, Pérez AB, Ruiz D, Rodríguez R, Pupo M, Calzada N, et al. Serological markers during dengue 3 primary and secondary infections. J Clin Virol. 2005 Jun;33(2):132-7.
8. Vázquez S, Acosta N, Ruiz D, Calzada N, Álvarez AM, Guzmán MG. Immunoglobulin G antibody response in children and adults with acute dengue 3 infection. J Virol Methods. 2009 Jul;159(1):6-9.
9. Morens DM, Halstead SB, Repik PM, Putvatana R, Raybourne N. Simplified plaque reduction neutralization assay for dengue viruses by semimicro methods in BHK-21 cells: comparison of the BHK suspension test with standard plaque reduction neutralization. J Clin Microbiol. 1985 Aug;22(2):250-4.
10. Álvarez M, Rodriguez-Roche R, Bernardo L, Morier L, Guzmán G. Improved Dengue virus plaque formation on BHK21 and LLCMK2 cells: Evaluation of Some Factors. Dengue Bull. 2005;29:49-57.
11. Russell PK, Nisalak A, Sukhavachana P, Vivona S. A plaque reduction test for dengue virus neutralizing antibodies. J Immunol. 1967 Aug;99(2):285-90.
12. WHO. Guidelines for plaque reduction neutralization testing of human antibodies to dengue viruses. Geneva: Word Health Organization; 2007.
13. Gromowski GD, Barrett AD. Characterization of an antigenic site that contains a dominant, type-specific neutralization determinant on the envelope protein domain III (ED3) of dengue 2 virus. Virology. 2007 Sep 30;366(2):349-60.
14. Volk DE, Lee YC, Li X, Thiviyanathan V, Gromowski GD, Li L, et al. Solution structure of the envelope protein domain III of dengue-4 virus. Virology. 2007;364:147-54.
15. Gromowski GD, Barrett AD, Barrett ND. Characterization of dengue virus complex-specific neutralizing epitopes on envelope protein domain III of dengue 2 virus. J Virol. 2008;82(17):8828-37.
16. Edelman R, Wasserman SS, Bodison SA, Putnak RJ, Eckels KH, Tang D, et al. Phase I trial of 16 formulations of a tetravalent live-attenuated dengue vaccine. Am J Trop Med Hyg. 2003 Dec;69(6 Suppl):48-60.
17. Sabchareon A, Lang J, Chanthavanich P, Yoksan S, Forrat R, Attanath P, et al. Safety and immunogenicity of tetravalent live-attenuated dengue vaccines in Thai adult volunteers: role of serotype concentration, ratio, and multiple doses. Am J Trop Med Hyg. 2002 Mar;66(3):264-72.
18. Sun W, Edelman R, Kanesa-Thasan N, Eckels KH, Putnak JR, King AD, et al. Vaccination of human volunteers with monovalent and tetravalent live-attenuated dengue vaccine candidates. Am J Trop Med Hyg. 2003 Dec;69(6 Suppl):24-31.
19. Jin X, Block OT, Rose R, Schlesinger J. Dengue vaccine development and dengue viral neutralization and enhancement assays. Antivir Ther. 2009;14(6):739-49.
20. Chanthavanich P, Luxemburger C, Sirivichayakul C, Lapphra K, Pengsaa K, Yoksan S, et al. Short report: Immune response and occurrence of dengue infection in Thai children three to eight years after vaccination with live attenuated tetravalent dengue vaccine. Am J Trop Med Hyg. 2006;75(1):26-8.
21. Thomas SJ, Nisalak A, Anderson KB, Libraty DH, Kalayanarooj S, Vaughn DW, et al. Dengue plaque reduction neutralization test (PRNT) in primary and secondary dengue virus infections: How alterations in assay conditions impact performance. Am J Trop Med Hyg. 2009 Nov;81(5):825-33.
22. Álvarez M, Pavón-Oro A, Rodríguez-Roche R, Bernardo L, Morier L, Sánchez L, et al. Neutralizing antibody response variation against dengue 3 strains. J Med Virol. 2008 Oct;80(10):1783-9.
23. Hiramatsu K, Tadano M, Men R, Lai CJ. Mutational analysis of a neutralization epitope on the dengue type 2 virus (DEN2) envelope protein: monoclonal antibody resistant DEN2/DEN4 chimeras exhibit reduced mouse neurovirulence. Virology. 1996;224(2):437-45.
24. Lin B, Parrish CR, Murray JM, Wright PJ. Localization of a neutralizing epitope on the envelope protein of dengue virus type 2. Virology. 1994;202(2):885-90.
25. Blaney JEJr., Matro JM, Murphy BR, Whitehead SS. Recombinant, live-attenuated tetravalent dengue virus vaccine formulations induce a balanced, broad, and protective neutralizing antibody response against each of the four serotypes in rhesus monkeys. J Virol. 2005 May;79(9):5516-28.
26. Endy TP, Nisalak A, Chunsuttitwat S, Vaughn DW, Green S, Ennis FA, et al. Relationship of preexisting dengue virus (DV) neutralizing antibody levels to viremia and severity of disease in a prospective cohort study of DV infection in Thailand. J Infect Dis. 2004 Mar 15;189(6):990-1000.
27. Zulueta A, Martin J, Hermida L, Valdes I, Prado I. Amino acid changes in the recombinant Dengue 3 Envelope domain III determine its antigenicity and immunogenicity in mice. Virus Res. 2006(121):65-73.
28. Shresta S, Brien JD, Sukupolvi-Petty S, Austin SK, Edeling MA, King T, et al. The development of therapeutic antibodies that neutralize homologous and heterologous gemotypes of dengue virus type 1. PLoS Pathog. 2010;6:e1000823.
29. Sukupolvi-Petty S, Austin SK, Engle M, Brien JD, Dowd KA, Williams KL, et al. Structure and function analysis of therapeutic monoclonal antibodies against dengue virus type 2. J Virol. 2010;84:9227-39.
Recibido: 25 de junio de 2013.
Aprobado: 16 de octubre de 2013.
Mayling Álvarez Vera. Instituto de Medicina Tropical "Pedro Kourí", Autopista Novia del Mediodía km 6 1/2 entre Autopista Novia del Mediodía y Carretera Central. Correo electrónico: mayling@ipk.sld.cu