Introducción
A mediados del siglo XX se conocían alrededor de 20 especies patógenas de hongos y en la actualidad se identifican más de 400, la mayoría de las cuales actúan de forma oportunista.1,2 De manera paralela, las infecciones causadas por estos agentes registran un incremento constante y se ubican entre el cuarto y décimo lugar como causa de muerte, particularmente en las unidades de cuidado intensivo.2,3
Se estima que más de mil millones de personas en el mundo sufren una infección fúngica grave y que más de 1,3 millones fallecen anualmente por esta causa, equiparable a la que ocasionan la tuberculosis y la malaria (1,4 y 1,2 millones de muertes anuales, respectivamente).4,5 Solo la aspergilosis y la candidiasis invasivas ocasionan tasas de mortalidad entre el 60 % y el 90 %.6,7)
Los métodos de diagnóstico microbiológico tradicionales presentan limitaciones que ocasionan retraso en la instauración del tratamiento específico oportuno y favorecen la aparición de daños orgánicos irreversibles. Lo anterior dio lugar al desarrollo de otros métodos que suplieran dichas deficiencias.5,8
El objetivo del presente trabajo fue describir las principales técnicas de diagnóstico no convencional de las enfermedades fúngicas más frecuentes, en especial las relacionadas con el diagnóstico serológico y molecular.
Métodos
Se compiló la información disponible sobre las técnicas no convencionales de diagnóstico de las infecciones fúngicas mediante una revisión bibliográfica de la literatura científica publicada entre los años 2000 y 2019. Se utilizaron como criterios de búsqueda los descriptores: diagnóstico micológico, diagnóstico precoz, inmunodiagnóstico, manano, galactomanano, D-arabinitol, β-D-glucano, serología, inmunodifusión, aglutinación con látex, inmunocromatografía, diagnóstico molecular, marcadores moleculares, PCR, MALDI-TOF, infecciones fúngicas, candidiasis, criptococosis, histoplasmosis, aspergilosis, coccidioidomicosis, paracoccidioidomicosis.
Como motores de búsqueda se emplearon Google y Google Scholar. Se revisaron las bases de datos Medline, PubMed, Science Direct, BUCea y SciELO. Se descartaron los trabajos duplicados, los de otros idiomas diferentes al español o inglés, los que no se ajustaban al tema, los que mostraban insuficientes datos de origen, las propagandas no científicas, las relacionadas con cursos y congresos, así como las presentaciones y los comentarios.
Análisis y síntesis de la información
Diagnóstico serológico
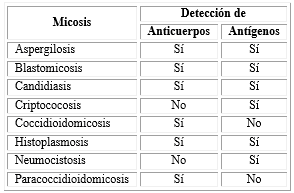
Las técnicas serológicas se emplean en el diagnóstico de las micosis invasivas o sistémicas (Cuadro 1) por ser fáciles, rápidas y confiables. Estas permiten la detección de antígenos fúngicos o de la respuesta de anticuerpos que se produce durante el desarrollo de la micosis.9
Detección de anticuerpos
Tiene utilidad limitada en el diagnóstico de las micosis invasivas debido a que la respuesta puede estar retrasada, reducida o no existir en pacientes inmunocomprometidos. Estos problemas podrían resolverse al elegir epítopes antigénicos apropiados y al utilizar técnicas más sensibles para detectar títulos bajos. El estudio de muestras seriadas del paciente permite analizar la evolución de dichos títulos y su correlación con los datos clínicos y microbiológicos.9,12)
A continuación se describen las pruebas más empleadas para el diagnóstico de las infecciones fúngicas más relevantes.
a) Detección de anticuerpos para el diagnóstico de candidiasis
El sistema de ensayo inmunoenzimático ligado a una fase sólida, o ELISA de sus siglas en inglés (Enzyme linked immunosorbent assay), se emplea de forma amplia para la detección de anticuerpos en los líquidos corporales. Basado en esta tecnología se desarrolló el Platelia Candida Ab/Ac/Ak® (Bio-Rad, Francia), el cual detecta anti-manano de Candida. Estos anticuerpos aparecen antes de las manifestaciones clínicas y se asocia a un riesgo mayor de candidiasis invasiva (CI) en pacientes neutropénicos. Presenta una sensibilidad y una especificidad del 50 % y 94 %, respectivamente. La utilización simultánea con el Platelia Candida Ag® (Bio-Rad, Francia) aumenta la sensibilidad del diagnóstico a un 80 %. Sin embargo, debido a la alta prevalencia de anticuerpos anti-manano en la población, se investigan otros marcadores más específicos de CI como los dirigidos contra antígenos citoplasmáticos y los expresados en la fase micelial de C. albicans.10
La detección de anticuerpos antimicelio o anti-tubo germinativo se comercializa en forma de inmunofluorescencia indirecta (IFI), Candida albicans IFA IgG® (Laboratorios Vircell, España). La técnica presenta buenos resultados de sensibilidad (84-87 %) y especificidad (94,7-95 %) para el diagnóstico de la infección sistémica por C. albicans, Candida tropicalis, Candida parapsilosis, Candida krusei, Candida glabrata, Candida guilliermondii y Candida dubliniensis, cuando se utiliza valor de corte > 1:160. Esta prueba permite distinguir entre candidemia transitoria o relacionada con catéter y la candidemia asociada a infección profunda y el seguimiento evolutivo de la infección al detectar cantidades decrecientes de anticuerpos en los pacientes que responden al tratamiento antifúngico.13,14,15)
b) Detección de anticuerpos en la aspergilosis broncopulmonar alérgica, aspergilosis pulmonar crónica y aspergiloma
El 90 % de los pacientes inmunocompetentes poseen anticuerpos detectables anti-Aspergillus.16,17Aspergillus fumigatus es quien, con mayor frecuencia, se encuentra implicado en el desarrollo de estas afecciones. Los individuos con fibrosis quística constituyen una población con riesgo importante para esta infección.18,19
El estuche comercial Aspergillus fumigatus IgG ELISA (IBL-America) permite determinar la presencia de anticuerpos IgG anti-Aspergillus en muestras de sueros de pacientes con sospecha clínica de aspergilosis pulmonar crónica.17)
El diagnóstico de aspergilosis broncopulmonar alérgica descansa en cinco criterios, entre ellos la detección sérica de anticuerpos específicos. PlateliaTM Aspergillus IgG (Bio-Rad, Francia) se basa en una técnica inmunoenzimática indirecta que permite detectar, en suero o plasma, IgG dirigidas contra un antígeno recombinante purificado de Aspergillus.20,21
Aspergillus fumigatus IgG ELISA IgG (Bordier Affinity Products SA, Suiza) permite la detección cuantitativa de IgG contra A. fumigatus en suero; también se utiliza para el seguimiento de pacientes en riesgo de desarrollar aspergilosis. Dumollard y otros refieren que esta técnica alcanza una sensibilidad del 97 % en pacientes afectados por diversos tipos de aspergilosis. De igual forma, se obtuvo una especificidad del 90,3 % en pacientes con síntomas respiratorios en los que se descartaron enfermedades relacionadas con Aspergillus.20
c) Detección de anticuerpos para el diagnóstico de las micosis endémicas
Histoplasmosis: existen pocas herramientas comerciales (Immy Diagnostics, Meridian, Diamedix; EE.UU.) las cuales se basan en la detección de anticuerpos mediante fijación del complemento (FC) o inmunodifusión.22) Estos aparecen entre la segunda y la sexta semana de infección por lo que no son útiles para el diagnóstico en etapas tempranas pero permiten prever las complicaciones crónicas, como las meningitis. En individuos seropositivos al VIH solo son detectables en el 50 % de los casos y la presencia de un título aislado solo indica que el paciente tuvo contacto con Histoplasma capsulatum.10
Los ELISA son poco utilizados debido a la dificultad para normalizar la técnica y a su difícil interpretación. Presentan reacciones cruzadas con paracoccidioidomicosis, blastomicosis, aspergilosis, candidiasis y coccidioidomicosis.23)
La inmunodifusión doble (IDD) se considera una prueba sencilla, económica y específica, aunque su sensibilidad es baja. Permite identificar dos bandas de precipitación entre la 4ta y 6ta semanas después de la exposición a H. capsulatum. Estas bandas corresponden al reconocimiento de los antígenos glicoproteicos H y M presentes en el suero de pacientes infectados.23,24 El antígeno H tiene homología con una β-glucosidasa y se detecta hasta en el 10 % de los casos. Los anticuerpos anti-H indican infección activa y se observan con mayor frecuencia durante la infección diseminada, histoplasmosis pulmonar cavitaria crónica o histoplasmosis pulmonar aguda muy grave y tienden a desaparecer mucho más rápido.23,25 El antígeno M tiene homología con una catalasa, se identifica en el suero de aproximadamente el 80 % de los pacientes y puede persistir durante años; su presencia indica infección tanto activa como pasada, o la aplicación reciente de una prueba intradérmica de histoplasmina.23,24
La FC es más sensible y menos específica que la IDD, pero requiere de experiencia y habilidad por parte del laboratorista. Los títulos de 1:8 y 1:16 se consideran débiles positivos y pudieran indicar una infección anterior, en especial en individuos de áreas endémicas. Se recomienda realizar simultáneamente a la IDD para alcanzar un mayor éxito en el diagnóstico.24)
Coccidioidomicosis: hace unos años, la prueba cutánea con esferulina o la coccidioidina, era el método de inmunodiagnóstico más empleado; sin embargo, esta resulta positiva en el 70 % de la población de áreas endémicas. Los ensayos comerciales de serodiagnóstico se basan en la detección de IgM o IgG ya sea en formato de ELISA, FC o IDD. La sensibilidad global es del 80 % pero pueden ser negativos en los estadios tempranos de infección. La probabilidad de falsos positivos es muy elevada cuando solo se evalúa IgM (82 %) y tienen sensibilidad reducida en pacientes inmunodeprimidos (50 %).5,26
Paracoccidioidomicosis: para su diagnóstico existen métodos basados en la IDD, la contrainmunoelectroforesis, la FC, la IFI y el ELISA. Se describe heterogeneidad alta en la validez diagnóstica. La sensibilidad y especificidad oscilan entre el 65-100 % y 90 % para la IDD cuando se utilizan filtrados de cultivos; entre 77-97 % y 95 % en la contrainmunoelectroforesis y entre 95-100 % y 88-93,4 % para el ELISA con filtrados de antígenos y gp43, respectivamente.27) La positividad depende de dos condiciones: la capacidad inmunológica del paciente de producir anticuerpos y un período ≥ 21 días desde el inicio de los síntomas. Los títulos son más elevados en los individuos que desarrollan la forma grave de la enfermedad y se pueden detectar hasta dos años después de tratar la infección.10
Detección de antígenos
A diferencia de la detección de anticuerpos, no necesita el tiempo de inducción de la respuesta inmune y no está influenciada por el estado inmunológico del paciente. Este tipo de diagnóstico está disponible para la mayoría de las micosis invasivas y demuestra utilidad en la histoplasmosis, la criptococosis, la aspergilosis y la candidiasis invasiva.28
a) Detección de antígenos en el paciente crítico con candidiasis invasiva
El manano es un polisacárido localizado en la pared celular de la mayoría de las especies del género Candida de importancia médica y las evidencias apuntan a la utilidad de su detección en líquido cefalorraquídeo (LCR) para el diagnóstico de la meningitis por Candida.29 Sin embargo, cada especie presenta un contenido de manano variable y en pacientes con CI la mananemia es de corta duración, por lo que a pesar de ser específico resulta poco sensible y se recomienda el estudio de muestras seriadas para mejorar este parámetro.14) Su detección mediante ELISA está disponible comercialmente (Platelia Candida Ag®; Bio-Rad, Francia). Esta prueba detecta residuos de manosa unidos por enlaces α (α-Man), la combinación con un ELISA que revele residuos de β-Man permite alcanzar mejores resultados (sensibilidad del 90 %, especificidad del 95 %, VPP del 79 % y VPN del 97 %).10
La determinación de manano y anticuerpos anti-manano de forma combinada está recomendada en las guías clínicas europeas para el diagnóstico y manejo de la candidiasis.14 Entre las limitaciones más importantes se encuentran la falta de reproducibilidad, la presencia de falsos positivos y negativos principalmente en los anticuerpos anti-manano y el gran número de resultados indeterminados en ambas técnicas.10
b) Detección de galactomanano
El galactomanano (GM) es un componente de la pared celular de Aspergillus, que se puede detectar mediante ELISA (Platelia Aspergillus; Bio-Rad, Francia) en suero, lavado broncoalveolar (LBA), biopsias, orina, LCR, líquido pericárdico y pleural de enfermos con aspergilosis invasiva (AI).5,11) Se considera la prueba de oro para su diagnóstico y constituye un criterio micológico de infección probable según el consenso de la EORTC/MSG (European Organization for Research and Treatment of Cancer/Mycoses Study Group del National Institute of Allergy and Infectious Diseases). (11
La mayor utilidad diagnóstica se describe en los pacientes oncohematológicos con riesgo de sufrir AI. En aquellos con neutropenia prolongada la sensibilidad es del 85 % y la especificidad superior al 95 %, con VPP y VPN mayores de 85 % y 95 %, respectivamente.12 En este grupo de pacientes puede detectarse antes de que las manifestaciones clínicas y radiológicas aparezcan, lo que facilita el comienzo temprano del tratamiento antifúngico. La concentración de GM en el suero es un reflejo de la carga fúngica en los tejidos; su disminución, mantenimiento o incremento, podrían orientar sobre la evolución de la infección y la respuesta al tratamiento impuesto.12
La detección de GM en el LBA de pacientes con neutropenia presenta también un valor diagnóstico alto (sensibilidad de 91,3 %, VPP de 76 % y VPN de 96 %).(6 Sin embargo, en otros grupos como los receptores de trasplante de órganos sólidos, la sensibilidad es menor. Esto se debe a la diferente capacidad angio-invasiva de Aspergillus respecto a los pacientes hematológicos.(6 No se refieren diferencias entre los pacientes pediátricos y adultos.6,12
Se describen varias fuentes de falsos positivos. Entre estos, la reactividad cruzada con otros hongos (Acremonium, Alternaria, Botrytis, Cladosporium, Cryptococcus, Fusarium, Paecilomyces, Penicillium, Rhodotorula, Wangiella), el uso de fármacos derivados de hongos (betalactámicos, sobre todo amoxicilina-ácido clavulánico y piperacilina-tazobactam) y otras formulaciones farmacológicas como la ciclofosfamida, inmunoglobulinas, hemoderivados y soluciones de alimentación parenteral. También se consideran fuentes de falsos positivos las dietas ricas en soja, la colonización digestiva por Bifidobacterium spp. y la enfermedad crónica de huésped contra injerto. Los resultados falsos negativos son infrecuentes y se asocian fundamentalmente al empleo de antifúngicos activos frente a Aspergillus, a las aspergilosis localizadas y a las infecciones por A. fumigatus ya que posee menos GM que otras especies.12,30
c) Detección de la glicoproteína de 40 kDa de Aspergillus
En el año 2008 se describió una prueba inmunocromatográfica conocida como Aspergillus lateral flow device. Esta resulta específica para una glicoproteína de 40 kDa secretada durante el crecimiento activo de Aspergillus. Se utiliza en muestras de suero o LBA y su lectura se efectúa a los 15 min.31) De forma global presenta sensibilidad y especificidad del 73,1 % y 50 %, respectivamente, siendo superiores en este último tipo de muestra.31,32) Entre las principales ventajas figuran requerir capacitación mínima de personal de laboratorio, el manejo simple mediante el uso de muestras de LBA sin ningún tratamiento previo, la disponibilidad rápida de los resultados y los bajos costos.11
d) Detección de antígenos para el diagnóstico de criptococosis
Debido a su rapidez (10-15 min), sencillez y especificidad, la detección del antígeno capsular del complejo de especies C. neoformans / C. gattii en líquidos orgánicos, especialmente LCR, es de especial interés ante la sospecha de meningitis criptococócica. Permite diagnosticar aproximadamente el 99 % de este cuadro y el 67 % de las formas diseminadas. La sensibilidad oscila entre 93 y 100% en pacientes con sida debido a que en este tipo de enfermos se describen aislados con poca cápsula y concentraciones antigénicas bajas.2,30,33
La cuantificación del antígeno es útil para controlar la evolución de la enfermedad, ya que el título desciende si la respuesta terapéutica es buena y suele aumentar en el LCR días antes de que se produzca una recaída.2,33) Las técnicas diseñadas para su detección están basadas en la aglutinación de partículas de látex o en el análisis inmunoenzimático. Estas se pueden aplicar a muestras de LCR, suero, secreciones respiratorias y orina. (10,11,30)
La aglutinación de partículas de látex sensibilizadas con gamma-globulina de conejo anti-polisacárido capsular de C. neoformans tiene una sensibilidad cercana al 95 % y una especificidad entre 93 % y 100 %.34 Se conocen falsos positivos debido a la presencia de factor reumatoideo, durante las infecciones por Trichosporon spp., Capnocytophaga canimorsus y en pacientes con septicemias o neoplasias. Las principales causas de falsos negativos se relacionan con la presencia de levaduras escasas, con poca o ninguna cápsula y al fenómeno prozona.10,11,34
Cryptococcal Antigen Lateral Flow assay (CrAg ® LFA) es una técnica inmunocromatográfica diseñada para la detección cualitativa y semicuantitativa del glucuronoxilomanano en muestras de suero, plasma, orina y LCR.11,35) Es una técnica sencilla, de fácil manejo, permite la obtención de resultados en 10 min, no requiere de personal especializado, de laboratorios con infraestructura avanzada, refrigeración, ni pre-tratamiento de las muestras y es útil hasta dos años a temperatura ambiente.11 La sensibilidad de la técnica en suero de pacientes seropositivos al VIH es del 93 % (IC 95 %: 66-100 %) y la especificidad del 100 % (IC 95 %: 88-100 %).36
e) Detección de antígenos para el diagnóstico de las micosis endémicas
Histoplasmosis: en esta micosis, la determinación antigénica se realiza principalmente en orina, aunque también se puede hacer en suero o LBA. El sistema más empleado es un ELISA, desarrollado por Immy diagnostics (Oklahoma Alpha Histoplasma EIA Test Kit) con una sensibilidad y especificidad del 81 % y 99 %, respectivamente.37 En pacientes inmunodeprimidos con histoplasmosis pulmonar subaguda o crónica la sensibilidad del ensayo es superior al 95 %. Sin embargo, existe reacción cruzada con otros hongos como Blastomyces dermatitidis, Coccidioides spp., Paracoccidioides brasiliensis y Aspergillus spp.5
El ELISA del laboratorio MiraVista (Indianapolis, EE.UU.) presenta una sensibilidad del 92 % en orina y del 100 % en suero de pacientes con infección diseminada.37 Sin embargo, en los casos con histoplasmosis pulmonar aguda o crónica la sensibilidad disminuye al 70 %. Este resultado se debe fundamentalmente a reacciones cruzadas con Blastomyces, lo que complica su uso en áreas endémicas de ambos patógenos.38
La detección de antígeno de Histoplasma en suero mediante un dispositivo de flujo lateral (MiraVista Diagnostics, Indianapolis, EE UU) en muestras provenientes de pacientes con sida e histoplasmosis diseminada confirmada por cultivo y de pacientes con otras infecciones tanto fúngicas como bacterianas mostró una sensibilidad de 95 % y una especificidad de 82 %.39,40) Además de presentar reacción cruzada con paracoccidioidomicosis, blastomicosis y peniciliosis, la antigenuria y la antigenemia pueden presentar falsos positivos debido a la presencia de anticuerpos humanos inespecíficos. También se observan resultados falsos negativos como consecuencia de una carga fúngica baja al momento de la toma de la muestra o al uso de antifúngicos.23
Paracoccidioidomicosis: el antígeno que más se emplea es el gp43. Se evaluó en muestras sanguíneas, respiratorias y LCR de centenares de enfermos demostrando sensibilidad diagnóstica y utilidad para realizar el seguimiento de esta infección. La detección del antígeno gp70 también resulta útil para el diagnóstico de esta micosis.10
Blastomicosis: existen técnicas de detección antigénica en orina y en muestras respiratorias para el diagnóstico de esta micosis. Aunque el número de enfermos en el que se evaluó no resulta representativo, su sensibilidad es del 90 % en orina y del 75 % en LBA. Su principal limitación son las reacciones cruzadas con otras infecciones fúngicas endémicas y oportunistas, en particular la aspergilosis y la criptococosis.10
Detección de componentes no antigénicos
La detección de componentes no antigénicos liberados por los hongos durante la infección es otra opción para el diagnóstico de las micosis. Entre ellos se destacan el D-arabinitol, metabolito producido durante la CI y el (1→3) β-D-glucano (BG), polisacárido presente en la pared celular de la mayoría de las especies fúngicas con la excepción de las especies del orden Mucorales y Cryptococcus spp. Estos liberan al medio de cultivo in vitro cantidades de BG< 200 pg/mL, por lo que dicha técnica no se recomienda para el diagnóstico de infecciones por estos agentes.30,41 En contraste, Candida spp. y Aspergillus spp. liberan una media de 2,119 pg/mL y 1,915 pg/mL, respectivamente.10
a) Detección de D-arabinitol
El D-arabinitol es un metabolito producido por C. albicans, C. tropicalis, C. parapsilosis y C. kefyr. Puede detectarse mediante cromatografía de gas-líquido en suero y orina de pacientes con CI.29)
Debido a que sus niveles son elevados en pacientes con fallo renal y este metabolito se excreta a través de los riñones al mismo ritmo que la creatinina, la proporción arabinitol/creatinina corrige sus variaciones en el suero debidas a la función renal. Candida solo produce D-arabinitol y el humano L-arabinitol por lo que la proporción D-arabinitol/L-arabinitol en la orina resulta un marcador temprano de la CI. Además, permite diferenciar a los pacientes con esta afección de los que tienen fallo renal. No obstante, la técnica resulta poco práctica debido a su complejidad.29)
b) Detección de (1, 3) β-D-glucano
La prueba diagnóstica se basa en la capacidad del BG de activar la cascada de coagulación en el lisado de amebocitos del cangrejo herradura Limulus polyphemus.42 Puede detectarse en los líquidos biológicos (principalmente suero) y la interpretación de los resultados requiere personal con experiencia en la prueba. En la actualidad se comercializan: Fungitec-G® (Seikagaku Kogyo Corporation; Japón), Wako® WB003 (Wako Pure Chemical Industries; Japón), B-G Star® (Maruha Corporation; Japón) y Fungitell® (Associates of Cape Cod Inc., EE. UU.). Todas detectan BG pero presentan diferencias en su límite de detección por lo que emplean puntos de corte diferentes.10
Se trata de una prueba diagnóstica panfúngica, por lo que un resultado positivo no permite identificar la especie causante de la infección. Es útil en el diagnóstico de AI en pacientes hematológicos (EORTC/MSG la aceptan para la clasificación de AI probable), de CI de origen abdominal y de neumonía por Pneumocystis jiroveci.43
Su detección presenta una sensibilidad del 90 % y una especificidad del 100 %. Su VPP es del 59 %, el VPN del 97 % y la eficacia global del 85 %.(10 Permite predecir la infección de etiología fúngica en poblaciones de alto riesgo y fiebre.44)
La sensibilidad analítica del ensayo está en el orden de 1 pg/mL. Los resultados falsos positivos se asocian a hemodiálisis, transfusión de sangre o derivados filtrados con membrana de celulosa, hemofiltración, bacteriemia por Streptococcus spp., Alcaligenes spp. y Pseudomonas aeruginosa, la exposición a gasas o esponjas quirúrgicas, en tratamiento con infusiones de albúmina e inmunoglobulinas, polisacáridos antitumorales (lentinano y polisacárido K), factores de coagulación, proteínas plasmáticas, quimioterapia antitumoral, amoxicilina-ácido clavulánico y piperacilina-tazobactam. Los resultados falsos negativos se relacionan con la existencia de sueros hiperpigmentados (bilirrubina y triglicéridos elevados), el tratamiento empírico o profilaxis antifúngica y las infecciones con especies que liberan poca cantidad de BG (Mucorales y Cryptococcus spp.).11,30,42)
Diagnóstico micológico mediante pruebas moleculares
Entre las técnicas moleculares que se utilizan en la identificación de hongos se describen: el análisis del polimorfismo de la longitud de los fragmentos de restricción (RFLP, del inglés, Restriction Fragment Length Polymorphism), la amplificación aleatoria de polimorfismos de ADN (RAPD, del inglés Random Amplifcation of Polymorphic DNA), la electroforesis de enzimas multilocus (MLEE, del inglés Multilocus Enzyme Electrophoresis), el uso de sondas de hibridación marcadas para la identificación de un fragmento específico de ADN (hibridación Southern o Southern blot) y la amplificación de diferentes fragmentos de ADN específicos mediante la reacción en cadena de la polimerasa (PCR, del inglés, Polymerase Chain Reaction) y sus modificaciones. Entre estas últimas se destacan la reacción en cadena de la polimerasa en tiempo real (qPCR, del inglés Real Time Polymerase Chain Reaction) y la PCR anidada.8,23
La amplificación de dianas acoplada a la secuenciación de los productos amplificados permite una identificación más precisa de diferentes agentes, tanto directamente de muestras clínicas como a partir de cultivos.9 A continuación se abordarán las técnicas moleculares más utilizadas en el diagnóstico micológico basadas en el formato PCR.
Secuenciación de ácidos nucleicos fúngicos
El progreso creciente en la tecnología y la disponibilidad de las secuencias del genoma completo de muchos hongos facilitó la aplicación de métodos basados en las secuencias del ADN en la investigación y el diagnóstico de diferentes microorganismos. La identificación se logra al comparar la secuencia del producto de amplificación que se obtiene a partir de muestras o cultivos con una base de datos de secuencias de especies conocidas. Es un método específico y rápido, por lo que se considera el candidato a convertirse en el prueba de referencia para la identificación de estos agentes.8)
La diana que se emplea con mayor frecuencia es la que codifica el complejo de los ARN ribosomales (genes 5,8S, 18S y 28S). Estos genes contienen secuencias conservadas comunes a todos los hongos, dominios variables y regiones espaciadoras internas, altamente variables. En dependencia del objetivo del método se pueden emplear para detectar secuencias muy conservadas e inespecíficas o variables y muy específicas.5)
a) Identificación de levaduras
La diferenciación por el método molecular es indiscutible para especies idénticas desde el punto de vista fenotípico. En los últimos años se reconocieron como patógenos humanos a C. dubliniensis, C. orthopsilosis, C. metapsilosis, C. nivariensis, C. bracariensis y C. auris; estas son fenotípicamente indistinguibles de C. albicans, C. parapsilosis, C. glabrata y C. haemulonii, respectivamente. Así mismo, el género Trichosporon sufrió varias reclasificaciones; en particular T. beigelii, se desplegó en al menos 18 especies. Estos y otros hallazgos proporcionaron el desarrollo de la identificación molecular mediante secuenciación. Las dianas que se emplean con más frecuencia para identificar las levaduras son la región D1/D2 del 28S ADNr y los espacios de transcripción internos 1 y 2 del ADNr, conocidos como ITS, del inglés internal transcribed spacer.5,45
b) Identificación de hongos filamentosos
Para los hongos filamentosos, la secuenciación de los ITS resuelve menos especies que en el caso de las levaduras. Por ejemplo, para Aspergillus y Scedosporium se debe emplear el gen de la beta-tubulina y para Fusarium el que codifica para el factor de elongación alfa.46,47,48
Sondas para la identificación de hongos patógenos
a) Histoplasma capsulatum
En este particular la PCR diagnóstica está más avanzada que en otras micosis endémicas.38 Existen diferentes protocolos tanto de qPCR como convencional dirigidos a la amplificación de la región transcrita interna, ITS o de genes de copia única como el Hc100p o el SCAR220.5) La sensibilidad y especificidad global de estos métodos fueron del 86 % y el 100 %, respectivamente, siendo más sensibles los basados en qPCR, lo que depende de las características de los oligonucleótidos que se utilicen para la amplificación (Cuadro 2).3,49
Cuadro 2 Genes blancos y secuencias de los oligonucleótidos utilizados para el diagnóstico molecular de la histoplasmosis23

*Combinado con: A (5’-CAC GCC GTG GGG GGC TGG GAG CCT-3’ y 5’-CGG TGT CCC CGG CGG ACA CGG GCC C-3’), B (5’-GGG CCC GTG TCC GGG GAC ACC GG-3 y 5’-CCC GGA ATA TCC AGG GGG CGC AA-3’), y C (5’-TGA TTG GCG TCTGAGCAT G-3 y 5’-ATG GTG GGC RGGAGCCGGCC-3’).
**Combinado con las sondas FRET: HC1-Fluos 5’- GTC GGT GAA CGA TTG GCG T-3’ y HC1-Red 5’- LCRED640-GAG CAT GAG AGC GAT AAT AAT CCA GT-3’.
El advenimiento de estas técnicas trajo consigo avances importantes tanto en la localización de nuevas zonas endémicas como en el conocimiento de la relación paciente-fuente de infección. Hasta hace pocos años se describían tres variedades de la especie: H. capsulatum var. capsulatum, H. capsulatum var. duboisii e H. capsulatum var. farciminosum. Las diferencias en las secuencias del ADN diferencian ocho clados: norteamericana clase 1 (clado 1); norteamericana clase 2 (clado 2); latinoamericana grupo A (clado 3); latinoamericana grupo B (clado 4); australiana (clado 5); holandesa (clado 6); eurasiática (clado 7) y: africana (clado 8). Estos conocimientos básicos tributan a una mejor comprensión de la epidemiología de la enfermedad que ocasiona.23,50
b) Aspergillus spp.
En los últimos años se diseñaron marcadores moleculares para el diagnóstico de la AI (Cuadro 3).
El uso de estos marcadores permite el diagnóstico en las primeras fases de la enfermedad y diferenciar las especies de Aspergillus de importancia médica. Las pertenecientes a la sección Fumigati, con morfotipos casi indistinguibles al de A. fumigatus, tienen diferentes perfiles de susceptibilidad a los antifúngicos (Ej. A. lentulus) por lo que una mala identificación repercute en el tratamiento de los pacientes. Entre los inconvenientes para su aplicación se encuentra la baja reproducibilidad de la técnica entre los laboratorios.51)
c) Candida spp.
Existen varios procedimientos para la identificación de especies de Candida a partir de amplificaciones por PCR. Además de los genes ribosomales (5.8S y 18S rARN), también se utilizan las secuencias ITS con resultados satisfactorios. Estas pruebas se caracterizan por ser rápidas y fieles (sensibilidad del 70-100% y especificidad del 98-100%). Los resultados se alcanzan en menos de 10 horas independientemente de la variante. La desventaja es que los oligonucleótidos que utilizan son “universales” y amplifican fragmentos de ADN de tamaños similares que están conservados en todas las especies de Candida. La combinación de la PCR con el RFLP permite obtener perfiles particulares de acuerdo con la especie o aislado. Esta metodología diferencia 16 especies de levaduras de importancia clínica, entre ellas C. tropicalis, C. parapsilosis, C. kruseii, C. glabrata, C. dubliniensis y C. auris.7,52
d) Cryptococcus spp.
Las pruebas moleculares para la identificación y diferenciación del complejo C. neoformans /C. gattii permiten agrupar las especies de dicho complejo de acuerdo con sus patrones moleculares. Entre estas técnicas se destacan la PCR con iniciadores universales como el M13, (GACA)4 y (GTG)5, el análisis del polimorfismo en longitud de fragmentos amplificados (AFLP), el RFLP de los genes URA5 y PLB1, así como la tipificación de secuencias multilocus o MLST, de siete genes conservados (CAP59, GPD1, LAC1, PLB1, SOD1, URA5 y IGS1).53,54
Hoy se reconocen 10 genotipos: VNI/AFLP1, VNII/ VNIB/AFLP1A, VNII/AFLP1B, VNIV/AFLP2, VNIII/ AFLP3, VGI/AFLP4, VGII/AFLP6, VGIV/AFLP10, VGIII/AFLP5 y VGIV/AFLP7. Este hallazgo y otras diferencias en cuanto a la fisiología, los perfiles de susceptibilidad in vitro, la patogenicidad y las manifestaciones clínico-epidemiológicas, entre otros aspectos, sustentan la propuesta de elevar a nivel de especie a cada uno.53,54
e) Coccidioides immitis y Coccidioides posadasii
Entre las técnicas moleculares disponibles para la identificación de Coccidioides, a partir de exudados, tejido fresco, tejido embebido en parafina y tejido fijado con formalina, se encuentran la PCR anidada y la qPCR.55) La primera es capaz de amplificar un fragmento de 340 pb del gen que codifica el antígeno específico Ag2/PRA con la que se alcanza un 98 % de sensibilidad y un 100 % de especificidad.56 La segunda, se basa en la identificación de un fragmento de 170 pb de la región ITS2 con una sensibilidad y especificidad del 100 % y 98,4 %, respectivamente, en muestras de tracto respiratorio. Estos valores son ligeramente inferiores en tejidos frescos (92,9 y 98,1 %) y en tejidos parafinados (73,4 y 100 %).57
La diferenciación entre C. immitis y C. posadasii alcanza su máximo valor en los estudios clínico-epidemiológicos. Esto es posible con el empleo de sondas Taqman para la amplificación de las secuencias blanco prolina 157, prolina 174 y glucosa sintetasa 192.58
Detección de los mecanismos de resistencia a los antifúngicos
Existen varias pruebas para detectar los mecanismos de resistencia en aislados e incluso directamente de muestras clínicas. Varias alteraciones de los genes ERG11 en levaduras y CYP51 en hongos filamentosos se relacionan con la pérdida de actividad de los azoles. Entre estas se destacan las mutaciones puntuales, la sobreexpresión del gen, la amplificación debida a la duplicación cromosómica, la conversión genética y la recombinación mitótica. Las más frecuentes son las primeras, las cuales de detectan mediante técnicas de PCR.59,60,61
Otro mecanismo frecuente en levaduras es la reducción de las concentraciones intracelulares de los azoles. Estas están mediadas por la sobreexpresión de los genes que codifican para las bombas de expulsión: los transportadores ABC (del inglés ATP binding cassette) y los MFS (del inglés major facilitators superfamily).45
La resistencia a caspofungina y otras equinocandinas suelen deberse a mutaciones de los genes de la vía de la síntesis de glucano, en especial en el gen FSK1, las cuales pueden detectarse en aislados clínicos mediante PCR múltiple en tiempo real.45
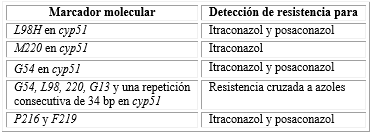
También se describen marcadores moleculares que detectan mutaciones asociadas con resistencia a triazoles en A. fumigatus (Cuadro 4). Sin embargo, su uso está limitado debido a que en la misma secuencia del gen cyp51 pueden existir otras mutaciones asociadas con la resistencia.51
Tipificación subespecífica de aislados clínicos
Los métodos de tipificación molecular se aplican para analizar brotes de infección intrahospitalaria y en estudios de genética poblacional. Entre otras, se emplean el análisis de isoenzimas y otras técnicas basadas en la PCR como el RFLP, el RAPD, el SSDP (del inglés, sequence-specific DNA primers), el PMM (del inglés, polymorphic microsatellite markers) y el MLST el cual se basa en la secuenciación de varias dianas. Algunas discriminan solo entre subespecies y otras son capaces de distinguir entre aislados individuales.45)
Espectrometría de masas en el diagnóstico fúngico
En la última década la espectrometría de masas MALDI-TOF (del inglés, Matrix-Assisted Laser Desorption/ Ionization-Time-of-Flight) se introdujo en el campo de la microbiología para la identificación de diferentes agentes. Esta técnica permite la obtención de una huella peptídica como resultado de la ionización suave de las proteínas ribosomales, lo cual crea un espectro de masas que es especie específico y permite crear bases de datos con los patrones que presenta cada una.8,62)
Durante el proceso, el espectro del agente a identificar se compara automáticamente con la base de datos de referencia y el resultado se emite a través de un puntaje de similitud entre ambos. La identificación puede hacerse directamente a partir de los aislados o de sangre y orina. La técnica es de fácil implementación, confiable, rápida y precisa para la identificación de especies fúngicas de importancia médica.8,62,63
La comparación entre los métodos convencionales y el MALDI-TOF demuestra que este permite identificar de forma correcta 27,5 % más aislados filamentosos hasta 50 veces más rápido; esta ventaja se amplía aun más al emplearse directamente muestras de hemocultivos, lo que permite seleccionar el tratamiento antifúngico apropiado de forma oportuna. A pesar del importe relativamente elevado del equipo, el precio de la identificación por muestra está por debajo de 1,35 € lo que lo hace costo efectivo.8,62)