Introducción
Fasciola hepatica es un trematodo hermafrodita que causa fascioliasis.1 Afecta a animales herbívoros, omnívoros y ocasionalmente al humano.2 Esta parasitosis presenta amplia distribución mundial, notificándose desde 1950 en 51 países. Se estima que de 2,4 a 17 millones de personas en el mundo están infectadas y 91 millones están en riesgo de infección, de las cuales, aproximadamente la mitad viven en Bolivia, Ecuador y Perú.3 Es un problema de salud pública, así como una enfermedad tropical desatendida. En Perú, las más altas prevalencias en humanos y animales se dan en valles andinos, hasta los 4 500 m, entre las regiones de Arequipa, Cajamarca, La Libertad, Apurímac, Ayacucho, Huánuco, Cuzco, Puno, Piura, Lambayeque y Junín.4 La transmisión ocurre principalmente en poblaciones rurales dedicadas a la agricultura. La población de edad escolar es la más afectada5 y el órgano más dañado es el hígado. Este parásito requiere de reservorio y un huésped intermediario para completar su ciclo biológico.4 En la región Apurímac no existen estudios en humanos sobre esta enfermedad, a pesar que presenta características ambientales y sociales similares a las zonas hiperendémicas de Perú con prevalencias en bovinos y tasas de decomiso de hígados superiores a 80 %.6 La provincia con mayor grado de infección es Andahuaylas, debido a su mayor altitud y a que sus periodos de lluvia coinciden con la estación de verano, donde la población de caracoles y la posibilidad de infección aumentan.7) Diversos autores han sugerido posibles asociaciones entre fascioliasis y coinfección con enteroparásitos,8,9,10 además de afectar al estado nutricional;11,12,13 sin embargo, esto aún no está demostrado. Por tanto, el objetivo de la investigación fue determinar la asociación de fascioliasis con parásitos intestinales y el estado nutricional de niños.
Métodos
Lugar de ejecución y periodo de duración
El estudio se realizó en el distrito de Santa María de Chicmo, uno de los 19 distritos de la provincia de Andahuaylas, región Apurímac y se encuentra a una altitud de 3 272 m.14
El análisis coprológico se realizó en el Laboratorio Referencial de la Dirección Regional de Salud Apurímac-Abancay y el análisis serológico se realizó en el Laboratorio de Zoonosis Parasitaria del Centro Nacional de Salud Pública (CNSP) del Instituto Nacional de Salud (INS), en la ciudad de Lima. El periodo de ejecución fue de septiembre de 2016 a abril de 2017.
El estudio fue analítico de corte transversal. Se tomaron 493 muestras de suero sanguíneo y heces a niños de ambos sexos de 6 a 16 años de edad en instituciones educativas de educación primaria y secundaria del distrito de Santa María de Chicmo, Andahuaylas. Asimismo, se les tomó medidas antropométricas y se les aplicó una entrevista epidemiológica para identificar los signos clínicos de fascioliasis.
La población de niños de 6 a 16 años estuvo constituida por 2 172 individuos.14 El tamaño de muestra fue de 435 niños y se determinó mediante un muestreo simple al azar. Además, para que el muestreo fuera más eficiente se distribuyó el tamaño total de la muestra entre los estratos I.E. Primaria e I.E. Secundaria, resultando 209 y 226 muestras, respectivamente. Sin embargo, se logró tomar 493 muestras coprológicas y serológicas repartidas proporcionalmente entre la totalidad de las 23 instituciones educativas; con ello se logró una distribución optimizada. El número de estudiantes de cada institución educativa se obtuvo del censo escolar del Ministerio de Educación.15
Las muestras serológicas y coprológicas de los niños se obtuvieron coordinando previamente con los directores de las Instituciones Educativas. Los niños incluidos en el estudio fueron elegidos aleatoriamente; se les entregó un kit que contenía un frasco para la toma de muestra de heces; una ficha para el consentimiento informado, a ser llenada por el padre o apoderado y una ficha para el asentimiento del niño.
Para todos los procedimientos de laboratorio se siguieron los protocolos del Instituto Nacional de Salud del Ministerio de Salud de Perú.16,17 Ergo, los procedimientos para levantar información se detallan a continuación:
Técnica de ensayo inmunoenzimático (ELISA-IgG) para el diagnóstico de fascioliasis:
La técnica de ELISA-IgG se usó como una prueba de tamizaje, para lo cual se emplearon kits de ELISA-IgG (in house) para el diagnóstico de fascioliasis.18 Dicho diagnóstico se realizó con la asesoría del personal profesional del Laboratorio de Zoonosis Parasitaria del CNSP-INS, Lima.
Se usó el antígeno metabólico “crudo” excretado/secretado de Fasciola hepatica (AMESFH) con una concentración proteica de 1mg/ml. La lectura se realizó con el equipo lector de ELISA. El valor de corte se logró obteniendo el valor promedio de las densidades ópticas de cada placa al cual se le sumó el valor de dos desviaciones estándar.
Técnica de inmunoblot para el diagnóstico de fascioliasis (IB-IgG):
Esta técnica se usó como prueba confirmatoria según el protocolo correspondiente.18 Se usó el antígeno metabólico total excretado/secretado de Fasciola hepatica (AMESFH) a una concentración de 2,07 ug/uL. El criterio de positividad para el diagnóstico es el reconocimiento de uno o más péptidos antígénicos de Mr entre 17 y 23 KDa.19
Análisis coproparasitológico con la técnica de sedimentación rápida (TSR) (Concentración por sedimentación sin centrifugación):
Método cuantitativo de KATO-KATZ (Análisis cuantitativo= hpg):
Se basa en la técnica de Kato y permite cuantificar la presencia de huevos de helmintos. Se expresa en número de huevos por gramo de heces (hpg). El número de huevos encontrados en la lámina se multiplica por k (k= 4), el resultado es el número de huevos por gramo de heces (hpg). Deben contarse todos los huevos del preparado. En caso de heces líquidas o pastosas, se usaron los factores de corrección que se incluyen en el kit: k/2 para heces “sueltas” y K/3 para heces diarreicas.16,20) El grado de infección por helmintos (alto, medio o bajo) se identificó conforme a los rangos propuestos por el Comité de Expertos de la OMS.16
Para determinar los signos clínicos:
La sintomatología se obtuvo realizando una anamnesis a la totalidad de niños mediante una entrevista epidemiológica para determinar los síntomas clínicos principales durante el último mes. Asimismo, se consideró la edad (6-8; 9-11; 12-14 y ≥15 años), género (varón o mujer) e institución educativa (Primaria o Secundaria). Se buscó la presentación de síntomas de fascioliasis más frecuentes, como: malestar, fatiga, dolor abdominal, náuseas, vómitos, diarrea, hiporexia, fiebre, astenia, dispepsia, anorexia, pérdida de peso, urticaria, íctero, cefalea toz seca, nódulo, entre otros.22
Para determinar el estado nutricional:
El estado nutricional de los niños (varones y hembras) se determinó antropométricamente a través de dos indicadores: Índice de Masa Corporal (IMC), varones y hembras por separado, de acuerdo con el protocolo del Centro Nacional de Alimentación y Nutrición de la Dirección Ejecutiva de Prevención de Riesgo y Daño Nutricional del Instituto Nacional de Salud de Perú, el cual está basado en protocolos actuales de la OMS.23,24,25 Con los valores de peso y talla del niño se calculó el IMC (kg/m2), de acuerdo con la siguiente fórmula: IMC= peso (kg) / talla (m) / talla (m).
El procesamiento y análisis de datos se realizó con el programa Excel de Windows 2010 y el programa Statistical Package for the Social Sciences SPSS 23. Se realizaron pruebas de regresión logística univariada y multivariada para determinar posibles asociaciones de la fascioliasis con la edad de los niños; Institución Educativa; sexo; coinfección con enteroparásitos; carga parasitaria; clasificación parasitaria; tipo de parásito e Índice de Masa Corporal, considerando a la menor cifra como referente y buscando el mejor modelo biológico. Asimismo, se compararon estadísticamente las variables categóricas con el test de Ji cuadrado (X2) y odds ratio (OR) con intervalos de confianza al 95 % y valor de p≤ 0,05 como nivel crítico de significancia.
Consideraciones éticas
El proyecto de investigación fue aprobado por el Instituto Nacional de Salud, mediante Resolución Directoral No 870-2016-OGITT-OPE/INS, el cual contempló el visto bueno del Director Ejecutivo de la Oficina Ejecutiva de Investigación de la OGITT del INS y la opinión favorable del Comité Institucional de Ética en Investigación del Instituto Nacional de Salud para ser ejecutado. Las muestras de los estudiantes se tomaron con su asentimiento y el consentimiento informado de los padres o apoderados, quienes firmaron una autorización para que los niños formen parte de la investigación y proporcionen muestras serológicas y coprológicas, además de la entrevista y toma de medidas antropométricas.
Resultados
La prevalencia de fascioliasis mediante IB fue de 5,3 % (IC95%= 3,2-7,4; 26/493) y mediante TSR fue de 0,8 % (IC95%= 0,2-2,1; 4/493). La tabla 1 indica que los factores edad, sexo e institución educativa no mostraron asociación estadística significativa con fascioliasis (p˃ 0,05).
Tabla 1- Seroprevalencia de fascioliasis y factores asociados en niños del distrito de Santa María de Chicmo

* Técnica de inmunoblot.
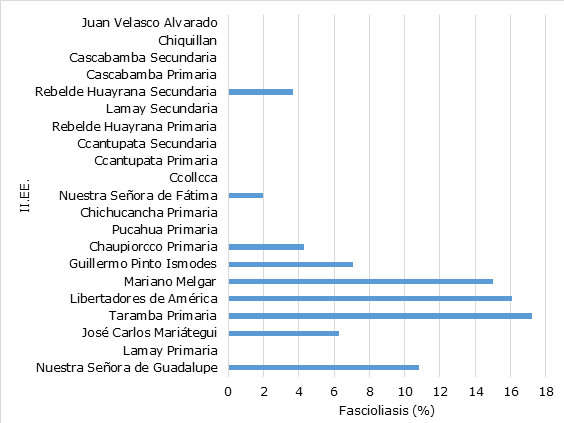
Las instituciones educativas que presentaron mayor prevalencia de niños con fascioliasis fueron Taramba con 17,2 % (5/29), Libertadores de América con 16,1 % (5/31), Mariano Melgar con 15 % (3/20) y Nuestra Señora de Guadalupe con 16,8 % (4/37), las cuales mostraron niveles hiperendémicos por presentar prevalencias superiores a 10 %, de acuerdo con la clasificación endémica existente para esta parasitosis en humanos; (26 tal como muestra la figura.
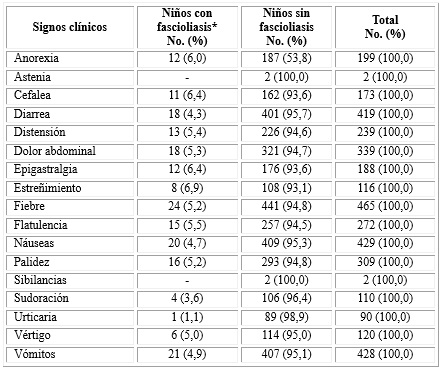
La tabla 2 muestra las frecuencias absolutas y porcentuales de los signos clínicos presentados por los niños.
Tabla 2. Frecuencias absolutas y porcentuales de signos clínicos de fascioliasis en niños del distrito de Santa María de Chicmo
*Técnica de sedimentación rápida.
La tabla 3 muestra que no se encontró asociación entre fascioliasis y la enteroparasitosis en los niños (p˃ 0,05).
Tabla 3- Asociación entre enteroparasitosis y seroprevalencia de fascioliasis en niños del distrito de Santa María de Chicmo

Los niños con carga parasitaria alta (hpg) de H. nana mostraron asociación con fascioliasis (OR= 7,6; IC95%= 1,4-41,0; p= 0,019). Las cargas parasitarias de los otros parásitos no mostraron asociación (p˃ 0,05).
La tabla 4 muestra que, los niños con poliparasitismo, así como los infectados con protozoarios, tuvieron 29,6 y 10,5 veces, respectivamente, más fuerza de asociación a presentar fascioliasis frente a aquellos niños sin enteroparasitosis.
Tabla 4- Asociación entre el tipo/clasificación de enteroparásitos y seroprevalencia de fascioliasis en niños del distrito de Santa María de Chicmo

* Técnica de inmunoblot; ** Técnica de sedimentación rápida.
El estudio advirtió que el peso promedio de los niños con fascioliasis fue 33,22 kg (desviación estándar ENT#091;DEENT#093;= 13,44) y de los niños sin fascioliasis fue 35,22 kg (DE= 11,24). Asimismo, la talla promedio de los niños con fascioliasis fue 1,72 cm (DE= 1,93) y de los niños sin fascioliasis fue 1,36 cm (DE= 0,15). Sin embargo, el análisis de diferencia de medias, no mostró diferencia estadística significativa entre el peso (t= 0,743; p= 0,464) y talla (t= -0,933; p= 0,395) de los niños con y sin fascioliasis.
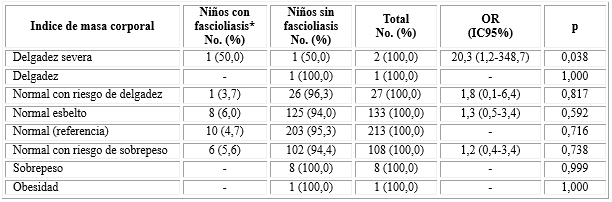
La tabla 5 muestra que en el estudio no se encontró asociación estadística significativa entre fascioliasis y la valoración nutricional antropométrica en niños (p˃ 0,05), a excepción de la delgadez severa que mostró 20,3 veces más fuerza de asociación a fascioliasis que los niños con índice de masa corporal normal (referencial).
Discusión
La búsqueda de huevos de fasciola humana en heces es poco sensible, ya que no aparecen en la fase aguda de la infección y, en la fase crónica se deben repetir varias veces por la intermitencia en la eliminación de huevos. Las técnicas de diagnóstico inmunológico tienen la ventaja de ser aplicables durante todas las fases de la enfermedad, especialmente en la fase aguda y en las presentaciones extrahepáticas.17,21 Asimismo, la mayor positividad de fascioliasis mediante la técnica de ELISA frente a la de TSR, hallada en este estudio, podría deberse a la infección de los niños en el pasado, a través de la ingestión de verduras como ingredientes en ensaladas o en jugos; (18,21 por lo que es importante considerar la posibilidad de que los niños presenten una no habitual fascioliasis extra hepática.21 Por otro lado, la mayor positividad de casos mediante la técnica de ELISA frente a la de IB se debería a la reactividad cruzada con otros helmintos. En consecuencia, consideramos inmunodiagnóstico positivo para fascioliasis, cuando se presentan conjuntamente los dos ensayos positivos (ELISA e IB). Los resultados demuestran la utilidad de combinar dos técnicas inmunoserológicas que permiten un despistaje inicial de la población con ELISA y un examen confirmatorio para llegar al diagnóstico definitivo a través del IB, superando así la baja sensibilidad del estudio coprológico con TSR.18,27
La prevalencia de fascioliasis encontrada en el estudio clasifica al distrito de Santa María de Chicmo como mesoendémico, debido a que se encuentra entre 1% y 5%,26 al igual que otras zonas de Perú como Huancabamba, Arequipa, Chontabamba, Celendín, Huancavelica, San Juan, Baños del Inca y Caujul.2,4) Las regiones endémicas se encuentran en zonas altoandinas, debido a que a mayor altitud los vectores, caracoles limneidos infectados, sobreviven más tiempo, ya que el período de eliminación de cercarias es más largo y el número de metacercarias producidas por el caracol es más grande.19 Las localidades rurales más altas y alejadas de las ciudades, con difícil acceso por carreteras, pueden tener mayor riesgo de infección humana. Por otro lado, la prevalencia hallada en este estudio es similar a lo informado en zonas mesoendémicas de Los Andes ecuatorianos,28 Cuba,29 Kirguistán30 y algunas localidades venezolanas,31 mexicana22,32 y egipcias.33
La investigación no mostró diferencia entre grupos de edad; sin embargo, los niños de seis años, en contraste con los de mayor edad, presentaron una prevalencia mayor a 10 %, lo que se consideraría como hiperendemia.20) Estos hallazgos podrían ser clasificados como un brote epidémico debido a que en la zona de estudio la fascioliasis es endémica en animales, pero no en humanos, alcanzando prevalencias de hasta 79,5 % en bovinos.7 Los brotes suelen afectar a pocos individuos, los cuales resultan infectados a partir de la misma fuente de contaminación (familiar, grupal, consumo de berros u otras hortalizas de cultivo silvestre portadoras de metacercarias).20
Del mismo modo, no se encontró diferencia entre la prevalencia de instituciones educativas de primaria y secundaria, al igual que en otras investigaciones,34 ratificando que la población humana de edad escolar es la que presenta mayor riesgo de infección por fascioliasis,3,34 no necesariamente por ser más susceptible al deficiente sistema sanitario de las zonas endémicas, sino a la deficiente inmunidad que existe en esta población para evitar la infección.34
Por otro lado, esta investigación tampoco mostró diferencia en la prevalencia entre varones y hembras, debido a que las labores de campo son compartidas entre ambos; así como, la participación igualitaria de estos en los centros educativos,3,26,28 tal como se muestra en la tabla 1. Asimismo, porque el tubo digestivo tiene la misma conformación en varones y hembras, los hábitos alimenticios son similares en ambos y tienen las mismas oportunidades de infectarse.28 No obstante, existen estudios en países como Turquía, Egipto e Irán que informan un predominio del sexo femenino en pacientes con fascioliasis.29
Las diferentes prevalencias de fascioliasis entre instituciones educativas, se deberían a que, las instituciones que se encuentran más alejadas del centro poblado tienen menor accesibilidad a servicios básicos como agua y alumbrado eléctrico.2 De la misma forma, la mayor cercanía a acequias podría aumentar la probabilidad de infección debido a que los niños mantienen contacto con aguas contaminadas, en las que se ha demostrado que la metacercaria es viable.3 Asimismo, los niños que eliminan sus heces en silos tienen mejores hábitos higiénicos que aquellos que eliminan sus heces en el campo, río o acequias (donde está la fuente de infección).26 Además, no solo se contamina el agua, sino que este a su vez puede contaminar plantas que son alimento para niños, a los que podría infectar.5
En cuanto a la presentación de signos clínicos en niños, si el signo clínico está presente por menos de cuatro meses, el caso debe considerarse agudo, pero de no presentarse se debe considerar que el caso tiene una infección latente asintomática; ya que el daño y los cambios histopatológicos en el hígado son aproximadamente proporcionales a la cantidad de parásitos. Además de esto, la motilidad del parásito, su tasa de crecimiento y sus efectos inmunológicos y tóxicos son importantes en la evolución del proceso patológico. Estas manifestaciones pueden aparecer, dependiendo del número de metacercarias ingeridas, desde algunos días hasta 2-3 meses después. La forma aguda dura 1-3 meses. El dolor abdominal, de leve a severo, en hipocondrio derecho o subxifoideo a veces generalizado se acompaña de hiporexia, flatulencia, náuseas, vómitos y diarrea;17 a diferencia de esta investigación, donde no se encontró asociación entre fascioliasis y los signos; por lo que los signos hallados estarían atribuidos a otras parasitosis.
El estudio no mostró asociación entre fascioliasis y enteroparásitos en niños; sin embargo, se encontró que Hymenolepis nana y Áscaris lumbricoides, entre otros, fueron coinfectantes (8,3 % y 6,3 %, respectivamente), al igual que lo informado por otros autores.3,22 La presencia de estos parásitos coinfectantes se debería a una fuente común de contaminación en niños, probablemente a través del agua; así como, a sus deficientes hábitos de higiene y la contaminación fecal a la que están expuestos.21,28
Se encontró asociación entre fascioliasis y la carga parasitaria alta de Hymenolepis nana (OR= 8,4), concordante con un estudio realizado en México donde se demostró la coinfección entre ambos parásitos,22,26 sin mencionar el nivel de carga parasitaria. Esta asociación se debería a que la hymenolepiasis es frecuente en áreas geográficas cálidas, templadas y secas de países en vías de desarrollo, y se identifica principalmente en niños, al igual que la fascioliasis. Tal es así que, la infección se produce por la ingesta de alimentos contaminados con huevos del parásito, por lo que no necesita huéspedes intermediarios; sin embargo, también está en íntima relación con las condiciones de insalubridad donde se desarrolla el niño, tales como falta de agua potable y mala higiene ambiental, particularmente en condiciones de hacinamiento como ocurre en colegios.1,30 Los huevos de H. nana que se eliminan por las heces son directa e inmediatamente infectantes, lo que inicia otro ciclo que puede producir autoinfección, aumentando la carga parasitaria.30) Este hallazgo evidencia las deficiencias en saneamiento y educación para la salud como factores de riesgo en la adquisición de fascioliasis e hymenolepiasis,31 ya que este último no necesita hospederos intermediarios. La H. nana se observa con frecuencia en niños por la facilidad de transmisión directa y por algún factor inmunitario no bien definido, que se desarrolla con la edad.4 La carga parasitaria de Fasciola hepatica alcanzó una intensidad de 50-300 hpg (moderada), por encontrarse en una zona mesoendémica,17 debido a que el grado de infección depende de la cantidad de especímenes adultos que se alojan en las vías biliares, por lo que el hallazgo de huevos en heces está en función del número de parásitos y de la cantidad de huevos que expulsen.21
El estudio mostró asociación entre la clasificación parasitaria y fascioliasis, donde niños con poliparasitismo tuvieron riesgo de contraer fascioliasis frente a niños que no presentaron parásitos al examen coprológico (OR= 29,6); debido a que, cuando dos o más parásitos infectan simultáneamente, los efectos son más severos en niños, por lo que el diagnóstico y descripción de estas asociaciones son importantes para un tratamiento antiparasitario específico.
No se encontró asociación entre fascioliasis y la valoración mediante el Índice de Masa Corporal, al igual que estudios realizados en Lima y Venezuela, donde no se encontró asociación entre el nivel de nutrición y parasitosis en niños;4,33 sugiriendo que, la causa de desnutrición en esta población fue multifactorial y que la parasitosis fue un factor contribuyente pero no determinante de la misma. Asimismo, el concepto de malnutrición o desnutrición no solo deriva de los parámetros antropométricos, que son valiosos, pero no suficientes ni contundentes en esta población etaria.33 El bajo peso y menor talla de los niños comparativamente con los de la costa, pueden deberse, entre otras causas, a una desnutrición crónica acentuada por el alto parasitismo encontrado.28)
Tampoco se encontró asociación entre fascioliasis y la valoración mediante Talla para Edad. Sin embargo, la tendencia a la talla baja y la elevada presencia de parásitos coinfectantes sugieren el impacto negativo de la infección parasitaria en el estado nutricional de los niños, lo que ameritaría profundizar los estudios, ya que la presencia de estos parásitos dificulta el análisis del impacto de la fascioliasis en el desarrollo infantil. (29
Conclusiones
El estudio determinó que no existe asociación de la fascioliasis con el estado nutricional ni con la coinfección enteroparasitaria en niños. Consecuentemente, las diversas manifestaciones de signos clínicos de los niños, atribuidas comúnmente a fascioliasis, se deberían también a la elevada presencia de parásitos entéricos.