Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.15 n.3 Ciudad de la Habana sep.-dic. 1999
Artículos de Revisión
Instituto de Hematología e InmunologíaVitamina B12: metabolismo y aspectos clínicos de su deficiencia
Lic. Mariela Forrellat Barrios, Lic. Irma Gómis Hernández y Dra. Hortensia Gautier du Défaix GómezRESUMEN
Se hace una revisión sobre el metabolismo de la vitamina B12, su estructura química, fuentes dietéticas y requerimientos en los diferentes grupos de edades, así como su absorción y distribución en el organismo. Se explica además la función metabólica de las cobalaminas y su papel en la etiología de las anemias megaloblásticas, así como las causas de deficiencia de esta vitamina y su tratamiento.Descriptores DeCS: VITAMINA B12/metabolismo; DEFICIENCIA DE VITAMINA B12; ANEMIA MEGALOBLASTICA/etiología.
Bajo el nombre de anemias megaloblásticas se agrupan una serie de desórdenes que se caracterizan por una apariencia morfológica característica en sangre periférica y/o en médula ósea,1 que son el resultado de una síntesis de DNA interrumpida con una síntesis de RNA y proteínas normales, lo cual se refleja morfológicamente como disociación o asincronía núcleo citoplasmática.
El ciclo celular normal consta de una serie de eventos coordinados de síntesis de DNA,RNA y proteínas, donde una fase de reposo (R) es seguida por una rápida duplicación del DNA celular en la fase de síntesis (S), posteriormente por la mitosis y la división en 2 células. En un momento dado, la mayoría de las células tienen valores de DNA de 2N y sólo unas pocas tienen valores de 4N(donde N es la cantidad de DNA en los genomas haploides). En contraste, la mayoría de las células megaloblásticas no están en reposo y se involucran en vano en la duplicación del DNA al producirse una retención en fase S. Esto hace que haya un elevado porcentaje de células con valores de DNA de 2 a 4N debido al retraso en la división celular. El aumento en el contenido de DNA en las células megaloblásticas se expresa morfológicamente como núcleos grandes e inmaduros con cromatina laxa, mientras que la síntesis de RNA y proteínas aparentemente no afectada origina células con un citoplasma abundante y maduro, que da como resultado un volumen celular aumentado.2
Esta descoordinación del ciclo celular afecta a todas las líneas hematopoyéticas; así la leucopenia y la trombocitopenia pueden estar presentes acompañando a la anemia. Por otra parte, pueden presentarse procesos megaloblásticos sin anemia, por lo que se puede plantear que el término anemia megaloblástica no es del todo acertado.3
Las causas de la megaloblastosis son numerosas, pero aproximadamente en el 95 % de los casos son el resultado de una deficiencia de ácido fólico, vitamina B12 o ambos. Nuestro objetivo fue tratar de resumir los conocimientos actuales acerca de las anemias megaloblásticas debidas a deficiencia de cobalaminas.
Estructura química
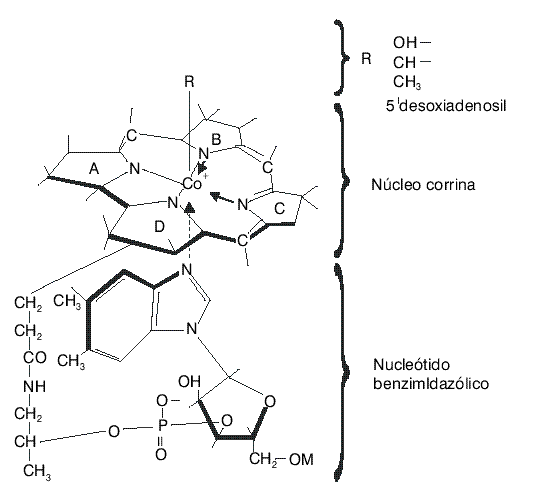
El término cobalamina se refiere a una familia de compuestos con una estructura determinada. La vitamina B12 es una cobalamina (PM 1,355) que resulta de la unión asimétrica de 4 anillos pirrólicos, formando un grupo macrocíclico casi planar (núcleo corrina) en torno a un átomo central de cobalto (Co). El anillo corrina es parecido al anillo porfirínico y se diferencia de éste por el carácter asimétrico de las uniones entre los grupos pirrólicos.En esta estructura, el Co posee 6 valencias de coordinación, 4 de las cuales establecen enlace covalente con los correspondientes nitrógenos (N) de los anillos pirrólicos. La quinta valencia de coordinación se halla siempre unida a un seudonucleótido complejo, el 5,6 dimetilbencimidazol, casi perpendicular al núcleo y la sexta valencia al unirse a diferentes radicales origina los diversos derivados de la cobalamina (fig. 1, tabla 1).
| Radical | |
| CN- (ciano) | |
| OH- (hidroxilo) | |
| CH3 (metilo) | |
| 5'desoxiadenosil | |
La hidroxicobalamina y la cianocobalamina (vitamina B12) son formas no fisiológicas de la cobalamina; en el organismo se transforman de forma espontánea en metil y 5' desoxiadenosil que son las formas fisiológicamente activas o coenzimas de la vitamina B12. La cianocobalamina por exposición a la luz y a los agentes reductores pasa rápidamente a la forma de hidroxicobalamina.4
La mayor parte de la vitamina B12 de las células y el hígado se encuentra en las mitocondrias en forma de 5' desoxiadenosilcobalamina, mientras que la metilcobalamina es la principal forma de cobalamina en el plasma, aunque pequeñas cantidades de esta coenzima se pueden encontrar en las células.5
En el plasma y otros órganos se han detectado otros corrinoides que contienen Co que no son cobalaminas, llamados análogos por su semejanza estructural con la vitamina, de la cual se diferencian por alteraciones en el núcleo corrínico,2 que pueden ser separados de las cobalaminas en el laboratorio a partir de sus propiedades cromatográficas y su pobre afinidad por el factor intrínseco gástrico. El significado biológico de estos análogos de la cobalamina no es bien conocido, aunque algunos pueden ser inertes, otros pueden tener actividad coenzimática y otros ser toxinas o inhibidores de la acción de la vitamina B12.6
Fuentes dietéticas y requerimientos
Aunque la vitamina B12 es sintetizada activamente por un gran número de bacterias intestinales que se hallan de modo habitual en el organismo humano, el aprovechamiento de ésta es mínimo, ya que la síntesis ocurre en sitios muy distales del lugar de absorción fisiológica de la vitamina, lo que determina que prácticamente en su totalidad sea eliminada por las heces. Como producto de esto, la vitamina B12 debe ser necesariamente aportada por los alimentos, cuya mayor fuente dietética se encuentra en las proteínas animales, ya que las frutas, los cereales y las verduras suelen carecer de B12, a menos que estén contaminadas con bacterias.5Los alimentos más ricos en vitamina B12(>10 m g/100 g de peso húmedo) son las vísceras como el hígado (reserva natural), los riñones o el corazón de ovinos y bovinos y los bivalvos como las almejas y las ostras. Existen cantidades moderadas de vitamina B12 (3 a 10 m g/ 100 g de peso húmedo) en la leche en polvo desnatada, así como en algunos pescados y mariscos (cangrejos, peces de roca, salmón y sardinas) y en la yema de huevo. En la carne y otros pescados y mariscos (langosta, lenguados, merluza, pez espada, atún) y quesos fermentados se encuentran cantidades discretas de cobalamina (1 a 3 m g//100 g de peso húmedo). Por su parte, los productos lácteos líquidos y los quesos cremosos contienen menos de 1 m g/100 g de peso húmedo.7
En general la cobalamina no se destruye por la cocción, pero en condiciones alcalinas y en presencia de vitamina C puede perderse cierta cantidad de vitamina cuando ésta se realiza a altas temperaturas. Asimismo, el procesamiento de la leche puede provocar pérdidas considerables de cobalamina (7 % por pasteurización de 2 a 3 segundos y hasta 30 % por hervir de 2 a 5 minutos), lo que hace que la leche resulte insuficiente como fuente única de vitamina B12.8 Además, el 30 % de la vitamina B12 de los alimentos puede ser análogo de la cobalamina más que la vitamina nutricionalmente activa o cobalamina unida a cobalofilinas (proteínas R), lo que puede limitar su biodisponibilidad (huevos y leche).9
Los requerimientos mínimos diarios de vitamina B12 oscilan alrededor de los 2 m g (tabla 2), cantidad completamente cubierta por una alimentación mixta normal que contenga entre 5 y 30 m g de cobalamina, de los que se absorben de 1 a 5 m g.10 El requerimiento mínimo es la cantidad de vitamina que cubre las necesidades provocadas por las pérdidas diarias de ésta, que se producen fundamentalmente por la orina, las heces y las decamaciones cutáneas y que son de 0,1 %/día (1,3 m g).11
| Grupo de edades | m g Vitamina B12/día | |
| 0-2,9 meses | | |
| Lactantes | 3-5,9 meses | |
| 6-11,9 meses | | |
| 1-1,9 años | | |
| Niños | 2-5,9 años | |
| 6-9,9 años | | |
| 10 años o más | | |
| Adultos | Hombre-mujer | |
| Mujer embarazada | | |
| Mujer lactando | |
Absorción
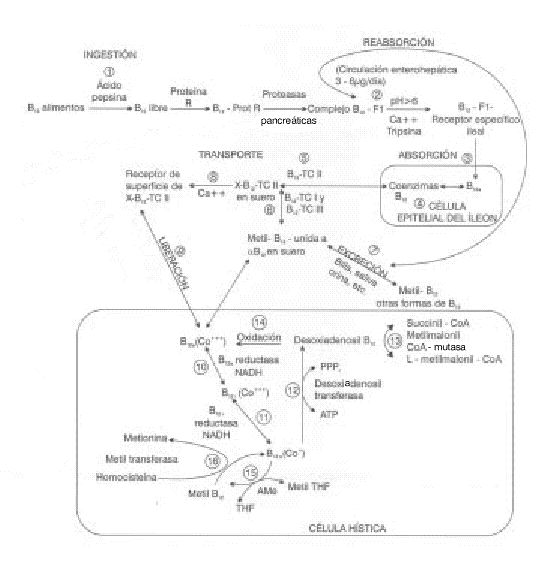
El tracto gastrointestinal humano está provisto de un complejo sistema para la absorción eficiente de las mínimas cantidades de vitamina B12 de la dieta, el cual consta de 5 pasos:- Liberación de las cobalaminas de los alimentos.
- Unión de las cobalaminas y sus análogos por las cobalofilinas del estómago.
- Digestión de las cobalofilinas en la parte alta del intestino por las proteasas pancreáticas con transferencia solamente de las cobalaminas al factor intrínseco (FI).
- Adhesión del complejo vitamina B12- FI al receptor específico en el íleon.
- Endocitosis y unión intracelular a la transcobalamina II (TcII) (fig. 2).12
FIG. 2. Representación esquemática del metabolismo de la vitamina B12.
En el estómago además se produce la secreción, por las células parietales del fundus y el cardias, del FI, que es una glicoproteína termolábil, estable en medio alcalino y resistente a la digestión proteolítica, que une cobalaminas con alta afinidad (Ka=1010/mol) y especificidad (no une los análogos de la cobalamina). Es un monómero de aproximadamente 45 KD de peso molecular codificado por un gen en el cromosoma 11,16 compuesto aproxima-damente por el 15 % de carbohidratos y unos 350 residuos aminoacídicos en su porción proteica.12 Cuenta en su estructura con 2 sitios específicos de unión: uno para la cobalamina, situado cerca del extremo carboxilo terminal y el segundo para un receptor específico ileal, ubicado cerca del extremo amino terminal de la molécula.17 En presencia de cobalamina, 2 moléculas del monómero se combinan rápidamente para formar un dímero que une 2 moléculas de vitamina B12. Cada miligramo de FI une aproximadamente 30 m g de cobalamina y la cantidad de esta proteína secretada diariamente es suficiente para unir de 40 a 80 m g de vitamina B12.12
La secreción de FI está a cargo de las mismas células que producen al ácido clorhídrico, por lo que es estimulada por la presencia de alimentos en el estómago, por la gastrina e histamina, y se encuentra bajo control vagal parcial. Además es inhibida por atropina y vagotomía, somatostatina y por bloqueadores del receptor H2 de la histamina como la cimetidina12 y el omeprazol. Cuando los complejos proteína R- vitamina B12 pasan al duodeno, son expuestos a las proteasas pancreáticas, al pH alcalino del intestino, la proteína R es degradada y la vitamina B12 es liberada del complejo y se une al FI para formar el complejo vitamina B12-FI.3 Estos complejos son muy resistentes a la digestión, por lo que transitan a través del intestino delgado hasta llegar al íleon, que es el sitio de absorción de la cobalamina, ya que los enterocitos ileales son altamente específicos para esta función. Al alcanzar el íleon, los complejos vitamina B12-FI comienzan a unirse a receptores específicos de la membrana de las microvellosidades de la célula mucosa, proceso que se verifica a pH entre 6,4 y 8,4 y requiere la presencia de cationes divalentes, especialmente calcio (Ca2+), pero no necesita energía metabólica.18 La presencia de estos receptores aumenta en frecuencia al aproximarse al íleon terminal, siendo su densidad máxima en la vecindad de la válvula íleocecal. Este receptor consta de 2 subunidades y tiene una secuencia aminoacídica muy semejante al FI, lo que sugiere un origen evolutivo por duplicación de genes.17
Posteriormente, el receptor unido al complejo vitamina B12-FI es internalizado por endocitosis, pasando a los lisosomas, donde después de un período de 4 a 5 horas se libera la cobalamina. Las moléculas de receptores reciclan hacia las microvellosidades para la captación de nuevos complejos vitamina B12-FI. Por su parte, la vitamina B12 libre en el citosol del enterocito se une a la transcobalamina II, glicoproteína de transporte que se encarga de su distribución a los tejidos y los hematíes, y pasa al sistema portal. Este proceso dura varias horas y el máximo de la vitamina en sangre se alcanza apro-ximadamente 8 horas después de la ingestión.12
Cuando llegan al intestino cantidades fisiológicas de vitamina B12 el FI es imprescindible para su absorción, pero cuando alcanzan la luz intestinal grandes cantidades, dosis farmacológicas del orden de 1 o más miligramos, la cobalamina atraviesa la barrera entérica por simple difusión y puede aparecer en sangre antes que en el caso de la ingestión de cantidades fisiológicas. Esta ventaja es utilizada en individuos en los que se desee evitar el empleo de la vía parenteral para la administración del tratamiento.18
Como los folatos, la cobalamina participa en una circulación enterohepática. Entre 0,5 y 9 m g de cobalamina son secretados diariamente en la bilis unidos a una proteína R. Estos complejos cobalamina-proteína R son tratados en el intestino exactamente igual que aquellos que provienen del estómago, o sea, la cobalamina es liberada por digestión de la proteína R por las proteasas pancreáticas y entonces es tomada por el FI y reabsorbida. Se ha estimado que del 65 al 75 % de la cobalamina biliar es reabsorbida por este mecanismo.19
Esta circulación enterohepática genera un importante ahorro de vitamina B12 y permite comprender que cuando la carencia es por una insuficiencia dietética pura, el déficit se manifiesta más tardíamente (entre 3 y 4 años).
Metabolismo
Para ser útil a la célula, la cianocobalamina y la hidroxicobalamina deben ser convertidas en 5' desoxiadenosil y metilcobalamina, las formas coenzimáticamente activas de la cobalamina. Esto se logra por reducción y alquilación de las formas farmacológicas antes mencionadas (fig. 2). La cianocobalamina y la hidroxicobalamina son primero reducidas a Co2+ (cob(II)alamina) (fig. 2,[10]) por reductasas dependientes de NADPH y NADH, que están presentes en las mitocondrias y los microsomas.20 Durante esta reducción, el cianuro y el hidroxilo son desplazados del metal. Una parte de las cob(II) alaminas son reducidas en la mitocondria a la forma intensamente reducida Co+ (cob(I)alamina) (fig. 2,[11]), la cual es alquilada por el ATP para formar 5' desoxiadenosilcobalamina en una reacción en la que la porción 5' desoxiadenosil del ATP es transferida a la cobalamina y los 3 fosfatos son liberados como trifosfato inorgánico (fig. 2,[12]). El resto de la cobalamina se une a la N5 metil-tetrahidrofolato-homocisteína metil transferasa citosólica, donde es convertida en metil cobalamina (fig. 2,[15 y 16]).21Cualquier alteración en estos pasos metabólicos puede producir defectos hereditarios del metabolismo de la vitamina B12 caracterizados por homocistinuria, aciduria metil malónica o ambos.22
Funciones metabólicas
La vitamina B12 es esencial en numerosas reacciones bioquímicas en la naturaleza, la mayoría de las cuales implican redistribución de hidrógenos (H) o de carbonos (C), como por ejemplo:- Reducción de ribonucleótidos (algunas bacterias).
- Biosíntesis de la metionina(mamíferos).
- Isomerización del metilmalonato a succinato (mamíferos).
- Isomerización del b metil aspartato a glutamato(Clostridium tetanomor-phum).
- Conversión de aldehídos en dioles (algunas bacterias).
Metilación de la homocisteína a metionina (fig. 2 [16])
Esta reacción es catalizada por la enzima N5 metiltetrahidrofolato-homocisteína metil transferasa que se halla íntimamente relacionada con el metabolismo del ácido fólico y por lo tanto, con el transporte de unidades de carbono, pues está acoplada a la transformación de N5 metiltetrahidrofolato, forma circulante del ácido fólico, en tetrahidrofolato. La forma activa de la vitamina B12 en esta reacción es la metilcobalamina y su déficit condiciona una disminución del tetrahidrofolato o de cualquiera de sus formas activas intracelulares, pero es especial del N5N10 metilentetrahidrofolato, cofactor fundamen-tal en la síntesis de DNA.Luego, el déficit de cobalaminas producirá una acumulación del folato en forma de N5 metiltetrahidrofolato que al quedar atrapado no podrá ser reutilizado. Asimismo, la acumulación de homocisteína sería la causa de su eliminación urinaria u homocistinuria.23
Isomerización del metilmalonilcoa A succinilcoa (FIG. 2 [13])
Esta reacción es de gran importancia en la reutilización mitocondrial del propionilCoA, procedente de la oxidación de ácidos grasos de cadena impar, para la obtención de energía en forma de ATP a través del ciclo de Krebs. Es catalizada por la enzima metilmalonilCoA mutasa, que es un homodímero de una subunidad de 78 KD codificada por un gen en el cromosoma 6.24 En este caso, la vitamina B12 interviene en la forma de 5' desoxiadenosilcobalamina, que actúa como un transportador intermediario de hidrógeno (H).17Su déficit metabólico produce acidosis metabólica con elevación del ácido metilmalónico en sangre y orina, así como también de ácido propiónico. También se ha señalado elevación en la eliminación de ácido acético en la orina, lo que sería la expresión de un incremento en su producción al desviarse el catabolismo del ácido propiónico por una vía o camino alternativo.18
La relación entre las funciones de las coenzimas de la vitamina B12 y las consecuencias metabólicas de la deficiencia de cobalaminas no ha sido del todo establecida, sin embargo, está claro que las 2 anormalidades principales observadas en pacientes con deficiencia de vitamina B12 son la anemia megaloblástica y los defectos desmielinizantes del sistema nervioso central (degeneración subaguda combinada).
La anemia megaloblástica es un desorden resultante de la interrupción en la síntesis del DNA. Puesto que no se conocen los pasos de la biosíntesis del DNA donde se requiere cobalamina como cofactor, parece probable que la vitamina desempeñe un papel indirecto en la misma. Para explicar este fenómeno se han enunciado 2 hipótesis, de las cuales la más aceptada es la conocida como trampa de los folatos o atrapamiento "metílico".25 Esta hipótesis sostiene que la interrupción de la síntesis de DNA en la deficiencia de cobalaminas es secundaria al trastorno del metabolismo de los folatos. Como consecuencia de la interrupción de la conversión de homocisteína a metionina, el metilte-trahidrofolato no puede ser convertido a tetrahidrofolato eficientemente. El folato comienza a ser "atrapado" en la forma de metiltetrahidrofolato y se desarrolla una deficiencia de metilentetrahidrofolato, la coenzima del tetrahidrofolato requerida para la síntesis del ácido timidílico.1,12
Se sugiere que el atrapamiento metílico puede representar un mecanismo desarrollado para proteger al organismo de la deficiencia de metionina.26 La metionina es un precursor de la S adenosil metionina (SAM) que es necesario para ciertas reacciones de transmetilación en las que se incluyen algunas que pueden ser esenciales para el mantenimiento de la mielina.27 La concentración de SAM es regulada por retroalimentación negativa, la SAM inhibe la conversión de metilentetrahidrofolato a metiltetrahidrofolato, que es la coenzima del folato que dona el grupo metilo a la homocisteína para formar metionina. Mientras el suministro dietético sea adecuado, la necesidad de síntesis endógena de metionina es mínima y poco metiltetrahidrofolato es formado. Si ocurre una deficiencia dietética de metionina, la concentración de SAM disminuye y la conversión de metilentetrahidrofolato a metiltetrahidrofolato se acelera.28 Por este mecanismo la homocisteína es desviada a metionina, una vía alternativa que mantiene las concentraciones esenciales de SAM cuando la metionina dietética está deficiente. En la deficiencia de cobalaminas ocurre una respuesta semejante, pero en este caso el metiltetrahidrofolato no puede ser utilizado, como resultado este metabolito intermediario no sólo es atrapado, sino que también es sintetizado de forma acelerada.
La biosíntesis de las purinas está disminuida en la deficiencia de cobalaminas y esta anormalidad puede también contribuir a una síntesis defectuosa del DNA.29 Tanto el atrapamiento del metiltetrahidrofolato como la carencia de SAM contribuyen a la interrupción en la síntesis de purinas.
La otra teoría sugerida para explicar la megaloblastosis es la hipótesis del "hambre de formato". En ella se establece que con la disminución en la producción de metionina que ocurre en la deficiencia de vitamina B12 la generación de formato está disminuida, lo que se debe a que éste es formado normalmente por oxidación del grupo metilo de la metionina.30 Esta disminución en la generación del formato ocasiona un descenso en la producción del N5 formiltetrahidrofolato que, según esta hipótesis, es el sustrato de la enzima conjugasa responsable de la poliglutamatación del folato y de su retención celular. Esto nos obligaría a considerar que los bajos niveles de folato tisular observados en la deficiencia de cobalaminas no pueden deberse solamente a la interrupción de la desmetilación del N5 metiltetrahidrofolato, sino que puede reflejar una disminución en la producción de metionina, fuente de formato necesaria para producir el sustrato conjugable, N5 formiltetrahidrofolato.
Ahora bien, puesto que las neuronas no se dividen, la interrupción de la síntesis de DNA no puede explicar la desmielinización que ocurre en la deficiencia de vitamina B12. Además, estas lesiones neurológicas no son aliviadas por la terapia con folatos, en realidad ellas son precipitadas o agravadas con este tratamiento. Consecuentemente, el efecto secundario de la deficiencia de cobalaminas sobre el metabolismo de los folatos no puede explicar las anormalidades características de la deficiencia de cobalaminas.12
Una hipótesis sugiere que la desmielinización resulta de una deficiencia tisular de SAM con el consecuente fallo de las reacciones esenciales de transmetilación27,29 que pueden ser importantes para la síntesis de la mielina en muchas formas, por ejemplo, los 3 grupos metilos de la fosfatidilcolina (lecitina) son donados por la SAM.
Esta hipótesis puede explicar por qué algunos pacientes deficientes de cobalaminas presentan alteraciones neurológicas y otros no, la variabilidad puede estar relacionada con la cantidad de metionina presente en la dieta junto con su contenido de folatos.
Estas anormalidades también han sido atribuidas a alteraciones en la reacción de la metilmalonilCoA mutasa, pues se han descrito defectos en los ácidos grasos de la mielina en pacientes deficientes de vitamina B12, pero no se ha determinado aún el papel que desempeñan estas alteraciones en la desmielinización observada en estos pacientes.31
Metabolismo no enzimático
Es bien conocido que la hidroxicobalamina es un antídoto con alta afinidad por el cianuro, que forma cianocobalamina en una relación molar, por lo que es posible que participe en la eliminación de esta toxina en los seres humanos.32 El tabaco y ciertos alimentos como frutas, frijoles y algunos tubérculos contienen cianuros que pudieran ser neutralizados por las cobalaminas.Causas de la deficiencia de cobalamina
Existen múltiples causas de deficiencia de vitamina B12, ya que el fallo de cualquiera de los pasos del complejo proceso de asimilación que sufren las cobalaminas desde los alimentos hasta su utilización al nivel celular, ocasiona la interrupción de éste y por lo tanto, la posibilidad potencial de desarrollar una deficiencia de cobalaminas. Veremos a continuación algunas de las causas de deficiencia de vitamina B12:- Insuficiencia dietética.
- Vegetarianos estrictos o veganos.
- Lactantes de madres vegetarianas.
- Desórdenes gástricos.
- Ausencia de FI.
- Anemia perniciosa (adulto y juvenil).
- Anemia perniciosa congénita.
- Desórdenes infiltrativos del estómago.
- Desórdenes mixtos.
- Enfermedad posgastrectomía.
- Derivación gástrica.
- Malabsorción de la cobalamina de los alimentos.
- Desórdenes intestinales.
- Defectos luminales.
- Sobrecrecimiento bacteriano del intestino delgado.
- Infestación por parásitos.
- Síndrome de Zollinger-Ellison.
- Insuficiencia pancreática.
- Defectos ileales.
- Enfermedad ileal.
- Resección ileal.
- Malabsorción inducida por drogas.
- Malabsorción congénita de cobalaminas.
- Desórdenes del transporte plasmático.
- Déficit congénito de transcobalamina II.
- Déficit de proteína R.
- Desórdenes del metabolismo celular.
- Exposición al óxido nitroso.
- Errores congénitos del metabolismo.
Insuficiencia dietética
La relación entre las reservas corporales de cobalamina y sus requerimientos diarios normales es de aproximadamente 1000:1, por lo que resulta difícil desarrollar una deficiencia de cobalaminas sobre la base de una dieta deficiente solamente. No obstante, se ha descrito deficiencia de esta vitamina en individuos cuyas dietas tienen muchos años de carencia de alimentos ricos en vitamina B12, como ocurre en los veganos que evitan la carne, el pescado y todos los productos animales como la leche, los quesos y los huevos. Estas restricciones dietéticas son usualmente voluntarias y están basadas en consideraciones religiosas, éticas o de salud. La ingestión de vegetales, cereales y pan es muy buena, pero estos alimentos son fuentes muy pobres de cobalaminas. No obstante, las restricciones dietéticas tienen que ser de muchos años para producir deficiencia de cobalaminas.33Los niños nacidos de madres vegetarianas estrictas tienen riesgo de desarrollar una deficiencia de vitamina B12, pues el feto obtiene cobalamina preferentemente de las reservas maternas. Este riesgo aumenta si las madres continúan mucho tiempo con la lactancia materna solamente, con lo que limitan la dieta subsecuente de los niños, pues como tienen las reservas de cobalamina en el límite, la leche materna será una fuente pobre en cobalaminas.34
Desórdenes gástricos
La causa más común de deficiencia de cobalaminas es una enfermedad gastroenterológicamente definida cuya patogénesis es la malabsorción resultante de la pérdida de la secreción de FI en el estómago.En la anemia perniciosa clásica hay severa atrofia gástrica con aclorhidria y secreción de FI marcadamente disminuida o totalmente perdida, producto de la atrofia de la mucosa. Estos pacientes presentan además fenómenos inmunológicos como anticuerpos anticélulas parietales y antiFI.
La anemia perniciosa congénita se debe al fallo en la secreción de FI, pero sin alteración del estómago y sólo en algunos pacientes se presenta hipoclorhidria. En estos casos no se han descrito alteraciones inmunológicas y la deficiencia de cobalaminas aparece en los primeros años de vida, aunque puede retrasarse hasta la segunda década o más.
Desórdenes mixtos
Después de una gastrectomía total, la deficiencia de cobalaminas se desarrolla entre los 5 y 6 años posoperatorios, ya que la operación remueve la fuente de FI. Sin embargo, pocos pacientes muestran franca deficiencia de cobalaminas luego de una gastrectomía parcial, aunque se ha descrito que aproximadamente el 5 % tiene niveles bajos de vitamina B12 sérica y en muchos de ellos hay disminución de la secreción de FI, que puede deberse a atrofia de la mucosa estomacal remanente.35Los pacientes con atrofia gástrica, aquellos que han sufrido una vagotomía o los que toman antiácidos, absorben pobremente la cobalamina de los alimentos debido a la disminución del ácido y la pepsina, responsables de la liberación de las cobalaminas de los alimentos para su unión a las proteínas R, aún cuando tengan FI adecuado para absorber la cobalamina libre.34
Desórdenes intestinales
El estado de malabsorción de vitamina B12 con anemia megaloblástica producido por estasis intestinal a partir de lesiones anatómicas (estrechamiento, divertículos, anastomosis, asas ciegas) o interrupción de la motilidad (esclerodermia, amiloidosis), es causado por la colonización del intestino delgado enfermo por bacterias que toman la cobalamina ingerida antes de que pueda ser absorbida.36 En estos casos se presenta esteatorrea acompañante.En los casos de infestación con el parásito Dyphyllobotrium latum la deficiencia de cobalaminas se debe a la competencia que se establece entre el parásito y el hospedero por la vitamina ingerida. En estos pacientes, el cuadro clínico puede ser desde asintomático hasta anemia megaloblástica con alteraciones neurológicas.
En el síndrome de Zollinger-Ellison, un tumor productor de gastrina, usualmente en el páncreas, estimula a la mucosa gástrica a secretar cantidades aumentadas de ácido clorhídrico que no pueden ser neutralizadas por la secreción pancreática, y provoca la acidificación del duodeno con la consiguiente inactivación de las proteasas pancreáticas, lo que impide la transferencia de la cobalamina de las proteínas R al FI.35
En la insuficiencia pancreática la malabsorción es causada por la deficiencia de proteasas pancreáticas, lo que implica un fallo parcial en la destrucción de los complejos cobalaminaproteína R que es un prerequisito para transferir la cobalamina al FI.35
Defectos ileales
La malabsorción congénita de cobalaminas se diagnostica usualmente en los primeros años de la vida y se piensa que es producto de un defecto en el receptor ileal del complejo vitamina B12-FI. En estos casos, es característica la coexistencia con proteinuria.37Ciertos medicamentos inducen malabsorción de cobalaminas que puede llevar a una deficiencia de la vitamina, entre ellos están el ácido para amino salicílico (PAS) (tuberculosis), la colchicina (gota), la neomicina (antibiótico), la melformina (diabetes), etc.38
Desórdenes del transporte plasmático
La deficiencia de Tc II es un desorden autosómico recesivo con evidente anemia megaloblástica que se presenta en la infancia temprana. Debido a la ausencia de la principal proteína transportadora de cobalaminas se produce una severa deficiencia tisular de la vitamina, que de no ser diagnosticada, puede causar daños irreversibles del sistema nervioso central.39Se ha reportado un número reducido de pacientes con deficiencia de proteína R, ninguno de los cuales tiene manifestaciones clínicas de deficiencia, aunque los niveles séricos de vitamina B12 son subnormales. Al parecer este desorden es de transmisión autosómica recesiva.35
Cuadro clínico
El cuadro clínico de la deficiencia de cobalaminas incluye manifestaciones no específicas: megaloblastosis, anemia, pérdida de peso, y características específicas causadas por la deficiencia de cobalaminas, principalmente alteraciones neurológicas. La tríada clásica de palidez flavínica, glositis y parestesias es la forma más habitual, aunque no constante, de presentación. Otras formas de presentación frecuentes derivan de la aparición de trastornos gastrointestinales o neuropsiquiátricos.38Cuando la anemia es severa, pueden presentarse todos los síntomas y signos derivados de ésta: palidez (con tinte flavínico y subictérica conjuntival), astenia, disnea de esfuerzo o taquicardia, soplos cardíacos, etc. En estadios avanzados puede haber fallo cardíaco y hepatomegalia.38
Las alteraciones morfológicas de este tipo de anemia afectan a todas las líneas celulares, así podemos encontrar marcada variación en la forma y el tamaño de los eritrocitos (macroovalocitos, megalocitos), los que pueden mostrar punteado basófilo y alteraciones nucleares (cuerpos de Howell Jolly, anillos de Cabot). Además puede presentarse leucopenia y es característica la existencia de más del 5 % de los neutrófilos con un índice de lobulación mayor a igual que 5 (hipersegmentación), lo que constituye un signo temprano de megaloblastosis cuando la causa es nutricional. Las plaquetas pueden aparecer disminuidas y muestran gran variabilidad en cuanto a tamaño.35 Es importante señalar que la aparición de pancitopenia obliga al diagnóstico diferencial con hemopatías malignas, fundamentalmente con las leucemias y la aplasia medular.
Cuando la anemia megaloblástica coexiste con anemia microcítica la morfología puede ser normocítica o incluso microcítica, pueden encontrarse en la lámina microcitos y macroovalocitos (anemia dimórfica) o microcitos solos, cuando el componente microcítico es suficientemente severo. La médula puede mostrar megaloblastos intermedios, que son menores y con menos apariencia megaloblástica que lo usual. Aún cuando la megaloblastosis esté enmascarada por la microcitosis severa, se encontrarán rasgos característicos del proceso megaloblástico, como son neutrófilos hipersegmentados en sangre y metamielocitos gigantes y bandas en la médula.40
En este tipo de anemia mixta el componente microcítico suele ser la deficiencia de hierro, pero puede ser talasemia menor o anemia de los procesos crónicos. El componente megaloblástico puede ser pasado por alto y el paciente puede ser tratado solamente con hierro. En este caso, la anemia responderá sólo parcialmente a la terapia y las características megaloblásticas emergerán cuando las reservas de hierro estén saturadas.
Las anormalidades megaloblásticas pueden aparecer también en otras células de rápido recambio celular como los epitelios bucales, el intestino delgado y cérvix uterino, donde los cambios megaloblásticos son difíciles de distinguir de la malignidad.
Alteraciones neurológicas
La deficiencia de cobalaminas produce una desmielinización discontinua, difusa y progresiva de los cordones dorsales y laterales de la médula espinal y la corteza cerebral. Los rasgos característicos de la disfunción neurológica son su distribución simétrica y distal, fundamentalmente en manos y pies.41Los síntomas más tempranos y comunes son parestesias, entumecimiento y pérdida de la sensibilidad. Es frecuente la pérdida del sentido de posición y de la vibración, especialmente a las altas frecuencias. Puede haber disminución de los reflejos tendinosos profundos, pero la hiperreflexia y la espasticidad sobrevienen cuando se involucran los cordones laterales. Con frecuencia se desarrollan trastornos de la marcha que pueden llegar hasta la ataxia.33
Las alteraciones mentales van desde la irritabilidad a la demencia, que se asemeja a la enfermedad de Alzheimer, y pudieran aparecer psicosis, esquizofrenia paranoide (locura megaloblástica) e incluso el coma. Pueden presentarse también somnolencia, perversión del gusto, del olfato y de la visión, con ocasional atrofia óptica. La lista de disfunciones neurológicas es larga y puede incluir disfunción vesical, impotencia, hipotensión ortostática, disturbios visuales que pueden incluir la pérdida de la agudeza visual y de la visión de colores.33
El grado de implicación del sistema nervioso central no se correlaciona totalmente con el grado de anemia. En casos excepcionales se encuentra neuropatía pronunciada en ausencia de cualquier anormalidad hematológica y las afectaciones neurológicas pueden progresar mientras los valores hematológicos permanecen normales. En algunos casos, estos fenómenos pueden deberse al tratamiento inadecuado con ácido fólico.
Algunos autores plantean que pacientes con niveles normales o cercanos al límite inferior normal de cobalamina sérica pueden desarrollar alteraciones neurológicas sin macrocitosis debido a una deficiencia tisular de cobalaminas, que puede ser detectada por la elevación de los niveles séricos de homocisteína y ácido metilmalónico.42
La anemia puede también acompañarse de otros síntomas como pérdida de peso, que es común en la deficiencia de cobalaminas y que usualmente revierte con el tratamiento sustitutivo al igual que la anorexia, los disturbios intestinales, la infertilidad y la hiperpigmentación de la piel y las uñas, especialmente en individuos no blancos.
En el caso de la anemia perniciosa, entidad representativa de la anemia megaloblástica, se suman además la aclorhidria histaminorresistente, la ausencia de FI, la gastritis atrófica, las endocrinopatías asociadas como la tiroiditis de Hashimoto, los anticuerpos contra FI y células parietales y las alteraciones en la prueba de Schilling.43
Tratamiento
En el tratamiento de la deficiencia de vitamina B12 se utilizan convencionalmente 2 preparados farmacológicos: la cianocobalamina y la hidroxicobalamina, que generalmente son administrados por vía intramuscular. En cuanto a la aplicación del tratamiento, existen diferentes esquemas terapéuticos. Uno de los más utilizados consiste en la administración de 1 000 m g diarios durante 2 semanas, luego semanalmente hasta la normalización del hematócrito y continuar mensualmente por tiempo indefinido. En los casos con manifes-taciones neurológicas, el tratamiento intensivo inicial se prolongará durante unos 6 meses.35,38,44Otros autores plantean dar una primera dosis, que restituiría los depósitos, de 1 000 m g diarios durante una semana y una dosis de mantenimiento de 1 000 m g cada 2 meses, que se mantendría mientras fuera necesario, según la naturaleza de la causa de deficiencia de vitamina B12.11
Otros sugieren la administración de 1 m g diario por vía intramuscular o una dosis única de 100 m g o más para lograr una remisión completa del cuadro clínico en pacientes sin complicaciones con enfermedades sistémicas no relacionadas u otros factores. Para mantener esta remisión, se utilizan inyecciones mensuales de 100 m g durante toda la vida del paciente.7,11,15
Un último esquema plantea administrar 100 m g intramusculares en días alternos durante 3 semanas, en ausencia de lesiones neurológicas, continuar con igual dosis 2 veces por semana hasta obtener una remisión completa y mantener igual dosis por mes como mantenimiento durante el resto de la vida del paciente.
Ante la presencia de manifestaciones neurológicas aconsejan utilizar dosis mayores en un intento por lograr la recuperación del sistema nervioso central. En estos casos, la dosis de ataque sería de 200 m g en días alternos durante 3 semanas, continuar con la administración 2 veces por semana durante 6 meses y luego semanal hasta completar el año de tratamiento. Como mantenimiento se emplearía igual dosis por mes.43
Los pacientes con niveles de cobalamina sérica en el límite inferior normal o normal con manifestaciones clínicas de deficiencia necesitan de tratamiento.42
Uso de la cobalamina oral
En un trabajo reciente se demuestra que la terapia oral y parenteral son igualmente efectivas y se plantea que pueden utilizarse en el tratamiento de la deficiencia nutricional de cobalaminas que se desarrolla en los vegetarianos y en pacientes con malnutrición general severa.45Indudablemente, el tratamiento parenteral continuará desempeñando un papel importante en el tratamiento del déficit cobalaminas, especialmente en los pacientes hospitalizados y con desórdenes gástricos, pero en los casos de los pacientes con deficiencias ligeras o moderadas que requieran terapia de mantenimiento, la cianocobalamina oral debe considerarse como una alternativa terapéutica.
SUMMARY
A review is made on the metabolism of vitamin B12, its chemical structure, dietetic spurces and requirements in the different age groups, as well as on its absorption and distribution in the body. The metabolic function of cobalamins, their role in the etiology of megaloblastic anemias, the causes of the deficiency of this vitamin and its treatment are also explained in this paper.Subject headings: VITAMIN B12/metabolism; VITAMIN B12 DEFICIENCY; ANEMIA, MEGALOBLASTIC/etiology.
REFERENCIAS BIBLIOGRÁFICAS
1. Forrellat M, Gautier du Défaix H. Papel del ácido fólico en la etiología de las anemias megaloblásticas. Rev Cubana Hematol Inmunol Hemoter 1997;13(2):77-89.
2. Antoni AC. Megaloblastic anemias. En: Hematology basic principles and practice. 2nd ed. New York: Churchill Livingston,1995:552-86.
3. Peterson LA, McKenna RW. Laboratory evaluation of megaloblastic anemia. En: Hematology clinical and laboratory practice. St Louis: Mosby Year Book, 1993:459-70.
4. Hernández P, Ferrá M, Boffill VM. Estudio del ácido fólico y vitamina B12:I. Metabolismo. Rev Cubana Med 1973;12:305-14.
5. Lanzkowski P. Anemias megaloblásticas y otras anemias nutricionales. En: Hematología pediátrica. 3a ed. La Habana, 1983:195-237. (Edición Revolucionaria).
6. Kanazawa S, Herbert V. Noncobalamin vitamin B12 analogues in human red cells, liver and brain. Am J Clin Nutr 1983;37:774-80.
7. Herbert V, Das KC. Folic acid and vitamin B12. En: Modern nutrition in health and disease. 8th ed. Philadelphia: Lea and Febiger, 1994:402-25.
8. Herbert V. Vitamin B12. En: Conocimientos actuales sobre nutrición. 6a ed. Washington DC:OPS-ILSI, 1991:194-204.
9. Baker SJ, Mathan VI. Evidence regarding the minimal daily requirement of dietary vitamin B12. Am J Clin Nutr 1981;34:2423-9.
10. Food and Nutrition Board. National Research Council: Recommended dietary allowances. 7th ed. Washington DC: National Acad Sciences, 1968:
11. Vives JL. Macrocitosis y anemia macrocítica. En: Hematología clínica. 2a ed. Barcelona: Ediciones Doyma, 1988:194-212.
12. Lee GR. Nutritional factors in the production and function of erythrocytes. En: Wintrobe's clinical hematology. 9th ed. Philadelphia: Lea and Febiger, 1993:158-94.
13. Jacob E, Baker SJ, Herbert V. Vitamin B12 - binding proteins. Physiol Rev 1980;60:918-25.
14. Harliman J, Zuber C. Vitamin B12 binders in human body fluids II synthesis in vitro. Clin Exp Immunol 1969;4:141-5.
15. Simons K, Weber T. The vitamin B12 binding proteins in human leucocytes. Biochem Biophys Acta 1966;117:201-4.
16. Herbert V, Castle WB. Intrinsec factor. N Engl J Med 1964;270:118-26.
17. Babior BM. Metabolic aspects of folic acid and cobalamin. En: William's hematology. 5th ed. New York: Mc Graw Hill, 1995:380-94.
18. Espinós D, Villegas AM. Bioquímica y metabolismo de la vitamina B12 y el ácido fólico. En: Enciclopedia Iberoamericana de hematología. Salamanca: Ediciones Universidad, 1992:253-62.
19. Booth MA, Spray GH. Vitamin B12 activity in the serum and liver of rats after total gastrectomy. Br J Haematol 1960;6:288-96.
20. Watanabe F, Nakano Y. Comparative biochemistry of vitamin B12 (cobalamin metabolism: biochemical diversity in the synthesis for intracellular cobalamin transfer and synthesis of the coenzymes. Int J Biochem 1991;23:1353-63.
21. Boddington MM, Spriggs AI. The epithelial cells in megaloblastic anemias. J Clin Pathol 1969; 12:228-33.
22. Fowler B. Genetics defects of folate and cobalamin metabolism. Eur J Pediatr 1998;153(Suppl 2):S60-6.
23. Herbert V, Zaluski R. Interrelation of vitamin B12 and folic acid metabolism. Folic acid clearence study. J Clin Invest 1962;41:1263-76.
24. Nham SV, Wilkemeyer MF, Ledley FD. Structure of the human methylmalonyl-CoA mutase (MUT) locus. Genomics 1990;8:710-23.
25. Das KC, Herbert V. Vitamin B12 -folate interrelations. Clin Haematol 1976;5:697-706.
26. Scott JM, Weir DG. The methyl folate trap. Lancet 1981;2:337.
27. Banerjee RV, Matthews RG. Cobalamin -dependent methionine synthesis. FASEB J 1990;4:1450-7.
28. Finkelstein JD, Martin JJ, Kyle WE, Harris BJ. Methionine metabolism in mammals: Regulation of methyltetrahydrofolate reductase content of rats tissues. Arch Biochem Biophys 1978;191:153-60.
29. Boss GR. Cobalamin inactivation decreases purine and methionine synthesis in cultured lymphocytes. J Clin Invest 1985;76:213-8.
30. Chanarin I. The methyl folate trap and the supply of S-adenosyl methionine. Lancet 1981;2:755.
31. Frenkel EP. Abnormal fatty acid metabolism in peripheral nerves of patients with pernicious anemia. J Clin Invest 1973:1237-45.
32. Demedts P, Wanters A, Franck F, Nells H. Monitoring of cyanocobalamin and hydroxicobalamin during treatment of cyanide intoxication. Lancet 1995;349:1706-7.
33. Carmel R. Clinical aspects of megaloblastic anemia. En: Hematology Clinical and Laboratory Practice. St. Louis Missouri: Moby Year Book Inc, 1993:437-59.
34. Higginbottom MC, Sweetman L, Nyham WL. A syndrome of methylmalonic aciduria, homocistinuria, megaloblastic anemia and neurological abnormalities in a vitamin B12 -deficient breast- fed infant of a strict vegetarian. N Engl J Med 1978;299:317-22.
35. Babior BM. The megaloblastic anemias. En: William's hematology. 5th ed. Mc Graw Hill, 1995:380-94.
36. Gianella RA, Broittman SA, Zanchec KN. Competition between bacteria and intrinsec factor for vitamin B12: implications for vitamin B12 malabsortion in intestinal bacterial overgrowth. Adv Intern Med 1972;16:191-7.
37. Collan Y, Lahdevirta J, Jokenin EJ. Selective vitamin B12 malabsorption with proteinuria: renal biopsy study. Nephron 1979;23:297-303.
38. Outeiriño J, Sánchez Fayos J. Patología de la deficiencia de vitamina B12. En: Enciclopedia Iberoamericana de Hematología. Salamanca: Ediciones Universidad, 1992:263-74.
39. Thomas PK, Hoffbrand AV, Smith IS. Neurological involvement in hereditary transcobalamin II deficiency. Neurol Neurosurg Psychiatr 1982;45:74-9.
40. Gulley ML, Bently SA, Ross DW. Neutrophil myeloperoxidase measurements uncovers megaloblastic anemias. Blood 1990;76:1004-6.
41. Ellison ABC. Pernicious anemia masked by multivitamins containig folic acid. JAMA 1960; 173:240-5.
42. Delva MD. Vitamin B12 replacement. To B12 or not to B12? Can Fam Physician 1997;43:917-22.
43. Hernández P, Cué A, Beltrán J, Bopha K. Estudio del ácido fólico y vitamina B12: II patologías producidas por deficiencias de estas coenzimas. Rev Cubana Med 1973;12:315-26.
44. Lee GR. Megaloblastic and nonmegaloblastic macrocytic anemias. En: Wintrobe's clinical hematology. 9th ed. Philadelphia: Lea and Febiger, 1993:745-90.
45. Kuzminski AM, Del Giacco EJ, Allen RH, Stabler SP, Linderbaum J. Effective treatment of cobalamin deficiency with oral cobalamin. Blood 1998;92:1191-8.
Recibido: 5 de enero de 1999. Aprobado: 14 de abril de 1999.
Lic. Mariela Forrellat Barrios. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Teléfono: (537)578268. Fax: (537)338979. e-mail:ihidir @hemato. sld.cu