Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.15 n.3 Ciudad de la Habana sep.-dic. 1999
Instituto de Hematología e Inmunología
Estudio de las reacciones medicamentosas por hipersensibilidad retardada mediante la proliferación linfoblástica
Lic. Yulién Alpízar Olivares, Lic. Lázaro O. del Valle Pérez, Dra. Consuelo Macías Abraham, Lic. Ileana Esquivel Suárez, Dra. Jacqueline Rodríguez Amado y Dra. Vianed Marsán SuárezRESUMEN
Se estudiaron 6 enfermos con el posible diagnóstico de reacciones medicamentosas por hipersensibilidad retardada (HR) mediante la prueba de transformación linfoblástica con criterio de incorporación de timidina tritiada. Se demostró que en 2 pacientes existían reacciones de HR a la carbamazepina, en uno al ácido acetil salicílico, en uno a la cloroquina y el sulfaprim y el otro paciente al ácido acetil salicílico en tabletas y a la materia prima. Se comprobó que la introducción de este método para la evaluación de la reacción de HR tipo IV en el estudio de las reacciones adversas a medicamentos es de gran utilidad en nuestro medio. Se modificó la conducta terapéutica en cada enfermo de acuerdo con los resultados obtenidos, lo que favoreció el pronóstico, la estadía hospitalaria y la curación.
Descriptores DeCS: HIPERSENSIBILIDAD RETARDADA/sangre; TRANSFORMACION LINFOCITICA; CLOROQUINA/efectos adversos; CARBAMAZEPINA/efectos adversos; ASPIRINA/efectos adversos; COMBINACION TRIMETOPRIM-SULFAMETOXAZOL/efectos adversos; TIMIDINA.
CARBAMAZEPINA/efectos adversos; ASPIRINA/efectos adversos; COMBINACION TRIMETOPRIM-SULFAMETOXAZOL/efectos adversos; TIMIDINA.
Las reacciones adversas a los medicamentos son manifestaciones clínicas im-previstas o indeseables que aparecen después de la administración de un medicamento o producto biológico. Éstas pueden ser inmunológicas (por hipersensibilidad) o no inmunológicas.1
La reacción de hipersensibilidad es la aparición de una respuesta inusual tras la administración de un medicamento, después que el paciente se ha puesto en contacto con concentraciones normales de éste en una o más ocasiones anteriores (contacto sensibilizante y contacto desencadenante). La mayor parte de los medicamentos son sustancias de bajo peso molecular (haptenos) que provocan este tipo de reacción si se combinan con macromoléculas (principalmente proteínas). Otras veces no es el medicamento el que se une a las macromoléculas para dar lugar a la reacción, sino sus metabolitos o las impurezas que contiene.2
Entre las pruebas que se han utilizado para el diagnóstico de la reacción medicamentosa del tipo hipersensibilidad retardada o tipo IV se encuentran: prueba cutánea, determinación del factor inhibidor de macrófagos, determinación del factor inhibidor de los leucocitos, citotoxicidad de los linfocitos, determinación de los receptores de activación expresados en la membrana de los linfocitos activados y la transformación linfoblástica de los linfocitos mediante criterio morfológico3 o con timidina tritiada.4
Se decidió evaluar a los pacientes en los que se sospechaba una reacción medicamentosa mediante una prueba de transformación linfoblástica, con el fin de poder seleccionar las drogas más adecuadas para el tratamiento de estos enfermos y así mejorar su pronóstico y la conducta terapéutica.
MÉTODOS
Se estudiaron 6 enfermos en los que se sospechaban reacciones medicamentosas del tipo de hipersensibilidad retardada a uno o más medicamentos. Previamente se les realizó un interrogatorio minucioso en relación con la enfermedad de base, enfermedades concomitantes, tratamiento médico y reacciones adversas.Estos enfermos tenían historia de reacciones adversas a medicamentos con mecanismo de acción similares o no, y no tenían tratamiento con dichos medicamentos al menos desde 1 ó 2 semanas previas al estudio. Se excluyeron los pacientes que llevaron tratamiento con medicamentos antiinflamatorios o inmunomoduladores en un período de 8 semanas previas al estudio y/o que en el momento del estudio presentaban signos, síntomas o ambos de infecciones o estado agudo de la enfermedad de base, así como los pacientes en que las manifestaciones clínicas no se consideraron secundarias a reacciones adversas a medicamentos.
Todos los enfermos seleccionados dieron su consentimiento para su inclusión en la investigación. Como grupo control se emplearon individuos supuestamente sanos, donantes de sangre en el IHI.5
Los linfocitos se obtuvieron de sangre periférica heparinizada (13 UI/mL) y se utilizó un gradiente de densidad de Ficoll Hipaque según la técnica de Böyum modificada y se ajustaron a 2 x 106 linfocitos/mL en RPMI 1640 al 20 % de suero fetal bovino.6
Las tabletas del medicamento se trituraron y se le adicionó medio RPMI 1640; el mismo proceder se siguió con la materia prima del medicamento si estaba disponible y se incubó durante una hora a 4 °C. El sobrenadante se filtró por membranas de acetato de celulosa 0,20 µm (Sartorius) y se guardaron a 4 °C hasta su uso.
Se montó en cada caso una prueba de transformación blástica con PHA, con células mononucleares del enfermo y uno o más individuos del grupo control, para determinar la capacidad proliferativa de los linfocitos. Se emplearon como condiciones experimentales la proliferación espontánea de los linfocitos en medio de cultivo y la estimulación con el mitógeno PHA (Wellcome, England) en su dosis óptima de 5µg/mL. Este cultivo duró 72 horas; después de las primeras 66 horas, se le añadió a cada pozo 1µCi de timidina tritiada ([6-3H]thymidine, actividad específica 999 GBq/mmol, 27 Ci/mmol, Amersham).
Los medicamentos de prueba se añadieron a las placas de poliestireno (Nunc, Dinamarca) de 96 pozos de fondo en U, desde el inicio del cultivo a partir de la dilución 1:2 y en diluciones dobles hasta la correspondiente de acuerdo con el medicamento estudiado. Se utilizó como testigo o control un pozo con células en medio de cultivo sin la presencia del medicamento.
En todos los casos, las placas se incubaron en una incubadora de CO2 (KEBO, ASSAB, Suecia) a 37 °C en atmósfera húmeda de CO2 al 5 %. A diferencia del cultivo con PHA, los ensayos con medicamentos permanecieron en la incubadora 144 horas y 18 horas antes de culminar el experimento a cada pozo se le añadió 1 µCi de timidina tritiada.
Las placas de cultivo se procesaron en un cosechador de células (Flow Laboratories, EE.UU.) y se recogieron los cultivos sobre filtros de nitrocelulosa (Whatman International Ltd, EE.UU.). La radiactividad se midió en un contador de centelleo de partículas b (LKB, Suecia). El índice de estimulación (IE) representa el cociente de los conteos por minutos (CPM) de las medias de los cultivos estimulados sobre las medias de los CPM del cultivo no estimulado. Se consideró una reacción medicamentosa positiva cuando el IE fue mayor que 5 para cualquiera de los medicamentos evaluados.
RESULTADOS
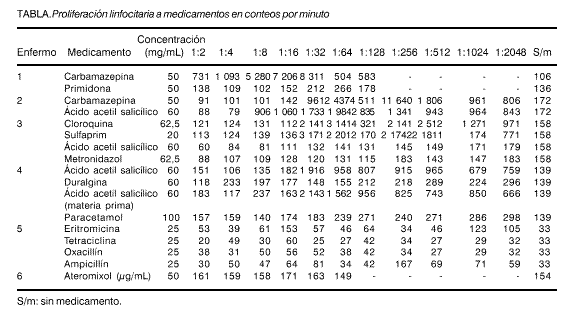
En la tabla se muestran los resultados de los enfermos estudiados. Al examinar los resultados del enfermo 1 se comprobó un aumento en la proliferación en los cultivos de linfocitos desde las diluciones 1:2 hasta 1:128 para el medicamento carbamazepina, no así para la primidona. Con estos resultados se propuso interrumpir la administración del primero y continuar con el segundo y se constató el cese del trastorno dermatológico. En el enfermo 2, ambos medicamentos evaluados, la carbamazepina y el ácido acetil salicílico provocaron un incremento de la proliferación de los linfocitos. En el enfermo 3, se demostró reacción de HR tipo IV a los medicamentos cloroquina, sulfaprim, y ácido acetil salicílico y no al metronidazol.
El enfermo 4, también mostró incremento de la proliferación linfocitaria al ácido salicílico y a su materia prima. Los enfermos 5 y 6 no mostraron reacción de HR tipo IV a los medicamentos evaluados.
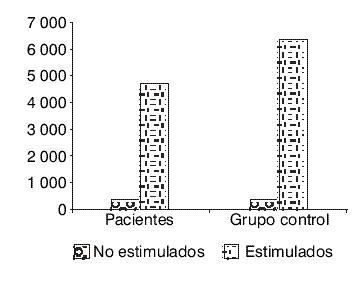
En la figura se destaca que los pacientes estudiados no presentaban limitaciones de la proliferación linfocitaria de tipo inespecífica frente a la PHA, ya que los valores de proliferación estaban por encima del valor de referencia (IE>20) según el sistema normalizado en el Departamento de Inmunología del Instituto de Hematología e Inmunología, condición que igualmente se cumplió con los valores del grupo control. Por lo tanto, se descartó la posibilidad de que los pacientes presentaran alteraciones de la inmunidad celular, y que la respuesta linfoproliferativa a los medicamentos estuviera disminuida.
FIG. Proliferación linfocitaria de enfermos e individuos sanos estimulados con fitohemaglutinina en conteos por minuto.
DISCUSIÓN
En trabajos realacionados con los aspectos bioquímicos del mecanismo de acción anticonvulsivante de la carbamazepina, se plantea que hace descender las concentraciones de alanina y nucleótidos cíclicos (AMP y GMP) elevados tras la actividad epiléptica,7 se conjuga ampliamente con las proteínas del plasma en un rango de 70- 80 % de la concentración plasmática total y no es desplazada por otros antiepilépticos; en cambio, la primidona no es capaz de asociarse a éstas.8 Esto explica en el enfermo 1 la reacción adversa de tipo IV a la carbamazepina, y no a la primidona, lo que corresponde con lo referido por otros investigadores.9En el enfermo 2, los medicamentos evaluados (carbamazepina y ácido acetil salicílico) provocaron un aumento en la proliferación de los linfocitos. Se conoce que los salicilatos inhiben la actividad de la enzima cicloxigenasa, y disminuye así la formación de precursores de las prostaglandinas (PG) y tromboxanos a partir del ácido araquidónico. Muchos de los efectos terapéuticos y también adversos de estos medicamentos posiblemente se deben a la inhibición de la síntesis de las PG. Se ha comunicado que la PGE inhibe la participación de los linfocitos en las reacciones de hipersensibilidad retardada, así como la producción y liberación de las linfocinas por los linfocitos T sensibilizados10 y que el ácido acetil salicílico ejerce un efecto "amplificador" de la proliferación y producción de interleucina 2 (IL 2) por parte de las células T.11 En los cultivos de células T, el ácido acetil salicílico fortalece la unión del mitógeno a las células, induce la expresión de marcadores de activación en la superficie celular (receptor de IL 2, transferrina y HLA-DR), regula la acción de las células supresoras, causa un aumento en los niveles de Ca2+ intracelular, fundamentalmente en las células CD4+, e incrementa la fluidez de las membranas (a concentraciones mayores que las terapéuticas),12 lo que podría explicar la respuesta de hipersensibilidad retardada al ácido acetil salicílico observada en este estudio.
Con las células del enfermo 3, se probaron los medicamentos cloroquina, sulfaprim, ácido acetil salicílico y metronidazol, y se observó que sólo los 2 primeros podían inducir respuesta adversa, según esta evaluación de la hipersensibilidad retardada. El sulfaprim es uno de los medicamentos que más comúnmente desarrolla reacciones de hipersensibilidad tipo IV13 y no se conoce exactamente qué hace desencadenar el mecanismo. En nuestro estudio no se descarta la posibilidad de una reacción cruzada entre las distintas clases de sulfas existentes, por existir antecedentes en el enfermo de tratamiento con otros tipos de sulfas.
La cloroquina es un medicamento de acción antipalúdica, antiprotozooaria, posee un índice de unión a proteínas plasmáticas que oscila entre el 50 y 65 % y que ha sido estudiado con el objetivo de evaluar su papel en la inmunidad celular. Se han observado que a concentraciones mayores que la terapéutica es capaz de disminuir la respuesta linfoproliferativa.14 Se han hallado evidencias de hipersensibilidad a este compuesto, aunque su mecanismo de acción se desconoce.15
El ácido acetil salicílico en tabletas y materia prima es el medicamento capaz de provocar estimulación linfocitaria en el paciente 4, lo que se explica de igual manera que en el enfermo 3. Es importante destacar el hecho de que la materia prima de dicho medicamento es también reactiva, o sea, puede desencadenar esta reacción. Esto tiene gran importancia, ya que no siempre es la materia prima del medicamento por sí misma quien provoca la reacción adversa, sino sus impurezas o constituyentes (excipientes o bases), por eso siempre que sea posible es necesario provocar la estimulación linfocitaria con la materia prima del medicamento.
Los medicamentos evaluados en los enfermos 5 y 6, no resultaron reactivos para la proliferación de los linfocitos de ambos pacientes. Se descartó así la posibilidad de una reacción adversa a estas drogas, por lo que las manifestaciones clínicas que presentaban estos enfermos se pueden atribuir a otras causas como: intoxicación alimentaria, interacciones medicamentosas y otros tipos de reacciones de hipersensibilidad (tipo I).
Existen variables que predisponen a la aparición de las reacciones medicamentosas como edad, sexo, peso corporal, equilibrio ácido base, superficie corporal, raza, hábitos alimentarios, enfermedades que afectan la farmacocinética de las drogas, enfermedades que requieren una terapéutica múltiple y enfermedades concomitantes.16
Las reacciones adversas a medicamentos pueden ser semejantes en sus manifestaciones clínicas a diferentes enfermedades y afectar múltiples órganos como el sistema linfohematopoyético y la piel. Los linfocitos TCD34+ desempeñan un papel fundamental en estas reacciones de una manera similar a la enfermedad de injerto contra huésped.17
Es difícil demostrar las reacciones de las células T específicas a drogas, debido, entre otras causas, a que las bases moleculares de las reacciones de las células T a los haptenos aún no está bien esclarecida. Recientemente, algunos investigadores han demostrado que las células T reconocen a los haptenos como epítopes que se asocian covalentemente a los péptidos propios de las moléculas del sistema principal de histocompatibilidad en el reconocimiento antigénico.17
Otra causa que hace difícil comprender la reacción de las células T a drogas in vitro, es el hecho de que éstas no son proteínas reactivas y el neoantígeno corresponde con un metabolito intermediario. Estos metabolitos pueden formarse no sólo en el hígado, sino también en las células fagocíticas presentes en diferentes tejidos del organismo.17
Todo lo anterior permite afirmar que las reacciones a drogas de origen inmunológico constituyen un área de la investigación biomédica en el campo de la inmunología cuya profundización proporcionaría nuevas potencialidades en el estudio, seguimiento y tratamiento de numerosos enfermos, en los cuales estas reacciones constituyen limitaciones importantes para la selección de una conducta terapéutica no dañina, aún en condiciones de sepsis grave u otras que pueden provocar su muerte.
SUMMARY
6 patients with the possible diagnosis of drugs reactions due to delayed hypersensitivity (DH) were studied by using the test of lymphoblastic transformation with criterion of incorporation of tritiated thymidine. It was proved that in 2 patients there DH reactions to carbamazepine, in one to aspirin, in one to chloroquine and sulfaprim, and the other patient to aspirin in tablets and to the raw material. It was proved that the introduction of this method for evaluating the reaction of type IV DH in the study of adverse reactions to drugs is very useful in our environment. The therapeutic conduct was modified in each patient according to the results obtained, which favored the prognosis, hospital stay and healing.Subject headings: HIPERSENSITIVITY, DELAYED/blood; LYMPHOCYTE TRANSFORMATION; CHLOROQUINE/adverse effects; CARBAMAZEPINE/adverse effects; ASPIRIN/adverse effects; TRIMETHOPRIM-SULFAMETHOXAZOLE COMBINATION/adverse effects; THYMIDINE.
REFERENCIAS BIBLIOGRÁFICAS
1. Davies DM. Textbook of adverse drug reactions. 4 ed. Oxford: University Press, 1991.
2. Anderson JA, Adkinson NF. Reacciones alérgicas a fármacos y agentes biológicos. En: OPS. Compendio de enfermedades alérgicas e inmunológicas. Washington DC, 1989:82-95.
3. Badá Ainsa JL, Salvá M. Reacciones adversas de los medicamentos y enfermedades yatrógenas. La Habana: Editorial Científico-Técnica, 1980:90-4.
4. Lawrence D. Delayed hypersensivity in vitro. Proc Natl Acad Sci USA 1966;56:72-5.
5. Procederes de Banco de Sangre. Cuba. MINSAP. Grupo Nacional de Hematología y Banco de Sangre. 1989:17-22.
6. Boyüm A. Isolation of mononuclear cells and granulocytes from human blood. Scand J Clin Lab Invest 1968;21:77-8.
7. Faigle JW, Feldmann KF. Antiepileptic drugs. New York: Raven, 1982:483-7.
8. Goodman-Gilman A, Rall TW, Nies AS, Taylor P. Las bases farmacológicas de la terapéutica. 8 ed. Editorial Médica Panamericana, 1991:458-9.
9. CIBA-GEIGY. Tegretol. El camino hacia el antiepiléptico de primer orden. Basilea, 1984:41-4.
10. Echevarría S, Cajigas J, Rodríguez de Lope C, Lozano JL, Pons Romero F. Role of prostagladins on lymphocyte transformation in Crohn's disease. Allergol Immunophatol 1989;17:317-21.
11. Flescher E, Fossum D, Gray PJ, Harper MJ, Talal N. Aspirin like-drugs prime human T cells. Modulation in intracellular calcium concentrations. J Immunol 1991;146:2553-9.
12. Simon RA. Oral challenges to detect aspirin and sulfite sensivity in asthma. Allerg Immunol 1994;26:216-8.
13. Adverse reaction to sulfa drugs: implications for malaria chemeoterapy. Bull Pan Am Health Organ 1991;69:297-304.
14. Valle LO del, Fonte L, Macías C, Lorigados L, Socarrás B, Finlay C. Efecto de dosis profiláctica de cloroquina sobre la respuesta linfoproliferativa a mitógenos. Rev Cubana Hematol Inmunol Hemoter 1992;8:23-7.
15. Drug Information for the Health Care Professional, USPDI. 15 ed. Massachusetts: United States Farmacopeia Convention, 1995:730-1.
16. Instituto Superior de Ciencias Médicas de La Habana. Manual de Farmacología. 3 ed. La Habana: Editorial Pueblo y Educación, 1988:124-5.
17. Gleichmann E. Adverse immune reactions to drugs. Exp Haematol 1995;23:664.Recibido: 30 de septiembre de 1998. Aprobado: 4 de marzo de 1999.
Lic. Yulién Alpízar Olivares. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Teléfono: (537)578268. Fax: (537)338979. e-mail:ihidir@hemato.sld.cu