Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.15 n.3 Ciudad de la Habana sep.-dic. 1999
Instituto de Hematología e Inmunología
Recuperación hematopoyética en el trasplante alogénico de médula ósea
Dra. Elvira Dorticós Balea,1 Dra. Carmen V. Díaz Durán,2 Lic. Marianela Estrada del Cueto,1 Dr. José Carnot Uría,3 Dr. Alejandro González Otero1 y Dra. Valia Pavón Morán1RESUMEN
Se evaluaron 19 pacientes con enfermedades hematológicas a los que se les realizó trasplante de médula alogénico. En 18 pacientes el donante fue un hermano HLA idéntico y en 1 caso un hermano haploidéntico. La edad media fue de 28,3 años. Dieciséis pacientes fueron del sexo masculino y 3 del femenino. La media del número de células de médula ósea infundidas fue de 3,05 x 108 /kg de peso y del número de unidades formadoras de colonias gránulomonocíticas fue de 12,79 x 104/kg de peso. La media de recuperación de neutrófilos fue de 18,3 días y de las plaquetas 20,8 días. No se encontró correlación significativa entre el número de células de médula ósea infundidas y el día de la recuperación hematopoyética, lo que tampoco se correlacionó con el número de unidades formadoras de colonias gránulomonocíticas, ni con la existencia de enfermedad injerto contra huésped.Descriptores DeCS: TRASPLANTACION DE MEDULA OSEA; TRASPLANTACION HOMOLOGA; HEMATOPOYESIS.
La médula ósea ha sido la fuente de células progenitoras tradicionalmente utilizada para el trasplante alogénico. La toma del injerto o implante generalmente ocurre entre las 2 y 8 semanas después de la infusión de la médula.1,2 Recientemente la sangre periférica (SP) ha emergido como una fuente alternativa en este tipo de trasplante. Una de sus ventajas potenciales es la recuperación hematopoyética más rápida.3
El incremento de los granulocitos en la sangre periférica es la medida práctica más efectiva para determinar el momento de la toma del injerto.2
El período de neutropenia puede prolongarse por diversas causas como tipo de trasplante realizado, fuentes de células progenitoras utilizadas, intensidad y duración de los tratamientos previos para la enfermedad de base, régimen de acondicionamiento pretrasplante, cantidad de células progenitoras infundidas, reservas medulares reducidas, rechazo del injerto, enfermedad injerto contra huésped (EICH), defectos del microambiente medular, toxicidad por los agentes empleados para purgar la médula ósea, así como la disminución de la producción de los factores de crecimiento.1,4-6
El fallo del injerto ocurre cuando no logra restablecerse una hematopoyesis funcional normal después del trasplante de médula ósea (TMO)7 o esta ocurre sólo transitoriamente. Este evento, aunque poco frecuente, está asociado con una alta mortalidad.8,9
La identificación y cuantificación de los elementos requeridos para el estable-cimiento de una hematopoyesis exitosa continúa siendo una área activa de investigación.
MÉTODOS
Se evaluaron 19 pacientes que recibieron TMO alogénico en el Instituto de Hematología e Inmunología y en el Hospital Clinicoquirúrgico "Hermanos Ameijeiras".En todos los casos los donantes fueron hermanos, 18 HLA idénticos y uno haploidéntico.
El número de células de médula ósea (CMO) a infundir se determinó mediante conteo realizado durante la extracción, expresado en número de CMO x 108/kg de peso del paciente y corregido por la contaminación con sangre periférica.
En 11 pacientes se determinó el número de UFC-GM utilizando la técnica de Pike y Robinson.10
Los pacientes se transfundieron con glóbulos rojos para mantener las cifras de hemoglobina por encima de 100 g/L y con tromboféresis o concentrados de plaquetas cuando la cifra de éstas fue inferior a 20 x 109/L.
La recuperación hematopoyética (RH) se valoró mediante controles diarios de leucocitos totales, número absoluto de neutrófilos, conteo de plaquetas y determinación de la hemoglobina, hematócrito y conteo de reticulocitos.
Se consideró como el día del implante el primer día en que el conteo absoluto de neutrófilos alcanzó de forma mantenida la cifra de 500. También se determinó cuándo éstos alcanzaron cifras de 1 y 2 x 109/L.
La recuperación de plaquetas se valoró determinando el momento en que se alcanzaron cifras superiores a 20 x 109/L, 50 x 109/L y 150 x 109/L, sin transfusión.
Se evaluó el número de pacientes que tuvieron EICH aguda, así como el grado de ésta.
Se determinó la correlación entre el día de la recuperación hematopoyética y 1) el número de CMO infundidas, 2) el número de UFC infundidas, 3) existencia de EICH y grado de ésta. También se hallaron las correlaciones entre la existencia y grado de EICH con el número de CMO infundidas.
Se determinó la media y la desviación estándar de las siguientes variables: edad, número de CMO y de UFC-GM infundidas, día del implante, así como de los días en que el conteo absoluto de neutrófilos alcanzó valores de 0,5, 1 y 2 x 109/kg y las plaquetas alcanzaron cifras de 20, 50 y 150 x 109/L.
El análisis estadístico se realizó mediante el programa de Microsta y se calculó el coeficiente de correlación.
RESULTADOS
La enfermedad de base de los pacientes y el estadio de ésta se muestran en la tabla 1. El régimen de acondicionamiento pretrasplante y el de prevención de la EICH en la tabla 2.
| Enfermedad de base y estadio pacientes Aplasia medular grave politransfundido Leucemia mieloide crónica: Fase crónica Fase acelerada Crisis blástica Leucemia linfoide aguda: 1ra. Remisión completa 2da. Remisión completa 4ta. Remisión completa Leucemia mieloide aguda: 1ra. Remisión completa 2da. Remisión completa Remisión parcial | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| |
| Régimen de acondicionamiento | | ||
| CFM + INT | | | |
| CFM + ICT | | ||
| 1 sesión | | ||
| | | ||
| | | ||
| Prevención de la EICH | |||
| Metrotexate | | ||
| Ciclosporina + metrotexate | | ||
La edad promedio de los pacientes trasplantados fue de 28,3 años (13-45 años). Dieciséis pacientes eran del sexo masculino y 3 del femenino.
La media del número de CMO infundidas fue de 3,05 ± 1,58 x 108/kg (rango 0,5-7,6 x 108/kg).
El número de UFC-GM osciló entre 3,74 y 44,86 x 104/kg, con una media de 12,79 ± 12,44 x 104/kg.
El trasplante fue exitoso en 17 de los 19 pacientes (89,4 %). Dos enfermos fallecieron sin indicios periféricos de recuperación hematopoyética, uno el día + 23 por hemorragia pulmonar y el otro el día + 25 por sepsis por Aspergillus. Las necropsias mostraron ausencia total de tejido hematopoyético. El número de CMO infundidas en estos pacientes fue de 2,4 x 108/kg y de 3 x 108/kg, respectivamente, pero en el último el valor de UFC-GM fue de 3,74 x 104/kg, que correspondió con el valor mínimo encontrado en nuestra serie.
El implante hematopoyético ocurrió el día 18,3 (rango 10-31). El comportamiento de los neutrófilos y de las plaquetas se muestra en la tabla 3.
| | | Media ± DE | | |
| Neutrófilos | | | | |
| | | | | |
| | | | | |
| Plaquetas | | | | |
| | | | | |
| | | | |
Sólo 15 de los 19 pacientes llegaron a tener valores de plaquetas superiores a 20 x 109/L. Dos pacientes ya señalados que fallecieron en aplasia postrasplante de MO y 2 enfermos que fallecieron por sepsis los días +27 y +46, en el estudio histológico mostraron presencia de las 3 líneas hematopoyéticas, aunque sin incremento de la cifra periférica de éstas.
Trece enfermos (68,4 %) desarrollaron EICH aguda, 5 grado I, 2 grado II, 3 grado III y 3 grado IV.
No se encontró correlación entre el número de CMO infundidas y los diferentes parámetros estudiados (fig.).
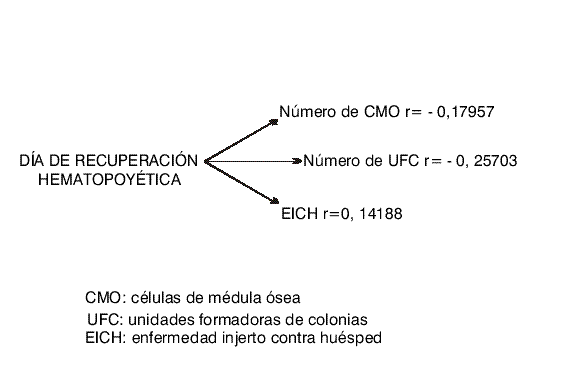
Fig. Correlación entre el momento de la recuperación hematopoyética y otros parámetros.
El coeficiente de correlación entre el día del implante y la existencia y severidad de la EICH, tampoco fue significativo r=0,01171.
DISCUSIÓN
El tiempo de recuperación de los neutrófilos en nuestra serie fue de 18,3 ± 4,9 días, cifra ligeramente inferior a la comunicada por otros autores en este tipo de TMO, que oscila entre los 21 y 24 días.11-13El momento de la recuperación de plaquetas a cifras de 20 y 50 x 109/L fue comparable con la de otras series.12,13 Se observó una mayor variabilidad en el día en que se normalizaron (>150 x 109/L), lo que se corresponde con lo comunicado en otros trabajos.4,6
La evaluación de la eritropoyesis es más difícil. Si bien pudiera reflejarse por el conteo de reticulocitos en sangre periférica, su aplicación en el TMO está limitada por la poca sensibilidad y falta de precisión de las técnicas visuales. Recientemente se está aplicando el conteo de reticulocitos por citometría de flujo, con resultados más precisos.14
Esta variabilidad en el comportamiento de las plaquetas y las dificultades con la técnica para evaluar la eritropoyesis, determina que el conteo de neutrófilos continúe siendo aceptado como la medida más efectiva para determinar el momento de la RH.2,14
El número de CMO infundidas se ha comunicado como un elemento que influye en la mortalidad relacionada con el trasplante, con la sobrevida y con la rapidez de la recuperación hematológica.15,16 Se acepta que con 2-3 x 108 células/kg de peso puede lograrse un trasplante alogénico exitoso.17 En nuestra casuística, la media del número de CMO infundidas estuvo dentro de los valores aceptados, pero no encontramos correlación con el momento de la regeneración medular. En un paciente que sólo recibió 0,5 x 108/kg de CMO ocurrió el implante, aunque en un momento más tardío (día +26) que la media de los pacientes.
En los 2 enfermos que fallecieron los días +23 y +27 sin RH, el número de CMO infundidas estuvo dentro del rango aceptado.
Otro parámetro que se ha considerado de importancia es el número de UFC-GM. Algunos autores comunican una correlación significativa entre la dosis de UFC-GM y la RH,18 otros no lo han demostrado,11 y pudiera explicarse por la variabilidad en las cifras de los laboratorios atribuibles a diferencias técnicas y de reactivos.19 Uno de los principales inconvenientes de esta técnica es que los resultados demoran de 12 a 14 días. Reportes recientes no encuentran correlación con la velocidad de la RH, pero sí con la calidad de ésta, así como con la sobrevida.20
En la actualidad se evalúa la calidad del injerto y por lo tanto la RH determinando las células CD34+ mediante citometría de flujo. Esta técnica es mucho más rápida, los resultados pueden conocerse pocas horas después de realizada, la recolección se correlaciona con el número de UFC-GM y es más confiable, por lo que debe emplearse en todos los centros que cuenten con este equipamiento.21
También se ha planteado relación entre el número de CMO infundidas y desarrollo de EICH, con una mayor incidencia de ésta cuando el número de CMO es menor.22 En nuestra serie no encontramos relación entre estos 2 parámetros, lo que coincide con otros trabajos.11
La existencia de EICH puede influir sobre la RH y producir un retardo de ésta.22 Se ha conferido importancia a su régimen de prevención, de modo que en aquéllos que usan metotrexate la recuperación es más lenta.6,23 En nuestro estudio no encontramos correlación entre la existencia ni el grado de EICH con el momento del implante.
SUMMARY
19 patients with hematologic diseases that underwent allogeneic bone marrow transplantation were evaluated. In 18 patients the donor was a HLA identical sibling and in one case a haploidentical sibling. Average age was 28.3. 16 patients were males and 3 females. The mean of the number of bone marrow cells infused was 3.05 ± 108 /kg of weight, whereas that of granulocyte-monocyte colony forming units was 12.79 ± 104/kg weight. The average recovery of neutrophils was 18.3 days and that of platelets 20.8 days. No significant correlation was found between the number of bone marrow cells infused and the day of the hematopoietic recovery. This was not correlated either with the number of granulocyte-monocyte colony forming units or with the existance of graft vs. host disease.Subject headings: BONE MARROW TRANSPLANTATION; TRANSPLANTATION, HOMOLOGOUS; HEMATOPOIESIS.
REFERENCIAS BIBLIOGRÁFICAS
1. Quiñones RR. Hematopoietic engrafment and graft failure after bone marrow transplantation. Am J Pediatr Hematol Oncol 1993;15:3-7.
2. Cairo MS, Suen Y, Sender L. Circulating granulocyte colony-stimulating factor (G-CSF) levels after allogeneic and autologous bone marrow transplantation: Endogenous G-CSF production correlates with myeloid engrafment. Blood 1992;79:1869-73.
3. Urbano-Ispizua A, Rozman C, Martínez C, Marín P, Briones J, Rovira M, Féliz P, Viguria MC, et al. Rapid engrafment without significant graft-versus-host disease after allogeneic transplantation of CD34+ selected cells from peripheral blood. Blood 1997;89:3967-73.
4. Chao NJ, Blume KG. Reconstitution of hematopoiesis following allogeneic bone marrow transplantation. En: Armitage JD, Antman KH, eds. High dose cancer therapy pharmacology, hematopoietins, stem cells. Baltimore: Willian & Wilkins, 1992:151-61.
5. Cordonnier JM, Mercier M, Plouvier E, Hervé P, Cahn JY. Prognostic factors for autologous bone marrow transplantation in acute leukemia: a single centre study of 105 patients. Nouv Rev Fr Hematol 1994;36:293-300.
6. Maraninchi D. The clinical consequences of haematological and nonhematological toxicity following bone marrow transplantation and the possible impact of haematopoietic growth factors. Bone Marrow Transplant 1993;11:12-22.
7. Mehta J, Powles R, Horton C, Treleaven J, Shingai S. Leukocyte recovery and early treatment-related mortality after bone marrow transplantation. Blood 1997;88:4237-8.
8. Filipovich AH. The histocompatibility barrier in bone marrow transplantation. En: Johnson FL, Pochedly C, eds. Bone marrow transplantation in children. New York: Raven, 1990:27.
9. Kernan NA. Graft failure following transplantation of T cell depleted marrow. En: Burakoff SJ, Deeg HJ, Ferrara JLM, Atkinson MK, eds. Graft vs. host disease: immunology, pathophysiology and treatment. New York: Marcel Dekker, 1988:557.
10. Pike BL, Robinson NA. Human bone marrow colony growth in agar gel. J Cell Physiol 1970;76:77-84.
11. Atkinson K, Norrie S, Chan P, Down K, Boggs J. Lack of correlation between nucleated bone marrow cell dose, marrow CFU-GM dose or marrow CFU-E and the rate of HLA identical sibling marrow engrafment. Br J Haematol 1985;60:245-51.
12. Eckardt JR, Roodman GD, Boldt DH. Comparison of engrafment and acute GVHD in patients undergoing cryopreserved or fresh allogeneic BMT. Bone Marrow Transplant 1993;11:125-31.
13. Beguin Y, Oris R, Fillet G. Dynamics of erythropoietic recovery following bone marrow transplantation: role of marrow proliferative capacity and erythropoietic production in autologous versus allogeneic transplants. Bone Marrow Transplant 1993;11:285-92.
14. Davies SW, Cavill I, Bentley N, Fegan CD, Poyton CH, Whittaker JA. Evaluation of erythropoiesis after bone marrow transplantation: quantitative reticulocyte counting. Br J Haematol 1992;81:12-17.
15. Mehta J, Powles R, Treleaven J, Horton C, Tait D, Meller S, Pinkertib CR, et al. Long-term follow-up of patients undergoing allogeneic bone marrow transplantation for acute myeloid leukemia in first complete remission after cyclophosphamide-total body irradiation and cyclosporine. Bone Marrow Transplant 1996;18:741-3.
16. Mehta J, Powles R, Treleaven J, Kulkami S, Horton C, Singhai S. Number of nucleated cells infused during allogeneic and autologous bone marrow transplantation. An important modifiable factor influencing outcome. Blood 1997;89:3808-10.
17. Rosenthal NS, Farhi DC, Fax RM, Lazarus HM. Marrow cellularity as a predictor of adequate cell yield for transplantation. Am J Clin Pathol 1994;101:81-4.
18. To LB, Roberts MM, Haylock DN, Dayson PG, Brandford AL, Thorp D, Ho JQK, Horvath N, et al. Comparison of haematological recovery times and supportive care requirements of autologous recovery phase pheripheral blood stem cell transplants, autologous bone marrow transplants and allogeneic bone marrow transplants. Bone Marrow Transplant 1992;9:277:84.
19. To LB. Assaying the CFU-GM in blood: correlation between cell dose and hematopoietic reconstitution. Bone Marrow Transplant 1990;5:16-8.
20. Bacigalupo A, Piaggio G, Podesta M, Figari O, Benvenuto F, Sogno G, Tedone E, Raffo MR, et al. Influence of marrow CFU-GM content on engrafment and survival after allogeneic bone marrow transplantation. Bone Marrow Transplant 1995;15:221-4.
21. Mavroudis D, Read E, Cottler-Fox M, Couriel D, Molldrem J, Carter C, Yu M, Dunbar C, et al. CD34+ cell dose predicts survival, posttrasplant morbidity and rate of hematologic recovery after allogeneic marrow transplants for hematologic malignancies. Blood 1996;88:3223-9
22. Sierra J, Storer B, Hansen JA, Bjerke JW, Martin PJ, Pedersdorf EW, Appelbaum FR, Bryant E, et al. Transplantation of marrow cells from unrelated donors for treatment of high-risk acute leukemia. The effect of leukemic burden, donor HLA-matching, and marrow cell dose. Blood 1997;89:4226-35.
23. Aschman I, Ringden O, Sunderb B, Garton G, Ljungman P, Winiarski J. Methrotexate combined with cyclosporine A decreases graft-versus-host disease, but increase relapse compared to monotherapy. Bone Marrow Transplant 1991;7:113-9.Recibido: 18 de diciembre de 1998. Aprobado: 8 de abril de 1999.
Dra. Elvira Dorticós Balea. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Teléfono: (537)578268. Fax: (537) 338979. e-mail:ihidir@hemato. sld.cu
1 Instituto de Hematología e Inmunología.
2 Hospital Clinicoquirúrgico Docente "Comandante Manuel Fajardo".
3 Hospital Clinicoquirúrgico "Hermanos Ameijeiras".














