Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.17 n.1 Ciudad de la Habana ene.-abr. 2001
Instituto de Hematología e Inmunología
Aspectos ultraestructurales de la leucemia mieloide crónica
Lic. Berta B. Socarrás Ferrer y Dr. Humberto Cabrera Rojas
RESUMEN
Se describen los aspectos ultraestructurales más importantes en la leucemia mieloide crónica (LMC). Se destacan las semejanzas entre la crisis blástica de la LMC y las leucemias agudas, cuyo rasgo más relevante en el mieloblasto es la presencia de mieloperoxidasa en los gránulos azurófilos, en el espacio perinuclear, el retículo endoplasmático rugoso y aparato de Golgi. Además, se observa en el citoplasma la presencia de un complejo de Golgi bien desarrollado, ribosomas alterados y numerosos haces de microfilamentos o fibrillas, núcleo con abundante eucromatina y nucleolo muy evidente.
DeCS: LEUCEMIA MIELOIDE CRÓNICA; MICROSCOPIA ELECTRÓNICA. .
La leucemia mieloide crónica (LMC) es una hemopatía clonal originada por la transformación neoplásica de una célula madre multipotente, caracterizada por la proliferación y acumulación de células mieloides en médula ósea y sangre periférica. En la mayoría de los casos, el clon maligno se demuestra por la presencia de un marcador citogenético, el cromosoma Philadelphia (Ph+), resultante de la traslocación 9:22 (q34,q11). En esta traslocación, el oncogen c-abl pasa del cromosoma 9 al punto de ruptura bcr en el cromosoma 22 y origina una nueva estructura genética bcr-abl.1-8
En la fase crónica de esta enfermedad se expresan todas las líneas de diferen-ciación mieloide y su aspecto es prácticamente normal, pues incluso al microscopio electrónico de transmisión (MET), los neutrófilos tienen una cantidad de gránulos normal o una leve disminución de estos. En algunas células pueden observarse bolsas nucleares, asicromismo madurativo núcleo/citoplasma y numerosos haces de microfilamentos. Con frecuencia se descubre un aumento en el número de apéndices nucleares. En ocasiones, la aparición de alteraciones nucleares de tipo pseudo Pelger (segmentación nuclear disminuida), sugiere la sospecha de la transformación de la enfermedad.4,5,9 Es común comprobar un cierto grado de eosinófilios y basofilias. En algunos pacientes coexisten en el mismo citoplasma gránulos basófilos con gránulos que ofrecen la característica estructura en rollo de las células cebadas.10,11 También es frecuente detectar en la misma célula una infidelidad de linaje que se expresa por la coexistencia de gránulos eosinófilos y basófilos.11 Según Schmidt, Mlynek y Leder12,13 se pueden descubrir regularmente leucocitos hibridoides que contienen una mezcla de gránulos eosinófilos, basófilos y mastocitoides, la cual sugiere la existencia de un precursor mieloide común para los eosinófilos, basófilos y células cebadas de tejido. La correspondencia ultraestructural con la reducción de la fosfatasa alcalina granulocítica se desconoce, puede ser por una disminución en los gránulos, por una disminución de la actividad enzimática de la fosfatasa o por disminución de la enzima en los gránulos.9,10
Inicialmente la médula ósea de la LMC es intensamente hiperplásica, pero a lo largo del proceso evolutivo puede hacerse evidente una hipoplasia, entre otras causas, debido a una mielofibrosis secundaria; los precursores y células intermedias son desplazados por elementos celulares como: fibras colágenas, fibras reticulares, osteoide calcificado y otros.1,4,5 Es habitual hallar algunos histiocitos de depósito cuya presencia refleja un aumento en el recambio celular de la médula ósea; estos histiocitos se conocen con el nombre de células de pseudo Gaucher.14
Hay casos con un intenso aumento de megacariocitos, los cuales tienden a ser de pequeño tamaño e hipolobulados. Con frecuencia muestran hipogranularidad y diversas anomalías del sistema membranoso de demarcación, que en ocasiones adoptan la configuración laberíntica. En sangre periférica se detectan frecuentemente micromegacariocitos, en especial cuando se aplica la técnica de la peroxidasa plaquetaria.5,15-20 En ocasiones se observan los llamados megacariocitos "gigantes", que al microscopio electrónico son fácilmente distinguibles y se caracterizan por núcleos multilobulados, presencia de sustancia nuclear, signos de demarcación citoplasmática y tendencia a lobulaciones marginales.18-23
Los precursores eritroides no suelen ofrecer ningún tipo de alteración.1,5,24
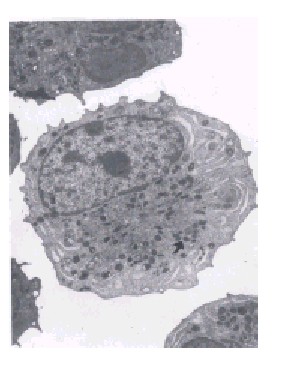
La crisis blástica de la LMC es una leucemia aguda. Sin embargo, faltan al microscopio óptico los signos de diferenciación blástica y por ello, en la correcta clasificación de las células blásticas, tiene un especial interés la contribución de la morfología y la citoquímica ultraestructurales (fig. 1).5,20,21
Fig. 1. Células blásticas con asincronismo madurativo entre el núcleo y el citoplasma. Presencia de gran cantidad de gránulos (flecha) (x 4 000).
Alrededor de una tercera parte de las crisis blásticas ofrece una morfología linfoblástica. Las células blásticas contienen escasos organelos y son peroxidasa negativas. Algunos blastos son muy pequeños y ofrecen una morfología linfoblástica tipo L1, mientras que otros son de mayor tamaño con un perfil nuclear irregular, una moderada condensación heterocromatínica y nucleolos más evidentes, como los observados en la variedad L2.23-25
Las crisis blásticas no linfoides son heterogéneas, y así, se han descrito tipos de predominio mieloblástico, monoblástico, basofílico, megacarioblástico, e incluso eritroblástico.
El rasgo principal del mieloblasto es la presencia de la mieloperoxidasa en los gránulos azurófilos, en el espacio perinuclear, en algunos trayectos del retículo endoplasmático rugoso (RER) y en los vesículos del aparato de Golgi.5 Los monoblastos contienen típicamente unos gránulos muy pequeños que son fosfatasa ácida positiva y meiloperoxidasa negativa.4,10,22
La transformación basofílica de la LMC se caracteriza por la presencia de las células blásticas hibridoides, las cuales ofrecen en su citoplasma una mezcla de gránulos basófilos inmaduros que contienen un material a modo de copos pálidos, gránulos basófilos maduros, que están repletos homogéneamente de pequeñas partículas y gránulos de células cebadas, con una estructura en forma de rollos y espirales.25-27 En ocasiones hay presencia de unos pequeños gránulos, divididos a la mitad por una fina membrana, los cuales tienen semejanza con la letra griega "theta" ( q ).26,27 Además, algunos autores han descrito la presencia de la actividad peroxidósica del tipo tanto basolífico como mastocítico (fig. 2).26
Fig. 2. Presencia de gránulos divididos por una fina membrana semejante a la letra griega (q ) (x 4 000).
Mediante estudios ultraestructurales se ha documentado la existencia de transformación megacarioblástica de la LMC.28-31
Los promegacarioblastos con la apariencia de células linfoblásticas pueden carecer de rasgos morfológios de diferenciación megacariocítica, pero casi siempre se descubre la positividad para la peroxidasa plaquetaria. En algunas ocasiones, se logra sin identificación, mediante el empleo de anticuerpos dirigidos contra las glucoproteínas de la membrana plaquetaria o contra el factor VIII. A veces de descubren elementos celulares con rasgos de diferenciación megacariocítica precoz, tales como gránulos a, membranas de demarcación, o ambas. Además se pueden observar células maduras de pequeño tamaño, con membra-nas de demarcación muy desarrolladas y la presencia de gránulos (micromegacariocitos). Con frecuencia se detectan células intermedias entre los promegacarioblastos, megacariocitos precoces y micromegacariocitos.29,32,33 La reacción de la peroxidasa plaquetaria es positiva, en casi todos los casos, y el producto de la reacción se localiza en los trayectos de RER, pero no en los gránulos ni en las cisternas de Golgi.
En algunos casos se ha descrito también crisis blástica eritroides.24,34 La morfología al MET ha permitido su identificación precisa, al descubrir la existencia de partículas de ferritina como moléculas libres en el citoplasma, formando agregados, o rodeados de membrana citoplasmática, que se asocian con la absorción de las moléculas de ferritina (rofeocitosis) y son características de los eritroblastos, incluso en sus formas más precoces. Las células blásticas eritroides se observan muy indiferenciadas, sin heterocromatina; en su citoplasma se descubren abundantes ribosomas, RER y mitocondrias. Existe un complejo de Golgi muy activo y a veces son muy evidentes las vacuolas lipídicas y los agregados de glucógeno. Las técnicas de microscopia electrónica hacen que la clasificación de las leucemias sea más objetiva y precisa. Uno de los grandes avances, es la posibilidad de definir el inmunofenotipo de las células leucémicas mediante anticuerpos monoclonales, con el empleo de la técnica de inmuno-oro. De todo esto se infiere que la microscopia electrónica, como complemento de los criterios morfológicos, inmunológicos y citogenético, permite un criterio certero sobre la clasificación de las leucemias.32,35,36
SUMMARY
The most important ultrastructural aspects in chronic myeloid leukemia (CML) are described. The similarities between the blast crisis of the CML and the acute leukemias, whose most important characteristic in the myeloblast is the presence of myeloperoxidase in the azurophil granules, in the perinuclear space, the rugose endoplasmatic reticulum and Golgis apparatus, are stressed. Besides, a well developed Golgis complex, altered ribosomes and numerous bundles of microfilaments or fibrils, nucleus with abundant euchromatin and a very evident nucleolus are present in the cytoplasma.
Subject headings: LEUKEMIA, MYELOID, CHRONIC; MICROSCOPY, ELECTRON.
REFERENCIAS BIBLIOGRÁFICAS
1. Florensa L, Woessner S, Lafuente R, Vila RM, Almarcha J, Sans J. Cultivo "in vitro" de célula germinal pluripotente de la médula ósea humana (CFU-GEMML). Aspectos técnicos, morfológicos y citoquímicos. Sangre 1985;30:292-301.
2. Fuchs FJ, Redi A, Jones RJ, Hosp AD. Cytotoxic T cells overcome bcr-abl-mediated assistance to apoptosis. Cancer 1995;55(3):463-466.
3. Nolte M, Werner M, Fwig M, von Masielews KR, Wilkens I, Georgi A. Demostration fo the Philadelphia translocation by fluorescence in situ hybridization (FISH) in paraffin sections and identification of aberrant cells by a combined FISH/immunophenotyping aproach. Histopathology 1995;26(5):433-7.
4. Clift R, Appelbaum FR, Thomas E. Bone marrow transplantation for chronic myelogenous leukemia. Blood 1994;83:2752-5.
5. Bhatia R, Verfaillie CM JS, McGlave PB. Autologous transplantation therapy for chronic myelogenous leukemia. Blood 1997;89:2623-6.
6. Wilson G, Frost L, Goodeve A, Vanderberghe E, Peake I, Reilly J. BCR-ABL transcript with an e 19a2 (C3a2). Junction in classical chronic myeloid leukemia. Blood 1997;89:3064-5.
7. Keating A, Wang XN, Laraya P. Variable transcription of bcr-abl by Ph positive cells arising from heniatopoietic progenitors in chronic myelogenus leukemia. Blood 1994;33:1744-7.
8. Sullivan RA, Schiffer CA, Patil SR, Hulserberg D, Leana-Cox J, Schwartz S. Application of FISH to complex chromosomal rearrangements asociated with chronic myelogenous leukemia. Cancer Genet Cytogenet 1995;82(2):93-9.
9. Ackerman GA. Ultrastracture and cytochemestry of the developing neutrophil. Lab Invest 1968;19:290-302.
10. Ullyot JL, Bainton D. Azurophil specific granules of blood neutrophils in chronic myelogenous leukemia: an ultrastructural and cutochemical analysis. Blood 1974;44:469-82.
11. Ackerman GA, Clark MA. Ultrastructural localization in human basophil leukocytes. Acta Haematol 1971;45:280-4.
12. Zucker-Franklin D. Electron microscopic study of human basophils. Blood 1981;29:878-90.
13. Weil SC, Haisinko MA. A hybrid eosinophilic basophilic granulocyte in chronic granulocytic leukemia. Am J Clin Pathol 1987;87:66-70.
14. Bednar B, Elleder M. Morphogenesis of Gauchers cells and cells similar to them in myelosis. Cesk Pathol 1981;17:167-70.
15. Breton-Gorius J, Reyes F, Vernant JP, Tulliez M, Dreyfus B. The blast crisis of chronic granulocytic leukemia. Megakaryocytic nature of cells revealed by presence of platelets peroxidase. A cytochemical ultrastructural study. Br J Haematol 1978;39:295-300.
16. Udomratin T, Steinberg MH, Dreiling BJ, Loelnard L. Circulating micromegakaryocytes signaling blast transformation of chronic myeloid leukemia. Scand J Haematol 1976;16(3):94-100.
17. Nafe R, Holgado de Colombo S, Choritz H, Georgii A. Morphometry of megakaryocytes for supporting the histologic diagnosis of chronic myeloproliferative diseases. Pathologe 1995;16(1):34-40.
18. Thiele J, Georgii A, Vykoupil KF. Ultrastructure of chronic megakaryocytic-granuylocytic myelosis. Blut 1976;32:433-6.
19. Bur Khardt R, Kleinknecht R, Jäger K, Firsch B, Mahl G, Bartl R. Megakaryocytic emperipolesis-accidental or diagnostic sign? Verh Dtsch Ges Pathol 1983;67:266-71.
20. Georgii A, Vykoupil KF, Thiele J. Chronic megakaryocytic myelosis-CMGM. A subtype of chronic myeloid leukemia. Virch Arch Acta Pathol Anat 1980;389:235-68.
21. Islam A, Catovsky D, Galton DAG. Histological study of bone marrow regeneration following chemotherapy for acute myeloid leukaemia and chronic granulocytic leukaemia in blast transformation. Br J Haematol 1980;45:535-40.
22. Marie JP, Vernant JP, Daeyfus B. Ultrastructural localization of peroxidase in "undifferentiated" blast during the blast crisis of chronic granylocytic leukemia. Br J Haematol 1979;43:549-58.
23. Burkhardt R, Bartl R, Jäger K, Frisch B, Kettner G, Mahl G, et al. Chronic myeloproliferative disorders (CM PD). Pathol Res Pract 1984;179:131-6.
24. Ekbloom M, Borgström G, Von Willebrand E, Gahmberg CG, Vuopio P, Anderson LC. Erytroid blast crisis in chronic myelogenous leukemia. Blood 1983;62:591-6.
25. Feliú E, Rözman C. Aspectos ultraestructurales de los síndromes mielodisplásticos adquiridos. Sangre 1985;30:651-8.
26. Pujol Moix N, Mitjavila MT, Ayats R, Remacha A, Soler J. Aspectos ultraestructurales de 34 casos de leucemia mieloides agudas en relación a la clasificación FAB. Biol Clin Hematol 1982;4:233-60.
27. Gabriel LC, Escribano LM, Marie JP, Zittoun R, Navarro JL. Peroxidase activity in circulating mast cells in blast crisis of chronic granulocytic leukemia. Comparative studies with basophils and cutaneous mast cells. Am J Clin Pathol 1986;86:212-9.
28. Bain B, Catovsky D, OBrien M, Spieas ASD, Richards HG. Megakaryoblastic transformation of chronic granulocytic leukaemia: an electron microscopy and cytochemical study. J Clin Pathol 1977;30:235-42.
29. Hanada T, Nakazawa M, Sakuma H, Takahashi M, Kordo I, Takita H. Megakaryoblastic transformation of chronic myelogenous leukaemia in a child. Scand J Haematol 1984;33:476-81.
30. Kantarjian HM, Talpaz M, Gulterman JU. Chronic myelogenous leukemia-past, present and future. Hematol Pathol 1988;2:91-4.
31. Williams WC, Weiss GB. Megakaryoblastic transformation of chronic myelogenous leukemia. Cancer 1982;49:921-4.
32. Polli N, OBrien M, Tavares de Castro J, Matutes E, San Miguel JI, Catovsky D. Characterization of blast cells in chronic granulocytic leukaemia in transformation, acute myelofibrosis and undifferentiated leukemia. I. Ultrastructural morphology and cytochemistry. BRJ Haematol 1985;59:277-96.
33. Gilberti MF, Metze K, Lorand-Metze I. Changes of nucleolar organizer regions in granulopoietic precursors during the course of chronic myeloid leukaemia. Ann Haematol 1995;71(6):275-80.
34. O Malley FM, Garson OM, McGrath K, Elliot PJ, Whiteside MG. Erytroblastic transformation of chronic granulocytic leukemia: a clinical and cytogenetic case study. Am J Hematol 1983;14:371-6.
35. Catovsky D, O Brien M, Cheachi M, Benavides I. Ultrastructural cytochemical and surface marker analysis of cells during blast crisis of chronic granulocytic leukaemia. Boll Ist Sieroter Milan 1978;57:344-54.
36. Robinson D, Tavares de Castro J, Polli N, O Brien, Catovsky D. Simultaneous demostration of membrane antigens and cytochemistry at ultrastructural level: a study with the immunogold method, acid phosphatase and myeloperoxidase. Br J Haematol 1984;56:617-31.
Recibido 18 de diciembre de 1998. Aprobado: 13 de diciembre de 1999.
Lic. Berta B Socarrás Ferrer. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Teléf.: (537)578268. Fax: (537)338979. e-mail:ihidir@hemato.sld.cu