Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.18 n.3 Ciudad de la Habana sep.-dic. 2002
Efecto in vitro de un extracto de Calendula officinalis L. sobre linfocitos humanos
Lic. Lázaro O. del Valle Pérez, Lic. Isabel Torres Leyva, Dra. Miriam Sánchez Segura, Lic. Bertha B. Socarrás Ferrer, Dra. Martha Sagarra Veranes, Dra. Vianed Marsán Suárez, Lic. Yanelkys Cos Padrón y Dra. Consuelo Macías Abraham
Resumen
La Calendula officinalis L. es una planta ornamental y medicinal a la que han atribuido propiedades inmunoestimulantes por la medicina tradicional herbolaria. Se estudió el efecto in vitro de un extracto de esta planta (100 mg/ mL) sobre los linfocitos de 30 donantes sanos y 30 enfermos, con diagnóstico de inmunodeficiencia celular mediante la transformación linfoblástica, con criterio de timidina tritiada y de roseta activa. No se hallaron diferencias estadísticamente significativas en las condiciones experimentales sin y con diluciones de Calendula officinalis L. (desde 1:2 hasta 1: 2048) en la prueba de trasformación blástica. En la roseta activa no se hallaron diferencias entre los linfocitos sin y con incubación de extracto (dilución 1: 64) durante las 24 horas previas a la formación de la roseta. Se concluye que el extracto de Calendula officinalis L. in vitro no produjo cambios en los linfocitos humanos, tanto de donantes sanos como de enfermos, con diagnóstico de inmunodeficiencia celular.
DeCS: CALENDULA; TRANSFORMACION LINFOCITICA; FORMACION DE ROSETA; IN VITRO.
Las plantas han sido utilizadas por el hombre desde hace miles de años como alimento y para la cura de diferentes afecciones. Desde hace relativamente poco tiempo ha crecido el interés científico por investigar los posibles mecanismos de acción que expliquen las propiedades atribuidas a ellas.1-4
La Declaración de Alma-Ata (1978) abrió la puerta al diálogo entre los conceptos tradicional y moderno en la atención de la salud, sobre la base de que las prácticas peligrosas se eliminarían y solo se promoverían las que fueran a la vez seguras y eficaces.5
La Calendula officinalis Lin (C) es una planta originaria de la región mediterránea que se cultiva extensamente en EE. UU, en Europa y en Cuba como planta de jardín. Es una de las especies que el Ministerio de Salud Pública ha incluido entre los medicamentos de origen vegetal cuyo uso ha sido autorizado. La parte más empleada son los capítulos florales o los pétalos, que tienen entre los componentes que se han aislado los siguientes: ácidos fenólicos, carbohidratos, cumarinas, taninos, carotenos, saponinas, tocofenoles, mucílagos, flavonoides, vitaminas y aceites esenciales,6-11 A la C se le han comprobado experimentalmente propiedades sobre: el sistema digestivo con acción farmacológica colerética y antiulcerosa;6,9,11 hipoglicemiante,10 y en la piel y mucosas es antibacteriana y antiinflamatoria.6,12-14 No se ha comprobado acción carcinogénica. Se ha reportado que todas las saponinas (dosis de 400 mg) demostraron tener actividad antimutagénica y no tóxica.8,15-16 En un modelo experimental in vitro con extracto orgánico de flores de C se encontró que posee acción inhibitoria en la replicación del virus de la inmunodeficiencia humana.17
En la medicina tradicional herbolaria se le atribuyen a la C las propiedades siguientes: inmunoestimulantes, citostáticas, antiespasmódicas, antiséptica, vulnenaria, emenagoga, sedante, analgésica, antidismenorreica, resolutiva, hemostática, para las afecciones de la piel y mucosas, como colutorios para la amigdalitis. Se ha comunicado un caso de shock anafiláctico posterior a este último uso.6
Métodos
Se obtuvieron 20 mL de sangre periférica heparinizada (15 UI/mL) de 30 donantes del Banco de Sangre del Instituto de Hematología y de 30 enfermos con diagnóstico de inmunodeficiencia celular que no habían recibido tratamiento inmunoestimulante.
El aislamiento de células mononucleares se efectuó según el método de Boyum modificado, sobre un gradiente de Ficoll-Hypaque (densidad 1,077 g/mL, Sigma, EE. UU.)18 Para valorar la respuesta a la C se incubaron (en placas Nunc, Dinamarca) los linfocitos a una concentración de 2 ´ 105 linfocitos/pocillo en 200 mL de RPMI 1640 al 20 % de suero fetal bovino (Sigma, EE. UU.) sin y con diluciones dobles de C (extracto 100 mg/mL) desde 1:2 hasta 1: 2048. El cultivo duró 72 horas a 37 °C en atmósfera húmeda de CO2 al 5 % (incubadora ASSAB, Suecia). Seis horas antes de culminar el cultivo se le añadió a cada pozo 1 mCi de timidina tritiada (Amersham, Inglaterra, actividad específica 20 Ci/mmol). Las placas se procesaron en un cosechador de células (Flow Laboratories, Inglaterra). La detección de partículas beta se realizó en un equipo RAK beta (LKB, Suecia). Los resultados se expresaron en conteos por minuto (cpm). El estudio del efecto de la C sobre la formación de la roseta activa (RA) se realizó sin y con incubación de los linfocitos con C (dilución 1/64), a 4 °C durante 24 horas previas a la formación de la misma.19 Para estudiar el efecto in vitro de las diluciones de C sobre los linfocitos incubados previamente al estudio de la formación de RA, se realizó la incubación sin y con diluciones de C (1/2-1/2048). Para el procesamiento estadístico de los datos se utilizó la t de Student para muestras pareadas para comparar los resultados obtenidos.
Resultados
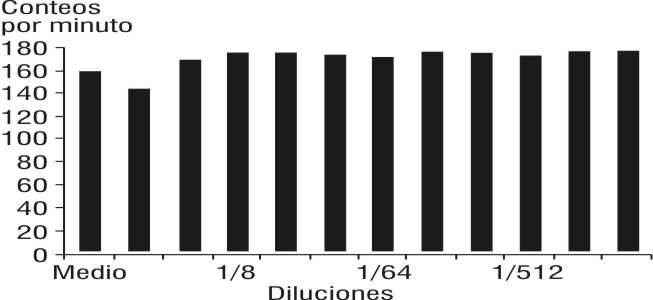
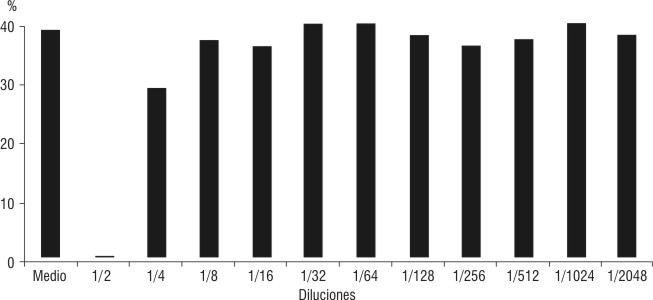
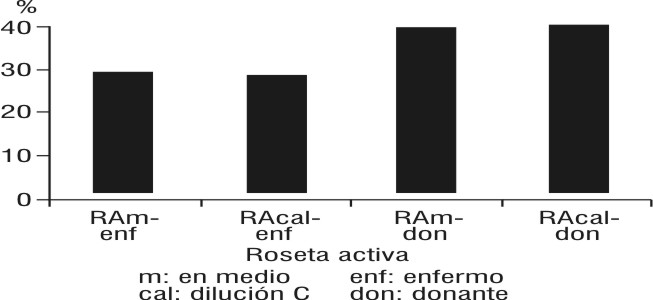
La proliferación in vitro de los linfocitos humanos incubados sin y con diluciones de C (1/2-1/2048) en donantes y enfermos con diagnósticos de inmunodeficiencia celular, no produjo cambios estadísticamente significativos (figs. 1 y 2). Los linfocitos de donantes previamente incubados sin y con diluciones de C (1/2-1/2048), no indujo diferencias estadísticamente significativas en la RA a partir de la dilución 1/4 (fig. 3). En los linfocitos de donantes y pacientes con inmunodeficiencia celular previamente incubados, sin y con C (dilución 1/64) antes de la formación de la RA, no hubo diferencias estadísticamente significativas (fig. 4).
Fig. 1. Efecto in vitro del extracto de Calendula sobre la proliferación de linfocitos de donantes sanos.
Fig. 2. Efecto in vitro del extracto de Calendula sobre la proliferación de linfocitos de enfermos con inmunodeficiencia celular.
Fig. 3. . Efecto in vitro del extracto acuoso de Calendula en la formación de rosetas activas en donantes.
Fig. 4. Efecto in vitro del extracto de Calendula en la formación de rosetas activas.
Discusión
El extracto de C no aumentó la proliferación de los linfocitos humanos tanto de los donantes sanos como de los enfermos con inmunodeficiencia celular, en nuestras condiciones experimentales (figs. 1 y 2). En la literatura revisada encontramos un reporte coincidente con el nuestro, donde no se halló efecto mitogénico de extracto de C ni con los linfocitos ni timocitos humanos.20
El efecto de las diluciones de C sobre los linfocitos incubados previamente antes de la formación de la RA, nos permitió conocer que en la dilución ½, la C tenía un efecto inhibitorio en la formación de la RA. La RA a partir de la dilución ¼ comienza a aumentar, y en las siguientes diluciones dobles no hay diferencias significativas con la RA incubada con el medio (fig. 3). La C no provocó aumento ni disminución en la expresión del marcador linfocitario CD-2 al comparar los linfocitos sin y con incubación con extracto de C mediante la RA con la dilución 1/64, tanto en los linfocitos de donantes como de los enfermos (fig. 4). No encontramos en la literatura revisada el empleo de la técnica de RA ni otra prueba celular que no fuese la TB.
La C posee principios activos que explican algunas de sus propiedades atribuidas por la medicina herbolaria, pero no hemos encontrado in vitro, al menos en estas condiciones experimentales, propiedades que justifiquen su acción unoestimulante,6,10-14
Este estudio ha contribuido a ampliar nuestros conocimientos sobre la medicina herbolaria tradicional, sobre bases científicas, de esta especie de planta.
Summary
Calendula Officinalis L is an ornamental and medicinal plant to which many immunoestimulating properties are attributed by the traditional medicine. The effect in vitro of an extract from this plant(100 mg/ML) on human lymphocytes from 30 healthy donors and 30 patients diagnosed with cellular immunodeficiency was studied through lymphoblastic transformation following tritated thymidine and active rosette criteria. No statistically significant differences were found under experimental conditions without and with Calendula officinalis L. dilutions (from 1:2 to 1:2048) in blastic transformation test. As to active rosette test, there was no difference between lymphocytes without and with incubated extract (dilution rate: 1:64) during the 24 hours before the rosette formation. It is concluded that Calendula officinalis L extract in vitro does not bring about changes in human lymphocytes from both healthy donors and patients diagnosed with cellular immunodeficiency.
Subject headings: CALENDULA; LYMPHOCYTE TRANSFORMATION; ROSETTE FORMATION; IN VITRO.Referencias bibliográficas
- Akerele O. Las plantas medicinales: un tesoro que no debemos desperdiciar. Foro Mund Salud 1993; 14: 390-5.
- Russel AS, Grace M. Hay que velar por la inocuidad y eficacia de los medicamentos. Foro Mund Salud 1993; 14: 32-5.
- Freyre E. Tendencias y controversias en la incorporación de la medicina natural y tradicional al sistema moderno de salud pública. En: Acosta S. Bioética desde una perspectiva cubana. La Habana: Centro Félix Varela; 1997. p. 183-8.
- Graf J. Herbel anti-inflammatory agents for skin disease. Skin Ther Lett 2000; 5: 3-5.
- Venediktov D. Alma-Ata y su proyección. Foro Mund Salud 1998; 19: 81-8.
- Cuba. Ministerio de Salud Pública. Plantas medicinales. Fitomed II. La Habana: Editorial Ciencias Médicas; 1993. p. 21-3.
- Zitterl-Eglseer K, Reznicek G, Jurenitsh J, Novak J, Zitterl W, Franz C. Morphogenetic variability of faradiol monoesters in marigold Calendula officinalis L. Phytochem Anal 2001; 12: 199-201.
- Final report on the safety assessment of Calendula officinalis. Int J Toxicol 2001; 20 (Suppl 2): 13-20.
- Marukami T, Kishi A, Yoshikawa M. Medicinal flowers IV. Marigold. (2): Structures of new ionone and sesquiterpene glycosides from Egyptian Calendula officinalis. Chem Pharm Bull 2001; 49: 974-8.
- Yoshikawa M, Murakami T, Kishi A, Kageura T, Matsuda H. Medicinal flowers. III. Marigold. (1): hypoglycemic, gastric emptyng inhibitory, and gastroprotective principles and new oleanane-type triterpene oligoglycosides, calendasaponins A, B, C and D from Egyptian Calendula officinalis. Chem Pharm Bull 2001; 49: 863-70.
- Schemigall J, Schnetz E, Hensel A. Evidence for bioadhesive effects of polysaccharides and polysaccharide-containing herbals in an ex vivo bioadhesion assay on buccal membranes. Planta Med 2000; 66: 48-53.
- Zitterl-Eglseer K, Sosa S, Jurenitch J, Schubert-Zsilavecz M, Della R, Tubaro A, et al. Anti-oedematous activities of the main triterpendiol esters of marigold (Calendula officinalis L.). J Ethnopharmacol 1997; 57: 139-44.
- Akihisa T, Yasukawa K, Oinuma H, Kasahara Y, Yamanouchi S, Takido M, et al. Triterpene alcohols from the flowers of compositae and anti-inflammatory effects. Phytochemistry 1996; 43: 1255-60.
- Della R, Tubaro A, Sosa S, Becker H, Saar S, Isaac O. The role the triterpenoids in the topical anti-inflammatory activity of Calendula officinalis flowers. Planta Med 1999; 60: 516-20.
- Ramos A, Edreira A, Vizoso A, Betancourt J, López M, Decalo M. Genotoxicity of an extract of Calendula officinalis L. J Ethopharmacol 1998; 61: 49-55.
- Elias R, De Meo M, Vidal-Ollivier E, Laget M, Balansard G, Dumenil G. Antimutagenic activity of some saponins isolated from Calendula officinalis L, C. arvensis L and Hedera helix L. Mutagenesis 1990; 5: 327-31.
- Kalvatchev Z, Walder R, Garzaro D. Anti-HIV activity of extracts of from Calendula officinalis flowers. Biomed Pharmacother 1997; 51: 176-80.
- Boyum A. Isolation of mononuclear cells and granulocytes from human blood. Scand J Clin Lab Invest 1968; 10: 1041-9.
- Cruz C, Fernández ML, Bernal B, Hernández P, Ballester JM. Técnica de rosetas. La aplicación en pacientes con alteraciones inmunológicas. Rev Cubana Med 1981; 20: 379-87.
- Amirghofran Z, Azadbakht M, Karimi MH. Evaluation of the immunomodulatory effects of five herbal plants. J Ethnopharmacol 2000; 72: 167-72.
Recibido: 27 de marzo de 2003. Aprobado 2 de abril de 2003.
Lic. Lázaro O. Del Valle Pérez. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Tel (537) 578268.Fax (537) 442334. e- mail: ihidir@hemato.sld.cu