Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.20 n.2 Ciudad de la Habana Mayo-ago. 2004
Instituto de Hematología e Inmunología
Trasplante de células progenitoras hematopoyéticas: tipos, fuentes e indicaciones
Dr. Juan Carlos Jaime Fagundo, Dra. Elvira Dorticós Balea, Dra. Valia Pavón Morán y Dr. Lázaro Cortina Rosales
Resumen
El traspalnte de células progenitoras hematopoyéticas, consiste en la infusión de estas células obtenidas de la médula ósea, la sangre periférica, el cordón umbilical o el hígado fetal, a un paciente que ha sido previamente acondicionado para recibir el injerto. Este proceder se ha convertido en una modalidad terapéutica para una gran variedad de enfermedades, como hemopatías malignas, anemia aplástica, inmunodeficiencias y gran número de tumores sólidos. En la actualidad se trasplantan más de 30 000 pacientes al año en todo el mundo. La selección de la fuente y el tipo de trasplante están determinados por diferentes factores. Se lleva a cabo una revisión de algunos aspectos básicos del trasplante de células hematopoyéticas como su historia, tipos, fuentes, e indicaciones.
Palabras clave: trasplante hematopoyético, fuentes, tipos, manipulación.
El trasplante de células progenitoras hematopoyéticas (TCPH), consiste en la infusión de precursores hematopoyéticos a un receptor que ha sido previamente acondicionado para recibir el injerto y constituye una terapéutica útil, en ocasiones única, para una gran variedad de enfermedades hematológicas y no hematológicas.
Tras las primeras experiencias con el trasplante de médula ósea (TMO) realizado por E. Donnall Thomas en la década de los 50, comenzó su expansión mundial en la década de los 70,1 para experimentar un espectacular desarrollo en los años 80 y 90. En el año 2000 se realizaron cerca de 30 000 trasplantes en el mundo, de ellos el 70 % fueron autólogos y el 30 % alogénicos. La sangre periférica (SP) fue la fuente de progenitores hematopoyéticos en el 90 % de los trasplantes autólogos y en el 30 % de los alogénicos.2
En la actualidad, el TCPH se ha expandido a un amplio grupo de modalidades terapéuticas, al ampliar las fuentes de obtención de células progenitoras hematopoyéticas (CPH). La fuente clásica de los progenitores hematopoyéticos para el TCPH es la médula ósea (MO), pero no es la única, y también se emplean para este fin CPH de la SP, del cordón umbilical (CU) o del hígado fetal. De ahí que el término trasplante de células progenitoras hematopoyéticas sea preferible al de trasplante de médula ósea.
En el momento actual, se han ampliado los objetivos del TCHP y se utiliza además, como una forma de inmunoterapia adoptiva. La morbilidad y mortalidad del proceder ha mejorado en los últimos años gracias a un mejor conocimiento del sistema de histocompatibilidad, al desarrollo de la terapia anti-infecciosa, al uso de ambientes con escasa contaminación microbiana, al soporte hemoterapéutico y a la administración de inmunosupresores potentes.
La introducción de este proceder en la práctica clínica no ha sido una tarea simple, pues a pesar de que la técnica para la obtención y administración de la médula ósea es un procedimiento relativamente sencillo, los problemas relacionados con el acondicionamiento del receptor, los estudios de histocompatibilidad, las alteraciones inmunes que aparecen en el período postrasplante, la prevención y el tratamiento de la enfermedad de injerto contra huésped (EICH) y de las infecciones que pueden ocurrir después del trasplante, así como las medidas de aislamiento del enfermo, hacen del TCHP uno de los más complejos dentro del campo de la trasplantología moderna.
Los experimentos en los que se basó el TMO humano se efectuaron en ratones hace más de 40 años, aunque se plantea que los inicios de este proceder comenzaron en el siglo pasado en 1891, cuando Brown le administraba a sus pacientes MO por vía oral, como tratamiento para trastornos hematológicos.3
En 1939, Rasjek y Osgood administraron a sus pacientes MO intramedular y endovenosa para el tratamiento de leucemias y aplasia medular. También en este año se realizó el primer intento de recuperar la hematopoyesis mediante la administración de transfusiones en un paciente con anemia aplástica, así como una pequeña cantidad de MO de su hermano, sin mediar ningún tratamiento condicionante previo. 4
En 1949, con los estudios de Jacobson y otros, se demostró que los ratones irradiados letalmente, podían recuperar su hematopoyesis normal si se protegía el bazo de las radiaciones, lo que demostraba el papel de este órgano como parte del sistema hematopoyético. 5
Después que se identificó a la aplasia medular producida por irradiación como una causa importante de muerte en la población japonesa expuesta a los efectos radiactivos de las explosiones de las bombas atómicas, se aceleraron las investigaciones en animales relacionadas con la cantidad de irradiación corporal que era necesaria para provocar aplasia medular, y se establecieron las bases para una aplicación clínica más racional del TMO. Poco tiempo después, en 1951, Lorenz y otros describieron que con la infusión de células de la MO de otro ratón, se podían rescatar los ratones sometidos a irradiación letal.6,7 Estos experimentos iniciales parecían demostrar que la protección a las radiaciones se debía a factores humorales. Sin embargo, Barnes y Loutit en 1954, revisando sus propios experimentos y otros realizados, concluyeron que la hipótesis química debía ser remplazada por la celular.8
Los intentos iniciales de aplicar este método a pacientes con enfermedades hematológicas graves fueron un fracaso, ya que se desconocía la importancia de la similitud de los antígenos de histocompatibilidad entre el donante y el receptor, y la necesidad de tratamiento inmunosupresor intenso.
Los anticuerpos inducidos por transfusiones y embarazos que reaccionaban con los antígenos presentes en los leucocitos humanos, fueron descritos inicialmente por Miescher y Fauconnet en 19549. Más tarde, Dausset y Van Rood en 1958, utilizaron estos anticuerpos para describir los grupos de antígenos de leucocitos humanos(HLA).10,11
En los años 50 se realizaron casi 200 trasplantes alogénicos de MO en humanos, sin éxito a largo plazo. Sin embargo, durante este tiempo, se obtuvieron resultados satisfactorios con el trasplante de gemelos idénticos, que sirvieron de base para el desarrollo de este proceder.12
En 1959 se utilizaron dosis letales de irradiación corporal total (ICT) y MO de un gemelo idéntico, para trasplantar 2 pacientes con leucemia linfoide aguda (LLA) avanzada, con recuperación de la hematopoyesis en algunas semanas, pero los pacientes murieron de enfermedad progresiva. 13
En 1965, Santos y Owens 14 comunicaron que la ciclofosfamida (CFM) era un potente inmunosupresor en modelos murinos. Como este medicamento era conocido por su efecto antileucémico, el grupo de Seattle administró 60 mg/kg durante 2 días antes de administrar la ICT, y con este régimen se obtuvieron los primeros receptores con sobrevida a largo plazo.
El primer intento de trasplante alogénico de MO en humanos se llevó a cabo en los años 60 por E. Donnall Thomas,15 por lo que recibiría el premio Nobel de Medicina en 1990.
A finales de la década de los 60, existía ya un soporte adecuado de plaquetas, una mejoría en el tratamiento antibiótico y un desarrollo mayor de agentes antineoplásicos efectivos. Los primeros trasplantes alogénicos exitosos ocurrieron en 1968 y 1969, donde 2 pacientes que sufrían de inmunodeficiencias congénitas y uno con enfermedad de Wiskott Aldrich sobrevivieron al proceder.16, 17
Posteriormente hubo una aceptación gradual de esta práctica durante los años 70.18
Los primeros trasplantes autólogos en humanos se realizaron en 1950 por Kurnick y otros,19 y por McGovern y otros en 1959.20 Estos implantes parecían proteger contra la toxicidad medular, pero su beneficio clínico era incierto, debido a la inefectividad en la erradicación de la enfermedad de base.
El trasplante autólogo fue utilizado exitosamente, primero en pacientes con linfomas en los años 70, y su uso se amplió en todo el mundo en la década de los 80.21
Los inicios del trasplante de SP fueron en 1962, cuando Goodman y Hodgson demostraron la existencia de CPH en la sangre de los ratones,22 las que podían recolectarse de forma exitosa, cuando comenzó a desarrollarse la tecnología de la citocentrifugación.
Esta fuente de CPH se comenzó a utilizar en pacientes en los que no se podían obtener células progenitoras medulares, debido a su enfermedad de base o a irradiación previa, y su uso se amplió después de descubrir que los factores de crecimiento hematopoyéticos causaban una liberación transitoria de CPH en la SP. De esta forma, en 1981 se introdujo la SP como fuente de CPH.23
La demostración de la presencia de CPH en el CU sugirió el uso de estas células para la realización de los TCPH y el primer trasplante exitoso de esta fuente se publicó por Gluckman y otros en 1989.24
Debido a la poca probabilidad de encontrar un donante familiar compatible, se realizaron los primeros TCHP no relacionados en los años 70.25 La heterogeneidad de los haplotipos HLA hizo necesaria le realización de grandes paneles de donantes, hasta la existencia hoy del registro internacional de donantes, no familiares.
Una de las hipótesis para realizar los TCPH en las leucemias, es que la curación depende en gran medida del efecto injerto contra leucemia, más que del régimen de acondicionamiento, y por lo tanto, es posible lograr un control de la enfermedad a largo plazo, con regímenes menos agresivos. Esto sentó las bases para la introducción en la década de los 90, del trasplante no mieloablativo o también llamado ''mini-trasplante''.26-28
Pasos para decidir la realización de un TCPH
- Selección del receptor.
- Estudio de la pareja donante-receptor. Estudio de compatibilidad HLA y otros estudios necesarios pretrasplante.
- Determinar el tipo de trasplante y la fuente de CPH.
- Determinar el régimen de acondicionamiento a utilizar.
- Ejecución del trasplante.
- Seguimiento del paciente trasplantado.
Indicaciones del TCPH
El TCPH está indicado en 2 situaciones fundamentales:
- Cuando el paciente tiene una enfermedad que afecta la MO y es curable por medio de la sustitución total de esta por otra sana o por la obtención de una quimera mixta, en el caso de los trasplantes no mieloablativos.
- En las afecciones en las que la toxicidad medular es un factor limítrofe para un tratamiento intensivo.
Como ejemplo de entidades en las que se utiliza esta variedad terapéutica tenemos las siguientes:
Neoplasias hematológicas.Leucemia mieloide crónica, leucemias aguda, síndromes mieloproliferativos, enfermedad de Hodgkin y linfomas no hodgkinianos (LNH), leucemia linfática crónica y otras enfermedades linfoproliferativas crónicas, mieloma múltiple (MM) y síndromes mielodisplásicos.
Enfermedades congénitas no malignas.
- Hemopatías.
Talasemia, drepanocitosis, síndrome de Wiskott-Aldrich y anemia de Fanconi. - Otras enfermedades congénitas que afectan la médula ósea.
Enfermedad de Gaucher, osteopetrosis, mucopolisacaridosis, y diversos trastornos lisosómicos. - Enfermedades que requieren un tratamiento antineoplásico intensivo.
Se incluyen la mayoría de los tumores sólidos, para cuyo tratamiento deban emplearse dosis de quimioterapia mortales por su efecto mielosupresor.
Las indicaciones más comunes para el alotrasplante y el autotrasplante difieren, y las más comunes para el primero son las leucemias agudas y crónicas, mielodisplasias y enfermedades no malignas (aplasia medular, deficiencias inmunes y trastornos metabólicos hereditarios).
Los autotrasplantes son generalmente usados para linfomas, MM y tumores sólidos. En el año 2000, los LNH y el MM fueron las causas principales de trasplante en los Estados Unidos.2 La tabla 1 muestra las principales indicaciones de los TCHP según el Grupo Europeo para el Trasplante de Médula Ósea (1998).
TABLA 1. Principales indicaciones de los trasplantes de células progenitoras hematopoyéticas (TCHP) según grupo europeo para el trasplante de médula ósea (1998)
| Trasplante alogénico | Trasplante autólogo |
| Indicaciones establecidas | |
| Anemia aplástica severa | Leucemia linfoide aguda en primera recaída (algunos subtipos) |
| Leucemia mieloide crónica | Enfermedad de Hodgkin en segunda recaída |
| Leucemia mieloide aguda (pacientes menores de 50 años) | Linfomas no-hodgkinianos en segunda recaída |
| Síndromes mielodisplásicos (pacientes menores 50 años) | Mieloma múltiple |
| Leucemia linfoide aguda en primera recaída (algunos subtipos) | Tumores sólidos como el neuroblastoma |
| Inmunodeficiencias combinadas graves | |
| Leucemias agudas mieloides y linfoides en segunda recaída | |
| Talasemia | |
| Indicaciones recientes | |
| Mieloma múltiple | Enfermedades autoinmunes, como esclerosis múltiple |
| Anemia drepanocítica | Leucemia linfoide crónica |
| Osteopetrosis | Leucemia mieloide aguda |
| Enfermedades metabólicas hereditarias | Tumores sólidos como ovario y mama |
| Enfermedad de Hodgkin | Leucemia mieloide crónica |
| Linfomas no-hodgkinianos | Enfermedad de Hodgkin en primera recaída |
| Linfomas no hodgkinianos en primera recaída | |
| Experimental | |
| Leucemia linfoide crónica | Amiloidosis |
| Carcinoma renal | Otros tumores sólidos |
| Cáncer de mama | Artritis crónica juvenil |
Por otra parte, en 1996 se definieron las diferentes categorías de los TCPH, aunque estas definiciones han estado en discusión, y se incluyen:
- Estándar: son los que se realizan frecuentemente sin que el paciente entre en ningún estudio nacional o institucional. Se hacen en cualquier centro con experiencia en el TCHP.
- Por protocolos de investigación clínica: el valor de estos trasplantes no está aún bien establecido. Se le ofrece al paciente la posibilidad de realizarle un TCHP en el contexto de un protocolo de investigación que utiliza diagnósticos definidos. El protocolo puede ser diseñado para una sola institución o puede ser parte de un estudio multicéntrico nacional o internacional. Generalmente debe ser aprobado por una comisión de ética.
- De desarrollo: se define así cuando hay poca o ninguna experiencia en este tipo de trasplante. Usualmente incluye casos aislados o estudios pilotos. Deben ser aprobado por una comisión de ética. Por lo general, los resultados son para presentaciones o publicaciones.
- No recomendado generalmente: comprende procederes contemplados en una fase o estado de la enfermedad en que el TCHP no se les realiza a los pacientes de forma convencional. Puede haber cierta superposición con la categoría anterior. También incluye estados iniciales de la enfermedad en la que no se justifica el riesgo de un trasplante o en enfermedades tan avanzadas en las que las posibilidades de éxito son muy pocas.
Tipos de trasplante
Los tipos de TCPH puede clasificarse como:
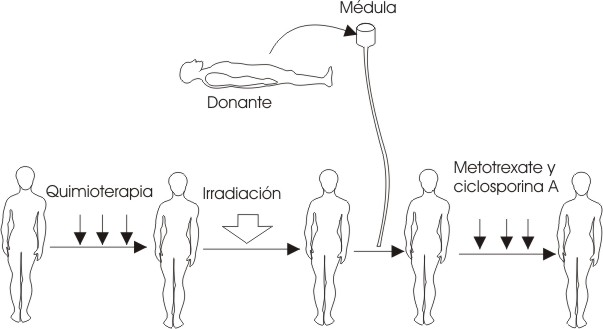
- Alogénico: efectuado entre individuos de una misma especie. El procedimiento implica la infusión de CPH de un donante sano a un paciente que se ha sometido a un tratamiento de acondicionamiento, administrado previamente, con el fin de erradicar las células neoplásicas y la capacidad de respuesta inmune del receptor, para evitar un rechazo del injerto una vez infundido. La principal limitación para la realización de este tipo de trasplante es la disponibilidad de un donante familiar HLA compatible. Sin embargo, los avances obtenidos en los últimos años en el campo de la inmunología y la biología molecular, así como la creación de registros de donantes de médula y bancos de sangre de cordón, han permitido ampliar las posibilidades de encontrar donantes histocompatibles no relacionados para los pacientes que lo requieren. El proceder para llevar a cabo el trasplante alogénico se observa en la figura 1.
FIG. 1. Esquema de los pasos seguidos en el trasplante alogénico.
A pesar de que la pareja donante-receptor sea idéntica para el sistema HLA, existen antígenos de compatibilidad menores, lo que provoca que en este trasplante exista una doble barrera inmunológica, y puede ocurrir que:
- El receptor rechace las células infundidas (rechazo del injerto).
- Las células inmunocompetentes infundidas pueden reconocer como extrañas las células del receptor, lo que se conoce como enfermedad injerto contra huésped (EICH).
Ventajas de este tipo de trasplante:
- Se trasplantan CPH sanas.
- Efecto injerto contra tumor.
Desventajas:
- Restringido a una minoría (posibilidad de donante, grupos étnicos, edad, estado general).
- Posibilidad de EICH.
- Mayor rechazo.
- Necesidad de inmunosupresión más severa.
Este tipo de trasplante comprende las siguientes variantes:
- Hermanos HLA-idénticos: cada persona hereda un haplotipo de cada uno de sus progenitores; por ello, la posibilidad teórica de disponer de un hermano HLA idéntico es del 25 %. Es el tipo de donante ideal. Actualmente la mayoría de los trasplantes alogénicos se hacen con este tipo de donante.2
- Familiares parcialmente compatibles: para los pacientes que no cuentan con un familiar HLA idéntico, el trasplante haploidéntico de un familiar es una opción, y la ventaja más significativa de este trasplante es la mayor disponibilidad, por lo que un donante está disponible en el 90 % de las veces y la demora para el proceder puede reducirse.29
La mayor desventaja es el aumento del riesgo y severidad de la EICH aguda y crónica, y aunque la depleción de linfocitos T puede disminuir esta complicación, no se han obtenido resultados totalmente satisfactorios con este proceder.30
- No familiares, total o parcialmente compatibles: debido a la limitación de los tipos de trasplantes anteriormente descritos, se ha trabajado para aumentar las posibilidades de donantes no relacionados, los cuales alcanzan más de 7,5 millones en todo el mundo. En la actualidad, el 25 % de los trasplantes alogénicos son este tipo.2, 31 A pesar de la cantidad de donantes disponibles en el registro internacional, es difícil encontrar uno para muchos pacientes, particularmente para las minorías étnicas y raciales.32
Se deben tener en cuenta algunas observaciones previas al inicio de una búsqueda internacional de donantes no emparentados o no relacionados, y entre ellas están las siguientes: - Confirmar que en el estudio de los familiares no existe algún donante compatible.
- Valorar los riesgos y beneficios de este tipo de trasplante frente a otras opciones como el autotrasplante y la quimioterapia.
- Considerar las condiciones generales: edad menor de 45 años y ausencia de alteraciones neurológicas en enfermedades congénitas.
El material a infundir en el trasplante no relacionado debe ser congelado y transportado al centro de trasplante donde este se va a realizar. En general, no hay efectos deletéreos de las células en las primeras 24 horas previas a la infusión. Se pueden eliminar los hematíes y el plasma en caso de incompatibilidad ABO, o los linfocitos T, para disminuir las posibilidades y severidad de la EICH.
Aunque la indicación de los trasplantes no relacionados debe ser analizada en cada caso en particular, las más aceptadas se resumen en la tabla 2.
TABLA 2. Principales indicaciones aceptadas del transplante no relacionado
| Entidad | Grupo | Indicaciones |
| Leucemia mieloide crónica | Frase crónica | Pacientes menores 40 años y en los 2 primeros años del diagnóstico |
| Leucemia linfoide aguda | Cromosoma Filadelfia | Primera y segunda remisiones completas, edad menores 45 años |
| Leucemia mieloide aguda | Secundaria o pos mielodisplásicos | Primera remisión completa edad 45 años |
| Síndromes mielodisplásicos | Factores de mal pronóstico | Menores 45 años |
| Aplasia medular | Formas muy graves | Menores 45 años, no respuesta a la inmunosupresión |
Los criterios para la selección de un donante no familiar han variado. En los años 80 y a principios de los 90, la mayoría de los trasplantes compatibles no relacionados se basaban en estudios serológicos del HLA. Después, el desarrollo de técnicas moleculares reveló que muchos casos aparentemente compatibles no lo eran, y en la actualidad, los estudios de HLA-DR de alta resolución han eliminado el uso del cultivo mixto de linfocitos.
Para seleccionar un donante no relacionado, se deben tener presentes algunas premisas:
- Estudio de clase I (A,B,C) y clase II DRß1 y DQß1, por técnicas moleculares.
- Utilización de donantes con una sola disparidad molecular en clase I o clase II, especialmente si existen varios idénticos con los criterios clásicos (serología A y B y molecular DRß1).
- Si sólo se identifica un donante que cumpla los criterios clásicos, pero no los de identidad molecular completa, habrá que valorar la edad del receptor y la urgencia del trasplante para decidir si se utiliza ese donante o se prosigue la búsqueda de otro más adecuado.
- No está bien definido si es más relevante la disparidad de clase I ó de clase II, aunque algunos autores plantean que las diferencias del locus A, son las que se asocian con mayor mortalidad. 33
Sin dudas, el trasplante no relacionado es más difícil y costoso que el trasplante de donantes compatibles, y el riesgo de complicaciones postrasplante es más alto. La EICHA se mantiene como una de las complicaciones inmunológicas más frecuentes después del TCPH y se produce en el 75 % en pacientes sometidos a este tipo de trasplante.33
Ventajas de este tipo de trasplante:
- Amplía la posibilidad de donantes.
- Mayor efecto injerto contra leucemia.
Desventajas:
- Riesgo aumentado de fallo del injerto (5 -10 %).
- Aumento de la frecuencia y severidad de la EICH (80 %).
- Mayor frecuencia de infecciones.
- Tiempo de demora en la búsqueda del donante.
- Alta toxicidad del régimen de acondicionamiento.
- Riesgo de infecciones fatales y de trastornos linfoproliferativos.
- Reconstitución inmune demorada o incompleta.
- Singénico o isogénico.
En este caso, el donante y el receptor son gemelos homocigotos y, por lo tanto, no existen entre ellos diferencias genéticas ni inmunológicas.
Como todo tipo de trasplante tiene sus ventajas y desventajas:
Ventajas:
- Poca o ninguna posibilidad de EICH.
- No necesita inmunosupresión.
Desventajas:
- No-efecto injerto contra tumor.
- Mayor posibilidad de recaídas.
- Autólogo o autotrasplante de médula ósea.
La experiencia acumulada con el trasplante alogénico, permitió comprobar in vivo el efecto curativo sobre algunas neoplasias hematológicas del uso de megadosis terapéuticas. Sin embargo, el aumento de la dosis se encuentra limitado por la aparición de toxicidades graves. Resulta especialmente crítica la provocada en la médula ósea, que conduce a una mielosupresión prolongada. De esta forma, la necesidad de garantizar una función hematopoyética correcta tras un tratamiento quimiorradioterápico en dosis elevadas, junto con las limitaciones del trasplante alogénico, ha sido la causa del desarrollo del autotrasplante en los últimos años.
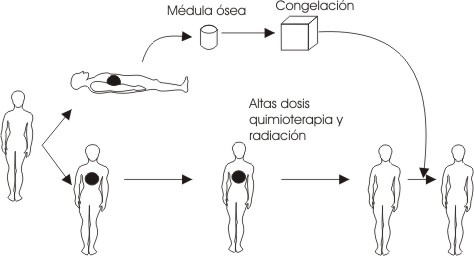
Este tipo de trasplante consiste en obtener células progenitoras hematopoyéticas del propio paciente, conservarlas y reinfundirlas, después de administrar dosis de quimioterapia y/o radioterapia ablativa, como se observa en la figura 2. Aunque su uso comenzó más tardíamente, en la actualidad es el tipo de trasplante más utilizado2. Sus diferencias con el trasplante alogénico se muestran en la tabla 3.
FIG. 2. Esquema de los pasos seguidos en el trasplante autólogo.
TABLA 3. Comparación entre trasplante hematopoyético alogénico y autólogo
| Parámetro | Autólogo | Alogénico |
| Necesidad de donante | No | Sí |
| Contaminación con células tumorales | Sí | No |
| Recuperación hematopoyética | Más rápida | Más lenta |
| Facilidad del proceso | ++ | + |
| Efectos adversos | Ligeros | Frecuentemente severos |
| Hematopoyesis duradera | Sí | Sí |
| Enfermedad injerto contra huésped | No | Sí |
| Inmunosupresión postrasplante | No | Sí |
| Necesidad de criopreservación | Sí | No |
| Efecto injerto contra leucemia | No | Sí |
| Edad límite para los candidatos (años) | 60-70 | 40-55 |
El régimen de acondicionamiento y la extracción de la médula se realizan de forma similar al trasplante alogénico, pero la inmunosupresión postrasplante no es necesaria. Es importante la criopreservación en este tipo de trasplante. 34
En la actualidad, la fuente más utilizada para el autotrasplante son las células obtenidas de la SP por medio de procedimientos de aféresis.2
Ventajas de este tipo de trasplante:
- No requiere la búsqueda de un donante.
- Menor toxicidad relacionada con el proceder.
- Se puede realizar a pacientes de mayor edad (60 - 65 años).
- No existen las complicaciones indeseables de EICH.
- Permite la realización de consolidación en los tumores sólidos, en el momento en que la masa tumoral es menor.
- Se necesita un número menor de células para la reconstrucción medular que en el trasplante alogénico.
- Es una opción en pacientes que por diferentes causas no pueden recibir un trasplante alogénico.
Desventajas:
- Las células recolectadas pueden tener una calidad deficiente.
- Existe el riesgo de contaminación con células tumorales, aunque es menor con el uso de SP.
- Mayor frecuencia de fallo en la recuperación medular debido a defectos en el microambiente medular, influido por la enfermedad de base y/o los tratamientos previos.
- Aumento del porcentaje de recaída por enfermedad mínima residual y no existencia de efecto injerto contra leucemia.
Existen diferentes factores que determinan la fuente de CPH a utilizar, tales como la patología para la que se va a realizar el trasplante, la disponibilidad de donantes y el interés investigativo de la institución que realiza el proceder.
Fuentes de células hematopotéticas
- Médula ósea: fue la primera fuente utilizada. Las CPH se obtienen por aspiración medular.
La mayoría de los equipos que realizan el TMO siguen la técnica de Thomas, que se describe brevemente a continuación. Al donante (o al paciente en el caso de un autotrasplante), se le administra en el quirófano anestesia general o raquídea y se practican entre 100 y 200 punciones aspirativas en las crestas ilíacas, con las que se obtienen en el adulto normal entre 800 y 1 200 mL de sangre medular con un contenido de entre 1,5 y 3,5 X10 8 células /kg del receptor. En el niño se debe obtener una muestra de 10-20 mL por kg del receptor.
A medida que se extrae la médula se deposita en un medio heparinizado para al final, pasarla a través de filtros de 200 a 300 nm de luz. De esta forma, los grumos medulares se convierten en suspensiones celulares y se eliminan las esquirlas óseas. En el TMO alogénico (fig. 1) esta sangre medular se transfunde 24 horas después de finalizado el régimen de acondicionamiento por vía intravenosa.
Las células progenitoras hematopoyéticas son capaces de llegar o regresar a la médula en un día. Las moléculas de adhesión, tales como VLA-4 y otras, son importantes en el anidamiento celular.
En el TMO autólogo la sangre medular se criopreserva hasta el momento de la transfusión ( fig. 2).
- Sangre periférica: en 1981, después de descubrir que los factores de crecimiento hematopoyéticos causaban una liberación transitoria de CPH en la SP, se comprobó que un número suficiente podía ser recolectado por leucoféresis y se lograba un implante rápido y mantenido después de la infusión.35 Recientemente, el uso de SP como fuente de CPH, ha aumentado.2 En el año 2000, más del 95 % de los adultos y el 80 % de los niños y adolescentes utilizaron la SP como fuente de CPH, y en los trasplantes alogénicos realizados, más del 50 % de los trasplantes HLA idénticos, la mayoría de los haploidénticos y singénicos, así como un tercio de los no relacionados, utilizaron esta fuente.2
Las células pueden ser recolectadas después de la utilización de varios métodos como el uso de quimioterapia, de factor estimulador de colonias (FEC) o de ambos, así como de una combinación de FEC, o el uso de estos factores de forma secuencial. Para el trasplante alogénico de SP exclusivamente se emplean los FEC para la movilización de las células del donante, ya que se trata de un individuo sano y éticamente no es aceptable el uso de quimioterapia.
Por lo general después del 4to. ó 5to. día de la movilización, las células se recolectan con una máquina separadora, con la que se obtienen las células mononucleares, y se reinfunden al donante los otros componentes de la sangre. Para este proceder se requieren 2 accesos venosos, para permitir un proceso continuo.
En muchos pacientes o donantes preparados para movilizar células hematopoyéticas, generalmente la extracción de un solo día no es suficiente para lograr el implante, ya que el número de células es pequeño, por lo que se requiere repetir el proceso durante varios días. Es necesario obtener un gran volumen de leucaféresis, que representa aproximadamente 20 L en un adulto o de 2 a 4 volúmenes sanguíneos en un niño.36 Para esto se necesitan realizar 2 o más días de aféresis, sobre todo cuando se va a efectuar un trasplante autólogo y en pacientes tratados previamente con quimioterapia. En los enfermos no tratados con quimioterapia intensiva, así como en donantes sanos para un trasplante alogénico, generalmente se requiere una sola sesión.36
La movilización inducida por quimioterapia, que se emplea en los trasplantes autólogos, se puede lograr con el uso de varios regímenes mieloablativos, siendo uno de los utilizados es el que emplea la Ciclofosfamida (CFM) generalmente en una dosis total de 2 g/m2 durante 2 días.
Actualmente los estudios muestran que el uso combinado de FEC granulocítico (G-CSF) junto con el etopósido, moviliza diferentes subtipos de células dendríticas, lo que favorecería una mejor generación de respuesta inmunológica, dado a que estas células están reconocidas como células presentadoras de antígenos.37
Se ha observado respuesta con el uso de G-CSF, en una dosis de 2-10 µc/kg, aunque con dosis tan altas como 24 µc/kg/día la respuesta ha sido superior, pero con la desventaja del alto costo y los efectos secundarios, principalmente el dolor óseo.
Se ha empleado el FEC gránulo-monocítico (GM-CSF) de igual modo, aunque se ha descrito una menor actividad de linfocitos T cooperadores, lo que tendría un impacto en la recuperación inmunológica después del trasplante, aunque no ha sido probado en ensayos clínicos. 38
La combinación de ambos factores puede ser superior al uso de uno solo, pero la mayoría de los pacientes responden bien solo a uno de ellos.
A continuación se detallan algunos regímenes utilizados para la movilización de CPH:
- Ciclofosfamida: 2 g/m2/d EV durante 2 días, seguido de G-CSF 5 µg/kg/d subcutáneo (SC) desde el día 3 hasta finalizar la aféresis.
- G-CSF: 10 µg/kg/d EV y etopósido (2 g/m2) EV.
- G-CSF: 5-10 µg/kg/d SC cada 12 horas durante 3-4 días, seguido por aféresis los días 4-5 siguientes.
- GM-CSF: 250 µg/m2/d SC durante 3-4 días, seguido por aféresis los días 4-5 siguientes.
- Combinación de G-CSF: 5-10 µg/kg/d (SC en la mañana) y GM-CSF 250 µ/m2/d (SC en la tarde) durante 4 días, con aféresis, comenzando el día 5.
- G-CSF: 12µg /kg 2 veces al día durante 4 días.
Se ha utilizado el stem cell factor (SCF) recombinante en pacientes que no responden a la movilización para trasplantes de SP con FEC o a la combinación de este con quimioterapia. Se ha empleado el mismo régimen anterior, en el cual se obtuvo una movilización pobre, más el SCF, que resultó en la obtención de un número suficiente de células CD34+ con una gran capacidad de reconstitución hematopoyética.39
En los pacientes que no logran una movilización adecuada, en condiciones como fibrosis o metástasis medular, y también en los trasplantes alogénicos, se utiliza con éxito el trasplante de médula estimulada con G-CSF, cuya eficacia es comparada con el TCPH de SP movilizado con este factor, con menor incidencia de EICH-A y crónica (EICH-C).
Los donantes sanos de CPH de SP deben tener los siguientes requisitos:
- Hemoglobina ³11g/dL.
- Recuento plaquetario ³150 X 109/L antes de comenzar el tratamiento de movilización.
- Resultados negativos de estudios virológicos (citomegalovirus, hepatitis B, C y virus de la inmunodeficiencia humana (VIH).
Si no se consigue la celularidad necesaria con un solo proceso de aféresis, los requisitos para las donaciones subsiguientes deben ser: hemoglobina ³10 g/L y recuento plaquetario ³ 70X109/L. La edad no constituye una limitante.
La ventaja principal del TCH de SP sobre el trasplante de MO, es que el primero contiene un mayor número de células y se logra un mejor implante. Por otro lado, también comprende un mayor número de linfocitos T, fenómeno que podría favorecer EICHA. A pesar de que la infusión de linfocitos T es unas 10 veces mayor con el trasplante de células de SP, el riesgo de EICHA no parece aumentar significativamente, aunque sí se eleva el riesgo de la EICHC. 38
Las razones por las cuales la EICH-A no es frecuente no se conocen bien, pero estudios recientes muestran que las células dendríticas producen interleucina 10 (IL-10), la que estimula a las células Th1 a transformarse en Th2, que segregan IL-4 e IL-5, las cuales actúan como inhibitorias de la respuesta inmune.40 El G-CSF estimula las células T auxiliadoras, e induce células dendríticas. Otras posibilidades planteadas para explicar la ausencia de EICHA, a pesar del gran número de linfocitos T, es que los monocitos infundidos junto con los linfocitos, pueden producir IL-10 inmunoinhibitoria y puede haber un incremento de las células NK inmunoinhibitorias. Por lo tanto, el balance de Th1/Th2 de los linfocitos CD4 es importante. La EICHA puede ser causada por un exceso de Th1 sobre los Th2 y el dominio de estos últimos inhibe la EICHA. 40,41
El empleo de esta fuente celular tiene problemas éticos derivados del uso de FEC en donantes sanos para la movilización celular, ya que persiste la duda de si se puede lograr o no una permanente reproducción de las células hematopoyéticas. El otro problema ético está relacionado con la posibilidad de alto riesgo de EICH, causado por el mayor contenido de células T. 38,40
La administración de FEC, causa la mayoría de los síntomas en el donante. Estos incluyen dolor lumbar, óseo y muscular, cefalea, hipotensión, malestar general, somnolencia, pérdida de apetito, erupción, náuseas, fiebre, retención de líquidos, etc.
Se han descrito casos de parada cardíaca e infarto del miocardio durante la aféresis en donantes con antecedentes de enfermedades cardiovasculares. Otras complicaciones incluyen aumento de tamaño del bazo y ruptura esplénica, así como signos de hematopoyesis extramedular. También se puede presentar epiescleritis e iritis. El sangramiento por trombocitopenia producido después de la administración del G-CSF en pacientes que comienzan con un número de plaquetas bajo, es debido al aumento de la agregación plaquetaria. 38,41
Ventajas de esta fuente de CPH:
- No hay necesidad de empleo del salón de operaciones y se evitan todos los riesgos que esto conlleva.
- Obtención de un mayor número de células hematopoyéticas.
- Rápida recuperación hematológica después del implante.
- Menor posibilidad de obtención de células malignas.
- Disminución del riesgo de infección del material recolectado.
- Se pueden obtener células hematopoyéticas en situaciones en las que se dificulta su extracción de la médula ósea (mielofibrosis, irradiación pélvica, etc.)
Desventajas:
- Mayor posibilidad de desarrollar EICH dado el mayor contenido de células T.
- Necesidad del uso de factores estimuladores hematopoyéticos en personas sanas.
Las CPH muestran un amplio rango de moléculas de adhesión, que incluye miembros de la familia de las integrinas, selectinas y la súper familia de las inmunoglobulinas, entre otras.42
Entre estas moléculas de adhesión, el VLA-4, conocida como CD49d, utiliza importantes moléculas, cuyos ligandos, la fibronectina y el VCAM-1, son expresados en el estroma de la médula ósea.43
La expresión CD49d sobre las células CD34 puede estar involucrada en el proceso de movilización y muestran una co-expresión más baja en las células, dado el efecto producido por la administración de factores estimuladores de colonias. El uso de FEC permite una migración hacia la periferia de las células hematopoyéticas, ya que es capaz de escindir las moléculas de adhesión y permitir la salida de las células de su nicho, por lo que se piensa que esta es una de las razones por las cuales las células CD34+ se movilizan fácilmente desde la MO hacia la SP.42
Las células son fácilmente reconocidas por el estroma medular, y en este proceso está involucrado el factor 1 derivado del estroma producido por la MO, que se une con el receptor CXCR4 y activan varias moléculas de adhesión como la VCAM-1 a través de varias señales intracelulares. Otro factor involucrado en el proceso de anidamiento y en el implante es la presencia del c-Kit , el que permite al stem cell adherirse al estroma medular.43
A pesar de que no existe un criterio uniforme en cuanto al número de CPH a recolectar, se considera necesario un mínimo de células CD 34+ > 2X106 /kg del receptor.41
- Cordón umbilical: el reconocimiento que las células del CU tienen características de crecimiento, capaces de producir una repoblación a largo plazo de células hematopoyéticas, llevó a la idea de obtener células de la placenta y de la vena umbilical después del parto para el trasplante alogénico. El primer trasplante alogénico de CU exitoso, se realizó en 1989, para tratar a un niño con anemia de Fanconi y se usó como donante su hermana HLA idéntica.44
Se ha demostrado, que el CU de recién nacidos tanto a término como pretérminos, contiene un número determinado de progenitores hematopoyéticos inmaduros y comprometidos, capaces de producir el implante en niños y adultos. Su eficacia en estos últimos está por probar, ya que el número de células es muy pequeño para proveer un implante duradero. 45
Es la actualidad, es la tercera fuente de células para trasplante en adultos y la segunda en niños.2 Se ha empleado en enfermedades genéticas y malignas y se ha utilizado en pacientes con compatibilidad total o parcial, familiares y no familiares.
Para la obtención de estas células se necesitan una serie se requisitos como: mujeres con historia obstétrica normal, controles serológicos negativos durante la gestación, ausencia de antecedentes médicos maternos o paternos que supongan un riesgo de trasmisión de enfermedades infecciosas o genéticas a través de la sangre del cordón, desarrollo normal del parto y consentimiento informado firmado por la madre. Se deben excluir partos antes de las 32 semanas, fiebre en el momento del parto mayor que 38 oC , inmunización feto-materna y signos de sufrimiento fetal.
Durante el embarazo se realiza una historia clínica y se efectúan determinaciones serológicas de enfermedades infecciosas a la madre, así como cultivo de la sangre del cordón. Al nacimiento se repiten estos exámenes serológicos y se hace un examen minucioso del recién nacido.
Los resultados serológicos, junto con el volumen, celularidad, estudio HLA y grupo sanguíneo, se guardan en un registro confidencial autorizando el uso terapéutico de la donación. Si no cumple las características requeridas, la sangre del cordón será desechada.
Métodos de recolección
- Previo alumbramiento (colección in-útero). Se realiza mediante la punción y aspiración de la vena umbilical utilizando jeringuillas de 60 mL con 5 mL de CPD o por punción de la vena umbilical con set de aguja incorporada a bolsa de recolección y recogido por gravedad en bolsas que contienen 25 mL de CPD.
- Después del alumbramiento (colección ex-útero). Se cuelga la placenta y se utilizan los mismos métodos que en la colección in -útero, o se secciona el cordón umbilical cerca de la placenta y se cateterizan la arteria y la vena umbilical.
A través de la arteria se infunde una solución salina con ACD, y a través de la vena se conectan jeringuillas de 60 mL y se aspira hasta obtener toda la sangre placentaria posible. El cordón se exprime suavemente y se deja correr la sangre venosa por gravedad en un tubo estéril.
Se determina el volumen, se realizan recuentos celulares: células totales, mononucleares, CD34, unidades formadoras de colonias granulo-monocíticas ( GM-CFU), tipaje HLA, grupo sanguíneo y factor, serologías virales y cultivos para bacterias y hongos.46
Una unidad se sangre del cordón se considera apta para el trasplante cuando presenta las condiciones siguientes:
- Volumen: 100 mL(40-250 mL).
- Recuentos de leucocitos: 10X108 (1,5-50).
- Recuentos de CD34+ : 3X106 (0,5-16).
- Recuentos de GM-CFU 5X105 (0,5-50).
Se sabe que las células progenitoras del CU poseen una expansión ex vivo mayor que las células de la MO cuando son estimuladas con factores de crecimiento. La expansión de las células CD34+ del CU durante 14 días con interleucina 11 (IL-11) y G-CSF, es significativamente mayor que la realizada en células de la MO.46
Se ha demostrado una alteración significativa en el número de citocinas y linfocinas hematopoyéticas en la sangre obtenida del CU, tales como G-CSF, GM-CSF, así como de IL-3 comparado con el adulto, lo que explica que el neonato esta más propenso a infecciones. Esto lleva a la demora en la recuperación hematológica e inmune después del trasplante. 45
Existe una disminución del número absoluto de células CD4+, CD 8+ y CD3+, pero una relación CD4+/CD8+ más alta que en las células de la SP.45
El volumen de sangre recolectada de cada placenta está entre 40-240 mLy el número de células nucleadas de una sola muestra varía entre 4,7 X 108 a 4,6 X 109.
Con el objetivo de aumentar el número de células, se utilizan múltiples cordones umbilicales en combinación para lograr el injerto. Barkers y otros 47 describieron un estudio en pacientes con hemopatías malignas de alto riesgo, que no poseían donantes relacionados y fueron trasplantados usando 2 cordones umbilicales, después de un acondicionamiento intenso, demostrando que el injerto ocurre más rápidamente que cuando se usa un solo CU.
El fácil y pronto acceso, la ausencia de riesgo en el proceder (tanto para la madre como para el recién nacido) y la no necesidad de una compatibilidad rigurosa, hacen este tipo de trasplante muy prometedor.
Ventajas de esta fuente de CPH:
- No riesgo para el donante.
- Menor posibilidad de transmisión de infecciones.
- Disminución de la frecuencia y severidad de EICH.
- Mayor posibilidad de crear un banco de células.
- Aumenta la posibilidad de incluir grupos minoritarios.
- Menor tiempo de búsqueda de donante.
- Utilización en accidentes nucleares.
- Uso para el trasplante de genes.
- Expansión ex vivo.
- Posibilidad de combinar varios donantes.
- Posibilidad de utilizar donantes no totalmente compatibles.
Desventajas:
- Escaso número de células.
- Poca factibilidad en adultos o pacientes de gran peso.
- Se desconoce si tiene un efecto injerto contra leucemia efectivo.
- Recuperación hematopoyética más lenta.
- Imposibilidad de una segunda donación en caso de fallo del implante.
- Posibilidad de trasmisión de enfermedades genéticas no reconocibles en el momento del nacimiento.
Hígado fetal
Se conoce que la primera hematopoyesis extravascular detectable en el feto humano, ocurre en el hígado en las primeras 6 semanas, y se mantiene como el mayor sitio con esta función hasta el nacimiento. 48
Esto motivó al uso de este órgano como fuente de CPH. Para la obtención de estas células del hígado fetal, se disgrega el material hepático obtenido de fetos procedentes de abortos espontáneos entre 16 y 24 semanas. Se separa el tejido conectivo de las suspensiones celulares por gravedad, los hematíes se lisan y las células mononucleares se separan por centrifugación, se coleccionan, se lavan y se criopreservan. 49
Métodos de evaluación del producto obtenido por cualquiera de las fuentes
Al finalizar el proceso de recolección de las células progenitoras, se realiza la cuantificación de las GM-CFU, pero estas técnicas son muy laboriosas, necesitan al menos 14 días para tener el resultado y las cifras varían de acuerdo con diferentes laboratorios.
Para tener una cifra de células con mayor rapidez, se cuenta el número de células CD34+, marcador presente en las células progenitoras y se considera como útil la presencia de al menos 2 X 106 células CD34+/ kg de peso del receptor. Por debajo de este valor, aumenta la posibilidad de demora del implante de neutrófilos y especialmente de plaquetas. 51
Después de la obtención de las CPH, estas se mantienen en refrigeración hasta su posterior infusión. Una vez que el producto se ha obtenido e identificado, debe ser conservado a una temperatura de 4 0C si es por un tiempo menor de 48 horas, ya que la viabilidad desciende un 5 % en 24 horas, y del 50 al 70 % en 7 días. 20Se debe criopreservar a -80 0C si se va a utilizar antes de 6 meses y después de este tiempo debe ser a una temperatura de -196 0C en nitrógeno líquido y pueden mantener la capacidad de producir un adecuado implante hasta 10 años después. 34
La criopreservación es un factor importante para los trasplantes autólogos, ya que permite el mantenimiento a largo plazo de la viabilidad y la función reconstructiva, con un mínimo de riesgo de contaminación microbiana. En el caso de los trasplantes alogénicos, estas células son obtenidas en el momento en que van a ser usadas, y no es necesaria la criopreservación.
En ocasiones es necesario actuar sobre la muestra obtenida antes de administrarla al paciente. En la selección de las células a infundir puede haber eliminación de las células malignas (selección negativa) u obtención de células CD34+ (selección positiva).
También se puede lograr una proliferación de células diana específicas, tales como células progenitoras o dendríticas y depleción de linfocitos T, entre otros procederes. A continuación se muestran métodos de purgado:
Separación física:
- Tamaño, densidad, lisis osmótica, hipertermia.
- Aglutinación con Lecitina.
Separación farmacológica:
- 4- Hidroperoxiciclofosfamida.
- Mafosfamida.
- Mostaza nitrogenada y VP-16.
Separación por métodos inmunológicos y anticuerpos monoclonales:
- Lisis mediada por complemento:
Campath 1(anti CD52) elimina Lin T, B y monocitos. - Inmunotoxinas: ricina A, exotoxinas) pseudomona diftérica.
- Anticuerpos con radionúcleos.
- Anticuerpos fijados a partículas: partículas inmunomagnéticas y AcMo, partículas densas combinadas con AcMo, partículas de polipropileno no porosas de baja densidad y separación por flotación.
Cultivos:
- En presencia de factores de crecimiento.
- Lisis por toxinas(Siga-like toxina-1).
Físico-químicos:
- Fotoactivación de la Rodamina.
Selección positiva de CD 34:
- Purgado indirecto. Recuperando únicamente las células CD34+.
- Combinación de selección positiva con purgado.
En general, después de la recolección, las células pueden ser sometidas a los procesos siguientes:
- Depleción de granulocitos por centrifugación.
- Depleción de las células tumorales por técnicas de purga.
- Depleción de las células T para disminuir el riesgo de EICH en el trasplante alogénico no alogénico.
- Aplicación de anticuerpos monoclonales.
- Cultivo junto con citocinas para lograr un crecimiento ex vivo.
- En caso de incompatibilidad eritrocitaria se debe reducir el hematócrito y/o el volumen plasmático.
- Para ahorrar espacio de almacenamiento, se realizan técnicas de separación por densidad física, utilizando dispositivos de procesamiento mecánico u otras técnicas.
Las células CD34+ movilizadas a la SP, proliferan con la presencia de IL-1, IL-3 e IL-6, Eritropoyetina (Epo), GM-CSF,G-CSF y SCF. El propósito de la llamada expansión, es lograr una capacidad reconstructiva hematopoyética suficiente, con pequeños volúmenes de material de cultivo o para pacientes que movilizan pocas células, con el objetivo de acortar la duración de la citopenia.51
En el trasplante alogénico, el tratamiento más frecuente, consiste en la depleción de los linfocitos T, con la finalidad de prevenir la EICH. Desafortunadamente, este procedimiento se acompaña de un aumento en el número de los fallos del implante, de recidivas leucémicas por un menor efecto injerto contra leucemia y un retraso en la reconstitución inmunológica. Por ello, la depleción linfoide T no mejora de forma global la supervivencia libre de enfermedad de los pacientes trasplantados.
En los trasplantes autólogos, el tratamiento ex vivo tiene como objeto eliminar la celularidad neoplásica residual que pueda existir, que es la mayor limitación de este tipo de trasplante. Se utilizan varios métodos para eliminar o purgar las células malignas de las colecciones de CPH con el objetivo es separar las células normales de las malignas existentes en el inóculo, sin provocar un daño sustancial de las CPH y así no afectar la potencialidad de un injerto exitoso.
Estos métodos están basados tanto en una selección negativa como positiva.
La selección positiva más utilizada es aquella que se basa en el uso de un medio enriquecido para conservación de las CPH y la selección de las células CD34+.
Esta técnica está basada en la presencia de antígenos de superficie expresados por los precursores hematopoyéticos y requiere la inmunoselección de la célula progenitora mediante el uso de antígenos de superficie como el CD34. La principal ventaja de este método es que no depende de características especificas de las células tumorales, tales como expresión de antígenos o sensibilidad a drogas citotóxicas, mientras la célula tumoral sea negativa para el antígeno de superficie celular. Otra ventaja de la selección positiva sobre la negativa es que la primera puede ser aplicada fácilmente a gran número de células mononucleares.
La selección negativa se basa en técnicas que depletan las células tumorales en una mayor cuantía que a las células normales. Esto incluye el uso de agentes farmacológicos tales como la mafosfamida (ASTA-Z), la 4-hidroperoxiciclofosfamida (4HC), la mostaza nitrogenada y el VP-16. Estas drogas tienen un respeto relativo a las células progenitoras hematopoyéticas no comprometidas, pero destruyen las células leucémicas. Las células a infundir se incuban con la droga por un período de tiempo apropiado y luego se lavan y se criopreservan. 52
Los agentes inmunológicos, en el caso de los anticuerpos monoclonales, actúan sobre determinados antígenos celulares, como es el caso del Campath 1.53
Las propiedades que debe tener un agente depurador, inmunológico o farmacológico son las siguientes:
- Exceptuar las células hematopoyéticas necesarias para la recuperación hematológica, luego del tratamiento con altas dosis.
- Eliminar las células tumorales durante la breve exposición, usualmente disponible antes de la criopreservación.
- No debe ser tóxico en infusión cuando las CPH se reinfunden o debe ser eliminable.
- Debe ser capaz de eliminar células malignas con independencia del estado del ciclo celular.
Summary
The hematopoietic progenitor cell transplantation is the infusion of these cells obtained from bone marrow, peripheral blood, umbilical cord or fetal liver into a patient who has been prepared for receiving the graft. This procedure has turned into a therapeutical variant to be used in a wide variety of diseases such as malignant hemopathies, aplastic anemia, immunodeficiencies and a large number of solid tumors. At present, the number of transplanted patients amounts to 30 000 yearly all over the world. The selection of the source and the type of transplantation depend on different factors. A literature review of some basic aspects of transplantation of hematopoeitic cells such as history, types, sources and indications was made.Key words: hematopoietic transplant, sources, types, handling.
Referencias bibliográficas
- Santos GW. History of bone marrow transplantation. Clin Haem 1983;12:611-39.
- IBMTR/ABMTR Newsletter, February 2002, volume 9, issue 1.
- Forkner CE. Leukemia and allied disorders. New York: Macmillan; 1938.
- Osgood EE, Riddle MC, Mathews TJ. Aplastic anemia treated with daily transfusions and intravenous marrow; case report. Ann Intern Med 1939;13:357-67.
- Jacobson LO, Marks EK. Role of the spleen in radiation injury. Proc Soc Exp Biol Med 1949;70:7440.
- Lorenz E, Uphoff D, Reid TR, Sheldon E. Modification of irradiation injury in mice and guinea pigs by bone marrow injections. J Natl Cancer Inst 1951;12:197-201.
- Lorenz E, Congdon CC. Modification of lethal irradiation injury in mice by injection of homologous and heterologous bone marrow. J Natl Cancer Inst 1954;14:955-61.
- Barnes DWH, Loutit JF. What is the recovery factor in spleen? Nucleonics 1954;12: 68-71.
- Miescher PP, Fauconnet M. Mise en e´vidence de diffe´rents groupes leucocytaires chez l'homme. Schweizerische Medizinische Wochenschrift 1954;84:597-9.
- Dausset J. Iso-leuco-anticorps. Acta Haematologica 1958;20:156-66.
- Dausset J, Rapaport FT, Legrand L, Colombani J, Barge A, Feingold N. Studies on transplantation antigens (HL-A) by means of skin grafts from 90 children onto their fathers. Nouv Rev Française d'Hématol 1969;9:215-9.
- Thomas ED. The evolution of scientific foundation of marrow transplantation based on human studies. En: Forman SJ Blume KG, Thomas ED. Bone marrow transplantation. Boston: Blackwell Scientific Publication; 1994. p.12-5.
- Thomas ED, Storb R, Clift RA. Bone-marrow transplantation. N Engl J Med 1975;292:832-43, 895.
- Santos GW Owens AH Jr. Allogeneic marrow transplants in cyclophosphamide treated mice. Transplantation Proceedings1969;1: 44-6.
- Thomas ED , Lochte HL, Jr. Intravenous infusion of bone marrow in patients receiving radiation and chemotherapy . N Eng J Med 1957;257:491.
- Bach FH, Albertini RJ. Bone marrow transplantation in a patient with Wiskott-Aldrich syndrome. Lancet 1968; 2:1364.
- Koning J, van Bekkum DW. Transplantation of bone marrow cells and fetal thymus in an infant with lymphopenic immunological deficiency. Lancet 1969;1:1223.
- Thomas ED, Storb R, Clift RA, et al. Bone-marrow transplantation. N Engl J Med 1975; 292:832-43, 895.
- Kurnick N B, Montano A, Gerdes JC, Feder BH. Preliminary observations on the treatment of postirradiation hematopoietic depression in man by the infusion of stored autogenous bone marrow. Ann Internal Med 1958;49:973-86.
- McGovern JJ Jr, Russel PS, Atkins L, Webster EW. Treatment of terminal leukemic relapse by total-body irradiation and intravenous infusion of stored autologous bone marrow obtained during remission. N Eng J Med 1959;260:675-83.
- Appelbaum FR, Herzig GP, Ziegler JL, Graw RG, Levine AS, Deisseroth AB. Successful engraftment of cryopreserved autologous bone marrow in patients with malignant lymphoma. Blood 1978;52:85-95.
- Goodman JW, Hodgson GS. Evidence for stem cells in the peripheral blood of mice. Blood 1962;19:702-14.
- Körbling M, Burke P, Braine H, Elfenbein G, Santos G, Kaizer H. Successful engraftment of blood-derived normal hemopoietic stem cells in chronic myelogenous leukemia. Exp Hematol 1981;9:684-690
- Gluckman E, Rocha V, Boyer-Chammard A, Locatelli F, Arcese W, Pasquini R, Ortega J, Souillet G, Ferreira E, Laporte JP, Fernandez M, Chastang C. Outcome of cord-blood transplantation from related and unrelated donors. N Eng J Med 1997:337,373-81.
- Speck B, Zwaan FE, van Rood JJ, Eernisse JG. Allogeneic bone marrow transplantation in a patient with aplastic anemia using a phenotypically HLA-A-identical unrelated donor. Transplantation 1973:16: 24-8.
- Carella AM, Champlin R, Slavin S, McSweeny P, Storb R. Mini-allografts: ongoing trials in humans. Bone Marrow Transplant 2000: 25:345-50.
- Champlin R, Khouri I, Kornblau S, Molldrem J, Giralt S. Reinventing bone marrow transplantation: reducing toxicity using nonmyeloablative preparative regimens and induction of graft-versus-malignancy. Curr Opin Oncol 1999:87-95.
- Giralt S, Estey E, Albitar M, et al. Engraftment of allogeneic hematopoietic progenitor cells with purine analog-containing chemotherapy: harnessing graft-versus-leukemia without myeloablative therapy. Blood 1997; 89:12-20, .
- Averso F, Tabilio A, Velardi A, et al. Treatment of high-risk acute leukemia with T-cell-depleted stem cells from related donors with one fully mismatched HLA haplotype. N Engl J Med 1998; 339:1186-93.
- Dini G, Cancedda R, Locatelli F, Bosi A, Bandini G, Alessandrino EP. Unrelated donor marrow transplantation: an update of the experience of the Italian Bone Marrow Group (GITMO). Haematologica 2001;86:451-6.
- Bone Marrow Donors Worldwide. December 2001. Edition.
- Gratwohl A, Passweg J, Baldomero H, Urbano-Ispizua AL. Bone marrow transplantation activity in Europe 1999. Report from the European Group for Bone Marrow Transplantation (EBMT). Bone Marrow Transplant 2001;27:899-916.
- Henson JA, Gooley TA, Martin PJ, et al. Bone marrow transplant from unrelated donors for patients with chronic myeloid leukemia. N Engl J Med 1998; 338: 962-8.
- Law P, Meryman H. Cryopreservation of human bone marrow grafts. En: Gee AP, ed. Bone marrow processing and purgin: A practical guide , Boca Raton, Fl: CRC Press; 1991.p.331-40.
- Körbling M, Burke P, Braine H, Elfenbein G, Santos G, Kaizer H. Successful engraftment of blood-derived normal hemopoietic stem cells in chronic myelogenous leukemia. Exp Hematol 1981;9:684-90.
- Cutler C, Antin JH. Peripheral blood stem cells for allogeneic transplantation: A Review. Stem Cells 2001 Mar;19(2):108-17.
- Bolwell B, Sobecks R, Pohlman B, Andresen S, Theil K, Serafino1 S, Rybicki L, Kalaycio M . Etoposide (VP-16) plus G-CSF mobilizes different dendritic cell subsets than does G-CSF alone Bone Marrow Transplantation 2003;31:95-8.
- Bensinger WI, Clift R, Martin P, et al: Allogeneic peripheral blood stem cell transplantation in patients with advanced hematologic malignancies: A retrospective comparison with marrow transplantation. Blood 1996; 88:2794.
- To LB, Bashford J, Durrant S, MacMillan J, Schwarer AP, Prince HM , Gibson et al J . Successful mobilization of peripheral blood stem cells after addition of ancestim (stem cell factor) in patients who had failed a prior mobilization with filgrastim (granulocyte colony-stimulating factor) alone or with chemotherapy plus filgrastim. Bone Marrow Transplant 2003,31:371-8.
- Lambrecht BM, De Veerman M, Coyle AJ. Myeloid dendritic cells induce Th2 response to inhaled antigen, leading to eosinophilic airway inflammation. J Clin Invest 2000;106:551-9.
- Körbling M. Collection of allogeneic peripheral blood stem cells. Bailliere´s Clin Hematol 1999;12:41-55.
- Kasai M, Masauzi N, Kobayashy N. Expression of adhesion molecules on hematopoietic progenitors cells mobilized by G-CSF. En: Sekiguchi S, ed. Transfusion Hematopoietic Stem Cells. UK: Blackwell Science; 1996 .p.130-7.
- Levesque JP Ty, Nilsson SK. Mobilisation of hemopoietic progenitor cells into peripheral blood is associated with VCAM-1 proteolytic cleavage in the bone marrow. Blood 2000; 96(suppl 1):221a.
- Gluckman E, Broxmeyer HE, Auerbach AD. Hematopoietic reconstitution in a patient with Fanconi's anemia by means of umbilical cord blood from an HLA-identical sibling. N Engl J Med 1989;321:1174.
- Broxmeyer HE, Gluckman E, Auerbach AD, Douglas GW, Friedman H, Cooper S, Hangoc G, Kurtzberg J, Bard J, Boyse EA. Human umbilical cord blood: A clinically useful source of transplantable hematopoietic stem/progenitor cells. Int J Cell Cloning 1990;8:76.
- Traycoff CM, Kosak ST, Grigsby S, Srour EF. Evaluation of ex vivo expansion potential of cord blood and bone marrow hematopoietic progenitor cells using cell tracking and limiting dilution analysis. Blood 1995;85:2059.
- Barker JN, Weisdorf DJ, DeFor TE. Impact of multiple unrelated donor umbilical cord blood transplantation in adults: preliminary analysis of safety and efficacy. Program and abstracts of the 43rd Annual Meeting of the American Society of Hematology; Orlando, Florida, December 7-11, 2001.
- Kelemen E. Macrophages are the first differentiated blood cells formed in human embryonic liver. Exp Hematol 1980; 8:996.
- Hsiang C. Hematopoietic stem cells express Tie-2 receptor in the murine fetal liver. Blood 2000;96:3757-62.
- Siena S, Schiavo R, Pedrazzoli P, Carlo-Stella C. Therapeutic relevance of CD34 cell dose in blood cell transplantation for cancer therapy. J Clin Oncol 2000; 18(6):1360-77.
- Mahon Fx , Pigeonnier -Lagarde V, Chahine H. Ex vivo cytokine expansion of peripheral blood Ph negative cells in chronic myeloid leukemia. Leukemia Lymphoma 1998;32:151-7.
- Smith D. Autologous bone marrow transplantation with 4-hydroperoxycyclo-phosphamide purging for acute myeloid leukaemia beyond first remission: a 10-year experience. Brit J Haematol 2002;117:907-13.
- Naparstek E, Delukina M. Engraftment of marrow allografts treated with Campath-1 monoclonal antibodies. Exp Hematol 1999;27:1210-8.
Recibido: 25 de mayo de 2004. Aprobado: 15 de julio de 2004.
Dr. Juan Carlos Jaime Fagundo. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800 Ciudad de La Habana, Cuba. Tel (537) 578268, 544214. Fax (537) 442334. e-mail:ihidir@hemato.sld.cu