Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.20 n.2 Ciudad de la Habana Mayo-ago. 2004
Instituto de Hematología e Inmunología
Tratamiento de la leucemia aguda no linfoide del niño en Cuba
Dra. Andrea F. Menéndez Veitía,1 Dr. Alejandro González Otero, 1 Dra. Patricia Corona Rodríguez, 2 Dra. Berta Vergara Domínguez, 3 Dra. Ileana Nordet Carrera, 1 Dra. Rosa María Lam Díaz, 1 Dr. Aramís Núñez Quintana, 1 Dra. Alina Pardo Núñez, 4 Dr. Sergio Machín García 1 y Dra. Eva Svarch 1
Resumen
Se les aplicó a 62 niños con todas las variedades de leucemia aguda no linfoide (LANL), excepto en la variedad promielocítica, tratamiento de quimioterapia intensiva basado en los lineamientos del grupo BFM. Se obtuvo el 56,4 % de remisión inicial. Durante la inducción fallecieron 26 niños, y las causas más frecuentes fueron los sangramientos y las infecciones. La sobrevida a los 60 meses fue del 37 %, similar a lo comunicado en países desarrollados. No existieron diferencias en la sobrevida entre los diferentes tipos morfológicos ni de acuerdo con la edad en el momento del diagnóstico.
Palabras clave: leucemia aguda no linfoide, supervivencia libre global.
A partir del comienzo de la quimioterapia en 1948 por Farber y colaboradores, el tratamiento y el pronóstico de la leucemia en la infancia ha tenido un desarrollo favorable, pues en la actualidad más del 70 % de los niños con leucemia linfoide aguda (LLA) permanecen en remisión después de los 5 años.1
Entre los factores que han contribuido a mejorar los resultados se destacan: mayor conocimiento de la biología celular y molecular de la enfermedad, uso de una mejor quimioterapia de combinación y mejor tratamiento de sostén . Sin embargo, en la leucemia aguda no linfoblástica (LANL) no promielocítica (M3 ) no se han obtenido resultados similares.2
Hace 2 décadas, la sobrevida (SV) a largo plazo en los niños con LANL era de menos del 10 %. En la actualidad es aproximadamente del 40 %. 2,3 Esta mejoría se debe a la obtención de la remisión completa inicial en un mayor número de pacientes y al desarrollo de una terapia de posremisión más efectiva, así como a un mejoramiento en los cuidados de sostén que han hecho posible que el tratamiento mielosupresor tenga menos complicaciones. 4
Antes de la década de los 90, la terapéutica de inducción se realizaba con 2 drogas, que incluían habitualmente 3 días con una antraciclina y 7 días de citarabina. 5 Desde entonces, el pronóstico de los niños con LANL ha mejorado notablemente con el empleo de tratamientos más intensivos, 6,7 como los aplicados por el grupo cooperativo Berlin-Frankfurt-Müster (BFM). 4 En los protocolos de este grupo es esencial la combinación de un antraciclínico con la citarabina, pero se incorpora el etopósido (VP-16), un inhibidor de la topoisomerasa II que ha demostrado ser efectivo en esta enfermedad. 8,9 Otra modalidad que se aplica en estos protocolos es la administración al grupo de pacientes considerados de riesgo alto, de una segunda inducción con altas dosis de citarabina y mitoxantrone, para mejorar la calidad de la remisión. 10 Se propone el uso posterior de quimioterapia combinada, con el objetivo de prevenir la aparición de clonas resistentes en la consolidación e intensificación. 4 Se utiliza la prevención de la infiltración del sistema nervioso central (SNC) que, aunque es discutible, la recaída del SNC puede ocurrir en el 20 % de los pacientes. 11,12 La etapa de mantenimiento está en controversia; sin embargo, los principales estudios pediátricos que lo incluyen son los que han tenido mejores resultados. También se ha incorporado el trasplante de células progenitoras hematopoyéticas (TCPH), con lo que se han mejorado aún más los resultados del tratamiento de esta enfermedad. 13,14
En este trabajo se exponen los resultados del tratamiento aplicado a niños con LANL no M3 , con la utilización de los protocolos de quimioterapia de combinación del Grupo Latinoamericano de Tratamiento de Hemopatías Malignas (GLATHEM), basados a su vez, en los protocolos del grupo cooperativo BFM. 4
El objetivo general de este trabajo fue mejorar los resultados en Cuba del tratamiento de la LANL en niños; como objetivo específico fue la evaluación de la influencia de algunos factores pronósticos como la edad y la variedad morfológica en el momento del diagnóstico, con respecto a la respuesta al tratamiento.
Métodos
Desde 1991 hasta 2002, se trataron 62 pacientes con LANL en el Instituto de Hematología e Inmunología y los hospitales pediátricos "Juan Manuel Márquez" de la capital y "José L. Miranda" de Villa Clara: 38 (61,2 %) del sexo masculino y 24 (38,7 %) del femenino. Las edades estaban comprendidas entre 2 meses y 15 años, y su distribución fue: 17 niños (27 %) menores de 3 años, 29 (47 %) entre 3 y 10 años y 16 (26 %) mayores de 11 años.
Se utilizó la clasificación morfológica Franco-Americano-Británica (FAB).
Se estatificaron los pacientes en 2 categorías:
Riesgo estándar: M1, M2.
Médula ósea el día 15 ó 21 < 5 % de blastos.
Riesgo alto: Otros subtipos de FAB.
No remisión el día 15 ó 21.
Para su inclusión en el riesgo estándar no se tomó en cuenta la variedad M4 con eosinofilia, porque a pesar de que hubo 3 enfermos con este tipo de leucemia, no se pudo determinar la inversión del cromosoma 16.
El tratamiento aplicado fue el GLATHEM: BFM- LMA 90 / 97.
En la inducción se empleó idarubicina en 22 pacientes y daunaomicina en los restantes. El resto del tratamiento se cumplió como está señalado en el protocolo. 15
En 2 niños se realizó trasplante autólogo de células progenitoras hematopoyéticas autólogo.
La supervivencia libre global (SV) fue determinada por el método de Kaplan Mier. Las diferencias entre las curvas fueron analizadas por la prueba de log-rank.
Resultados
De los 62 pacientes, 18 (29 %) presentaron las variedades morfológicas M1 o M2; la M4 con eosinofilia 3 (4,8 %); y las variedades de la M4 a M7, 41 (66,1 %).
Hicieron remisión inicial 35 pacientes (56,4 %) y 26 (41,9 %) fallecieron durante la inducción. Las causas fueron las siguientes en orden de frecuencia: 10 niños por sangramiento, 8 por sepsis, 3 por progresión de la enfermedad, 3 por fallo multiorgánico, uno por insuficiencia renal aguda y otro por distrés respiratorio. En total fallecieron 38 pacientes (63 %), de ellos 12 que hicieron recaída después de la remisión inicial. Se encuentran vivos 23 (37 %).
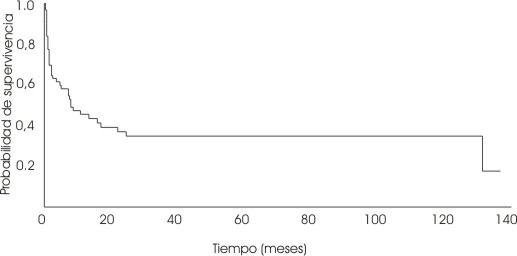
La supervivencia global (SV) en todo el grupo fue a los 60 meses del 37 % ( fig. ). Por grupos de edades, la SV fue: de 0 a 2 años 44,4 % y de 3 a 15 años 28,2 %, con p=0,53 y p=0,32. Agrupadas según el pronóstico, por la variedad morfológica la SV fue del 47 % en el grupo M1 - M2 y del 28 % en el grupo M4 - M7, con una p=0,32.
Los 2 niños a los que se les realizó TCPH autólogo están vivos y se mantienen en remisión completa.
FIG. Supervivencia global en la leucemia aguda no linfoide en niños.
Discusión
Antes de la década de los 70, la casi totalidad de los niños con LANL fallecía a causa de la enfermedad. Sin embargo, la quimioterapia moderna, el TCPH y los cuidados de sostén, han mejorado el pronóstico de esta entidad.
Al inicio de la enfermedad el tratamiento está dirigido fundamentalmente a la estabilización de los parámetros metabólicos, y a prevenir o controlar el sangramiento, la infección y otras complicaciones. En los cuidados de sostén se incluyen la administración de antimicóticos y el uso del factor estimulador de colonias granulocíticas durante los períodos prolongados de neutropenia producida por la quimioterapia. 16
En el presente trabajo se logró una remisión inicial del 56,4 %, ya que 26 pacientes fallecieron durante la inducción. Se describe que las principales causas de muerte en los primeros días son debidas a las coagulopatías y leucoestasis del SNC.17 En nuestros pacientes, las principales causas fueron las hemorragias y la sepsis, en ese orden de frecuencia. El porcentaje de remisión está aún por debajo de los descritos por otros autores, 16 pero es un paso de avance en nuestro medio, ya que los resultados previos eran muy desfavorables, pues sólo alcanzaban la remisión aislados pacientes y mucho menos tenían largas sobrevidas.
La SV a los 60 meses fue del 37 %, que se acerca bastante a lo comunicado por otros autores. 17
Se ha planteado que existen factores que son predictivos de la respuesta al tratamiento en la LANL. 18 Los pacientes jóvenes y adultos de edad mediana menores de 60 años tienen una remisión inicial que puede llegar al 75 % aproximadamente, y una supervivencia a los 5 años del 35-40 %, no así los mayores. En algunos estudios se ha señalado que la edad por debajo de los 2 años, así como los subtipos morfológicos M4 y M5 y la leucocitosis inicial, se relacionan con un mal pronóstico. 19
En este estudio no encontramos diferencias significativas en cuanto a la SV entre menores y mayores de 2 años, ni tampoco en relación con las variedades morfológicas. Creemos que es necesario incluir un mayor número de pacientes y relacionar los factores con el inmunofenotipo, 20 los hallazgos citogenéticos 21 y las alteraciones moleculares. 22-23
Se cumplió el objetivo de mejorar la remisión inicial así como la SV. Este protocolo debe extenderse, con una mejoría de la infraestructura material y de las medidas de sostén, para disminuir el número de muertes en inducción y aumentar la supervivencia. Sería conveniente evaluar también los resultados del TCPH autólogo comparados con los de la quimioterapia o con el empleo de trasplante con regímenes no mieloablativos.
Summary
Sixty-two children, who presented with all acute non-lymphocytic variants except for the promyelocytic type, were treated with Berlin-Frankfurt-Muster (BFM) group protocols-based intensive chemotheraphy. Initial remission amounted to 56,4 %. Twenty six children died during the induction phase and the most frequent causes were bleeding and infections. At the 60th month, the global survival rate was 37 %, a figure similar to that reported in developed countries. There were no significant differences in terms of survival rates either in the various morphological types or in the age groups at the time of diagnosis.
Key words: acute non-lymphocytic leukemia, global free survival.
Referencias bibliográficas
- Kersey, J H. Fifty years of studies of biology and therapy of childhood leukemia. Blood 1997;90:4233-51.
- Hurwitz CA, Mounce KG, Grier HE. Treatment of patients with acute myelogenous leukemia: review of clinical trials of the past decade. J. Pediatr Oncol 1995;17:185-97.
- Creutzing U, Ritter J, Zimmermann M, Schelong G. Improved treatment results In childhood acute myelogenous leukemia: a report of the German cooperative study AML-BFM-78. Blodd 1985; 65:298-304.
- Vogler WR, Velez-Garcia E, Weiner RS. A phase III trial comparing idarubicin and daunorrubicin in combination with cytarabine in acute myelogenous leukemia: a Southeastern Cancer Study Group study. J Clin Oncol 1992;10:1103-11.
- Bishop, JF Matthews, PM, Young GA. A randomized investigation of high-dose of cytosine arabinoside versus standard-dose cytosine arabinoside with daunorrubicin in patients with previously untreated acute myeloid leukemia: a Southwest Oncology Group study. Blood 1996;88:2841-51.
- Bishop JF, Lowenthal PM, Joshua D. Etoposide in acute non-lymphoblastic leukemia. Blood 1990;75:27-3.
- Bloomfield CD. Postremission therapy in acute myeloid leukemia. J Clin Oncol 1985;3:1570-2.
- Kalwinsky D, Mirro J, Schell M. Early intensification of chemotherapiy for childhood acute nonlymphoblastic leukemia: improved remission induction with a five-drug regimen including etoposide. J Clin Oncol 1998; 6:1134-43.
- Arlin Z, Case D, Moore J. Randomized multi-center trial of cytosine arabinoside with mitoxantrone or daunomycin in previously untreated adults with acute nonlymphoblastic leukemia (ANLL). Leukemia 1990;4:177-83.
- Winsetein HJ, Mayer RJ. Chemotherapy for acute myelogenous leukemia in children and in adults: VAPA update. Blood 1983;62:315-9.
- Pui C-H, Dahl GV, Kalwinsky DK. Central nervous system leukemia in children with acute nonlymphoblastic leukemia. Blood 1985;66:1062-3.
- Bunin NJ, Pui C-H. Differing complications of hyperleukocytosis in children with acute lymphoblastic or acute non lymphoblastic leukemia. J Clin Oncol 1997;17:198-210.
- Amadori S, Testi AM, Arico M. Prospective comparative study of bone marrow transplantation and postremission chemotherapy for childhood acute myelogenous leukemia. J Clin Oncol 1993;11:1046-54.
- Woods W, Neudorf S, Gold S. Aggressive post-remission chemotherapy is better than autologous bone marrow (BMT) and allogenic BMT is superior both in children wiht acute myeloid leukemia (AML). P Am Soc Clin Oncol 1996;15:A1091.
- GATLA-GLATHEM. Protocolo LMA-90/4-LMA-97.
- Terpstra W, Löwenberg B. Review. application of myeloid growth factors in the treatment of acute myeloid leukemia. Leukemia 1997;11:315-85.
- Creutzing U, Ritter J, Budde M. Early deaths due to hemorrhage and leukostasis in childhood acute myelogenous leukemia. Cancer 1987;60:3071-9.
- Berman E, Heller G, Santorsa J. Results of trial comparing idarrubicin and cytosine arabinoside and cytosine arabinoside in adult patients with newly diagnosed acute myelogenous leukemia. Blood 1991;1:1666-74.
- Löwenberg B. Treatment of acute myelogenous leukemia. J Inter Med 1997;242 (Supp 240):17-22.
- Prognostic factors in acute myeloid leukaemia. Best practice and research clinical haematology 2001;41:65-75.
- Grier HE, Gelber RD, Camitta BM. Prognostic factors in childhood acute myelogenous leukemia. J Clin Oncol 1987;5: 1026-32.
- Sanz M, Sempere A. Immunophenotyping of AML and MDS and detection of residual disease. Balliére' s Clin Haematol 1996;9:35-55.
- Mrzozek K, Heinonen K, de la Chapelle A, Bloomfield CD. Clinical significance of cytogenetics in acute myeloid leukemia. Sem Oncol 1997;24:17-31.
- Crans HN, Sakamoto KM. Transcription factors and translocations in lymphoid and myeloid leukemia. Leukemia 2001;15:313-31.
- Estey EH. Prognosis factors in acute myelogenous leukemia. Leukemia 2001;670-72.
Recibido: 6 de junio del 2004. Aprobado: 2 de julio del 2004.
Dra. Andrea F. Menéndez Veitía. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Tel (537) 578268, 544214. Fax (537) 442334. e-mail: ihidir@hemato.sld.cu
1 Instituto de Hematología e Inmunología.
2 Hospital Pediátrico "Juan Manuel Márquez", Ciudad de La Habana.
3 Hospital Pediátrico "José L. Miranda", Villa Clara.
4 Hospital Pediátrico Guantánamo.