Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.20 n.2 Ciudad de la Habana Mayo-ago. 2004
Presentación de casos
Instituto de Hematología e Inmunología
Posible quimera M3: M5 en un paciente con leucemia aguda promielocítica: diferente respuesta clonal al tratamiento con ANTRA y quimioterapia
Lic. Niubys Cayado Gutiérrez, Dr. Carlos Hernández Padrón, Dr. Luis Gabriel Ramón Rodríguez, Dr. Porfirio Hernández Ramírez y Dra. Gisela Martínez Antuña
Resumen
Se presenta un caso con leucemia aguda promielocítica (LAP) en el que se demostró la presencia del gen híbrido PML/RARa y la duplicación interna en tandem del gen FLT3 (DIT/FLT3) al momento del diagnóstico. Después de recibir tratamiento de inducción con ácido transretinoico (ATRA) y quimioterapia, el estudio citomorfológico de la médula ósea mostró una transformación a leucemia monocítica aguda (LMA-M5). En el estudio molecular desapareció el transcripto PML/RARa, pero se mantuvo la DIT/FLT3. Estos resultados sugieren la coexistencia de 2 clones leucémicos independientes, un clon promielocítico (M3) con el gen quimérico PML/RARa y otro monocítico (M5) con DIT/FLT3. Aunque la evolución hematológica y molecular apoya esta sugerencia, no se puede excluir la presencia de la DIT/FLT3 en el clon M3, pues no es un marcador específico de la LMA-M5.
Palabras clave: leucemia aguda promielocítica, PML/RARa, DIT/FLT3, ATRA.
La leucemia aguda promielocítica (LAP) es el subtipo M3 en la clasificación de las leucemias mieloides agudas (LMA) del grupo Franco-Americano-Británico (FAB). Presenta diferentes variantes morfológicas, entre ellas la hipogranular fue la primera reconocida y clasificada como LMA-M3v por el grupo FAB. 1
La LAP se caracteriza por la presencia de la translocación t(15;17)(q22;q21) que en la actualidad se considera el marcador específico de esta enfermedad. Como resultado de dicha translocación, se origina el gen híbrido PML/RARa y su forma recíproca RARa/PML. 2,3
El gen FLT3 codifica un receptor de la familia tirosina quinasa involucrado en la proliferación y diferenciación de las células pluripotentes hematopoyéticas. Recientemente se ha detectado en la leucemia mieloide aguda (LMA) una alteración somática en este gen, que consiste en una duplicación interna en tandem (DIT) que da lugar a su activación constitutiva. Esta mutación se encuentra aproximadamente en el 20 % del total de casos con LMA y representa hasta el momento la alteración genética mas frecuente en esta enfermedad. La DIT/FLT3 es más frecuente en algunos subtipos de LMA, como es el caso de la LAP, donde puede encontrarse entre el 30-40 % de los pacientes, y en particular dentro de la LMA-M3v, se observa en el 61,5 % de los casos. Se ha encontrado que la presencia de la DIT/FLT3 está asociada con una mala evolución clínica, tanto en pacientes adultos como pediátricos con LMA. 4-6
En el presente trabajo comunicamos un caso de LAP con la presencia del gen híbrido PML/RARa y la DIT/FLT3 al momento del diagnóstico. Al estudiarlo 45 días después de recibir terapia de inducción con ácido transretinoico (ATRA) y quimioterapia, el estudio morfológico de la médula ósea mostró una transformación a leucemia monocítica aguda (LMA-M5). En el estudio molecular desapareció el transcripto PML/RARa, pero se mantuvo el mismo patrón para la DIT/FLT3.
Reporte del caso
Paciente masculino, blanco, de 55 años de edad que al momento del ingreso refería fiebre persistente, astenia, artralgias, palpitaciones y mostraba toma del estado general. En el examen físico se encontró palidez cutáneo-mucosa, hepatomegalia de 2 cm y adenopatías inguinales pequeñas no dolorosas. El hemograma evidenció niveles de hemoglobina de 105 g/L, conteo de leucocitos de 19,5 x 109 /L con presencia de mieloblastos, células monocitoides, muchas con núcleos bilobulados y promielocitos, conteo de plaquetas de 18 x 109 /L. Los estudios de coagulación fueron normales.
En el estudio morfológico de la médula ósea se encontró un marcado incremento de la celularidad con una infiltración de mieloblastos (16 %), células monocitoides (22 %) y promielocitos (62 %), algunos de estos mostraron un notable aumento de las granulaciones citoplasmáticas. No se observaron bastones de Auer. Con este cuadro morfológico se planteó el diagnóstico de una LAP con aumento de células monocitoides, lo que sugería una variante hipogranular.
El estudio histológico de la médula ósea mostró una celularidad del 95 % con infiltración de moderada a severa por células inmaduras de aspecto promielocítico.
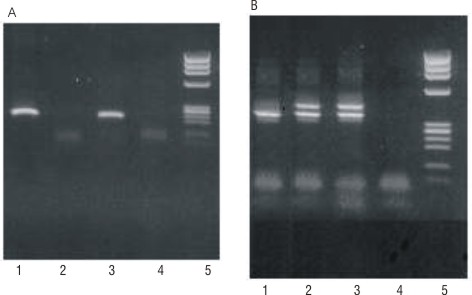
Los estudios citogenéticos no resultaron útiles, pero los moleculares, realizados por las técnicas establecidas en nuestro laboratorio, 7-9 indicaron la presencia del gen híbrido PML/RARa con punto de ruptura bcr1 y de la DIT/FLT3 (fig.).
Figura. Resultados del estudio molecular
| A) PML/RARa (bcr1) | B) DIT/FLT3 |
| 1- Paciente al inicio | 1- Control normal FLT3 |
| 2- Paciente 45 días después | 2- Paciente al inicio |
| 3- Control positivo | 3- Paciente 45 días después |
| 4- Control negativo | 4- Control negativo |
| 5- Marcador de peso | 5- Marcador de peso |
molecular phi X 174/Hae III molecular phi X 174/Hae III
El análisis de todos estos complementarios permitió plantear el diagnóstico de una LAP variante hipogranular y se inició la terapia de inducción con ATRA 45 mg/m2/día y rubidomicina 45 mg/m2/día (4 dosis). Además, como tratamiento preventivo del síndrome del ácido retinoico se usó: prednisona 60 mg/m2/día y furosemida 40 mg/m2/día. Se usaron varias combinaciones de antibióticos por infecciones respiratorias y linfangitis agudas que presentó el paciente en su evolución.
En el día 45 de tratamiento con ATRA no se había alcanzado la remisión hematológica, por lo que se hizo estudio morfológico, citoquímico y molecular de la médula ósea.
En el estudio morfológico se encontró depresión de los 3 sistemas hematopoyéticos por una infiltración del 90 % de células blásticas, de las cuales, más del 80 % eran monoblastos. Las coloraciones citoquímicas mostraron los siguientes resultados: PAS negativo; negro Sudan: positivo solo en algunos blastos; peroxidasa negativa; esterasa positiva con más del 95 % de inhibición con fluoruro. Estos resultados fueron compatibles con el subtipo de LMA-M5a.
En los estudios moleculares no se detectó el reordenamiento PML/RARa, pero se observó el mismo patrón inicial para la DIT/FLT3 (fig.). La secuencia nucleotídica de los fragmentos amplificados de la DIT/FLT3 en la muestra inicial y de la muestra analizada 45 días después, demostró que ambas mutaciones eran idénticas.
A los 49 días de iniciado el tratamiento, se decidió suspender el ATRA y se comenzó con arabinósido de citosina a bajas dosis (20 mg/día) por el estado crítico del paciente, que se encontraba séptico y con fallo multiorgánico. Pocos días después falleció.
Discusión
La expresión simultánea de 2 aberraciones cromosómicas específicas en un mismo clon leucémico es poco frecuente. El primer caso reportado fue en la leucemia mieloide crónica (LMC) con asociación de la t(15;17) y la t(9;22). Otras alteraciones cromosómicas específicas asociadas han sido descritas en diferentes enfermedades.10-12
Hasta donde conocemos, no se ha publicado un caso con el diagnóstico molecular de LPA y DIT/FLT3 que haya realizado una transformación morfológica a LMA-M5, con desaparición del PML/RARa y que muestre la misma mutación DIT/FLT3 inicial. 6,13 Nuestros resultados sugieren la coexistencia de 2 clones leucémicos independientes, un clon promielocítico (M3) con el gen quimérico PML/RARa y otro monocítico (M5) con DIT/FLT3. Sin embargo, no podemos excluir la presencia de la DIT/FLT3 en el clon M3, pues no es un marcador específico de la LMA-M5. En este caso, si la misma DIT/FLT3 estuviera presente en ambos clones, nos sugeriría que esta mutación ocurrió en un precursor común a ambos clones leucémicos.
Atendiendo a la evolución hematológica y molecular del paciente, podemos sugerir que el tratamiento de inducción eliminó el clon M3, pues la presencia del gen PML/RARa está asociada con una buena respuesta al ATRA, pero que este no impidió la progresión del clon M5 inicial.
El desarrollo alcanzado en los últimos años en la biología molecular ha permitido detectar alteraciones moleculares asociadas con subtipos específicos de leucemia, con importancia pronóstica o con ambas características. La descripción de nuevos casos con más de un reordenamiento genético destaca la importancia de los estudios moleculares para mejorar la calidad de las evaluaciones y las decisiones terapeúticas. Además, ayuda a profundizar en el conocimiento de los mecanismos comprometidos en la etiopatogenia de esta enfermedad.
Agradecemos a la Lic. Lilia Corral de la Clinica Pediátrica, Ospedale San Gerardo, Monza, Italia, la realización de la secuencia nucleotídica de los fragmentos amplificados de la DIT/FLT3.
Summary
A case of acute promyelocytic leukemia in which the presence of hybrid PML/RAR a gene and the internal tandem duplication of FLT3 (DIT/FLT3)were demonstrated at the time of diagnosis was reported in this paper. After the induction treatment with transretinoic acid and chemotherapy, the cytomorphological study of the bone marrow revealed some change into acute monocytic leukemia (AML-M5). The molecular study revealed that PML/RARa had disappeared but ITD/FLT3 remained. These results suggest that two independent leukemia clones co-exist, that is, one promyeolytic (M3) with chimeric gene PML/RARa and the other monocytic (M5) with ITD/FLT3). Although the hematological and molecular evolution supports such a suggestion, the presence of ITD/FLT3 in clone M3 can not be ignored because it is not a specific marker for AML-M5.
Key words: promyelocytic acute leukemia, PML/RARa, ITD/FLT, ATRA
Referencias bibliográficas
- Bennett JM, Catovsky D, Daniel MT, Flandrin G, Galton DAG, et al. Proposals for the classification of the acute leukemias. Br J Haematol 1976;33:451-58.
- de The H, Chomienne C, Lanotte M, Degos L, Dejean A. The t(15;17) translocation of acute promyelocytic leukemia fuses the retinoic acid receptor a gene to a novel transcribed locus. Nature 1990;347:558-61.
- Mistry AR, Pedersen EW, Solomon E, Grimwade D. The molecular pathogenesis of acute promyelocytic leukaemia: implications for the clinical management of the disease. Blood Rev 2003;17:71-97.
- Kiyoi H, Naoe T, Yokota S, Nakao M, Minami S, et al. Internal tandem duplication of FLT3 associated with leukocytosis in acute promyelocytic leukemia. Leukemia 1997;11:1447-52.
- Gilliland DG, Griffin JD. The roles of FLT3 in hematopoiesis and leukemia. Blood 2002;100:1532-42.
- Stirewalt DL, Radich JP. The role of FLT3 in haematopoietic malignancies. Nature Rev 2003;3:650-65.
- Maniatis T, Fritsch EF, Sambrook J. Molecular cloning: A laboratory manual. Cold Spring Harbor Laboratory; 1982.
- Van Dongen JJM, Macintyre EA, Gabert JA, Delabesse E, Rossi V, et al. Standardized RT-PCR analysis of fusion gene transcripts from chromosome aberrations in acute leukemia for detection of minimal residual disease. Leukemia 1999;13:1901-28.
- Nakao M, Yokota S, Iwai T, Kaneko H, Horiike S, et al. Internal tandem duplication of the FLT3 gene found in acute myeloid leukemia. Leukemia 1996;10:1911-18.
- Daniel MT, Bernhein A, Garand R, Bray B, Leverger G, et al. Rechute sous forme monoblastique (M5a) d´une leucémie aigüe myéloblastique (M2) avec t(8;21). Nouv Rev Fr Hématol 1986;28:115-17.
- Lai JL, Fenaux P, Zandecki M, Savary JB, Estienne MH, et al. Promyelocytic blast crisis of Philadelphia positive thrombocytemia with translocations (9;22) and (15;17). Cancer Genet Cytogenet 1987;29:311-14.
- Bonomi R, Giordano H, Moreno MP, Bodega E, Landoni MI, et al. Simultaneous PML/RARa and AML1/ETO expression with only t(15;17) detection in onset, and relapse with the sole cytogenetic and molecular evidence of t(8;21) in an acute promyelocytic leukemia patient. Cancer Genet Cytogenet 2000;123:41-3.
- Lowenberg B, Griffin JD, Tallman MS. Acute myeloid leukemia and acute promyelocytic leukemia. Hematology (Am Soc Hematol Educ Program) 2003;82-101.
Recibido: 6 de junio del 2004. Aprobado: 2 de julio del 2004.
Lic. Niubys Cayado Gutiérrez. Instituto de Hematología e Inmunología. Apartado 8070,CP 10800 Ciudad de La Habana, Cuba. Tel (537) 578268, 544214. Fax (537) 442334. e-mail: ihidir@hemato.sld.cu