Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.20 n.3 Ciudad de la Habana sep.-dic. 2004
Artículos de revisión
Instituto de Hematología e Inmunología
Medicina regenerativa. Células madre embrionarias y adultas
Prof. Porfirio Hernández Ramírez y Dra. Elvira Dorticós Balea
Resumen
En los últimos años ha surgido una nueva rama de la medicina denominada medicina regenerativa, basada fundamentalmente en los nuevos conocimientos sobre las células madre y en su capacidad de convertirse en células de diferentes tejidos. Las células madre se clasifican en embrionarias y somáticas o adultas. Durante varios años se consideró que la célula madre hematopoyética era la única célula en la médula ósea con capacidad generativa. Sin embargo, estudios recientes han mostrado que la composición de la médula ósea es más compleja, pues en ella se ha identificado un grupo heterogéneo de células madre adultas, entre las que se encuentran las: hematopoyéticas, mesenquimales (estromales), población lateral, células progenitoras adultas multipotentes (MAPC). Varios estudios han sugerido que la potencialidad de algunos tipos de células madre adultas es mayor de lo esperado, pues han mostrado en determinadas condiciones capacidad para diferenciarse en células de diferentes linajes, lo que las acercan a la potencialidad de las células embrionarias. Esto ha creado nuevas perspectivas para el tratamiento de diferentes enfermedades con células madre adultas, lo que inicialmente se pensaba solo podía hacerse con las embrionarias.
Palabras clave: medicina regenerativa, células madre, plasticidad celular, transdiferenciación.
En los últimos años se ha producido un extraordinario avance en los conocimientos relacionados con diferentes ramas biomédicas, entre ellas la biología celular. Esto ha dado un notable impulso a una nueva rama de la medicina denominada medicina regenerativa. Esta disciplina médica se ha basado fundamentalmente en los nuevos conocimientos sobre las células madre y en su capacidad de convertirse en células de diferentes tejidos. 1
Un aspecto que se debe destacar y que conforma el elemento básico de este tipo de medicina, es que se apoya en los mismos factores intra e intercelulares que el organismo emplea para su auto-reparación. Se sustenta en la terapia celular, en la administración de elementos subcelulares y en la ingeniería de tejidos, conductas utilizadas para remplazar por células sanas a las células dañadas por diversos procesos en determinados tejidos.
A continuación se exponen conceptos básicos que consideramos necesarios para una mejor comprensión del desarrollo médico en este nuevo campo científico.
Células madre
Los términos aplicados en español para identificar a estas células han sido variados. Inicialmente se utilizó el mismo término que en inglés: stem cells, pero posteriormente se han introducido diversos nombres que han dependido más bien del criterio del traductor. Así encontramos los de células troncales, células tronco, células precursoras, células progenitoras y células estaminales. De estos preferimos el término de células madre. Por otra parte, le célula progenitora o precursora puede considerarse una célula que ya ha alcanzado una diferenciación parcial y ha perdido la capacidad pluripotencial de la célula madre. Además, en su progresión evolutiva, puede comprometerse con un determinado linaje celular y dar lugar a células especializadas específicas.
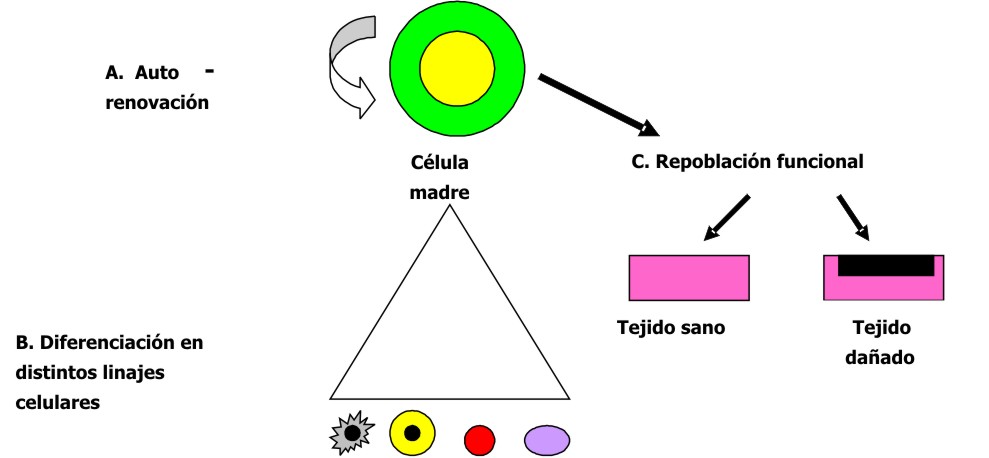
Desde el punto de vista de su capacidad reproductiva y funcional, las células madre se han definido como aquellas que pueden dividirse simultáneamente para mantener por un lado su auto-renovación, con producción de más células madre semejantes a ella, y por otro lado, generar células hijas comprometidas con diferentes linajes celulares que se diferencian en diversos tipos de células especializadas, no solo morfológicamente, sino también funcionalmente. Además, se le han añadido 2 propiedades funcionales: las capacidades de implantación persistente tanto en tejidos dañados como en sanos. 2-4 (fig. 1).
Fig. 1. Propiedades de las células madre.
De acuerdo con su estado evolutivo, las células madre se clasifican en embrionarias y somáticas o adultas.
Célula madre embrionaria
Deriva del embrión de los mamíferos en su etapa de blastocisto y posee la capacidad de generar cualquier célula diferenciada en el organismo.
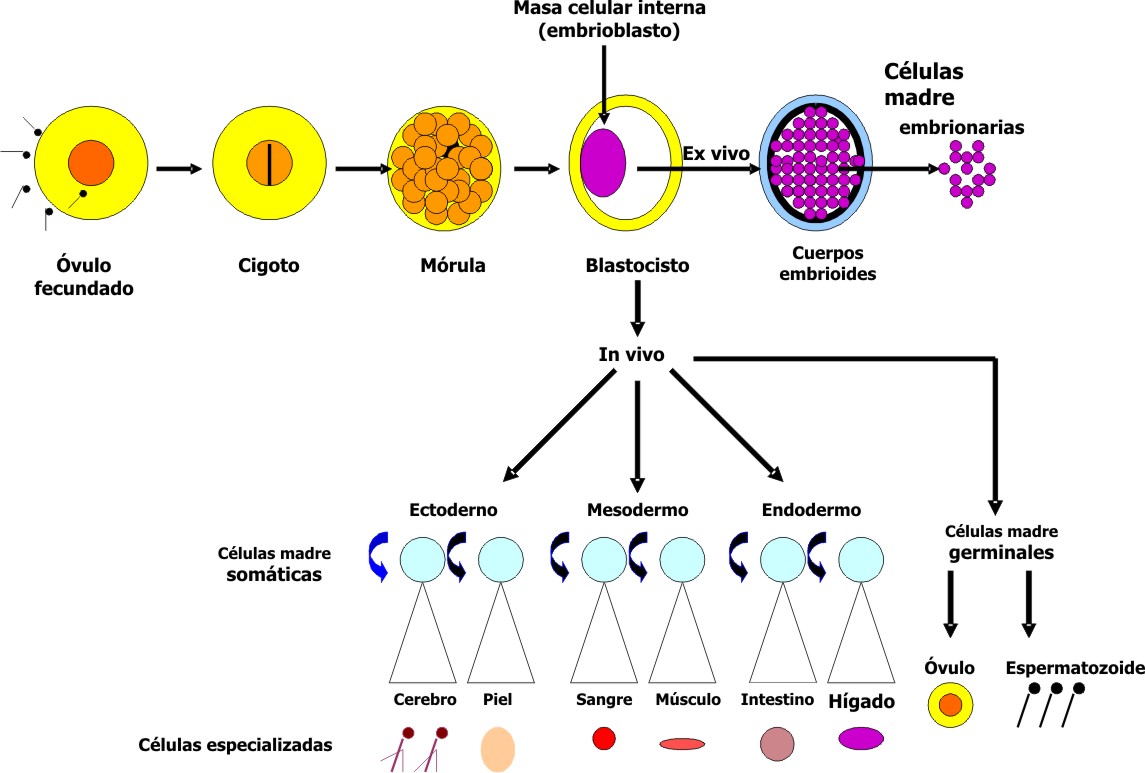
Después de la penetración del espermatozoide, el óvulo fecundado adquiere la condición de cigoto, en el que durante su recorrido por la trompa de Falopio, se van produciendo sucesivamente distintos períodos de división celular que aumentan rápidamente el número de sus células, las cuales reciben el nombre de blastómeros. Aproximadamente a los 3 días, el embrión tiene el aspecto de una esfera compacta que se denomina mórula y que contiene de 12 a 16 blastómeros. Alrededor de los 4 días llega a la cavidad uterina, y sobre los 5 días, comienza a introducirse líquido en su interior para formar una cavidad: el blastocele. En esta etapa, el cigoto se llama blastocisto y posee en uno de sus polos una agrupación celular que recibe el nombre de masa celular interna o embrioblasto que forma una prominencia dentro del blastocele. Las células que la integran dan origen a todos los tipos celulares, sistemas, tejidos y órganos del individuo en formación. Además, tiene una capa celular aplanada que recubre la cavidad del blastocisto y la parte exógena del embrioblasto, la cual se denomina masa celular externa o trofoblasto, de donde deriva la placenta.
Hacia el final de la primera semana del desarrollo, el blastocisto humano ha comenzado su anidación en la mucosa uterina mediante la introducción en esta de las células trofoblásticas que recubren el polo del embrioblasto. 1,5-7
Un aspecto que debe quedar bien esclarecido es que las células de la masa interna no mantienen indefinidamente in vivo su capacidad de generación de cualquier tipo celular, pues estas se van diferenciando progresivamente en los diversos tipos celulares durante la fase intrauterina del desarrollo. Sin embargo, cuando se extraen de su ambiente embrionario natural y se cultivan in vitro, sí son capaces de proliferar ilimitadamente y a su vez mantener su potencial de generar células capaces de diferenciarse en cualquiera de los tejidos del organismo. 1, 8 En este estado es que se califican como células madre embrionarias (fig. 2).
Fig. 2. Esquema simplificado de la generación de células madre embrionarias y somáticas.
Las células germinales no inician la diferenciación sexual hasta la mitad de la gestación; se conoce que hasta ese momento mantienen capacidad de diferenciación hacia diferentes líneas celulares. 1 Las células madre germinales se han aislado a partir de esas células germinales primordiales embrionarias y fetales, y tal como ocurre con las células madre embrionarias, estas poseen una gran capacidad proliferativa que se hace evidente cuando se someten a cultivo. Se ha señalado que en estas condiciones las células madre germinales se mantienen viables solo durante 70 a 80 pases, pero tienen la ventaja que no forman teratomas cuando se inyectan en ratones, por lo que pudieran representar una fuente más segura de material trasplantable. 2
A pesar de que las células madre embrionarias de ratón se venían estudiando desde el inicio de los años 80 del siglo pasado, no fue hasta 1998 que se obtuvieron las primeras células madre embrionarias de procedencia humana, lo que abrió un nuevo campo de investigación y posibilidades de aplicación práctica.
Históricamente, el término de célula madre embrionaria se introdujo en 1981 para distinguir las células embrionarias procedentes de las masa celular interna, de aquellas derivadas de teratocarcinomas y que también poseen la capacidad de diferenciarse en distintos tipos celulares. 9
Para que las células madre embrionarias puedan crecer indefinidamente y mantener su estado indiferenciado, se utiliza en los cultivos una capa alimentadora formada por fibroblastos embrionarios de ratón y un suplemento de factor inhibidor de leucemia (LIF, del inglés leukemia inhibitory factor) para aprovechar su actividad bloqueadora de la diferenciación. Cuando las células embrionarias se extraen de estas condiciones comienzan a diferenciarse espontáneamente. 4 El mecanismo por el cual los fibroblastos embrionarios de ratón facilitan el crecimiento indiferenciado de las células embrionarias humanas, no está bien esclarecido, pero posiblemente sea multifactorial. Recientemente se ha planteado la necesidad de buscar sustitutos para esta capa nutricia xenogénica. 1
La diferenciación espontanea que ocurre en los cultivos de células embrionarias puede acelerarse en determinadas condiciones. En el ratón, el método más empleado es la formación de cuerpos embrioides 8 y su forma más simple es hacer el cultivo celular en suspensión en ausencia de la capa alimentadora o del LIF. Así, se genera un agregado celular llamado cuerpo embrioide, en el que se forman 2 capas: una externa que tiene las propiedades del endodermo extraembrionario, y otra interior que representa el tejido embrionario con capacidad generativa de las diferentes líneas celulares. El cultivo de estos cuerpos embrioides bajo diferentes condiciones ambientales puede dar origen a diversos tipos de células diferenciadas. Los cuerpos embrioides también se han podido obtener a partir de células madre embrionarias humanas. 1, 10
Sin lugar a dudas, las células madre embrionarias han resultado un gran aporte científico que ha despertado un gran interés no solo en el campo de la biología del desarrollo, sino también en el de la medicina regenerativa en particular, por las expectativas que se han creado para su aplicación terapéutica en múltiples enfermedades humanas. 1 Sin embargo, esto último es un proceder muy complejo, pues existen varios aspectos que aún no son bien conocidos, entre ellos uno fundamental: no conocemos bien cómo hacer que la célula embrionaria humana se diferencie en una célula específica y cuáles son los factores y señales que lo harían posible. Por otra parte, se conoce que el trasplante de células madre embrionarias puede formar teratomas o teratocarcinomas. Además, puesto que estas células proceden de un embrión humano vivo, desde el primer momento su manipulación y destino se ha enfrentado en diferentes países a una fuerte oposición, basada principalmente en aspectos éticos, religiosos y políticos.
Célula madre somática o adulta
Clásicamente se ha definido como una célula especializada dentro de la organización de las células de un tejido específico de un organismo ya formado, que está restringida en su capacidad de diferenciación y es capaz únicamente de generar células del tejido que representa, a las que debe recambiar de forma natural. 3, 4 Se ha señalado que en su evolución el organismo sitúa en los tejidos células madre somáticas como parte de los mecanismos que emplea para su renovación en condiciones fisiológicas o ante un daño hístico.
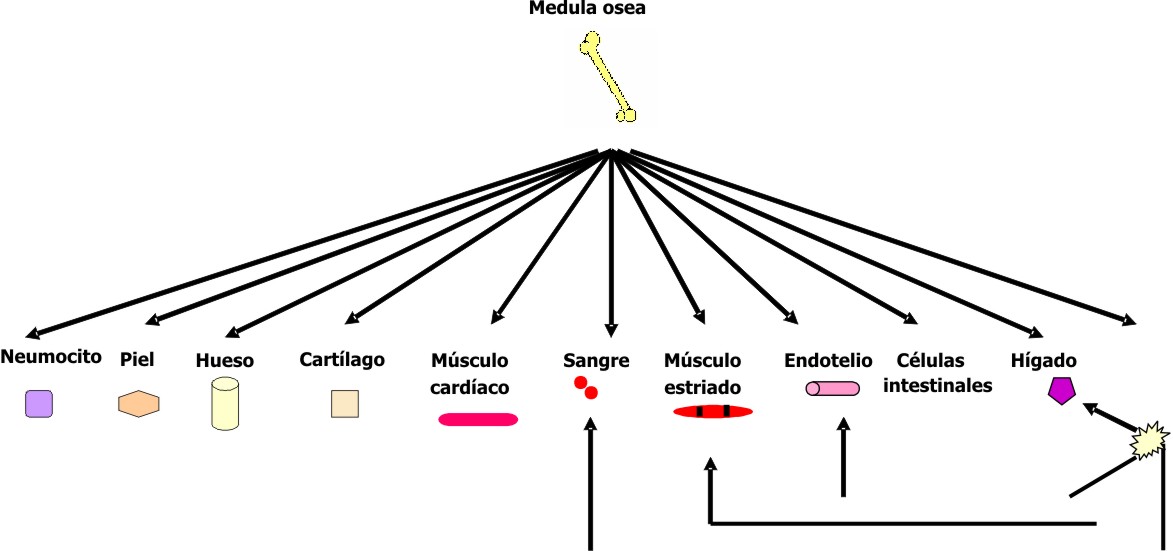
Sin embargo, en los últimos años, se han realizado varios estudios que han aportado resultados sorprendentes, pues sugieren que la potencialidad de algunos tipos de células madre adultas es mayor de lo esperado, ya que han mostrado en determinadas condiciones capacidad para diferenciarse en células de diferentes linajes. 1-4, 11-15 El caso más destacado es el de las células madre hematopoyéticas capaces de diferenciarse en diversos tejidos, entre ellos endotelio, músculo cardíaco, músculo estriado, hepatocitos, neuronas, piel e intestino. 4,12,13,16-19 Aunque se ha planteado que los criterios establecidos para definir a una célula madre adulta son difíciles de comprobar experimentalmente, 2 se ha señalado que la mayor parte de los criterios que cumplen las células madre embrionarias los satisfacen también la célula madre hematopoyética, pues esta puede tener divisiones auto-renovadoras, puede dar lugar a todas las células sanguíneas, reconstruir la médula ósea cuando se trasplanta en receptores irradiados letalmente o aplasiados mediante quimioterapia, y además se ha observado su implantación en tejidos sanos. 1,3,4,20-23 Más recientemente, estos criterios se han aplicado también para identificar otras células madre adultas, como es el caso de la célula madre del tejido nervioso. 1
Diversas informaciones han señalado la existencia de células madre adultas en varios sitios del organismo que incluyen médula ósea, sangre periférica, sangre del cordón umbilical, cerebro, médula espinal, grasa, pulpa dentaria, vasos sanguíneos, músculo esquelético, piel, tejido conjuntivo, córnea, retina, hígado, conductos pancreáticos, folículo piloso, tejido gastrointestinal y pulmón. 1,23-27
Todos estos hallazgos han ampliado los conocimientos sobre las células madre adultas, y particularmente los relacionados con el mayor potencial generativo de algunos de sus tipos que lo acercan al de las células embrionarias. Esto ha creado nuevas perspectivas para el tratamiento de diferentes enfermedades con células madre adultas, lo que inicialmente se pensaba solo podía hacerse con células madre embrionarias.
Potencialidad celular
La potencialidad representa la capacidad y posibilidades de diferenciación, de las células, y se manifiesta en el ámbito natural de acuerdo con el orden jerárquico de su desarrollo. De acuerdo con su potencial de diferenciación las células madres se han clasificado en: totipotentes, pluripotentes y multipotentes. 24,28,29
Las células madre totipotentes son aquellas que en las condiciones apropiadas son capaces de formar un individuo completo, pues pueden producir tejido embrionario y extra-embrionario. Así en el ciclo evolutivo posfecundación, el cigoto u óvulo fertilizado se considera una célula totipotente, capaz de dar origen a todo el organismo. Igual sucede con la etapa siguiente de mórula, en que todas las células son totipotentes. En el ratón se plantea que la totipotencia solo persiste hasta el estadio evolutivo de 8 células. 1
Las células madre pluripotentes son las que tienen la habilidad de diferenciarse a tejidos procedentes de cualquiera de las 3 capas embrionarias. Aunque estas células por sí solas no pueden producir un individuo, ya que necesitan el trofoblasto, sí originan todos los tipos de células y tejidos del organismo. En esta categoría estarían las células provenientes de la masa celular interna del blastocisto.
En la categoría siguiente estarían las células madre multipotentes, que pueden diferenciarse en distintos tipos celulares procedentes de las misma capa embrionaria, lo que las capacitaría para la formación de tipos celulares diferentes, pero no de todos. Tradicionalmente, las células madre adultas se habían ubicado en esta etapa de la evolución celular. Sin embargo, en los últimos años, se ha hecho evidente que la potencialidad de algunos tipos de células madre adultas es mayor que la que habitualmente se les confería, pues se evidenció que podían diferenciarse en tejidos derivados de cualquiera de las capas embrionarias, señalándose como el caso más típico el de las células madre hematopoyéticas. 12-15,28-30 Este fenómeno ha sido calificado como versatilidad de las células madre adultas, tomando en cuenta la flexibilidad que tienen algunas de ellas para formar células especializadas de otros linajes. Para esto se ha planteado que cuando su entorno natural es sustituido por otro, cambian su programa de diferenciación de acuerdo con las nuevas señales de diferenciación que reciben, por lo que se les ha asignado capacidad pluripotencial, y en este sentido, se asemejarían a las células madre embrionarias. 2,11,12 Estos hechos contradicen el dogma clásico en biología celular de la capacidad diferenciativa limitada de las células madre adultas. El cambio del programa de diferenciación podría estar relacionado con variaciones en las señales internas y externas que recibirían las células en las interacciones que tendrían con todos los elementos constitutivos del nuevo microambiente, hábitat o "nicho" en que se situarían en el organismo. 31,32 Entre esos elementos podrían considerarse, entre otros factores: proteínas promotoras e inhibidoras del ciclo celular, factores secretados por las células vecinas, interacciones intercelulares y con la matriz extracelular del tejido mediante proteínas de membrana. Recientemente se ha propuesto una interesante explicación para estos cambios, basada en las modificaciones que podrían suceder en diferentes fases del ciclo celular, en la modulación de la cromatina y en la variación de los receptores de la membrana celular. 33
En el orden jerárquico inferior se situarían las células unipotentes, que son aquellas que solo se pueden diferenciar en un tipo celular, y que han sido calificadas en algunos trabajos como células en tránsito, 15 células progenitoras comprometidas, 1 o células precursoras. 2
Finalmente, se encuentran las células diferenciadas, que son las que han alcanzado su plena maduración y una actividad funcional específica.
Ventajas y desventajas de las células madre embrionarias y adultas
Los estudios que han puesto en evidencia las propiedades pluripotenciales de algunos tipos de células madre adultas han creado grandes perspectivas terapéuticas, por lo que se ha planteado que aunque no están bien definidas las características de estas células y su mecanismo de acción, es posible que se amplíe su uso clínico mediante su aplicación autóloga en la regeneración de tejidos. Por otra parte, se han tratado de contraponer sus indicaciones con las de las células madre embrionarias, pero todavía es muy temprano para definir la superioridad de unas sobre las otras, por lo que las futuras investigaciones en este campo contribuirán seguramente a esclarecer aspectos hoy no bien delimitados. Por el momento, con ambos tipos de células madre se han señalado ventajas y desventajas, que quizá podrían modificarse en el futuro. 4
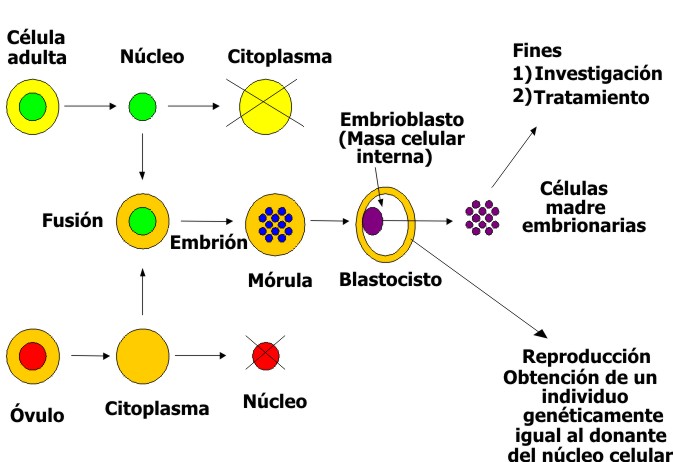
Entre las ventajas de las células madre embrionarias humanas está que ellas virtualmente pueden formar cualquier tipo de tejido y mantenerse indefinidamente en cultivo. En su contra tendrían los problemas éticos que provienen de la necesidad de extraerla de su medio natural que es un embrión en desarrollo, lo que equivaldría a la interrupción de la vida de un nuevo ser ya en proceso de formación. Además, su procedencia alogénica es en la actualidad una gran limitante, establecida por la conocidas diferencias en el sistema de histocompatilidad HLA. Esto pudiera resolverse a mediano o largo plazo mediante el desarrollo de óptimos métodos de inmunotolerancia o en un período más cercano, con el empleo de células embrionarias provenientes del propio paciente, lo que equivaldría a un autotrasplante sin problemas de rechazo u otras reacciones inmunes que se presentan con el trasplante de células alogénicas. En esto intervendría el desarrollo del método de la transferencia de un núcleo de célula somática del propio paciente a un óvulo desnucleado, con lo que se crea un embrión, derivado de una célula somática y que algunos han llamado "embrión artificial", el cual se lleva hasta la fase de blastocisto para la obtención de las células embrionarias que se utilizarían en el enfermo y que tendrían las características de células autólogas. Este proceder es lo que se ha llamado clonación terapéutica, que ya ha sido aceptada por gran parte de la comunidad científica, mientras que se mantiene la oposición a la clonación con fines reproductivos (fig. 3).
Fig. 3. Aplicaciones de la clonación de embriones humanos.
Por otra parte, aún no se han establecido ni se conocen bien las condiciones necesarias para la diferenciación hacia líneas celulares específicas, aunque se espera que en este campo pueda avanzarse con rapidez a medida que se vayan incrementando los conocimientos que podrían proporcionar las investigaciones actuales y perspectivas. Una desventaja adicional, es su conocida potencialidad teratogénica. 1
En cuanto a las ventajas de las células madre adultas, se plantea que dada su procedencia autóloga, no producen trastornos inmunológicos ni presentan problemas éticos. Pueden ser de diferentes tipos y obtenerse de distintas fuentes; algunos de ellos tienen un amplio potencial de autorrenovación y posibilidades de modificar su diferenciación y de utilización para la transferencia génica.
Entre las desventajas se ha señalado que la mayor parte de estas células tienen una autorrenovación limitada y una manipulación engorrosa y costosa. 4 Sin embargo, los resultados obtenidos en algunos ensayos clínicos con células madre adultas de la médula ósea han abierto la posibilidad de un método de obtención más factible y menos costoso. 3
Células madre adultas presentes en la médula osea
Durante varios años se consideró la célula madre hematopoyética como la única célula en la médula ósea con capacidad generativa y se pensaba que solo era multipotencial. Sin embargo, estudios recientes han mostrado que la composición de la médula ósea es más compleja, pues en ella se ha identificado un grupo heterogéneo de células madre adultas (fig. 4), entre las que se encuentran los tipos siguientes:
- Hematopoyéticas.
- Mesenquimales (estromales).
- Población lateral.
- Células progenitoras adultas multipotentes (MAPC).
Fig. 4. Poblaciones de células madre presentes en la médula ósea.
Células madre hematopoyéticas
Estas células se han utilizado desde hace más de 50 años en el trasplante de médula ósea y han mostrado su efectividad en el tratamiento de diversas enfermedades. En los primeros tiempos, su fuente casi exclusiva era la médula ósea; posteriormente se extrajeron de la sangre periférica, tras su movilización de la médula ósea mediante factores de crecimiento, y también de la sangre del cordón umbilical. Ocasionalmente se ha usado como fuente tejido hepático fetal.
Habitualmente se ha empleado el marcador de superficie CD34 para la identificación de estas células, pero estudios más amplios han mostrado que su inmunofenotipo es más complejo, ya que puede expresar un espectro de marcadores de acuerdo con su estado de diferenciación.
En fecha relativamente reciente se ha incorporado un marcador de superficie (CD133) que indica un estadio más inmaduro de estas células, 34 y se han encontrado células CD133+, CD34-, CD38-, así como CD34+, CD38- y CD34+., CD38+. 35 Un inmunofenotipo característico se considera CD133+, CD117+ (c-kit), CD34+, CD38-, Lin- (marcadores de linaje celular). Algunos autores señalan que hay casos que pueden expresar CD45. 1
En el ratón se ha planteado que las células madre hematopoyéticas son CD45+, Thy 1.1+ (grupo de antígenos descubierto en el ratón en la superficie de timocitos y linfocitos), c-kit+, Sca-1+ (stem cell antigen 1), Lin - y no expresan niveles significativos de CD34 en contraste con los humanos, en que la mayoría son CD34+. 1
Estudios recientes apoyan también la existencia de células madre hematopoyéticas CD34-, lo que va en contra del criterio establecido hasta ese momento de que siempre expresan CD34. Se ha señalado que en el ratón las células CD34- representan una subpoblación en estado quiescente, que después que son activadas, mediante diferentes procederes que incluyen la adición de citocinas, se diferencian en células CD34+. 20 Esto concuerda con las opiniones de que las células CD34- podrían representar un estado más primitivo que el de las CD34+. 38 Es posible que algunas de las células CD34- correspondan a la subpoblación medular recientemente identificada como "población lateral" (del inglés side population), que contiene una alta proporción de células CD34-. 36-39
Otros estudios han incorporado nuevos marcadores en el inmunofenotipo de las células madre hematopoyéticas, entre ellos el VEGFR-2 (receptor tipo 2 del factor de crecimiento del endotelio vascular), también conocido como KDR/flk -1. 19 Este es un marcador que se ha encontrado en células hematopoyéticas y sus precursores, así como en células endoteliales. Se ha planteado que tiene una intervención importante en el desarrollo hematopoyético y vascular. Por otra parte, se ha observado que la subpoblación CD34+ KDR+ incluye una alta proporción de células madre hematopoyéticas con gran capacidad de autorrenovación, mientras que en la CD34+ KDR- esta capacidad es mucho menor. 38
Atendiendo a lo antes expuesto, se ha sugerido que las células madre hematopoyéticas son capaces de contribuir en buena medida a la angiogénesis y vasculogénesis.
En la actualidad se acepta la existencia del hemangioblasto como un progenitor común endotelial y hematopoyético, lo que apoyaría la potencialidad endotelial de las células madre hematopoyéticas de la médula ósea. 12,19 Además se ha señalado que la interrelación entre las células hematopoyéticas y las endoteliales, es un hecho esencial para la angiogénesis, puesto que en esta interviene la liberación por las células hematopoyéticas de varios factores angiogénicos, tales como angiopoyetinas y factores de crecimiento del endotelio vascular. Tanto en la médula ósea humana como en sangre periférica, la célula progenitora endotelial se ha caracterizado como CD133+ , CD34+ VEGFR2+ , lo que indica su estrecho vinculo con la célula madre hematopoyética. A estos marcadores se suman antígenos distintivos como el CD146 (sialomucina) y el CD144 (VE-Cadherina). En su maduración, las células endoteliales pierden el antígeno CD133. 19
Investigaciones recientes han mostrado el potencial de las células madre hematopoyéticas adultas para la regeneración de diversos tejidos, tanto en experimentos animales como en ensayos clínicos. 1,3 Todos estos datos evidencian que el comportamiento y la potencialidad de las células madre hematopoyéticas son mucho más complejas de lo que se creía previamente.
Células mesenquimales
En 1976 se informó que de la médula ósea se podían obtener células estromales con capacidad clonogénica. Con posterioridad, se describió en la médula ósea una población de células que presentaba una gran capacidad proliferativa y de diferenciación a varios linajes celulares. Estas células se denominaron células madre mesenquimales, las cuales se identifican habitualmente por las siglas MSC, del inglés mesenchymal stem cell. 40 También se han llamado mesenquimatosas o mesenquimáticas. Por su procedencia del estroma de la médula ósea otros las han llamado células madre estromales. 24 Estas fueron las primeras células madre no hematopoyéticas que se aislaron de la médula ósea. Entre sus características se destacan su adherencia al plástico, el aspecto de fibroblastos fusiformes en cultivos no estimulados, expresión de marcadores específicos como SH2, SH3 y SH4 con ausencia de marcadores hematopoyéticos como CD45, CD34, CD11 y CD14. 40-42 Más recientemente se han añadido otros antígenos de superficie útiles para la identificación de las MSC, como son CD29, CD44, CD71, CD90 y CD106. 24
Se ha demostrado que las células estromales son necesarias para el mantenimiento y expansión de células madre hematopoyéticas derivadas de la médula ósea de adultos y de la sangre del cordón umbilical. 43 Estas células, además de dar apoyo a la hematopoyesis pueden diferenciarse en osteoblastos, condroblastos, adipoblastos y mioblastos. 44
Por otra parte, se ha señalado la posibilidad de diferenciación de células estromales derivadas de la médula ósea en células con marcadores asociados con las neuronas, como es la nestina. Estas observaciones abren posibilidades para su empleo en diferentes enfermedades neurológicas 45 y amplían el potencial terapéutico que estas células podrían tener en la medicina regenerativa.
Población lateral
Esta población se representa en la literatura con las siglas SP provenientes de su nombre en inglés: side population.
Habitualmente las células madre hematopoyéticas se han identificado mediante su inmunofenotipaje de membrana estudiado por citometría de flujo. Otra estrategia que se ha incorporado para su detección es la evaluación de su capacidad funcional para emitir mayor o menor fluorescencia cuando se enfrentan a determinados colorantes fluorescentes y el análisis se realiza en un separador de células activadas con fluorescencia (FACS). Esto se basa en su mayor o menor capacidad para expulsar esos citofluorocromos.
Los estudios iniciales se hicieron en ratones empleando la rodamina -123 y se comprobó la existencia de 2 subpoblaciones de células primitivas: una con una fluorescencia muy tenue y otra con una emisión brillante. Con posterioridad se comprobó en los humanos este diferente comportamiento celular y además que las células hematopoyéticas primitivas tienen también una mayor capacidad de eliminación del citofluorocromo Hoechst 33342. 46 Hasta hace poco se aceptaba que la débil emisión fluorescente era un reflejo de su hipoactividad metabólica y de un estado de quiescencia. Sin embargo, hoy se acepta que la débil emisión de fluorescencia se debe, en su mayor parte, a la rápida expulsión del fluorocromo. Este flujo del colorante es mediado al menos por 2 transportadores que se unen con ATP y que son miembros de la familia ABC (siglas que provienen de su nombre en inglés: ATP-binding cassette). Estos son el ABCG2, equivalente a una nueva proteína resistente al cáncer de mama (BCRP), y la glicoproteína P. 47 La subpoblación de células madre que eliminan rápidamente el Hoechst 33342 presenta un patrón característico en la citometría de flujo, a lo que se debe su nombre de población lateral.
Se ha señalado que esta población celular tiene una frecuencia media de 0,02 % en la sangre periférica movilizada y extraída por aféresis, y es menor en la médula ósea y en la sangre del cordón umbilical. 48 Formando parte de esta población, se han detectado subpoblaciones CD34+ y CD34- (36, 39). Se plantea que en los humanos gran parte de las células SP son CD34-. 48 Por otro lado, se ha señalado que la expresión del transportador ABCG2 constituye una indicación de una célula madre muy primitiva. 49 Se ha indicado que las células de la SP pueden dar lugar a diferentes tipos de células especializadas e integrarse en distintos tejidos in vivo que incluyen tejidos no hematopoyéticos. 24,50
Células progenitoras multipotenciales adultas
Recientemente se han generado nuevas expectativas en la comunidad científica ante la posibilidad de que algunas células madre adultas puedan tener propiedades de diferenciación muy similares a las de las células madre embrionarias. Esto está estrechamente relacionado con el aislamiento en cultivos de médula ósea de ratas, ratones y humanos de células progenitoras multipotenciales adultas con una versatilidad inusual, pues mostraban capacidad de diferenciarse rápidamente en múltiples tipos celulares según las condiciones de cultivo. 11,51 Estas células se denominan con las siglas MAPC derivadas de su nombre en inglés multipotent adult progenitor cells. Después que estas se introducen en blastocistos murinos, pueden generar la mayoría de los tipos celulares derivados de cualquiera de las 3 capas embrionarias. 1 De igual forma sucede cuando se someten a determinadas condiciones de cultivo. 3 Aunque no hay evidencias concretas de que las MAPC existan como tales en tejidos normales, estas se pueden obtener mediante cultivos a largo plazo de células estromales de la médula ósea mantenidas en condiciones específicas. 4
A diferencia de las células madre embrionarias, las MAPC se pueden obtener de la médula ósea autóloga, con lo que se evita la reacción de rechazo que se puede producir debido a la expresión en las células embrionarias de antígenos de histocompatibilidad diferentes a los del receptor de esas células. Por otra parte, no se ha observado en estas el potencial teratogénico que tienen las embrionarias. 3 Se ha señalado que las MAPC son capaces de proliferar in vitro con más de 120 divisiones celulares sin un aparente envejecimiento, y también que no expresan CD34, CD44, CD45, c-kit ni antígenos del complejo mayor de histocompatibilidad de clase I y clase II. Su expresión de Flk-1, Sca-1 y Thy-1 es muy baja, pero la de CD13, SSEA-1 (en rata/ratón) y SSEA-4 (en humano) es alta. 3,24 Los antígenos embrionarios 1, 3 y 4 específicos de etapas, reconocidos por las siglas SSEA (derivadas del término que los designa en inglés: stage - specific embryonic antigens), se detectan mediante anticuerpos monoclonales que se emplearon originalmente para identificar las primeras etapas del desarrollo del ratón. Las células pluripotentes de los primates expresan SSEA-3 y SSEA-4, pero el SSEA-1 solo se manifiesta después de su diferenciación. En las células embrionarias del ratón ese patrón de expresión antigénica se invierte. 1 Las mayores limitantes que se plantean para el empleo de las MAPC son las condiciones tan especializadas que al parecer son necesarias para su cultivo. Por otra parte, las condiciones que se requieren para que se diferencien en tipos celulares específicos no están totalmente esclarecidas, por lo que esto es un tema de gran interés y objeto en la actualidad de diversas investigaciones. 4 Indudablemente que la identificación y estudio de las MAPC abren nuevas perspectivas no solo en su posible aplicación terapéutica, sino también para el mejor conocimiento de la biología de las células madre.
Células ovales
Investigaciones realizadas en modelos animales han evidenciado que entre las células de la médula ósea se puede encontrar una población con las características de las células ovales a las que se le atribuye una capacidad generativa bipotencial, pues pueden transformarse en hepatocitos y células epiteliales del árbol biliar. Se ha señalado que una pequeña subpoblación de células CD34+ Lin- es la que tiene esta propiedad. Estudios posteriores efectuados en humanos también apoyan estos criterios. 17,18,52 Así se ha planteado que la contribución de las células de la médula ósea a la regeneración hepática pudiera estar relacionada con la infusión de células ovales presentes dentro del conjunto de células medulares. 1 Estos estudios, tomados en forma integrada, apoyan el concepto actual de la heterogeneidad de las poblaciones de células madre adultas existentes en la médula ósea y la contribución de sus células circulantes a la formación de tejidos no hematopoyéticos.
Contribución de células circulantes a la formación de tejidos no hematopoyéticos
En los últimos tiempos se han acumulado algunas evidencias que indican que las células madre hematopoyéticas pueden contribuir a la homeostasis de tejidos no hematopoyéticos. Este criterio se apoya en los resultados obtenidos en modelos animales y en observaciones realizadas en humanos.
Las investigaciones sobre este tema se han realizado en general mediante la evaluación del quimerismo que se puede producir en determinados órganos, cuando se realiza un trasplante alogénico de médula ósea o de células madre hematopoyéticas extraídas de sangre periférica después de su movilización por medio de un factor estimulador. En algunos trabajos también se han utilizado como material de estudio, casos en que se ha hecho un trasplante de órgano. En ambas situaciones, donantes y receptores eran de sexos diferentes, lo que permitía usar el cromosoma Y como marcador para identificar la existencia de quimerismo en tejidos de casos femeninos. En los trasplantes de células hematopoyéticas los donantes eran siempre masculinos, mientras que una situación inversa se usó en los casos de trasplantes de órganos, ya que el órgano trasplantado siempre provenía de una donante.
En los trasplantes experimentales de células hematopoyéticas practicados en ratones, en la hembra receptora se observaron células con el marcador masculino en diferentes localizaciones, que incluían músculo esquelético y cardíaco, neuronas, hepatocitos, células endoteliales, alvéolos pulmonares, bronquios, tracto digestivo y piel. 4,18 En los humanos también se pudieron comprobar diferentes porcentajes de células con el marcador masculino en diferentes sitios de la receptora, que incluían osteoblastos, hepatocitos, epitelio gastrointestinal, cardiocitos, piel y células de Purkinje. 4,17,21
En los trasplantes de órganos también se observó quimerismo en el órgano femenino trasplantado; así en el trasplante hepático se encontraron hepatocitos con el marcador masculino y en los corazones trasplantados cardiomiocitos con el marcador Y procedente de células del receptor masculino.
Todos estos datos sugieren que las células procedentes de la médula ósea pueden llegar a través de la circulación a los tejidos no hematopoyéticos, donde pueden adquirir características de las células del tejido donde se implanten. En la actualidad, no está completamente definido el mecanismo por el cual las células madre circulantes pueden se atraídas por diferentes sectores del organismo y después diferenciarse en células específicas de esos tejidos.
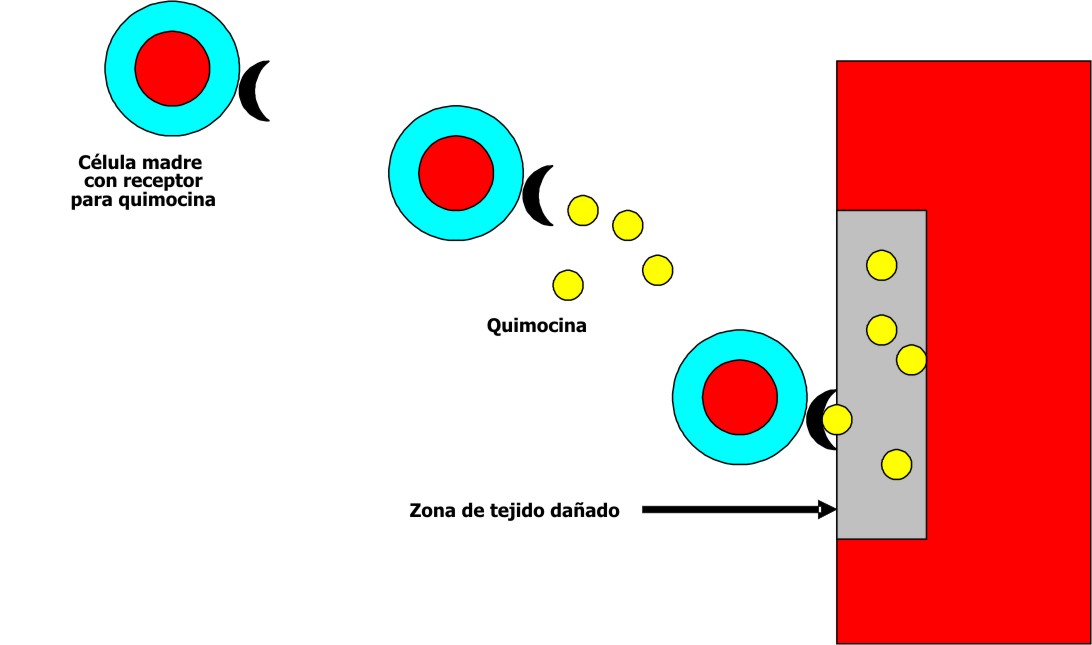
Se ha señalado que las lesiones hísticas pueden originar cambios en el microambiente de un órgano determinado y desempeñar una importante función en la atracción de las células madre circulantes. Una posibilidad sería la producción en la zona dañada de quimocinas específicas las cuales atraerían a las células madre dotadas de receptores que les permitan unirse con ellas (fig. 5). 2 Sin embargo, la situación no parece tan simple, pues las células madre circulantes también pueden incorporarse a órganos no dañados, situación en que la explicación resulta más difícil.
Fig. 5. Mecanismo propuesto para explicar la migración de las células madre a tejidos lesionados.
La habilidad de las células madre adultas para en determinadas situaciones adquirir características de células específicas de otros tejidos, se ha atribuido a un proceso calificado como plasticidad celular.
Plasticidad de las células madre adultas
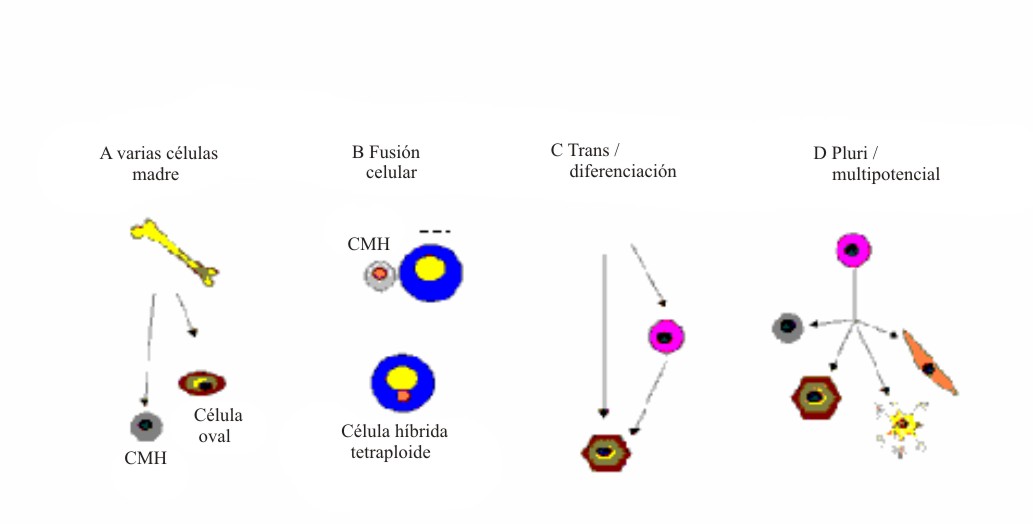
En los últimos años, se ha acumulado una serie de conocimientos sorprendentes que contradicen el dogma de que una célula madre adulta solo puede diferenciarse en células de un tejido específico. Así, ha surgido el concepto de plasticidad de las células madre adultas. Como este concepto no está perfectamente esclarecido, se le ha dado una posible definición, en la que se identifica a la plasticidad como la capacidad que adquieren estas células, bajo determinadas condiciones microambientales, de diferenciase en células de tejidos distintos de aquel con el cual la célula madre se encuentra aparentemente comprometida.1,3 Así, se ha señalado una plasticidad potencial para diferentes células madre adultas, entre las que destacan las hematopoyéticas y las neuronales (fig. 6). Sin embargo, al parecer esta situación es mucho más compleja, pues sobre esta capacidad se han emitido diferentes opiniones e interrogantes acerca de los mecanismos que pueden explicar la versatilidad de las células madre adultas y su aparente plasticidad. En la actualidad, para esclarecer este proceso, se plantean 4 hipótesis o modelos. Se ha señalado la existencia de datos en la literatura que apoyan la intervención de 4 mecanismos (fig. 7). 1
Fig. 6. Plasticidad potencial de algunas células madre adultas (las flechas indican la posible capacidad de transformación de la célula madre).
Fig. 7. Mecanismos para explicar la plasticidad de las células madre adultas.CMH: célula madre hematopoyética; CET: célula específica del tejido.A: heterogeneidad de células madre que se ha encontrado en la médula ósea. B: fusión celular con producción de una célula híbrida con características de ambas células fusionadas. C: procesos de transdiferenciación, desdiferenciación y rediferenciación que pueden dar lugar a que las células sean reprogramadas y se diferencien en otras de distinto linaje. D: persistencia en el organismo ya desarrollado de células madre somáticas con capacidad multi o pluripotencial. (Tomado de las referencias 1 y 24).
Los mecanismos planteados son los siguientes:
- Heterogeneidad de las células madre presentes en una población celular.
- Fusión de las células madre trasplantadas con las células específicas residentes en un órgano.
- Consumación de un proceso de desdiferenciación y rediferenciación celular.
- Persistencia de células madre adultas con capacidad multi o pluripotencial.
Heterogeneidad de las células madre somáticas presentes en una población celular
Diversos estudios apoyan la coexistencia de tipos diferentes de células madre en determinados tejidos, cada una con distintas características y potencialidades. Como ejemplo de este modelo está la heterogeneidad de células madre que se ha encontrado en la médula ósea. Esto ha llevado a plantear que la regeneración de tejidos no hematopoyéticos que se ha observado después de la infusión de células procedentes de la médula ósea, podría deberse a la acción específica de alguno de los tipos de células madre que actualmente se han identificado en ella, y no a la transdiferenciación de la célula madre hematopoyética, aunque esta última posibilidad no puede se excluida. 1,11,51
Fusión de las células trasplantadas con las células propias de un tejido
Existen varios trabajos que apoyan el criterio de que la aparente plasticidad y pluripotencialidad se deben en algunos casos a un proceso de fusión celular. 2, 53,54 También se ha visto que la fusión de mioblastos con fibroblastos induce en estos últimos la expresión de proteínas propias del músculo, lo que ha sugerido la existencia en los mioblastos de algunos factores que pueden inducir la diferenciación muscular de otros tipos de células. 1 Por otra parte, se ha señalado que el contacto intercelular podría tener una acción importante en la fusión de una célula incorporada a un nuevo microambiente. Este mecanismo daría lugar a células híbridas con características de ambas células fusionadas, pero con la desventaja de poseer una menor capacidad proliferativa, pues generalmente debido a la fusión adquieren doble dotación cromosómica. 24
El mecanismo de fusión celular se ha comprobado en estudios experimentales con ratones en que la mayor parte de las células híbridas eran tetraploides o hexaploides. 3,54 Sin embargo, muchas de las células específicas de tejidos y con marcadores propios del donante que se han identificado en pacientes que han recibido trasplantes alogénicos de células madre hematopoyéticas, han mostrado una dotación cromosómica normal. Para compatibilizar esta situación, se sugirió que tal vez la célula fusionada hiperdiploide podía evolutivamente llevar su dotación cromosómica a un estado diploide. Pero estudios posteriores no han favorecido esta hipótesis. 3
Se ha señalado que hasta donde se conoce en la actualidad, no existe ningún estudio que permita eliminar radicalmente la posibilidad de la fusión celular como un mecanismo que pueda intervenir en la versatilidad de las células madre somáticas, aunque es muy poco probable que pueda justificar todas las observaciones de pluripotencialidad celular realizadas hasta la fecha. Quizá la fusión pudiera explicar la transformación celular en determinados tejidos donde la frecuencia de los otros mecanismos sea extremadamente baja. 1
Existencia de un proceso de desdiferenciación y rediferenciación celular
Se ha planteado que una célula madre programada para su diferenciación en células especializadas específicas puede transdiferenciarse en determinadas situaciones ambientales, es decir, cambiar su destino y dar lugar a células de otros tejidos diferentes.
Desde hace mucho tiempo se conoce que la desdiferenciación y rediferenciación pueden ocurrir en ciertos animales, y como ejemplo se citan los anfibios, que son capaces de regenerar completamente alguna extremidad dañada. Tal como sucede durante el proceso de la clonación celular, en que el núcleo de una célula somática es sometido a un proceso de reprogramación genética, se ha planteado la posibilidad de que las células madre adultas pudiesen ser reprogramadas cuando se extraen de su microambiente natural y se sitúan en otros diferentes, en los cuales reciben estímulos y señales que las inducen a la activación de un nuevo programa genético que las lleva a la diferenciación en células del nuevo tejido en que se han implantado. De esta forma, una célula genéticamente comprometida puede sufrir un proceso de desdiferenciación mediante un salto atrás en su etapa de maduración y adquirir por esta retrodiferenciación una nueva capacidad regenerativa, que le permite después rediferenciarse en células maduras especializadas de estirpes diferentes. 1,3,24 Un ejemplo de este proceso es la desdiferenciación que se ha observado en células epidérmicas que se han transformado en células inmaduras con características de células madre. 55
Persistencia de células madre adultas con capacidad multi o pluripotencial
Se ha sugerido la posibilidad de que en el organismo después de rebasado el período embrionario, persistan células madre con capacidad multi o pluripotencial, que en dependencia del medio en que se sitúen, pueden diferenciarse hacia células de diferentes linajes. Algunos estudios han evidenciado la existencia de células que apoyan esta hipótesis. 1,51
Hasta el momento, ninguno de los modelos expuestos puede por sí solo explicar completamente el mecanismo de la plasticidad atribuida a las células madre. Es posible que en determinados casos, tejidos y situaciones ambientales, pueda ocurrir más de uno de estos procesos. La explicación de la versatilidad planteada en las células madre adultas es el objeto de diferentes investigaciones, y resulta de gran interés y preocupación para muchos científicos en el mundo, lo que seguramente contribuirá a esclarecer este importante tópico de la moderna biología celular.
Todos los aspectos analizados en este trabajo ofrecen una visión panorámica de los grandes avances que se han logrado en el estudio de las células madre en un tiempo relativamente corto, y aunque aún persisten muchas incógnitas por despejar, no cabe duda que la investigación en este campo ha creado grandes expectativas, fundamentalmente en relación con la aplicación terapéutica de estas células y el desarrollo de la medicina regenerativa, pues los nuevos conocimientos podrían abrir las puertas a una verdadera e importante "revolución" en el tratamiento de diversas enfermedades.
Summary
In the last few years, there has emerged a new branch of medicine called regenerative medicine based mainly on the new knowledge about stem cells and their capacity to turn into cells of different tissues. Stem cells are classified into embryonic cells and somatic or adult cells. For many years, it was believed that hematopoietic stem cell was the only one with regenerative capacity in the bone-marrow. However, recent studies have shown that the composition of the bone marrow is more complex an heterogeneous group of adult stem cells such as hematopoietic, mesenchymal (stromal), lateral population and multipotent adult progenitor cells have been identified there. Several studies suggested that the potential of some types of adult stem cells is greater than expected since they have shown their capacity to differentiate into cells of various lineages under certain conditions, which means that their potential is very close to that of the embryonic cells. This has given rise to new prospects for the treatment of a number of diseases with adult stem cells that it was thought to be possible only with the embryonic cells.
Key words: regenerative medicine, stem cells, cell plasticity, transdifferentiation.
Referencias bibliográficas
1. Verfaillie CM, Pera MF, Lansdorp PM. Stem cells: Hype and reality. Hematology 2002;1:369-91.
2. Rosenthal N. Prometheus´s vulture and the stem-cell promise. N Engl J Med 2003;349:267-74.
3. Körbling M, Estrov Z. Adult stem cells for tissue repair - A new therapeutic concept? N Engl J Med 2003;349:570-82.
4. Daley GQ, Goodell MA, Snyder EY. Realistic prospects for stem cell therapeutics Hematology 2003;1:398-418.
5. Langman J. Embriología Médica. Ciudad de La Habana: Pueblo y Educación; 1977:21-32.
6. Thomson JA, Odorico JS. Human embryonic stem cell and embryonic germ cell lines. Triends Biothec 2000;18:53-7.
7. Rossant J. Development of the extraembryonic lineages. Sem Cell Dev Biol 1995;6:237-47.
8. Desbaillets J, Ziegler U, Groscurth P, Gassmann M. Embryoid bodies: An in vitro model of mouse embryogenesis. Exp Physiol 2000;85:645-51.
9. Thomson JA, Itskovitz-Eldor J, Shapiro SS, Waknitz MA, Swiergiel JJ, Marshall VS, et al. Embryonic stem cell lines derived from human blastocysts. Science 1998;282:1145-7.
10. Itskovitz-Eldor J, Schuldiner M, Karsenti D, Eden A, Yanuka O, Amit M, et al. Differentiation of human embryonic stem cells into embryoid bodies compromising the three embryonic germ layers. Mol Med 2000;6:88-95.
11. Jiang Y, Vaessen B, Lenvik T, Blackstad M, Reyes M, Verfaillie CM. Multipotent progenitor cells can be isolated from postnatal murine bone marrow, muscle, and brain. Exp Hematol 2002;30:896-904.
12. Grant MB, May WS, Caballero S, Brown GA, Guthrie SM, Names RN, et al. Adult Hematopoietic stem cells provide functional hemangioblast activity during retinal neovascularization. Nat Med 2002;8:607-12.
13. Krause DS, Theise ND, Collector MI, Henegariu D, Hwang S, Gardner R, et al. Multi-organ, multi-lineaje engrafment by a single bone marrow-derived stem cell. Cell 2001;105:369-77.
14. Jackson KA, Mi T, Goodell MA. Hematopoietic potential of stem cells isolated from murine skeletal muscle. Proc Natl Acad Sci USA 1999;96:14482-6.
15. Wei G, Schubiger G, Harder F, Müller AM. Stem cell plasticity in mammals and transdetermination in Drosophila: common themes?. Stem Cells 2000;18:409-14.
16. Orlic D, Hill JM, Arai AE. Stem cells for myocardial regeneration. Circ Res 2002;91:1092-102.
17. Theise ND, Nimmakayalu M, Gardner R, Illei PB, Morgan G, Teperman L, et al. Liver from bone marrow in humans. Hepatology 2000;32:11-6.
18. Theise N, Badve S, Saxena R. Derivation of hepatocytes from bone marrow cells in mice after radiation-induced myeloblation. Hepatology 2000;31:234-40.
19. afii S, Lyden D. Therapeutic stem and progenitor cell transplantation for organ vascularization and regeneration. Nat Med 2003;9:702-12.
20. Quaini F, Urbanek K, Beltrami AP, Finato N, Beltrami CA, Nadal-Ginard B, et al. Chimerism of the transplanted heart. N Engl J Med 2002;346:5-15.
21. Körbling M, Katz RL, Khanna A, Ruifrok AC, Rondon G, Allatar M, et al. Hepatocytes and epithelial cells of donor origin in recipients of peripheral - blood stem cells. N Engl J Med 2002;346:738-46.
22. Deb A, Wang S, Skelding KA, Miller D, Simper D, Caplice NM. Bone marrow-derived cardiomyocytes are present in adult human heart: a study of gender-mismarched bone marrow transplantation patients. Circulation 2003;107:1247-9
23. López Moratalla N. La racionalidad terapéutica en la medicina regenerativa con células troncales embrionarias o de adulto. Anal Real Acad Nal Farm 2003;69:21-45.
24. Prosper F, Verfaillie CM. Células madre adultas. An Sist Sanit Navar 2003;26:345-56.
25. Morris RJ, Liu Y, Marles L, Yang Z, Trempus C, Li S, et al. Capturing and profiling adult hair follicle stem cells. Nat Biotechnol 2004;22:411-7.
26. Mina M, Braut A. New insight into progenitor/stem cells in dental pulp using Col 1a1-GFP transgenes. Cells Tissues Organs 2004;176:120-33.
27. Zuk PA, Zhu M, Ashjian P, De Ugarte DA, Huang JI, Mizuno H, et al. Human adipose tissue is a source of multipotent stem cells. Mol Biol Cell 2002;13:4279-95.
28. Weissman IL, Anderson DJ, Gage F. Stem and progenitor cells: origins, phenotypes, lineage commitments and transdifferentiation. Annu Rev Cell Dev Biol 2001;17:387-403.
29. Mayo M. Cellules souches: histoire d´ une decòuverte. Science Vie 2001;1010:86-93.
30. Polli EE. Transplanting bone-marrow stem cells into the central nervous system. Haematologica 2000;85:1009-10.
31. Blau HM, Brazelton TR, Weimann JM, The evolving concept of a stem cell: entity or function? Cell 2001;105:829-41.
32. Malcon RA, Poulsan R, Forbes S, Wright NA, An introduction to stem cells. J Pathol 2002;197:419-23.
33. Quesenberry PJ, Colvin GA, Lambert JF. The chiaroscuro stem cell: a unifed stem cell theory. Blood 2002;100:4266-71.
34. Yin AH, Miraglia S, Zanjani ED, Almeida-Porada G, Ogawa M, Leary AG, et al. AC 133, a novel marker for human hematopoietic stem and progenitor cells. Blood 1997;90:5002-12.
35. Eaves CJ. Myelopoiesis. En: Henderson ES, Lister TA, Greaves MF, eds. Leukemia. 7. ed. Philadelphia: Saunders; 2002;19-46.
36. Guo Y, Lubbert M, Engelhardt M. CD34¯ hematopoietic stem cells: Current concepts and controversies. Stem Cells 2003;21:15-20.
37. Zanjani ED, Almeida-Porada G, Livingston AG, Porada CD, Ogawa M. Engraftment and Multilineage expression of human bone marrow CD34¯ cells in vivo. Ann NY Acad Sci 1999;872:220-31.
38. Thomas TE, Miller CL, Eaves CK. Purification of hematopoietic stem cells for further biological studies. Methods 1999;17:202-18.
39. Pearce DJ, Ridler CM, Simpson C, Bonnet D. Multiparameter analysis of murine bone marrow side population cells. Blood 2004;103:2541-6.
40. Koc ON, Lazarus HM. Mesenchymal stem cells: heading into the clinic. Bone Marrow Transplant 2001;27:235-9.
41. Haynesworth S, Baber M, Caplan A. Cell surface antigens on human marrow-derived mesenchymal cells are detected by monoclonal antibodies. Bone Marrow Transplant 1992;13:69-80.
42. Reyes M, Lund T, Lenvik T, Aguiar D, Koodie L, Verfaille CM. Purification and ex vivo expansion of postnatal human marrow mesodermal progenitor cells. Blood 2001;98:2615-25.
43. Pecora AL. Progress in clinical application of use of progenitor cells expanded with hematopoietic growth factors. Curr Opin Hematol 2001;8:142-8.
44. Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, et al. Multilineage potential of adult human mesenchymal stem cell. Science 1999;284:143-7.
45. Woodbury D, Schwarz EJ, Prockop DJ, Black IB. Adult rat and human bone marrow stromal cells differentiate into neurons. J Neurosci Res 2000;61:364-70
46. Goodell MA, Brose K, Paradis G, Conner AS, Mulligan RC. Isolation and functional properties of murine hematopoietic stem cells that are replicating in vivo. J Exp Med 1996;183:1797-806.
47. Eaker SS, Hawley TS, Ramezam A, Hawley RG. Detection and enrichment of hematopietic stem cell by side population phenotype. Methods Mol Biol 2004;263:161-80.
48. Guo Y, Follo M, Geiger K, Lubbert M, Engelhardt M. Side-population cells from different precursors compartments. J Hematother Stem Cell Res 2003;12:71-82.
49. Scharenberg CW, Harkey MA, Torok-Storb B. The ABC G2 transporter is an efficient Hoechst 33342 efflux pump and is preferentially expressed by immature human hematopietic progenitors. Blood 2002;99:507-12.
50. Asakura A, Rudnicki MA. Side population cells from diverse adult tissues are capable of in vitro hematopoietic differentiation. Exp Hematol 2002;30:1339-45.
51. Jiang Y, Jahagirdar BN, Reinhardt RL, Schwartz RE, Keene CD, Ortiz-González XP, et al. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature 2002;418:41-9.
52. Petersen BE. Hepatic "stem" cells: coming full circle. Blood Cells Mol Dis 2001;27:590-600.
53. Terada N, Hamazaki T, Oka M, Hoki M, Mastalerz DM, Nakano Y, et al. Bone marrow cells adopt the phenotype of other cells by spontaneous cell fusion. Nature 2002;416:542-5.
54. Wang X, Willenbring H, Akkari Y, Torimaru Y, Foster M, Al-Dhalimy M, et al. Cell fusion is the principal source of bone-marrow-derived hepatocytes. Nature 2003;422:897-901.
55. Fu X, Sun X, Li X, Sheng Z. Dedifferentiantion of epidermal cells to stem cells in vivo. Lancet 2001;358:1067.
Recibido: 2 de noviembre de 2004. Aprobado: 18 de diciembre de 2004.
Prof. Porfirio Hernández Ramírez. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Tel (537) 578268, 578695, 544214. Fax (537) 442334. e-mail: ihidir@hemato.sld.cu
 Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons