Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.21 n.3 Ciudad de la Habana sep.-dic. 2005
Artículos de revisión
Instituto de Hematología e Inmunología
Organización de la membrana celular: banda 3, estructura y función
Lic. Ada Amalia Arce Hernández y Lic. Rinaldo Villaescusa Blanco
Resumen
El término banda 3 se refiere a un grupo de intercambiadores aniónicos (AE 0-3), que están presentes en la membrana de todas las células y organelos celulares, y que participan en diversas actividades fisiológicas, entre las que se destacan el intercambio bicarbonato/ cloruro, unión de IgG y remoción celular y el mantenimiento de la integridad celular. El AE 1 constituye el elemento central integral de un macrocomplejo proteico en el contexto de la organización de la membrana del eritrocito, que está constituido por 3 dominios con funciones estructurales y metabólicas específicas. Cambios estructurales de la banda 3 y la presencia de autoanticuerpos naturales anti banda 3 se han asociado con el envejecimiento celular y la generación del antígeno de senescencia celular (ASC). Se analiza el mecanismo de envejecimiento prematuro de los eritrocitos SS en la drepanocitosis a partir de la auto-oxidación aumentada de la hemoglobina, que trae como consecuencia alteraciones en la banda 3 y expresión del ASC, unión de IgG y la remoción de los eritrocitos SS mediante fagocitosis. Alteraciones en banda 3 se han observado también en enfermedades neurológicas como el Alzheimer, disquinesia idiopática familiar, epilepsias idiopáticas, así como en enfermedades cardiovasculares, señalándose la elevada mortalidad en el neonato con deficiencia total de banda 3.
Palabras clave: antígeno de senescencia celular, banda 3, drepanocitosis, membrana celular.
El término banda 3 define a un grupo de intercambiadores aniónicos (AE 0-3), que están presentes en la membrana de todas las células y organelos celulares.1-4 Esta proteína fue identificada por primera vez en eritrocitos, y se designó como banda 3 por ser la tercera banda que aparecía a partir de la parte superior de una corrida en la electroforesis en gel de poliacrilamida (SDS – PAGE). Showe5 en 1987 localizó el gen para banda 3 en 17q21 mediante análisis por Southern blot de ADN de híbridos de células somáticas. Están implicados en diversas actividades fisiológicas como son: el mantenimiento del equilibrio osmótico y volumen celular; intercambio HCO3-/Cl-; unión de IgG, la remoción celular y en el mantenimiento de la integridad estructural de la célula.6-13
El intercambiador aniónico de banda 3 (AE 1) es la proteína integral principal de la membrana del eritrocito; tiene un peso molecular aproximado de 95 kDa y es el prototipo de todos los AEs, constituido por 911 aminoácidos y presenta alrededor de 1,2 X 10 6 copias por célula. Esta proteína multifuncional tiene 3 dominios: un dominio de membrana transversal donde ocurre el intercambio cloruro/ bicarbonato, un dominio citoplasmático corto C-terminal, y un dominio citoplasmático largo N-terminal.14,15 El dominio C- terminal citoplasmático de la banda 3 une la anhidrasa carbónica II (CA II), formando un complejo metabólico que permite el paso de bicarbonato en la fase citoplásmica de la banda 3.16
El dominio citoplásmico N-terminal de la banda 3 une enzimas glicolíticas, hemoglobina y hemicrones, que pueden inducir la agregación de la banda 3 y el recambio celular.17 Una función fundamental del dominio N-terminal de la banda 3 es el anclaje de la membrana eritrocitaria al citoesqueleto subyacente.18 Por lo tanto, la banda 3 constituye el elemento central de un macrocomplejo de proteínas integrales y periféricas en la membrana del eritrocito.
Organización de la membrana eritrocitaria
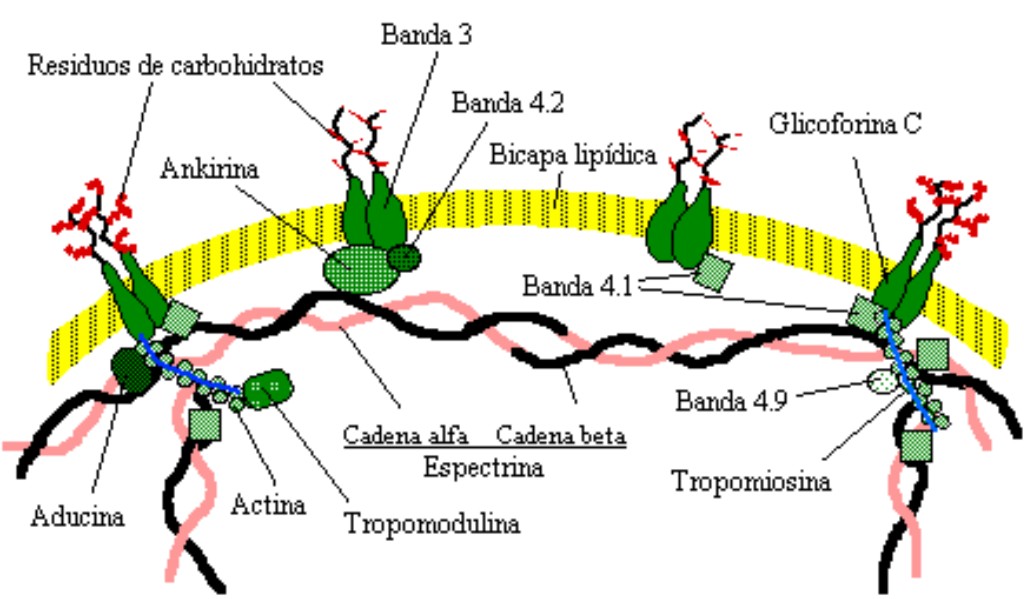
El modelo que se observa en la figura detalla la red de proteínas de membrana asociadas con el citoesqueleto y que están involucradas en el control de la forma del eritrocito, uniones con otras células y con el sustrato, así como en la organización de dominios especializados de la membrana.
Fig. Organización de la membrana eritrocitaria. Red de proteínas de membrana asociadas con el citoesqueleto .
El componente de mayor masa molecular en el citoesqueleto de la membrana del eritrocito es la espectrina. Tetrámeros de espectrinas están unidos con la membrana por una proteína llamada ankirina, la cual está conectada a la banda 3. El objetivo de la banda 4.2 es estabilizar la unión entre la ankirina y el intercambiador aniónico banda 3. La espectrina se une también con la glicoforina C mediante la banda 4.1; este entramado es anclado en múltiples sitios de la membrana. La banda 4.1, así como la aducina, estabilizan la asociación de la espectrina con la actina. Subunidades de la actina forman microfilamentos con la tropomiosina, a los que se asocia la proteína tropomodulina. La banda 4.9, conocida también como dematina, produce el entrecruzamiento de estos microfilamentos de actina. La estructura de la doble capa lipídica es fundamental en la organización del citoesqueleto.19-21
Papel de la banda 3 en enfermedades
Cambios estructurales en la banda 3 y la presencia de autoanticuerpos naturales anti banda 3 se han asociado con el envejecimiento celular y mecanismos de generación del antígeno de senescencia celular (ASC). Los cambios en banda 3 relacionados con el envejecimiento incluyen una disminución en la eficiencia del transporte aniónico, disminución en el transporte de glucosa, un incremento en la degradación de banda 3 y la unión de autoanticuerpos naturales de la clase IgG resultando en la remoción celular.22-31
Existe consenso con relación con que el ASC se deriva de la banda 3 y que la oxidación es el mecanismo de generación del neoantígeno. Autoanticuerpos naturales anti ASC son parte de un entramado regulatorio que protege al organismo del medio interno y externo, incluyendo lo propio alterado y senescente. Estos autoanticuerpos se han demostrado en la eliminación de eritrocitos en infecciones virales, en diversas anemias hemolíticas, en eritrocitos infectados con malaria y en la drepanocitosis.32-36
En la drepanocitosis se ha demostrado que los eritrocitos SS generan el doble de la cantidad de moléculas oxidativas altamente reactivas al compararlos con los heterocigóticos AS y normales AA, probablemente como resultado de una auto-oxidación aumentada de la hemoglobina.37 Este fenómeno oxidativo puede inducir la formación de agregados de banda 3 y la generación de ASC, lo que posibilita la unión de autoanticuerpos de la clase IgG y la remoción de los eritrocitos mediante fagocitosis. Estos datos sugieren que en esta enfermedad se produce el envejecimiento acelerado de los eritrocitos, como ocurre en las deficiencias de vitamina E. La mayoría de los drepanocitos tienen características que se han demostrado en eritrocitos normales senescentes, tales como un incremento en la densidad, unión de IgG, transporte alterado de aniones y glucosa y la unión de ankirina. En experimentos preliminares, se ha observado que la suplementación con vitamina E cambia algunos de estos parámetros hasta niveles normales.28,36,38-40 Mecanismos de oxidación que posibilitan la formación prematura de ASC en la banda 3 se han observado en otras enfermedades como Alzheimer, síndrome de Down y diversas enfermedades cardiovasculares.41-44 Alteraciones genéticas en la banda 3 se han demostrado en anemias hemolíticas severas, en la acidosis tubular renal distal, en la ovalocitosis hereditaria, esferocitosis hereditaria, en enfermedades neurológicas como la disquiinesia paroxística familiar, coreoacantocitosis y epilepsias idiopáticas.45-49 La ausencia de banda 3 tiene serias consecuencias, pues procuce entre el 90 y 95 % de mortalidad durante el período neonatal; los pocos que sobreviven este período presentan una anemia hemolítica severa con eritrocitos esferocíticos y un estado de hipercoagulación causante de trombosis.50,51
Summary
The term band 3 refers to a group of anion exchangers (AE 0-3) that are present in the membrane of all cells and cellular organella and take part in diverse physiologic activities, among which the bicarbonate/ chloride exchange, the IgG binding and cellular removal , and the maintenance of cellular integrity stand out. AE1 is the central integral element of a protein macrocomplex in the context of the organization of the erythrocyte membrane that is composed of 3 domains with specific structural and metabolic functions. Structural changes of band 3 and the presence of natural anti band 3 antibodies have been associated with cellular aging and the generation of the senescent cell antigen (SCA). The mechanism of early aging of SS erythocytes in drepanocytosis is analysed starting from the augmented autooxidation of hemoglobin that brings about alterations in band 3 and SCA expression, IgG binding and the removal of SS erythrocytes by phagocytosis. Band 3 alterations have also been observed in neurological diseases, such as Alzheimer's disease, family idiopathic dischinesia, and idiopathic epilepsies, as well as in cardiovascular diseases. The high mortality in the newborn with total band 3 deficiency has been stressed.
Key words: Senescent cell antigen, band 3, drepanocytosis, cell membrane.
Referencias bibliográficas
1. Havenga MJ, Bosman GJ, Appelhans H, De Grip WJ. Expression of the anion exchanger (AE) gene family in human brain. Identification of a new AE protein: AEO. Mol Brain Res 1994;25:97-104.
2. Kay MMB, Tracey CM, Goodman JR, Cone JC, Bassel PS. Polypeptides immunologically related to erythrocyte band 3 are present in nucleated somatic cells. Proc Natl Acad Sci USA 1983;80:6882-6.
3. Rutes S, Lindsey AE, Ward CL, Kopito RR. Functional activation of plasma membrane anion exchangers occurs in a pre-Golgi compartment. Cell Biol 1993;121:37-48.
4. Yannoukakos D, Stuart-Tilley A, Fernandez HA, Fey P, Duyk G, Alper SL. Molecular cloning, expression, and chromosomal localization of two isoforms of the AE3 anion exchanger from human heart. Circ Res 1994;75:603-14.
5. Showe LC, Ballantine M, Huebner K. Localization of the gene for the erythroid anion exchange protein, band 3 (EMPB3), to human chromosome 17. Genomics 1987;1:71-6.
6. Steck TL. The band 3 protein of the human red cell membrane: A review. J Supramol Struct 1978;8:311-24.
7. Kay MMB, Hughes J, Zagon I, Lin F. Brain membrane protein band 3 performs the same function as erythrocyte band 3. Proc Natl Acad Sci 1991;88:2778-82.
8. Kay MMB, Bosman G, Jonson RC, Poulin J, Goodman J. Molecular basis of human band 3 mutation associated with increased anion transport. Exp Clin Immunogenet 1994;11:209-21.
9. Wang DN, Sarabia VE, Reithmeier RAF, Kuhlbrandt W. Three dimensional map of dimeric membrana domain of the human erythrocyte anion exchanger , band 3. EMBO J 1994;13:3230-5.
10. Perlman DF, Musch MW, Goldstein L. Band 3 in cell volume regulation in fish erythrocytes. Cell Mol Biol 1996;42:975-84.
11. Popov M, Li J, Reithmeier R. Transmembrane holding of the human erythrocyte anion exchanger (AE1, band 3) determined by scanning and insertional N-glycosilation mutagenesis. Biochem J 1999;339:269-79.
12. Kay MMB. Contribution of band 3 and its genetic polymorphisms and variants to health and disease. En: Human blood cells-consequences of genetic polymorphisms and variation. King MJ, ed., London : Imperial College Press; 2000. p.193-228.
13. Kay MMB, Goodman J. Immunoregulation of cellular lifespan: Physiologic autoantibodies and their peptide antigens. Cell Mol Biol 2003;49:217-43.
14. Tanner MJA. The structure and function of band 3 (AE1): Recent developments [review]. Mol Membr Biol 1997;14:155-65.
15. -----------. Band 3 anion exchanger and its involvement in erythrocyte and kidney disorders. Curr Opin Hematol 2002;9:133-9.
16. Sterling D, Reithmeier RAF, Casey JR. A transport metabolon: functional interaction of carbonic anhydrase II and chloride/bicarbonate exchangers. J Biol Chem 2001;276:47886-94.
17. Zhang D, Kiyatkin A, Bolin JT, Low PS. Crystallographic structure and functional interpretation of the cytoplasmic domain of erythrocyte membrane band 3. Blood 2000;96:2925-33.
18. Lux SE, Palek J. Disorders of the RBC membrane. En: Handin RI, Lux SE, Stossel TP, eds. Blood: Principles and Practice of Hematology. Philadelphia: JB Lippincott; 1995. p.1701-818.
19. Michaely P, Bennett V. The ANK repeats of erythrocyte ankyrin form two distinct but cooperative binding sites for the erythrocyte anion exchanger. J Biol Chem 1995;270:22050-7.
20. Rybicki AC, Schwartz RS, Hustedt EJ, Cobb CE. Increased rotational mobility and extractability of band 3 from protein 4.2-deficient erythrocyte membranes: evidence of a role for protein 4.2 in strengthening the band 3-cytoskeleton linkage. Blood 1996;88:2745-53.
21. Chang SH, Low PS. Regulation of the glycophorin C-protein 4.1 membrane-to-skeleton bridge and evaluation of its contribution to erythrocyte membrane stability. J Biol Chem 2001;276:22223-30.
22. Khansari N, Fudenberg HH. Immune elimination of autologous senescent cells by Kupffer cells in vivo. Cell Immunol 1983;80:426-30.
23. Khansari N, Springer GF, Merler E, Fudenberg HH. Mechanism for the removal of senescent human erythrocytes from circulation: Specificity of the membrana-bound immunoglobulin . J Mech Aging Dev 1983;21:49-58.
24. Lutz HU, Flepp R, Stringaro-Wipf G. Naturally occuring autoantibodies to exoplasmic and crytic regions of band 3 protein,the major integral membrane protein of human red blood cells. J Immunol 1984;133:2160-8.
25. Kay MMB. Band 3, the predominant transmembrane polypeptide, undergoes proteolytic degradation as cells aged. Monogr Dev Biol 1984;17:245-53.
26. Gaczynska M, Rosin J, Soszynski M, Bartosz G. Proteolytic susceptibility of membrane proteins during erythrocyte aging. Mech Ageing Dev 1986;35:109-21.
27. Bartosz G, Gaczynska M, Grzelinska E, Soszynski M, Michalak W, Gondko R. Aged erythrocytes exhibit decreased anion exchange. Mech Ageing Dev 1987;39:245-50.
28. Kay MMB, Bosman GJCGM, Jhonson G, Beth A. Band 3 polymers and aggregates and hemoglobin pr ecipitates in red cell aging. Blood Cells 1988;14:275-89.
29. Bosman GJCGM,, Kay MMB. Alterations of band 3 transport protein by cellular aging and disease: Erythrocyte band 3 and glucose transporter share a functional relationship. Biochem Cell Biol 1990;68:1419-27.
30. Ferroni L, Giuliani A, Marini S, Caprari P, Salvati AM, Condo FC, et al. A new monoclonal antibody to an age sensitive band 3 transmembrane segment. Adv Exp Med Biol 1991;307:351-6.
31. Lutz HU, Pfister M, Hornig R. Tissue homeostatic role of naturally occuring anti band 3 antibodies. Cell Mol Biol 1996;42:995-1005.
32. Green GA. Autologous IgM, IgA and complement binding to sickle erythrocytes in vivo. Evidence for the existence of dense sickle cell subsets. Blood 1993;82:985-92.
33. Crandall I, Guthrie N, Sherman IW. Plasmodium falciparum: Sera of individuals living in malaria-endemic region recognize peptide motifs of the human erythrocyte anion transport protein. Am J Trop Med Hyg 1995;52:450-5.
34. Crandall I, Guthrie N, Sherman IW. Plasmodium falciparum: Naturally occurring rabbit immunoglobulins recognize human band 3 peptide motifs and malaria-infected red cells. Exp Parasitol 1996;82:45-53.
35. Janvier D, Sellami F, Missud F, Fenneteau O, Vilmer E, Cartron J, et al. Severe autoimmune hemolytic anemia caused by a warm IgA autoantibody directed against the third loop of band 3 (RBC anion-exchange protein 1). Transfusion 2002;42:1547-52.
36. Bosman G. Erythrocyte aging in sickle cell disease. Cell Mol Biol 2004;50:81-6.
37. Hebbel RP. Auto-oxidation and a membrane-associated Fenton reagent: A possible explanation for development of membrane lesions in sickle erythrocytes. Clin Haematol 1985;14:129-40.
38. Bosman GJCGM, Kay MMB. Erythrocyte aging: A comparison of model systems for simulating cellular aging in vivo. Blood Cells 1988;14:19-35.
39. Kay MMB, Bosman CJCGM, Shapiro SS, Bendich A, Bassel PS. Oxidation as a possible mechanism of cellular aging: Vitamin E deficiency causes premature aging and IgG binding to erythrocytes. Proc Natl Acad Sci USA 1986;83:2463-7.
40. Ohnishi ST, Ohnishi T, Ogunmola B. Sickle cell anemia: A nutritional approach for a molecular disease. Nutrition 2000;16:330-8.
41. Bosman GJ, Renkawek K, Van Workum FP, Bartholomeus IG, Marini S, De Grip WJ. Neuronal anion exchange proteins in Alzheimer´s disease pathology. J Neurol Transm Suppl 1998;54:248-57.
42. ------------. Involvement of neuronal anion exchange proteins in cell death. I. Alzheimer´s disease. Gerontology 1997;43:67-78.
43. Bartosz G, Sosynski M, Kredsiona J. Aging of the erythrocyte. VI. Accelerated red cell membrane aging in Down¨s syndrome. Cell Biol Int Rep 1982;6:73-7.
44. Santos-Silva A, Castro E, Teixeira N, Guerra F, Quintanilha A. Altered erythrocyte band 3 profile as a marker in patients at risk for cardiovascular disease. Atherosclerosis 1995;116:199-209.
45. Ribeiro MI, Alloisio N, Almeida H, Gomes C, Texier P, Lemos C, et al. Severe hereditary spherocytosis and distal renal tubular acidosis associated with the total absence of band 3. Blood 2000;96:1602-4.
46. Einum DD, Zhang J, Arneson PJ, Menon AG, Ptacek LJ. Genomic structure of human anion exchanger 3 and its potential role in hereditary neurological disease. Neurogenetics 1998;1:289-92.
47. Kay MMB, Goodman J, Goodman S, Lawrence C. Membrane protein band 3 alteration associated with neurologic disease and tissue reactive antibodies. Clin Exp Immunogenet 1990;7:181-99.
48. Kay MMB, Goodman J, Lawrence C, Bosman G. Membrane channel protein abnormalities and autoantibodies in neurological disease. Brain Res Bull 1990;24:105-11.
49. Sander T, Toliat MR, Heils A, Leschik G, Becker C, Ruschendorf F, et al. Association of the 867Asp variant of the human anion exchanger 3 gene with common subtypes of idiopathic generalized epilepsy. Epilepsy Res 2002;51:249-55.
50. Hassoun H, Wang Y, Vassiliadis J, Lutchman M, Palek J, Aish I, et al. Targeted inactivation of murine band 3 (AE1) gene produces a hypercoagulable state causing widespread thrombosis in vivo. Blood 1998;92:1785-92.
51. Inaba M, Yawata A, Koshino I, Sato K, Takeuchi M, Takakuwa Y, et al. Defective anion transport and marked spherocytosis with membrane instability caused by hereditary total deficiency of red cell band 3 in cattle due to a nonsense mutation. J Clin Invest 1996;97:1804-17.
Recibido: 10 de diciembre de 2005. Aprobado: 15 de diciembre de 2005
Lic. Ada Amalia Arce Hernández. Instituto de Hematología e Inmunología. Apartado 8070, Ciudad de la Habana, CP 10800, Cuba. Teléf (537) 57868, 578695, 544214. Fax (537) 442334. E-mail: ihidir@hemato.sld.cu