Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.23 n.1 Ciudad de la Habana ene.-abr. 2007
Instituto de Hematología e Inmunología
Purificación de la proteína banda 3 de eritrocitos humanos (AE 1)
Lic. Ada Amalia Arce Hernández, DrC. Rinaldo Villaescusa Blanco y Lic. Julio César Merlín Linares
Resumen
Se purifica la proteína banda 3 a partir de membranas de eritrocitos humanos con rapidez y eficiencia, mediante una combinación de cromatografía de intercambio iónico en DEAE-celulosa y de afinidad mediante el empleo de una columna pCMB-Sepharose. La obtención de banda 3 permitirá investigar su posible participación en los fenómenos oclusivos en la drepanocitosis.
Palabras clave: banda 3, cromatografía, DEAE-celulosa, drepanocitosis, membrana de eritrocitos humanos, pCMB-Sepharose 4B.
La proteína banda 3 se define como un grupo de intercambiadores aniónicos (AE 0-3), que están presentes en la membrana de todas las células y organelos celulares, 1-4 Esta proteína fue identificada por primera vez en eritrocitos humanos donde se designó como banda 3 por ser la tercera banda que aparecía a partir de la parte superior de una corrida en la electroforesis en gel de poliacrilamida. Están implicados en diversas actividades fisiológicas, como son: el mantenimiento del equilibrio osmótico y volumen celular; intercambio HCO3 - / Cl - ; unión de IgG y la remoción celular y en el mantenimiento de la integridad estructural de la célula.5-12
El intercambiador aniónico banda 3 (AE 1) es la proteína integral principal de la membrana del eritrocito humano; tiene un peso molecular aproximado de 95 kDa, constituido por 911 aminoácidos y presenta alrededor de 1,2 X 106 copias por célula. Esta proteína multifuncional tiene 3 dominios: un dominio de membrana transversal donde ocurre el intercambio cloruro/ bicarbonato; un dominio citoplasmático corto C-terminal; y un dominio citoplasmático largo N-terminal.13,14 La banda 3 constituye el elemento central de un macrocomplejo de proteínas integrales y periféricas en la membrana del eritrocito.
Diversas investigaciones relacionadas con las crisis vasooclusivas en la drepanocitosis han permitido acumular información acerca de las moléculas de adhesión, tanto en eritrocitos SS como en el endotelio vascular, así como factores plasmáticos que participan en este fenómeno de oclusión.15-17 En la actualidad se trabaja en el posible papel de la proteína banda 3.
Bajo ciertas condiciones, la proteína banda 3 se agrega en la superficie del eritrocito, lo que trae como consecuencia 2 cambios significativos: primero, estas células adquieren naturaleza adhesiva, y segundo, los agregados de banda 3 son reconocidos por el sistema inmune, todo lo cual señala su posible participación tanto en la etiología como en la solución de las crisis vasooclusivas en la drepanocitosis.18,19 La obtención de la proteína banda 3 purificada permitiría profundizar en el fenómeno oclusivo.
En este trabajo se introduce un método rápido y eficiente para la purificación de la proteína banda 3 a partir de eritrocitos humanos.
Métodos
Obtención de membranas de eritrocitos humanos.
Sangre total (A Rh+) depletada de leucocitos, proveniente del banco de sangre, se centrifugó a 500g, 10 min. El precipitado se resuspendió en PBS-glucosa (10 mM NaKHPO 4, 150 mM NaCl, 1 g/L D-glucosa, pH 7,4) suplementado con 1 mM diisopropilfluorofosfato (DFP), incubándose 5 min a 4 0 C. Se centrifugó la suspensión de eritrocitos y el precipitado se lavó 3x con buffer fosfato-salino, pH 7,4; posteriormente se lisaron los hematíes con buffer de hemólisis frío (5 mM NaKHPO 4, 1 mM EDTA, pH 7,4). El lisado se centrifugó a 23 000g por 20 min y se eliminó el sobrenadante. Se resuspendieron las membranas y se lavaron 3x con el buffer de hemólisis, el que en su primer lavado se suplementó con 0,5 mM DFP. Las membranas de eritrocitos se conservaron en alícuotas a -70 0 C.
Purificación de la proteína banda 3.
Se purificó la proteína banda 3 a partir de extracto de las membranas de eritrocitos mediante cromatografía de intercambio aniónico y cromatografía de afinidad.20
Las membranas se suspendieron en 6 volúmenes de PBS, y se incubaron 20 min en baño de hielo. Las membranas se centrifugaron a 23 000g, 20 min y se eliminó el sobrenadante. El precipitado se lavó 1x con PBS, posteriormente se resuspendió en 5 volúmenes de buffer de baja fuerza iónica (36 mM NaKHPO 4 , 0,5 % Triton X-100, pH 7,5) manteniéndolo a 4 0 C durante la noche bajo atmósfera de nitrógeno. La mezcla se centrifugó a 23 000g, 20 min y el sobrenadante se filtró a través de lana de vidrio.
Cromatografía de intercambio aniónico.
El extracto de membranas de eritrocitos filtrado se aplicó a una columna de DEAE-celulosa (2,5 x 10 cm) equilibrada con 3 volúmenes de buffer de baja fuerza iónica, con una velocidad de flujo de 38 mL/h. Posteriormente la columna se lavó con 3 volúmenes de buffer de baja fuerza iónica. La proteína unida se eluyó con buffer de alta fuerza iónica (150 mM NaKHPO 4, 150 mM NaCl, 0,5 % Triton X-100, pH 7,5). 20 Se seleccionaron las fracciones de la 19 a la 70.
Cromatografía de afinidad.
La muestra obtenida de la cromatografía en DEAE-celulosa se aplicó rápidamente a una columna de 2,5 x 8 cm de [[p-(chloro-mercuri)benzamido] ethyl] -Sepharose 4B a una velocidad de flujo de 23 mL/h. 20 La columna se lavó con 3 volúmenes de buffer de alta fuerza iónica y a continuación con 3 volúmenes de buffer de baja fuerza iónica. La banda 3 fue eluida con un gradiente continuo de L-cisteína 0,5, 1, 3, y 5 mM en buffer de baja fuerza iónica. La proteína eluida se colectó en tubos conteniendo b -mercaptoetanol para lograr una concentración final de 15 mM. Una mezcla de la proteína banda 3 pura se obtuvo de las fracciones de la 26 a la 38, que eluyeron con la cisteína 0,5 y 1 mM. La mezcla de proteína banda 3 se dializó contra 20 M NaKHPO 4 (pH 7,4), 0,04 % Tritón X-100. La banda 3 se concentró a través de un filtro de Amicon YM 30 a 1 mg/mL y conservada en alícuotas a –70 0 C.
El control de pureza de las muestras obtenidas se realizó mediante una electroforesis en gel de poliacrilamida, SDS-PAGE.21 La concentración de la proteína banda 3 pura se determinó por el método de Lowry utilizando BSA como estándar.22
Resultados
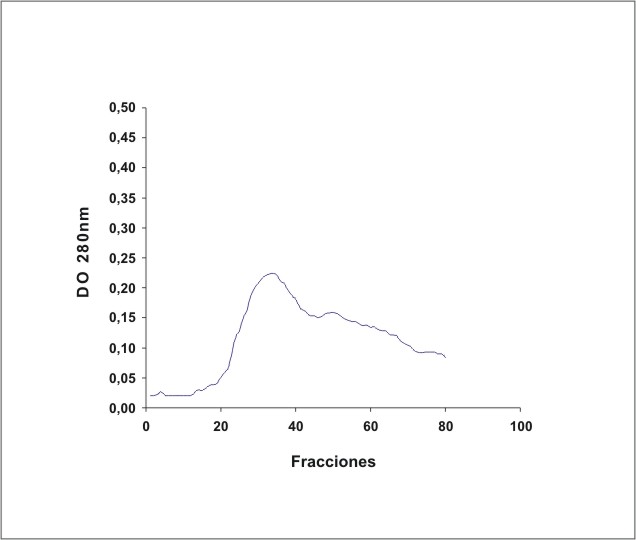
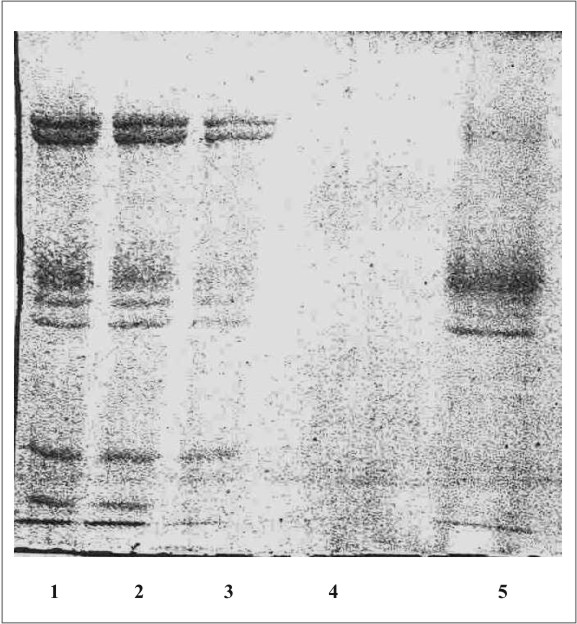
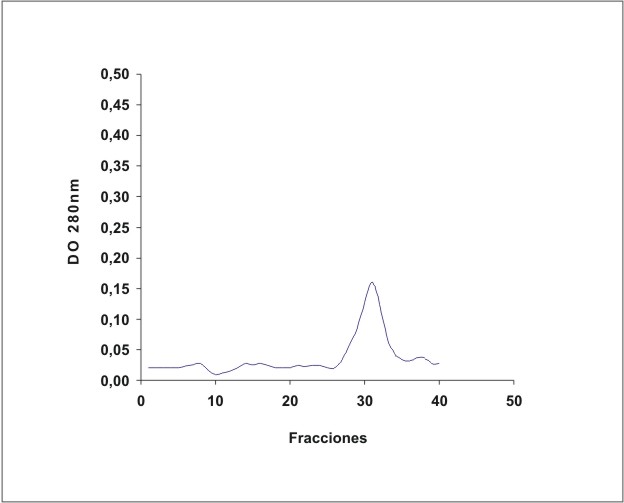
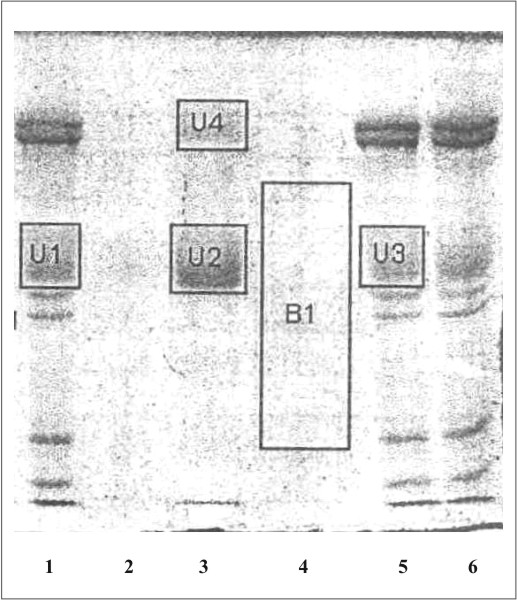
La figura 1 muestra el cromatograma del fraccionamiento en DEAE-celulosa del extracto de membrana de eritrocitos. En la figura 2 se observa el resultado de la electroforesis en gel de poliacrilamida de las fracciones de la 19 a la 70 que se obtuvieron en el fraccionamiento en DEAE-celulosa. La figura 3 muestra el fraccionamiento de la cromatografia de afinidad en p-CMB-Sepharose 4-B. La pureza de la banda 3 obtenida se observa en la electroforesis en gel de poliacrilamida (fig. 4). La concentración final fue de 0,568 mg banda 3/mL.
Fig. 1. Fraccionamiento del extracto de membrana de eritrocitos en DEAE-celulosa.
Fig. 2. Electroforesis en gel de poliacrilamida (SDS-PAGE).
1,2: mezcla de proteínas de la membrana de eritrocitos hemolizados; 3: mezcla de proteínas de la membrana extraídas con Triton X-100; 4: proteínas en el lavado inicial de la columna de DEAE-celulosa; 5: proteínas eluÍdas de la columna de DEAE-celulosa.
Fig. 3. Cromatografía de afinidad en p-CMB-Sepharose 4B.
Fig. 4. Electroforesis en gel de poliacrilamida (SDS-PAGE).
1, 5 ,6: mezcla de proteínas de la membrana de eritrocitos hemolisados; 2: proteínas en el lavado inicial de la columna de pCMB-Sepharosa 4B; 3: proteína de banda 3 eluidas de la columna de pCMB-Sepharosa 4B; 4: proteínas en el lavado final de la columna de pCMB-Sepharosa 4B.
Discusión
Diversos métodos se han empleado para la purificación de la proteína banda 3 a partir de membrana de eritrocitos humanos; en estudios de reconstitución se purificó en una columna de afinidad con concanavalina A con una pureza mayor del 90 %, siendo común la contaminación con glicoforina y banda 4.2.23 Kahlenberg 24,25 obtuvo banda 3 con un 95 % de pureza mediante cromatografía en una columna tiol activado-Sepharose 4B; sin embargo, las membranas se trataron con anhídrido dimetilmaleico previo a la extracción con Tritón produciendo la inhibición de su actividad en lo referente a la permeabilidad aniónica.
En nuestro trabajo, la proteína banda 3 se purificó a partir de membranas de eritrocitos humanos que inicialmente se lavaron con solución salina y posteriormente se realizó la extracción incubando durante la noche con Tritón al 0,5 %. El extracto se concentró y se aplicó a una columna de DEAE-celulosa para eliminar las proteínas de bajo peso molecular; a continuación se empleó un buffer de elevada fuerza iónica para eluIr la fracción que contiene fundamentalmente banda 3. Esta fracción parcialmente pura de banda 3 se aplicó a una columna de afinidad de p-CMB-Sepharose 4B eluyendo glicoforina y banda 4.2; se ha demostrado que el p-CMB posee un sitio de unión específico a la banda 3 a través de un enlace sulfidrilo el cual puede ser revertido con cisteína.26 La columna se lavó con el mismo buffer de alta fuerza iónica con que se aplicó la muestra y con buffer de baja fuerza iónica previo a que la proteína banda 3 pura se eluyera con cisteína 0,1 mM. Luego de eluida la banda 3 se le añadió b -mercaptoetanol 15 mM para evitar su agregación.
Consideramos que el método anterior posibilita la obtención de la proteína banda 3 con rapidez, eficiencia y un aceptable nivel de pureza, lo que permitirá, en estudios posteriores, establecer su posible participación en los fenómenos oclusivos en la drepanocitosis.
Summary
Purification of band 3 protein from human erythrocytes (AE 1)
The band 3 protein is purified starting form the membranes of human erythrocytes with celerity and efficiency by a combination of DEAE-cellulose ion-exchange and affinity chromatography by using a pCMB-Sepharose column. The obtention of band 3 will allow to investigate its possible participation in the occlusive phenomena in drepanocytosis.
Key words: band 3, chromatography, DEAE-cellulose, drepanocytosis, human erythrocyte membrane, pCMB-Sepharose 4B.
Referencias bibliográficas
1. Havenga MJ, Bosman GJ, Appelhans H, de Grip WJ. Expression of the anion exchanger (AE) gene family in human brain. Identification of a new AE protein: AEO. Mol Brain Res 1994;25:97-104.
2. Kay MMB, Tracey CM, Goodman JR, Cone JC, Bassel PS. Polypeptides immunologically related to erythrocyte band 3 are present in nucleated somatic cells. Proc Natl Acad Sci USA 1983;80:6882-6.
3. Rutes S, Lindsey AE, Ward CL, Kopito RR. Functional activation of plasma membrane anion exchangers occurs in a pre-Golgi compartment. Cell Biol 1993;121:37-48.
4. Yannoukakos D, Stuart-Tilley A, Fernandez HA, Fey P, Duyk G, Alper SL. Molecular cloning, expression, and chromosomal localization of two isoforms of the AE3 anion exchanger from human heart. Circ Res 1994;75:603-14.
5. Steck TL. The band 3 protein of the human red cell membrane: A review. J Supramol Struct 1978;8:311-24.
6. Kay MMB, Hughes J, Zagon I, Lin F. Brain membrane protein band 3 performs the same function as erythrocyte band 3. Proc Natl Acad Sci 1991;88:2778-82.
7. Kay MMB, Bosman G, Jonson RC, Poulin J, Goodman J. Molecular basis of human band 3 mutation associated with increased anion transport. Exp Clin Immunogenet 1994;11:209-21.
8. Wang DN, Sarabia VE, Reithmeier RAF, Kuhlbrandt W. Three dimensional map of dimeric membrana domain of the human erythrocyte anion exchanger, band 3. EMBO J 1994;13:3230-5.
9. Perlman DF, Musch MW, Goldstein L. Band 3 in cell volume regulation in fish erythrocytes. Cell Mol Biol 1996;42:975-84.
10. Popov M, Li J, Reithmeier R. Transmembrane holding of the human erythrocyte anion exchanger (AE1, band 3) determined by scanning and insertional N-glycosilation mutagenesis. Biochem J 1999;339:269-79.
11. Kay MMB. Contribution of band 3 and its genetic polymorphisms and variants to health and disease. En: King MJ (ed). Human Blood Cells-Consequences of Genetic Polymorphisms and Variation. London : Imperial College Press; 2000. p.193-228.
12. Kay MMB, Goodman J. Immunoregulation of cellular lifespan: Physiologic autoantibodies and their peptide antigens. Cell Mol Biol 2003;49:217-43.
13. Tanner MJA. The structure and function of band 3 (AE1): Recent developments [review]. Mol Membr Biol 1997;14:155-65.
14. __________. Band 3 anion exchanger and its involvement in erythrocyte and kidney disorders. Curr Opin Hematol 2002;9:133-9.
15. Harlan JM. Introduction: Anti-adhesion therapy in sickle cell disease. Blood 2000;95:365-7.
16. Ortiz A, Hugh-Davies TH, Hebbel RP, Solovey A. Circulating endothelial cells in sickle cell anemia. N Engl J Med 1998;338:1162-3.
17. Platt OS. Sickle cell anemia as an inflammatory disease. J Clin Invest 2000;106:337-8.
18. Kay MMB. Band 3, the predominant transmembrane polypeptide, undergoes proteolytic degradation as cells aged. Monogr Dev Biol 1984;17:245-53.
19. Gaczynska M, Rosin J, Soszynski M, Bartosz G. Proteolytic susceptibility of membrane proteins during erythrocyte aging. Mech Ageing Dev 1986;35:109-21.
20. Lukacovic MF, Verkman AS, Dix JA, Solomon AK. Specific interaction of the water transport inhibitor, pCMBS, with band 3 in red blood cell membranes. Biochim Biophys Acta 1984;778:253-9.
21. Fasler S, Skvaril F, Lutz HU. Electrophoretic properties of human IgG and its subclasses on sodium dodecyl-sulfate-polyacrylamide gel electrophoresis and immunoblots. Anal Biochem 1988;174:593-600.
22. Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. Protein measurement with the Folin phenol reagent. J Biol Chem 1951;193:265-75.
23. Roos AH, Mc Connell HM. Reconstitution of band 3, the erythrocyte anion Exchange protein. Biochem Biophys Res Commun 1977;74:1318-25.
24. Kahlenberg A. Preparative isolation of band 3, the predominant polypeptides of the human erythrocyte membrane. Anal Biochem 1976;2:337-42.
25. __________. Partial purification of a membraneprotein from human erythrocyte involved in glucose transport. J Biol Chem 1976;251:1582-90.
26. Lukacovic MF, Verkman AS, Dix JA, Solomon AK. Specific interaction of the water transport inhibitor, pCMBS, with band 3 in red blood cell membranes. Biochem Biophys Acta 1984;778:253-9.
Recibido: 22 de diciembre del 2006. Aprobado: 15 de enero del 2007.
Lic. Ada Amalia Arce Hernández . Instituto de Hematología e Inmunología. Apartado Postal 8070, Ciudad de La Habana, CP 10800, Cuba. Tel (537) 6438268, 6438695, 6434214, Fax (537) 442334. e -mail: ihidir@hemato.sld.cu