Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.24 n.1 Ciudad de la Habana ene.-abr. 2008
ARTÍCULOS DE REVISIÓN
Transmisión de infecciones bacterianas y parasitarias por transfusiones de sangre y sus componentes
Transmission of bacterial and parasitic infections by blood transfusions and their components
DrC. René A. Rivero Jiménez
RESUMEN
Aunque las infecciones causadas por agentes virales tienen una gran significación entre las infecciones transmitidas por transfusión (ITT), no se puede desconocer el peligro que representan las bacterias y algunos protozoos. Se ofrecen datos sobre la trascendencia de la transmisión por Treponema pallidum, causante de la sífilis y sobre otras bacterias que pueden contaminar las bolsas de sangre o de componentes, en particular los concentrados de plaquetas, y se hace hincapié en la importancia de las medidas higiénico-sanitarias en los centros de colecta de sangre, sean fijos o móviles. Además, se mencionan los principales parásitos, como el Trypanosomas cruzi, causante de la tripanosomiasis americana o enfermedad de Chagas, y el género Plasmodium causantes de la malaria, responsables del mayor número de ITT en la América Latina, y que se consideran enfermedades infecciosas exóticas para Cuba, lo que nos obliga a adoptar medidas epidemiológicas para mantener la seguridad de la sangre que se transfunde en el país.
Palabras clave: transfusión, VDRL, sífilis, infecciones, malaria, Chagas.
ABSTRACT
Although the infections caused by viral agents are very important among the transfusion-borne diseases, the danger represented by bacteria and some protozoa cannot be ignored. Data on the transcendence of the transmission by Treponema pallidum, causative of syphilis, and on some other bacteria that may contaminate the blood bags or their components, particularly the platelet concentrates, are given. Emphasis is made on the importance of the hygienic and sanitary measures that should be taken in the fixed or mobile blood collection centres. Moreover, the main parasites such as Tripanosomas cruzi, causing American tripasonomiasis or Chagas' disease, and the genus Plasmodium producing malaria, which are responsible for the highest number of transfusion-borne infections in Latin America, are mentioned. These infectious diseases that are exotic for Cuba make us adopt epidemiological measures to maintain the safety of the blood that is transfused in the country.
Key words: Transfusion, VDRL, syphilis, infections, malaria, Chagas.
INTRODUCCIÓN
Según estudios internacionales, la seguridad en el suministro de sangre ocupa el 50 % del gasto que un sistema de salud debe emplear para mantener un programa de sangre, tomando en cuenta los costos del proceso de selección de los donantes, la donación propiamente dicha, las pruebas de pesquisaje y confirmación a que se someten todas las unidades de sangre colectadas, así como el procesamiento correcto y aséptico de las donaciones y los gastos debidos a la calificación del personal necesario para hacer funcionar el programa.1
Muchas medidas que se toman para garantizar la seguridad de la sangre son consideradas altamente inefectivas por su fácil vulnerabilidad, por ejemplo, la selección de donantes; o muy efectivas pero extremadamente costosas, y por lo tanto, con un bajo valor costo-beneficio, como la aplicación de las técnicas moleculares o de ácidos nucleicos (NAT) en el pesquisaje de donantes.1
La aparición de enfermedades emergentes transmitidas por animales salvajes o criados en granjas, o por vectores como mosquitos, garrapatas, chinchas, y otros, se ha convertido en un problema internacional debido a la globalización de la economía mundial y a las migraciones de poblaciones de unas regiones más desfavorecidas a otras. Como resultado de estos fenómenos, la seguridad de la sangre se ha convertido en un reto global que requiere de la cooperación concertada entre países desarrollados y en vías de desarrollo.
La transfusión de sangre se considera un sostén fundamental para muchos procederes clínico-quirúrgicos y por ende, la seguridad de la sangre se ha elevado con la aplicación de tecnologías muy modernas, siendo hoy más segura que nunca. Sin embargo, el riesgo para un receptor de adquirir una infección transmitida por transfusión (ITT) todavía existe y es un problema de salud.1
TRANSMISIÓN DE INFECCIONES BACTERIANAS POR VÍA TRANSFUSIONAL
Dada la impresionante reducción que han tenido las infecciones virales transmitidas por las transfusiones, las infecciones bacterianas han pasado a ocupar uno de los factores de riesgo más importantes. Las fuentes de contaminación bacterianas se derivan del brazo del donante; la bacteriemia en el donante, equipos de colecta contaminados y la contaminación que se adquiere durante el procesamiento y el almacenamiento de la sangre o de los hemoderivados.2
La sífilis
Su agente etiológico es el Treponema pallidum, es una espiroqueta que se distingue fácilmente de otros microorganismos, tanto por su morfología como por su manera de desplazarse. Se trata de células alargadas en forma de espiral que se desplazan por rotación alrededor de su eje y fue la primera enfermedad descrita como transmisible por vía transfusional. Las pruebas serológicas se han realizado habitualmente en donantes de sangre por más de 50 años.3 En la actualidad, la transmisión de sífilis por esta vía es excepcional y no se han publicado casos desde 1969.3-5 Este hecho se debe a varios factores, que incluyen la mejoría en la selección de los donantes, la aplicación uniforme de ensayos serológicos y la refrigeración de los componentes, lo que ocasiona la muerte del microorganismo dentro de las primeras 72 horas.3 No obstante, el almacenamiento de las plaquetas a temperatura ambiente presenta un entorno más favorable para la sobrevida y crecimiento del T. pallidum.
En 1995, el Instituto Nacional de la Salud de los EE.UU. (NIH) llegó a la conclusión de mantener el pesquisaje de donantes para sífilis, principalmente por la capacidad potencial de las pruebas de servir como marcador alternativo de otras infecciones, especialmente de la causada por el virus de la inmunodeficiencia humana (VIH).6 Se demostró que en poblaciones de riesgo, como pacientes tratados por enfermedades de transmisión sexual, la prevalencia de sífilis era mayor que en la población control.7 Lo mismo ocurre con drogadictos por vía endovenosa y homosexuales y también en donantes de sangre con marcadores para VIH o virus de la hepatitis B (VHB). A pesar de esto, existen estudios consistentes que indican que los ensayos para sífilis tendrían muy poco valor como marcador alternativo, ya que identificarían menos de una donación en período de ventana para VIH, y el valor predictivo para infecciones por VHB, virus de la hepatitis C (VHC) y virus linfotrópico para la célula T humana (HTLV), sería también muy bajo.3 La utilización en la actualidad de técnicas moleculares para la detección de ácidos nucleicos (NAT), disminuye aún más el valor de esta prueba como alternativa.
Por lo tanto, en poblaciones de donantes de baja prevalencia para VIH, VHB y VHC, es difícil de justificar el valor alternativo de una prueba para sífilis, mientras que en poblaciones de mayor prevalencia la realización de este pesquisaje estaría justificada; como la prevalencia de esta enfermedad también es mayor en estas poblaciones, el valor del pesquisaje para prevenir la transmisión de la enfermedad por vía transfusional sería más evidente y, además, ventajoso para la salud pública, aunque en un estudio piloto preliminar, no se pudo detectar ADN de T. pallidum en 100 muestras de donantes con serología positiva para sífilis.8
Pruebas serológicas para sífilis
Para el diagnóstico serológico de la sífilis se utilizan tanto pruebas no treponémicas como treponémicas. Estas pruebas se diferencian en los antígenos utilizados y en el tipo de anticuerpo que se determina.9-11
Pruebas no treponémicas: determinan anticuerpos reagínicos que se detectan con un antígeno cardiolipina-lecitina altamente purificado. A pesar de que las pruebas no treponémicas son relativamente específicas, no son exclusivas para la sífilis.10
Las pruebas no treponémicas que se usan en la actualidad se dividen en 2 grupos, según la forma en que se detecten los complejos antígenos-anticuerpos; existen pruebas no treponémicas de fijación del complemento y pruebas no treponémicas de floculación. Estas últimas resultan más fáciles de realizar y se usan más cada día en los EE.UU. y en otras partes del mundo, 11 entre ellas la del Venereal Disease Research Laboratory (VDRL) y las pruebas de reaginas rápidas o Rapid plasma reagin (RPR).
La prueba serológica no treponémica más utilizada es la VDRL. Se trata de una prueba bien controlada, fácil de realizar y que se puede cuantificar con exactitud. Es una técnica que utiliza el antígeno de cardiolipina para detectar anticuerpos anti-treponémicos inespecíficos producidos por el individuo ante una infección sifilítica. Se practica normalmente en lámina de cristal, en la que se mezcla el suero del paciente (previamente calentado para inactivar el complemento), con una suspensión fresca de antígeno de cardiolipina; esta mezcla se agita de forma rotatoria y al cabo de pocos minutos se puede observar la floculación utilizando un microscopio de bajo aumento; sus resultados se pueden expresar tanto cualitativa como cuantitativamente, como positivos o reactivos, débil reactivo y negativas o no reactivas.12-14
Las pruebas de RPR se desarrollaron para detectar la enfermedad en estudios de campo. En general, las pruebas denominadas Plasma Crit Test (PCT), Unheated rerum reagin (USR), Tear-drop-card (pruebas en tarjetas) son las más sensibles, pero las menos específicas. Siempre que una prueba de reagina rápida resulte positiva, se debe confirmar mediante una prueba más específica como la VDRL.10,15,16 Las pruebas en tarjetas denominadas Circle card y Automated reagin test (ART) son cada vez más aceptadas. Estos, en realidad, no son métodos selectivos, sino diagnósticos, se pueden llevar a cabo de forma cualitativa y cuantitativa; sin embargo, no existe correspondencia directa entre los títulos obtenidos con la prueba RPR Circle card, ART y VDRL. Además, los cambios en los títulos obtenidos con la RPR Circle card y con la ARP no se han podido relacionar con el tratamiento, las recaídas o las reinfecciones.11
Pruebas treponémicas: el antígeno es el T. pallidum, su finalidad es la de detectar anticuerpos antitreponémicos específicos que generalmente aparecen en infecciones provocadas por treponemas como en la sífilis, frambesia, bejel o sífilis endémica y la pinta. Debido a su mayor especificidad, estas pruebas solo se utilizan para confirmar los datos obtenidos en las pruebas no treponémicas. Son técnicamente complejas y costosas en relación con las no treponémicas. Entre ellas están las pruebas de inmovilización del treponema (TPI), muy específicas pero costosa y difícil de estandarizar, que requiere de microorganismos vivos. No es tan sensible como el método de anticuerpos fluorescentes, y en la actualidad, su empleo se limita a casos especiales.10,15,16 La Fluorescent-Treponemal antibody absorbed (FTA-ABS) es una modificación que se emplea con sueros de prueba previamente absorbidos para eliminar anticuerpos de grupo, y así se hace relativamente más específica. La FTA-ABS es compleja, lleva tiempo y no se recomienda para estudios amplios, sino para la confirmación de pruebas no treponémicas positivas y para el diagnóstico de estadios tardíos de la sífilis en los cuales las pruebas no treponémicas dan resultados falsos negativos. Esta prueba es específica y sensible,17 pero usualmente permanece positiva después del tratamiento. 18 La FTA-ABS IgM se utiliza para el monitoreo de enfermedades activas, pues la IgM no puede atravesar la placenta intacta, y la presencia de IgM fetal antitreponémica indicaría la existencia de una infección sifilítica activa en el recién nacido.19 No obstante, esta prueba puede resultar no confiable si se encuentran presentes anticuerpos IgG bloqueadores o un factor reumatoideo como puede ocurrir en niños infectados de forma congénita.19 Se probó que se puede reducir este problema, con la introducción de una columna de 19s del suero para eliminar la IgG y el factor reumatoideo, así la FTA-ABS19 IgM y la IgM capturada por ELISA se han convertido en las pruebas disponibles para este uso.20-22
Entre las pruebas de hemaglutinación para la detección de anticuerpos se emplea la Treponema pallidum haemagglutination assay (TPHA). En este caso, la presencia de anticuerpos se pone de manifiesto mediante macrohemaglutinación de T. pallidum. Entre las modificaciones posteriores está la prueba automatizada y cualitativa de hemaglutinación, es decir, la Automated microagglutination Treponemal pallidum (AMHA-TP). Este último método se puede usar también de forma manual cualitativa y cuantitativa, y recibe el nombre de MHA-TP. Las pruebas de hemaglutinación treponémica son menos caras y más sencillas que otras pruebas treponémicas,11 y se pueden efectuar en un elevado número de muestras gracias a su automatización. Estas son menos sensibles que las FTA-ABS en la sífilis primaria, pero en los demás períodos resultan más sensibles que dicha prueba.
La Enzyme-linked inmunosorbent assay (ELISA) es una prueba rápida, se compara su sensibilidad con la FTA-ABS y se usan anticuerpos monoclonales de ratón contra el treponema9,23 y la especificidad molecular de los anticuerpos a los antígenos de T. pallidum se pueden luego examinar por inmunoblot y radioinmunoprecipitación.24-26
El uso de la reacción en cadena de la polimerasa (PCR) para detectar el genoma del T. pallidum y por tanto, la presencia del microorganismo también es útil, especialmente en investigaciones.
MANEJO DE LOS RESULTADOS DE LA VDRL EN EL BANCO DE SANGRE
El diagnóstico positivo de la sífilis se basa en 3 pilares: los elementos clínicos, las investigaciones de laboratorio y los antecedentes epidemiológicos. No se puede confiar en el resultado de una prueba serológica como la VDRL para un diagnóstico definitivo de sífilis, ya que pueden existir pacientes sifilíticos con hallazgos serológicos no reactivos e individuos sin sífilis con hallazgos serológicos reactivos.12 Es necesario tener presente que la reactividad para la VDRL se debe utilizar como parámetro altamente sugestivo de sífilis, pero nunca como sinónimo de esta, por lo que la donación se desecha pero la conducta con el donante que tuvo un resultado reactivo debe ser muy prudente. 27-29 El resultado de la VDRL se debe evaluar adecuadamente en combinación con un conocimiento histórico, epidemiológico y clínico del donante.14,30-32
Además de en las treponematosis, la reactividad en la prueba de la VDRL se puede encontrar en casos de fiebre recurrente, leptospirosis, enfermedad de Lyme y otras borreliosis, y se considera que estas enfermedades provocan una reacción serológica reactiva verdadera.12,33 Pero también se puede encontrar una VDRL reactiva en enfermedades por micobacterias, como la tuberculosis y la lepra; en otras enfermedades producidas por bacterias, como las neumonías neumocócicas, endocarditis infecciosa, chancro blando y escarlatina; 30,31 en enfermedades virales como la mononucleosis infecciosa, neumonías virales, sarampión, varicela, hepatitis infecciosa, vaccinia;30-33 en enfermedades por Clamidias, como el linfo-granuloma venéreo;29,30 en enfermedades parasitarias, como el paludismo y tripanosomiasis; 29,30,32 en enfermedades por disregulación del sistema inmune, como en las anemias hemolíticas autoinmunes, enfermedades del colágeno, síndrome antifosfolipídico primario y otras, 12,14,28,33 y situaciones especiales, como en las inmunizaciones (posvacunación) y el embarazo.12,14
Pero además, existen otras posibilidades de reactividad del VDRL, por ejemplo, el falso reactor biológico, que es un individuo sano, con un nivel de anticuerpos contra la cardiolipina capaz de alterar el examen de VDRL, 28,29 y por errores de laboratorio provocados por cambio de muestra, cristalería sucia, poco adiestramiento del personal, temperatura inapropiada del laboratorio, no conservación correcta de los reactivos, preparación incorrecta de la emulsión del antígeno VDRL, no uso de sueros humanos controles con reactividades conocidas, empleo de muestras no transparentes, lipémicas o contaminadas, así como dificultades en la lectura de este ensayo.12,34
Por otra parte, un donante con sífilis podría tener una prueba serológica no reactiva durante el período de incubación de la enfermedad y hasta 15 días después de la aparición del chancro sifilítico, pues no se han producido aún anticuerpos por el paciente,30-32 y cuando este tiene títulos muy altos de anticuerpos anticardiolipina (1 ó 2 % de los pacientes con sífilis) y se observa una reacción prozónica o fenómeno de turbidez. En estos casos, no se produce floculación, a menos que se diluya el suero.12,13,29
Cuando al médico de la familia, a través del sistema de epidemiología, le llega la información procedente del banco de sangre de que uno de sus pacientes que actuó como donante de sangre tuvo una VDRL reactiva, debe indicar la prueba de VDRL a la o las parejas sexuales del donante y lo interconsultará con el dermatólogo que atiende el área de salud. 30 Se considera de vital importancia que el propio médico de familia participe en la interconsulta con el dermatólogo, pues podría conocer el estilo de vida de su paciente y contar con los elementos epidemiológicos necesarios para concluir un diagnóstico de sífilis.13
Por todo lo explicado, los falsos positivos son relativamente frecuentes en la prueba de VDRL. En un estudio realizado en Cuba donde se recolectaron 157 muestras de sueros de individuos con serologías VDRL reactivas remitidas desde diferentes laboratorios de servicios asistenciales, se efectuó la confirmación por métodos treponémicos y se aplicó la prueba comercial de hemaglutinación de T. pallidum (HATP) [SYPHILIS TPHA liquid, Human GmbH, Wiesbaden, Alemania] y se confirmó la presencia de sífilis adquirida en el 29,9 % de los individuos (47/157), al presentar resultados positivos por VDRL y HATP; mientras que el 70,1 % restante (110/157) resultó ser falsos positivos por VDRL, al ser negativos por la HATP.34 Como son diversas las causas que pueden ocasionar un resultado falso positivo por VDRL, los falsos positivos biológicos se clasifican en agudos y crónicos.35,36
El antígeno VDRL (Quimefa, La Habana) empleado en la red de laboratorios del sistema nacional de salud en Cuba, se evaluó en diferentes ocasiones y mostró parámetros cualitativos aceptables, con valores de sensibilidad global y especificidad por encima de 80 y 90 %, respectivamente. En una de las evaluaciones se detectó para este antígeno 0,2 % de resultados falsos positivos, encontrando negativas por HATP el 25 % de las serologías VDRL reactivas en el grupo de individuos "supuestamente negativos a sífilis". En otra de las evaluaciones realizadas en un grupo similar de individuos se demostró el 6,2 % de resultados falsos positivos, siendo negativas por la HATP el 100 % de las muestras VDRL reactivas.
Los falsos positivos biológicos en ambas evaluaciones estuvieron dados fundamentalmente por los pacientes con leptospirosis, mononucleosis infecciosa, hepatitis, tuberculosis, diabetes mellitus y fiebre reumática, así como por embarazadas y ancianos, grupos en los que es frecuente este fenómeno (Restoy GA. Diagnóstico microbiológico en pacientes con sífilis. Estudio cualitativo de dos métodos serológicos con antígenos de producción nacional. Tesis de Especialidad. Ciudad de La Habana: Instituto Pedro Kourí;1993) (Álvarez EL. Validación del sistema microELISA anti-TmpA, novedoso método para el diagnóstico de la sífilis. Tesis de Maestría. Ciudad de La Habana: Instituto Pedro Kourí;1998).
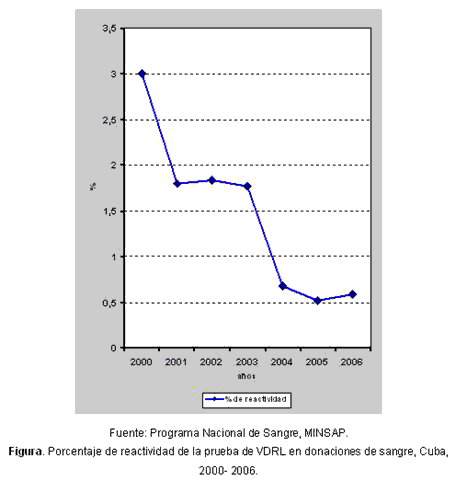
En Cuba, la serología para sífilis se realiza en los bancos de sangre mediante la prueba no treponémica VDRL y en la actualidad se ensaya una nueva prueba del tipo RPR. Los resultados de la determinación en las donaciones de sangre desde el año 2000 al 2006, se muestran en la tabla y la figura.
Brucelosis
Es una enfermedad causada por el género Brucella: son coco bacilos gramnegativos, intracelulares, inmóviles, no esporulados, y parásitos obligados de animales y hombres. La brucelosis es una zoonosis distribuida mundialmente.37 Las especies más comunes son B. abortus, B. melitensis, B. ovis, etc. En algunos países, se considera como un agente con riesgo de transmisión por vía transfusional, pero solo hay un trabajo en la literatura publicado en 1976 que menciona esta probabilidad. 38 Por ejemplo, en Argentina, la prevalencia general en donantes de sangre se estimó en 0,94 % en el período 1987-1992.39 Más recientemente, en un banco de sangre de la ciudad de Buenos Aires, se observó una prevalencia del 0,46-0,60%. 40 Un resultado reactivo puede significar infección antigua recuperada o activa, o presencia de anticuerpos dirigidos contra otros microorganismos que pueden producir una reacción cruzada. En Cuba no hay evidencias de transmisión transfusional de esta bacteria.
CONTAMINACIÓN BACTERIANA DE COMPONENTES SANGUÍNEOS
Las reacciones sépticas originadas por la presencia de bacterias en los componentes sanguíneos, constituyen un aspecto importante en la seguridad transfusional. Están implicados una gran variedad de microorganismos, lo que da lugar a una importante mortalidad.41 Estas reacciones fueron ubicadas como la tercera causa de muerte por transfusiones reportadas por la FDA desde 1976 a 1985 en los EE.UU.42 Posteriormente, de 1996 a 1991, 29 de 182 (16 %) de las muertes asociadas con transfusiones y reportadas a la FDA, fueron causadas por productos contaminados por bacterias. 43 En Francia, entre 1994 y 1999, la transmisión bacteriana fue la causa del 22 % de las muertes debidas a transfusiones,44 lo que, según el Sistema Francés de Hemovigilancia, es la primera causa de muerte por transfusión, 45 mientras que en el Reino Unido, entre 1995 y 2003, las infecciones bacterianas fueron la causa del 58 % de las ITT. 46 En Cuba, aunque la muerte por sepsis bacteriana postransfusional es un evento raro y excepcional, se le considera también como una de las principales causas de muerte por reacciones adversas derivadas de las transfusiones sanguíneas.
La contaminación bacteriana se origina en la mayor parte de los casos por la presencia de bacterias en la piel del brazo del donante.46-48
La desinfección del brazo del donante reduce significativamente la carga bacteriana a ese nivel, pero no "esteriliza" el brazo del donante. Aunque se ha demostrado que con la aplicación de las buenas prácticas de desinfección del brazo del donante, se pueden reducir los niveles de contaminantes en la parte superior de la piel, es virtualmente imposible desinfectar los niveles inferiores.49,50
La segunda causa se debe a donantes aparentemente sanos con bacteriemia transitoria. 51 La Yersinia enterocolítica es la bacteria más frecuentemente implicada en la transmisión de glóbulos contaminados.52 Estudios prospectivos demostraron que la prevalencia de bacterias en componentes sanguíneos varía del 0,04 al 2 %, dependiendo del componente.53
En los receptores de glóbulos rojos el riesgo es bajo, ya que estos se almacenan refrigerados, y se calcula de 1:1 000 000 en EE.UU. En alrededor de la mitad de los casos el agente implicado es la Yersinia enterocolítica que aunque su temperatura óptima de crecimiento es de 25 ºC, es capaz de crecer a 4 °C y da lugar a reacciones severas y a veces fatales.41,52 Muchos de los casos remanentes son debidos a Pseudomonas spp. El primero estaría presente en el torrente sanguíneo del donante y el segundo sería un contaminante ambiental.6 Otros agentes biológicos asociados a donantes con bacteriemia asintomática son Campylobacter jejuni, Salmonella heidelberg, Echerichia coli y Salmonella enterica.46,54-56 También se han informado casos de transmisión bacteriana debido a donantes con infecciones crónicas de bajo grado causadas por Salmonella choleraesuis y Serratia liquifaciens, y por bacteriemias transitorias después de tratamientos dentales causadas por Staphylococcus aureus.2
El foco de atención internacional se centra ahora en los concentrados de plaquetas, ya que es el hemoderivado más vulnerable a las infecciones bacterianas porque se almacenan a una temperatura que favorece el crecimiento de diversas bacterias contaminantes.53,57 A escala mundial, la mortalidad debida a sepsis transmitidas por concentrados de plaquetas oscila entre 1 en 20 000 y 1 en 100 000 transfusiones y, debido al incremento del riesgo con el tiempo de almacenamiento, estos componentes se deben descartar después de 5 días de su obtención. 58 Son varios los microorganismos involucrados, de los géneros Staphylococcus, Salmonella, Enterobacter, Serratia, Klebsiella, y otros.6,59,60
Para prevenir las contaminaciones bacterianas el método más lógico es evitar la introducción de bacterias en los componentes sanguíneos durante todas las etapas desde la fabricación de las bolsas.
La colecta de la sangre es un momento crítico, ya que es muy frecuente la contaminación con bacterias de la piel. Se han evaluado distintas medidas de intervención para minimizar las contaminaciones, que van desde la mejoría en la desinfección del brazo de los donantes, la separación o desviación de la parte del contenido de la bolsa más "probablemente contaminada", hasta la implementación de métodos o sistemas de pesquisaje para bacterias.2
La desinfección de la piel antes de la venipuntura continúa siendo la primera línea de defensa para prevenir la contaminación bacteriana. Hay un grupo de bacterias que forman parte de la flora normal residente en la piel y que sistemáticamente se identifican en estudios de esta índole, como puesto por Staphylococci coagulasa negativa, Staphylococcus aureus, y especie Bacillus.61 Estudios separados llevados a cabo por varios servicios de sangre, recomiendan como la mejor técnica de desinfección de la piel del brazo del donante, el uso de alcohol isopropílico al 70 % seguido de la aplicación de tintura de yodo. 50,62 En Cuba se insiste en un lavado profundo con agua y jabón del antebrazo, la desifección con alcohol etílico al 70 % y la aplicación de una solución yodada a base de yodo povidona, que cuando se aplica con rigor, satisface las expectativas.
La separación o desvío de los primeros mililitros de la sangre colectada, se basa en el principio de que la contaminación bacteriana a partir de la piel del brazo del donante estaría presente en el flujo inicial de sangre, y si esta se desvía a una bolsa satélite o a un tubo colector diferente de la bolsa de sangre, esta estaría protegida de esa contaminación, y no sería necesario que esta sangre se pierda o se deseche, ya que ese tubo o bolsa satélite se puede emplear para las pruebas serológicas o de grupos sanguíneos del donante. 2 Los estudios realizados revelaron que con este sencillo proceder, se pueden reducir las contaminaciones bacterianas del 40 al 88 %, 2 y la contaminación residual después de la introducción de una combinación de procedimientos que incluyen la desviación y una desinfección mejorada de la piel del brazo podría estar en el orden del 30-40%, 63 por lo que resulta de utilidad desviar los primeros 15 mL de la donación, que suelen presentar mayor contaminación con bacterias de la piel. 53,61 Recientemente, se están implementando controles de esterilidad sistemáticos en concentrados de plaquetas en algunos países.
El pesquisaje de bacterias, a diferencia del que se emplea para detectar infecciones virales, representa un reto especial por las siguientes razones: a diferencia de los virus, las bacterias se pueden multiplicar o morir durante el almacenamiento de los componentes de la sangre; el inóculo inicial podría ser extremadamente pequeño y no ser detectable en sus inicios; una amplia gama de bacterias pueden contaminar la sangre a diferencia de los virus; no se encuentra una respuesta de anticuerpos relevante en la mayoría de los casos, ya que la contaminación no siempre se produce como consecuencia de la propia infección en el donante; no existen métodos rápidos, sensibles y específicos, como los que se han desarrollado para los principales virus de transmisión sanguínea; las pruebas no se deberían realizar "inmediatamente" después de la colecta de la sangre, pues no tendría sentido como en los virus; todos los componentes de una donación deberían ser evaluados por separado; la selección del donante desempeña un papel menor cuando se trata de contaminación bacterianas provocadas por procedimientos no imputables al donante.2
Además de los métodos microbiológicos convencionales (como la coloración de Gram) o el uso de marcadores alternativos (como las tiras reactivas para determinar el pH o los niveles de glucosa), varios métodos eficientes están disponibles en el mercado internacional para detectar la contaminación bacteriana en los componentes sanguíneos, especialmente en los concentrados de plaquetas.
Estos se dividen en 2 principios metodológicamente diferentes: el primero, emplea métodos que se basa en la inoculación y cultivo de las bacterias contaminantes, es altamente sensible (teóricamente podría detectar hasta una bacteria por muestra), pero requiere de tiempo de incubación para que produzca señales (al menos 24 horas). Si se toma en cuenta la poca cantidad de bacterias que podrían pasar durante el proceso de la donación de sangre (usualmente solo de 10 a 100 bacterias por bolsa, lo que corresponde a 0,03 a 0,3 bacterias por mL). Este principio no ofrece resultados rápidos y los concentrados de plaquetas se tendrían que almacenar al menos un día después de su fabricación en el banco de sangre. 64,65 Durante ese tiempo, ocurre la primera multiplicación de bacterias contaminantes en la bolsa, dando lugar a un incremento en el conteo de bacterias y por ende, a una mayor probabilidad diagnóstica del método.
Se ha acumulado más experiencia con el empleo de los métodos microbiológicos de cultivos automatizados, como el BacT/Alert (BioMerieux, Francia), que monitorea de forma permanente el nivel de CO2 producido por las bacterias.66 Las muestras de los concentrados de plaquetas se inoculan en los frascos de cultivo listos-para-el-uso, y se pueden detectar tanto bacterias aeróbicas como anaeróbicas. Muchos autores recomiendan mantener el monitoreo aún después de que la bolsa del concentrado se use, y si apareciera algún signo de contaminación, se debe avisar al hospital receptor para retirar el producto o en caso de que ya haya sido empleado, aplicar un tratamiento antibiótico al paciente antes de que sea demasiado tarde.
Otro sistema basado en el cultivo es el desarrollado por la firma Pall Corporation, de los EE.UU., llamado Sistema de Detección Incrementado de Bacterias, que emplea el consumo de O2 como marcador. Una muestra del concentrado de plaquetas se pasa a una bolsa satélite y se incuba por 18-24 horas a 35 °C, pero tiene la desventaja de que no detecta bacterias anaeróbicas estrictas o bajas consumidoras de O2.67
El segundo principio se basa en los métodos rápidos de detección de bacterias sin incubación. Los ácidos nucleicos de las bacterias se marcan con colorantes fluorescentes y luego se miden usando diferentes procedimientos. Otros autores han reportado el uso de NAT-PCR midiendo secuencias codificadas de ADN ribosomal de genes bacterianos altamente conservados por la evolución, pero aún no están disponibles en el mercado.68,69 Los métodos rápidos requieren menos tiempo, solo minutos o algunas horas, pero su sensibilidad global es más baja, y depende del método analítico empleado y del volumen de muestra tomado.
TRANSMISIÓN DE INFECCIONES PARASITARIAS POR VÍA TRANSFUSIONAL
Enfermedad de Chagas
La enfermedad de Chagas es endémica en América Latina, se la denomina tripanosomiasis americana y es una de las zoonosis más extendidas, desde California hasta el sur de Argentina y Chile. El agente etiológico es el Trypanosoma cruzi. Se estima que entre 16 y 18 millones de individuos están infectados70 y otros 100 000 000 se encuentran expuestos al riesgo de contraer la infección. Alrededor de 45 000 a 50 000 personas mueren por año por la enfermedad de Chagas.71,72
La infección en el ser humano ocurre en la mayoría de los casos por penetración del T. cruzi en el torrente sanguíneo transportado por las heces del vector, un triatomíneo del cual se han descrito aproximadamente 100 especies. Otras formas de transmisión de la infección son las transfusiones con sangre contaminada, la transmisión congénita, y excepcionalmente, la infección por accidentes de laboratorio, por trasplantes de órganos, por alimentos contaminados y por lactancia.73
En los países donde no existe el ciclo de transmisión autóctona, como en Cuba, la seroprevalencia es una función directa de la población inmigrante que ha estado expuesta a la infección en áreas endémicas.74,75
Sin embargo, en el caso de Cuba, no se puede descartar que algún día se produzca la transmisión vectorial, ya que los triatomíneos desempeñan un papel importante en la transmisión,76 y en el país se encuentran 4 especies de triatomíneos: Triatoma flavida, Neiva, 1911, Triatoma bruneri, Usinger, 1944, Bolbodera scabrosa, Valdés, 1990 y Triatoma rubrofasciata, De Geer, 1973. La especie T. flavida es considerada una especie selvática que presumiblemente es atraída a las casas por la luz; de las especies encontradas en Cuba es la más abundante, y posee características que aumentan su peligrosidad como vector potencial.77
Los problemas económicos en América Latina han estimulado la emigración a zonas urbanas, y en la mayoría de los países más del 60 % de la población vive en las ciudades, lo que aumenta la probabilidad de transmisión del T. cruzi en donantes de sangre.71 La proporción de donantes infectados en algunas áreas endémicas de América Latina oscila entre el 3-53 %, más elevada que la seroprevalencia de anticuerpos para VHB, VHC y VIH.70
Cada vez es mayor la emigración a países no endémicos, con el potencial peligro de transmisión de la infección por vía transfusional en estos países. 71,73 En EE.UU. se han descrito algunos casos autóctonos, ya que la región sudeste es subtropical y rural y la población puede resultar expuesta a los vectores infectados durante su trabajo al aire libre,78,79 pero la mayoría de los casos se deben a transmisión por vía transfusional con unidades obtenidas de inmigrantes de áreas endémicas. 80,81 En 1990 residían en EE.UU. legalmente 7 millones de personas provenientes de países donde la infección por T. cruzi es endémica y se estimó que entre 100 000 y 370 000 individuos padecían de infección crónica por este parásito.71 Francia, el Reino Unido, España, Italia, Portugal, Japón, Canadá y Australia tienen también gran cantidad de inmigrantes, sobre todo de Brasil,71 y se han identificado casos de transmisión por vía transfusional en países no endémicos 80-83 donde la seroprevalencia de anticuerpos anti T. cruzi en donantes se ha calculado entre el 0,06 y 4,9 %. 84
Como se puede apreciar, la transfusión de sangre es la segunda vía de infección en importancia, y esto se debe a la gran progresión de la infección al estado crónico asintomático, a su prevalencia elevada en la población de donantes de sangre y la viabilidad del parásito en las condiciones de almacenamiento de la sangre.85 El T. cruzi puede sobrevivir en plaquetas almacenadas a temperatura ambiente, en sangre entera o glóbulos rojos a 4 °C por 21 días y en plasma y crioprecipitados. El riesgo de recibir una unidad infectada con T. cruzi se incrementa en proporción a la prevalencia de la infección en los donantes de sangre. Se ha estimado que el riesgo de infección después de una transfusión con una unidad infectada varía del 14 al 49 %. 86 Este riesgo depende del estado inmunológico del receptor, del número de unidades de productos sanguíneos infectados transfundidos, de la concentración del parásito en la unidad transfundida y de la cepa del parásito.
En cuanto a la situación en el Cono Sur, el vector más importante en Argentina es el Triatoma infestans por su hábito casi exclusivamente doméstico. Cuando en el Instituto Nacional de Diagnóstico e Investigación de la Enfermedad de Chagas "Dr. Mario Fatala Chabén" se realizó una encuesta nacional en las instituciones que se ocupan de transfusiones de sangre, respondieron 423 centros, de los cuales la mitad efectuaba una única reacción serológica y la seroprevalencia fue del 17-24 % en provincias tales como Jujuy, Chaco, Santiago del Estero y La Rioja, y de menos del 5 % en la de Buenos Aires. 87 Pérez Bianco y colaboradores 39 recolectaron información de 49 bancos de sangre desde 1987 a 1992; para la detección de anti-T. cruzi se utilizaron diferentes técnicas, la más utilizada fue la prueba de hemoaglutinación indirecta. La prevalencia calculada para anti-T. cruzi fue del 4,4 %. En 1997, en la VII Reunión de la Comisión Intergubernamental para la eliminación de Triatoma infestans y la interrupción de la tripanosomiasis americana por transfusión, celebrada en Buenos Aires, Argentina, del 24 al 26 de marzo de 1998, se informó que en 742 330 donantes la prevalencia fue del 4,4 %, y El ANLIS (Administración Nacional de Laboratorios e Institutos de Salud "Dr. Carlos G. Malbrán"), calculó con datos de instituciones públicas y privadas de toda Argentina una prevalencia de marcadores anti-T. cruzi del 5,28 % en 370 000 donantes de sangre en el mismo año. En 1998 en una población de 481.827 donantes, la prevalencia se mantenía en el 4,6 %. Con respecto a la ciudad de Buenos Aires, el ANLIS, compilando datos de varias instituciones privadas, informa que la prevalencia de anti-T. cruzi en el año 1998 fue del 2,65 % en 75 484 donantes. En el año 1999 el porcentaje de donantes reactivos calculado fue del 4,08 % en 277 374 donantes de sangre. Datos de la VIII Reunión de la Comisión Intergubernamental para la eliminación del Triatoma infestans y la interrupción de la tripanosomiasis americana por transfusión, celebrada en Tarija, Bolivia, del 16 al 18 de marzo de 1999, indican que más de 50 millones de personas están expuestas al riesgo de infectarse, solo en esta región del continente, y se calcula que el total de la población infectada es de alrededor de 10 a 11 millones de habitantes. En la Sección de Medicina Transfusional de la Fundación Favaloro, la prevalencia de marcadores anti-T. cruzi fue del 2,68 % (1 744/64 887, muestras que fueron repetidamente reactivas por 1 ó 2 pruebas de pesquisaje), y el 1,46 % (949/64 887 sueros que fueron reactivos en al menos 2 de 3 métodos) se consideraron confirmados como positivos.88
La prevalencia en los diferentes bancos de sangre dependerá del área en que se encuentre (urbana o rural), y en el caso de estar ubicado en un área urbana no endémica, del porcentaje de donantes que han emigrado de zonas que sí lo son, y de la rigurosidad del cuestionario de autoexclusión.
Según los Procederes para Bancos de Sangre vigentes en Cuba, las personas que tengan un diagnóstico de enfermedad de Chagas son excluidos de forma permanente como donantes y las personas saludables que han visitado áreas endémicas no pueden donar al menos en 1 año (Ballester JM y colaboradores. Procederes para Bancos de Sangre y Servicios de Transfusiones de la República de Cuba. IHI-MINSAP, 2004).
Paludismo
También conocido como "malaria", causado por el género Plasmodium (malariae, vivax, falciparum y ovale). Se estima que anualmente existen entre 300 y 500 millones de casos en el mundo. En Cuba se considera una enfermedad exótica. En cuanto a las estrategias para el control de su transmisión por vía transfusional, es poco lo que se puede hacer en áreas de alta endemicidad; una alternativa es tratar a los receptores con medicación como profilaxis y excluir como donantes a individuos con antecedentes de paludismo reciente. En áreas no endémicas se toman diferentes medidas, por ejemplo, muchos países europeos excluyen por 6 meses a los donantes que hayan viajado a un área endémica, en EE.UU. y Dinamarca se les excluye por un año, y en Irlanda por 4 años, 89 mientras que los que han vivido en zona endémica o tengan una historia de paludismo, se rechazan en EE.UU. por 3 años.6 En Francia, no pueden donar sangre durante 4 meses después de haber regresado de zonas endémicas, la exclusión es permanente para personas con historia de paludismo y se realiza pesquisaje para anticuerpos anti-malaria en donantes entre los 4 meses y los 3 años posteriores a su retorno de un área endémica. Estas medidas serían efectivas, ya que se describen pocos casos por año de paludismo adquirido por vía transfusional.90
Según lo establecido en Cuba (Ballester JM y colaboradores. Citado anteriormente), los donantes que hubieran estado en áreas endémicas para paludismo serán rechazados y solo podrán donar sangre luego de permanecer 12 meses asintomáticos en área no endémica. Las personas que hubieran recibido drogas antipalúdicas como profilaxis y que no hubieren tenido síntomas atribuibles al paludismo, solo podrán donar sangre después de 3 años de finalizado el tratamiento, y los donantes que padecieren o hubieren padecido alguna vez paludismo quedarán excluidos permanentemente.
Babesia
Es endémica en ciertas áreas al noreste de EE.UU. y existen unos 20 casos reportados, 3 de ellos fatales, de transmisión por vía transfusional. 91 No existen pruebas serológicas para determinar su prevalencia y el método de prevención es evitar utilizar donantes de zonas endémicas, principalmente durante el verano. La babesiosis es una infección parasitaria intraeritrocitaria causada por la picada de una chincha lxodes infectada. La enfermedad se parece mucho a la enfermedad de Lyme, y a la malaria. Afecta de forma significativa al sistema hematológico, causando anemia hemolítica, trombocitopenia, y formación linfocítica atípica. Los parásitos transmitidos solo infectan eritrocitos mediante la alteración de las membranas celulares, lo que provoca disminución de la conformabilidad e incremento de la adherencia de los eritrocitos, lo cual puede provocar el desarrollo de un síndrome de distrés respiratorio agudo entre aquellos severamente afectados. Los parásitos de la Babesia invaden y sobreviven dentro de los eritrocitos y pueden permanecer viables en las condiciones de almacenamiento de la sangre en los bancos. La babesiosis es una enfermedad que amenaza la vida de los pacientes y represente un problema de salud pública significativo en el nordeste de los EE.UU. De los pacientes con babesiosis, el 84 % pierde la funcionalidad del bazo y el 53 % cae en estado de coma y mueren. Aquellos que han padecido y sobrevivido a la enfermedad, deben ser excluidos como donantes de sangre de forma permanente.91
CONCLUSIONES
Los ejemplos que se han descrito, refuerzan la necesidad de incrementar las medidas epidemiológicas de prevención, poniendo un empeño especial en la selección de los donantes según lo establecido en los procederes vigentes. Por otra parte, la colecta de sangre se debe realizar bajo estrictas medidas de asepsia y antisepsia, teniendo en cuenta que nuestro clima es húmedo y cálido, lo que favorece el crecimiento bacteriano y esto incrementa el riesgo de la contaminación de las bolsas desde el momento de la punción venosa, especialmente cuando se trabaja en unidades móviles alejadas del banco de sangre y donde siempre hay que garantizar las condiciones para poder ejecutar este trabajo con la máxima calidad. Los esfuerzos del personal, su nivel de calificación y la aplicación de una adecuada gestión por la calidad total, garantizarán la excelencia en los servicios y una cada vez mayor seguridad de la sangre.
REFERENCIAS BIBLIOGRÁFICAS
1. Allain JP. Editorial. Transfusion Today 2006;(66):3. Disponible en: http://www.isbt-web.org/files/TT66.pdf.
2. McDonald CP. Bacterial risk reduction by improved donor arm disinfection, diversion and bacterial screening. Transf Med 2006;16(6):381-96.
3. Cable R. Evaluation of syphilis testing of blood donors. Transfus Med Rev 1996;10:296-302.
4. Walker R. The disposition of STS reactive blood in a transfusion service. Transfusion 1965;5:452-6.
5. Chambers R, Foley H, Schmidt P. Transmission of syphilis by fresh blood components. Transfusion 1969;9:324.
6. NIH. Infectious disease testing for blood transfusions. NIH Consensus Development Panel on infectious disease testing for blood transfusions. JAMA 1995;274:1374-9.
7. Blocker M, Levine W, St. Louis M. HIV prevalence in patients with syphilis, United States. Sex Transm Dis 2000;27:53-9.
8. Dodd R. Transmission of parasites and bacteria by blood components. Vox Sang 2000;78 (Suppl 2):239-42.
9. Luger A. Diagnosis of syphilis. Bull World Health Organ 1989;59:647-54.
10. Olansky S. Serological diagnosis of syphilis. Med Clin North Am 1972;38:571-4.
11. Rudolph AH. Sífilis. En: Tratado de enfermedades infecciosas. 2 ed. La Habana: Editorial Ciencia y Técnica; 1982.
12. Yehudi M, Nikitas S. Syphilis serology today. Arch Dermatol 1980;116(1):84-9.
13. Sánchez M. Infectious syphilis. Semin Dermatol 1994;13(4):234-42.
14. Siegel D, Larsen S, Golden E, Morse S, Fullilove M, Washinton A. Prevalence, incidence, and correlates of syphilis seroreactivity in multiethnic San Francisco neighborhoods. Ann Epidemiol 1994:4(6):460-5.
15. Gutman LT. Treponema pallidum. En: Microbiología de Zinsser. 17 ed. La Habana: Editorial Ciencia y Técnica; 1983.
16. Jawetz E, Melnick JL, Adelverg EA. Espiroquetas y otros microorganismos espirales. En: Microbiología Médica. 11 ed. México DF: El Manual Moderno; 1987.
17. Deacon WE, Nicas JB. Fluorescent treponemal antibody absorption (FTA-ABS): Test for syphilis. JAMA 1966;198:624-8.
18. Atwood WG. The TPI and FTA-ABS tests in treated late syphilis. JAMA 1968;203:549-51.
19. Reimer CB, Black CM. The specificity of fetal IgM: antibody or anti-antibody? Am Acad Sci 1975;254:77-93.
20. Muller F. Evaluation of an enzyme immunoassay for IgM antibodies to T. pallidum in syphilis in men. Br J Vener Dis 1984;60:288- -92.
21. Lee JB, Farsky CE. Detection of IgM in cerebrospinal fluid for syphilis patients by ELISA. J Clin Microbiol 1986;24:736-40.
22. Ijsselmuiden OE. Sensitivity and specificity of an ELISA using the recombinant DNA derived T. pallidum protein trop A for serodiagnosis of syphilis. J Clin Microbiol 1989;27:152-7.
23. WHO Expert Committee on Venereal Diseases and Treponematosis. Sixth report. Geneva: WHO; 1986. (Technical Report Series; 736).
24. Morris JT, Alcerete JF. Identity of T. pallidum subsp. Pallidum polypeptides: Correlation of duodecyl sulfate polyacrylamide gel electrophoresis results from different laboratories. Electrophoresis 1987;8:77-92.
25. Hanff PA, Fehringer TE, Miller JN. Humoral immune response in human syphilis to polypeptides of T. pallidum. J Immunol 1982;129:1287-91.
26. Moskophidis M, Muller F. Molecular analysis of IgM and IgG response to protein antigens of T. pallidum in human syphilis. Infect Immunol 1984;127-32.
27. Larrondo RJ, González AR, Hernández LM, Larrondo RP. La técnica serológica del VDRL. Indicaciones y manejo en la atención primaria. Rev Cubana Med Gen Integr 1999;15(5):570-3.
28. Larrondo RJ, Hernández LM, González AR, Larrondo RP. Lesiones en los genitales externos, enfoque diagnóstico y conducta que debe seguir el médico de la familia. Rev Cubana Med Gen Integr 1998;14(1):5-14.
29. Cañizares O. A manual of dermatology for developing countries. 2 ed. Oxford: Oxford University; 1993. pp. 309-49.
30. Thomas JC, Kulic Al, Schoenhach VJ. Syphilis in the south: rural rates surpass urban rates in North Carolina. Am J Public Health 1995;85(8 pt 1):1119-22.
31. Arenas R. Atlas de dermatología, diagnóstico y tratamiento. 2 ed. México DF: Interamericana; 1996. pp. 287-94.
32. Fitzpatrick TB. Dermatología en Medicina General. 4 ed. México DF: Interamericana; 1997. pp. 1033-46.
33. Widmann F. Interpretación clínica de las pruebas de laboratorio. La Habana: Editorial Científico-Técnica; 1987. pp. 411-5.
34. Rodríguez González I, Fernández Molina C, Martínez Salgueiro MB. Falsos biológicos positivos por VDRL en el diagnóstico serológico de la sífilis. Rev Cubana Med Trop. [online]. ene.-abr. 2006;58(1) [citado 09 Mayo 2007], p.0-0. Disponible en: http://www.scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0375-.
35. Campuzano G, Jaramillo DE. Diagnóstico de sífilis. Medicina & Laboratorio 1997;7(1):13-25.
36. Larsen SA, Steiner BM, Rudolph AH. Laboratory diagnosis and interpretation of tests for syphilis. Clin Microbiol Rev 1995;8(1):1-21.
37. Corbel M. Brucellosis: an overview. Emerg Infect Dis 1997;3:213-21.
38. Economidou J, Kalafatas P, Vatopolou T, Petropolou D, Kattamis C. Brucellosis in two thalassaemic patients infected by blood transfusions from the same blood donor. Acta Haematol 1976;55:244-9.
39. Pérez Bianco R, Santarelli M. Análisis de un relevamiento serológico para enfermedades transmisibles por transfusión de sangre a nivel nacional. Rev Arg Transf 1994;20:73-82.
40. García M, Talanda C, Pugliese P, Mendez M, Schmee E. Comparación de dos métodos para el pesquisaje de brucelosis en donantes de sangre. Rev Arg Transf 2001;27:69-74.
41. Wagner S, Friedman L, Dodd R. Transfusion-associated bacterial sepsis. Clin Microbiol Rev 1994;7:290-302.
42. Sazama K. Reports of 355 transfusion-associated deaths: 1976 through 1985. Transfusion 1990;30:583-90.
43. Hoppe PA. Interim measures for detection of bacterial contaminated red cell components. Transfusion 1992;32:199-201.
44. Morel P. Bacterial contamination of platelets workshop, Bethesda, 2005. Disponible en: www.http://www.fda.gov/cber/minutes/bact092499.pdf">http://www.fda.gov/cber/minutes/bact092499.pdf .
45. Debeir J, Noel L, Allen JP, Frette C, Sari F, Mai M, Cosson A. The French Haemovigilance system. Vox Sang 1999;77:77-81.
46. Stainsby D, Cohen H, Jones H, Knowles S, Milkins C, Chapman C, et al. Serious hazards of transfusion (SHOT). SHOT Annual Report 2003;1-88.
47. Puckett A, Davison G, Entwistle CC, Barbara JA. Post transfusion septicaemia 1980-1989: importance of donor arm cleansing. J Clin Pathol 1992;45: 55-57.
48. Goldman M, Blajchman MA. Bacterial contamination. En: Transfusion Reaction. 2 ed. Popovsky M, 133-159, AABB, Bethesda; 2001.
49. Lee CK, Ho PL, Chan NK, Mak A, Hong J, Lin CK. Impact of donor arm skin disinfection on the bacterial contamination rate of platelet concentrates. Vox Sang 2002;83:204-8.
50. Goldman M, Roy G, Frechette N, Decary F, Massicotte L, Delage G. Evaluation of donor skin disinfection methods. Transfusion 1997;37:309-12.
51. Wagner S. Transfusion-related bacterial sepsis. Curr Opin Hematol 1997;4:464-9.
52. Jones BL, Saw MH, Hanson MF, Mactine MJ, Scott J, Murphy WG. Yersinia enterocolitica septicaemia from transfusion on red cell concentrate stored for 16 days. J Clin Pathol 1993;46:477-8.
53. Bruneau C, Pérez P, Chassaigne M, Allouch P, Audurier A, Gulian C, et al. Efficacy of a new collection procedure for preventing bacterial contamination of whole-blood donations. Transfusion 2001;41:74-81.
54. Tipple MA, Bland LA, Murphy JJ, Arduino MJ, Panlilio AL, Farmer JJ 3rd, et al. Sepsis associated with transfusion of red cells contaminated with Yersinia enterocolitica. Transfusion 1990;30:207-13.
55. Pepersack F, Prigogyme T, Btuzler JP. Campylobacter jejuni posttransfusion septicemia (letter). Lancet 1979;2:911.
56. Heal JM, Jones ME, Forey J, Chaudhry A, Stricof RL. Fatal Salmonella septicemia after platelet transfusion. Transfusion 1987;27:2-5.
57. Goldman M, Blajchman M. Blood product-associated bacterial sepsis. Transfus Med Rev 1991;5:73-83.
58. Goodnough L, Brecher M, Kanter M, AuBuchon J. Transfusion Medicine. Blood transfusion. N Engl J Med 1999;340:438-47.
59. Sazama K. Bacteria in blood for transfusion. A review. Arch Pathol Lab Med 1994;118:350-65.
60. Klein H, Dodd R, Ness P, Fratantoni J, Nemo G. Current status of microbial contamination of blood components: summary of a conference. Transfusion 1997;37:95-101.
61. de Korte D, Marcelis JH, Verhoeven AJ, Soeterboek AM. Diversion of first blood volume results in a reduction of bacterial contamination for whole-blood collections. Vox Sang 2002;83:13-16.
62. McDonald CP, Lowe P, Robbins S, Hartley S, Harrison JF, Slopecki A, et al. Evaluation of donor arm disinfection techniques. Vox Sang 2001;80:135-141.
63. McDonald CP, Roy A, Majahan P, Smith R, Charlett A, Barbara JA. Relative values of the interventions of diversion and improved donor-arm disinfection to reduce the bacterial risk from blood transfusion. Vox Sang 2004;86:178-82.
64. Brecher ME, Hay SN, Rothenberg SJ. Monitoring of apheresis platelet bacterial contamination with an automated liquid culture system: a university experience. Transfusion 2003;43:974-78.
65. de Korte D, Curvers J, de Kort WLAM, Hoekstra T, vd Poel CL, Beckers EAM, Marcelis JH. Effects of skin disinfection method, deviation bag, and bacterial screening on Clinical Safety of Platelet Transfusions in The Netherlands. Transfusion 2006;46:476-85.
66. Larsen CP, Ezligini F, Hermansen NO, Kjeldsen-Kragh EJ. Six years' experience using the BacT/Alert system to screen all platelet concentrates, and additional testing of outdated platelet concentrates to estimate the frequency of false-negative results. Vox Sang 2005;88:93-7.
67. McDonald CP, Pearce S, Wilkins K, Colvin J, Robbins S, Colley L, et al. Pall eBDS: An enhanced bacterial detection system for screening platelet concentrates. Transfus Med 2005;15:259-68.
68. Mohammadi T, Reesink HW, Vandenbroucke-Grauls CM, Savelkoul PH. Optimization of real-time PCR assay for rapid and sensitive detection of eubacterial 16S ribosomal DNA in platelet concentrates. J Clin Microbiol 2003;41:4796-8.
69. Petershofen EK, Fislage R, Faber R, Schmidt H, Roth WK, Seifried E. Detection of nucleic acid sequences from bacterial species with molecular genetic methods. Transfus Sci 2000;23:21-7.
70. WHO Chagas disease, Chile. Weekely Epidemiological Records 1999;74:9-16.
71. Schmuñis G. Riesgo de la enfermedad de Chagas a través de las trasfusiones en las Américas. Medicina (Bs. Aires) 1999;59(Supl. II):125-34.
72. Moncayo A. Progress towards interruption of transmission of Chagas disease. Memorias do Instituto Oswaldo Cruz 1999;94(Suppl 1):401-4.
73. Wendel S, Gonzaga A. Chagas' disease and blood transfusion: A new World problem?. Vox Sang 1993;64:1-12.
74. Shulman I, Appleman M, Saxena S, Hiti A, Kirchhoff L. Specific antibodies to Trypanosoma cruzi among blood donors in Los Angeles, California. Transfusion 1997;37:727-31.
75. Leiby DA, Fucci MH, Stumpf RJ. Trypanosoma cruzi in a low-to moderate-risk donor population: Seroprevalence and possible congenital transmission. Transfusion 1999;39:310-5.
76. Fraga Nodarse J, Rodríguez J, Fuentes O, Castex M, Fernández-Calienes A. Comparación entre 5 métodos para la extracción de ADN de Triatomíneos: su utilización en la técnica de ADN polimórfico amplificado al azar (RAPD). Rev Cubana Med Trop 2004;56(3):208-13.
77. Jiménez-Ozete H. Observaciones sobre la biología de Tritoma flavida, Neiva, 1911 en Cuba. Rev Cubana Med Trop 1981;33:42-50.
78. Woody NC, Woody HB. American trypanosomiasis (Chagas' disease): first indigenous case in the United States. JAMA 1995;159:676-7.
79. Herwaldt BL, Grijalva MJ, Newsome AL, McGhee CR, Powell MR, Nemec DG, et al. Use of Polymerase Chain Reaction to diagnose the fifth reported US case of autochthonous transmission of Trypanosoma cruzi, in Tennessee, 1998. J Infect Dis 2000;181:395-9.
80. Cimo P, Luper W, Scouros M. Transfusion-associated Chagas disease in Texas: Report of a case. Tex Med J 1993;89:48-50.
81. Grant IH, Gold JW, Wittner M, Tanowitz HB, Nathan C, Mayer K, et al. Transfusion-associated acute Chagas disease acquired in the United States. Ann Intern Med 1989;111:849-51.
82. Nickerson P, Pamela O, Schroeder M, Sekla L, Johnston J. Transfusion-associated Trypanosoma cruzi infection in a non-endemic area. Ann Intern Med 1989;111:851-3.
83. Villalba R, Fornés G, Álvarez M, Román J, Rubio V, Fernández M. Acute Chagas' disease in a recipient of a bone marrow transplant in Spain: Case report. Clin Infect Dis 1992;14:594-5.
84. Leiby DA, Herron RM Jr, Read EJ, Lenes BA, Stumpf RJ. Trypanosoma cruzi in Los Angeles and Miami blood donors: Impact of evolving donor demographics on seroprevalence and implications for transfusion transmission. Transfusion 2002;42:549-55.
85. Schmuñis GA. Trypanosoma cruzi, the etiologic agent of Chagas' disease: status in the blood supply in endemic and non-endemic countries. Transfusion 1991;31:547-57.
86. Wendel S. Current concepts on the transmission of bacteria and parasites by blood components. São Paulo Med J 1995;113:1036-52.
87. Pérez A, Segura E. Transfusión de sangre y transmisión de la infección chagásica en Argentina. Rev Arg Transf 1989;15:127-32.
88. Blejer J, Saguier M, Salamone H. Antibodies to Trypanosoma cruzi (T. cruzi) among blood donors in Buenos Aires, Argentina. Int J Infect Dis 2001;5:89-93.
89. Thellier M, Lusina D, Guiguen C, Delamaire M, Legros F, Ciceron L, et al. Is airport malaria a transfusion-transmitted malaria risk?. Transfusion 2001;41:301-2.
90. Nahlen B, Lobel H, Cannon S, Campbell C. Reassessment of blood donor selection criteria for United States travellers to malarious areas. Transfusion 1991;31:798-804.
91. McQuiston J, Childs J, Chamberland M, Tabor E. Transmission of tick-borne agents of disease by blood transfusion: A review of known and potential risks in the United States. Transfusion 2000;40:274-84.
Recibido: 15 de diciembre del 2007.
Aprobado: 3 de enero del 2008.
DrC. René A. Rivero Jiménez.
Instituto de Hematología e Inmunología. Apartado Postal 8070, Ciudad de La Habana, CP 10800, Cuba. Tel (537) 6438268, 6438695, 6434214. Fax (537) 6442334. e-mail: ihidir@hemato.sld.cu














