Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.25 n.1 Ciudad de la Habana ene.-abr. 2009
ARTÍCULO DE REVISIÓN
Antecedentes, diagnóstico y estudio evolutivo de la hepatitis C y la hemofilia
Hepatitis C related to hemophilia. Backgrounds, diagnosis, and evolutionary study
DrC. René A. Rivero Jiménez
Instituto de Hematología e Inmunología. Ciudad de La Habana, Cuba.
RESUMEN
Los pacientes hemofílicos tratados con hemoderivados no inactivados se han expuesto a múltiples cepas del virus de la hepatitis C (VHC), y con frecuencia aparecen pacientes con infecciones de genotipos virales mezclados. Estos pacientes también se han expuesto al riesgo de contraer el virus de la inmunodeficiencia humana (VIH) y el de la hepatitis B (VHB). El VHC es un virus ARN lineal monocatenario de la familia Flaviviridae, que mide 72 nm, tiene un período de incubación de 15 a 160 días, y se considera el agente etiológico de la hepatitis C, que se ha convertido en una de las principales causas de morbilidad y mortalidad en los hemofílicos. Varios estudios seroepidemiológicos realizados en América Latina para determinar la presencia de anticuerpos contra el VHC (Ac vs. VHC) en hemofílicos, revelaron cifras de prevalencia que van desde el 26,9 % en Honduras hasta el 64,3 % en Brasil, mientras que en Cuba se encontró el 59 %. Se comentan los factores que podrían estar provocando la elevada seroprevalencia de Ac vs. VHC en la mayoría de los países, a pesar de la existencia de sistemas de escrutinio serológico en los donantes de sangre.
Palabras clave: hemofilia, hepatitis C, seroprevalencia, genotipos.
ABSTRACT
Hemophilic patients treated with non-activated hemoderivatives have been exposed to multiple strains of hepatitis C virus (HCV), and frequently appear patients presenting with infections from mixed viral genotypes. These patients also have been exposed to risk of HIV, and that of hepatitis B virus (HBV). HBV is a monocatenarius lineal RNA-virus from Flaviviridae family (72 nm), has a incubation period of 15 to 160 days, and its is considered like the etiologic agent of hepatitis C becoming one of the main causes of morbidity and mortality in hemophiliacs. Some seroepidemiologic studies made in Latin America to determine presence of antibodies to HCV (Ac versus HCV) in hemophiliacs, showed prevalence figures from 26,9 % in Honduras to 64,3 % in Brazil, whereas in Cuba we found a 59,0 %. We comment on possible factors provoking the high seroprevalence of Ac versus HCV in most of countries, despite existence of serological count systems in blood donors.
Key words: Hemophilia, hepatitis C, seroprevalence, genotypes.
ANTECEDENTES
El período desde el descubrimiento del virus de la inmunodeficiencia humana (VIH) al inicio de la década de los años 80 del siglo pasado y el desarrollo de los procedimientos de inactivación viral capaces de erradicar el virus de las fuentes sanguíneas, fue prolongado, y muchos receptores de derivados de la sangre en otros países, incluyendo los EE. UU. se convirtieron en seropositivos, lo que se tradujo en un impacto devastador sobre la calidad de vida, la calidad de la atención médica, así como sobre la expectativa de vida de estos pacientes, y en especial de los hemofílicos. Algunos años después, se identificó también la infección por el virus de la hepatitis C (VHC), otro agente causante de infecciones transmisibles por sangre, lo que complica el tratamiento de estos pacientes. Hoy en día, la amenaza potencial de nuevos agentes emergentes ha reforzado la necesidad de brindarles productos efectivos y sobre todo seguros (en relación con los agentes infecciosos), así como establecer guías terapéuticas actualizadas frecuentemente para el tratamiento.1
Los individuos con hemofilia que reciben tratamiento con hemoderivados no inactivados, ya sean concentrados de factores de la coagulación u otros como el crioprecipitado, han estado y están expuestos a múltiples cepas del VHC, por lo que la frecuencia con que aparecen infecciones con genotipos virales mezclados es más elevada en ellos que en la población en general,2 y estos pacientes también están expuestos a la co-infección con VIH o con el virus de la hepatitis B (VHB).3
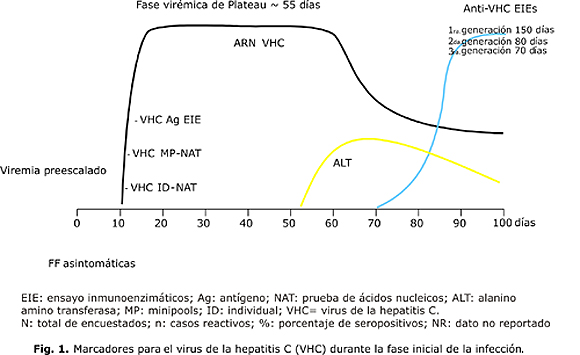
La hepatitis C, que se ha convertido en una causa principal de morbilidad y mortalidad en hemofílicos, es causada por el VHC, un virus ARN lineal monocatenario de la familia Flaviviridae que mide 72 nm, tiene un período de incubación de 15 a 160 días, nunca se ha podido cultivar o aislar a partir de cultivos celulares, y casi siempre provoca infección asintomática y de progresión lenta, dando lugar a un mecanismo lesional hepático eminentemente inmunológico. Actualmente se le considera como el mayor riesgo de infección viral en Cuba y América Latina para los receptores de sangre y hemocomponentes, superando con creces al VIH y al VHB, ya que los métodos de pesquisaje que se aplican en la mayoría de los países, son ensayos inmunoenzimáticos (EIE) de 3ra. generación, y en estos sistemas de detección de anticuerpos, el período de ventana (sin detección), puede llegar a ser de 70 días (fig. 1).
Los estudios iniciales mostraron resultados contradictorios en cuanto a la severidad de la hepatitis C en los hemofílicos, describiéndola como ligera, de progresión lenta, y observada en varios niños y adultos jóvenes que se examinaron mediante biopsias hepáticas repetidas, mientras que una hepatitis más progresiva a la severidad y la cirrosis se documentó en otros casos.4 Casi todos los hemofílicos a quienes se administraron concentrados de factor VIII (F VIII) o IX (F IX) antes de 1985, se han expuesto al VHC, y casi el 100 % presentan anticuerpos contra el VHC (Ac vs. VHC).4
Un problema importante con respecto a la infección por VHC, es su propensión a causar enfermedad hepática crónica y, en general, se reconoce que esto ocurrirá en por lo menos 50-75 % de las personas infectadas.5 Se podría presentar cirrosis en el 20-30 % de quienes padecen infección crónica.6 El carcinoma hepatocelular es también una complicación reconocida de la infección crónica por VHC, y generalmente ocurre en asociación con la cirrosis hepática.7,8
Un punto principal de disputa estaba centrado en que si estas discrepancias se debían en parte a las diferencias epidemiológicas entre los estudios, dado que la hepatitis C adquirida en edades tempranas de la vida, podría inicialmente tener un curso benigno y empeorar después, provocando un recrudecimiento espontáneo de la hepatitis o interferencia con otros factores de co-morbilidad, como el abuso del alcohol o la infección con el VIH.9
Genotipos del VHC
Según los datos de la literatura, es muy variable la prevalencia de genotipos virales mezclados, entre otras razones, por las dificultades en las técnicas de genotipificación de la población viral. Las células mononucleares de sangre periférica (CMSP) y el plasma, se han empleado como fuentes del reservorio viral para estas determinaciones, y en un estudio en Buenos Aires, Argentina, se detectó que la infección con mezclas de genotipos virales estaba presente en el 5,6 % de los hemofílicos (16 de 288), pero si se estudiaba en los cultivos de CMSP, el valor se incrementaba al 62,5 %, con una significación estadística (p < 0,0001).2
En Japón, para determinar si la persistencia de una infección natural por VIH era capaz de afectar la diversidad genética del VHC mediante una menor presión selectiva a través de la inmunosupresión en pacientes hemofílicos co-infectados con VIH-VHC, tanto los cambios como la diversidad genética y la presión selectiva se examinaron en los genes de la envoltura del VHC (E1 y E2) de 325 subclones del genotipo 1ª, de 8 hemofílicos positivos al VIH y 5 pacientes negativos al VIH con 2 puntos de corte (más de 6 años de diferencia). Los resultados indicaron que el grupo de hemofílicos VIH positivos fue significativamente más diverso en estructura poblacional que el grupo VIH negativo. En conclusión, los pacientes VIH positivos podrían tener una mayor diversidad de poblaciones virales del VHC que los VIH negativos, debido a una menor presión selectiva de su sistema inmune.3
Diagnóstico y seguimiento de infección por VHC en hemofílicos
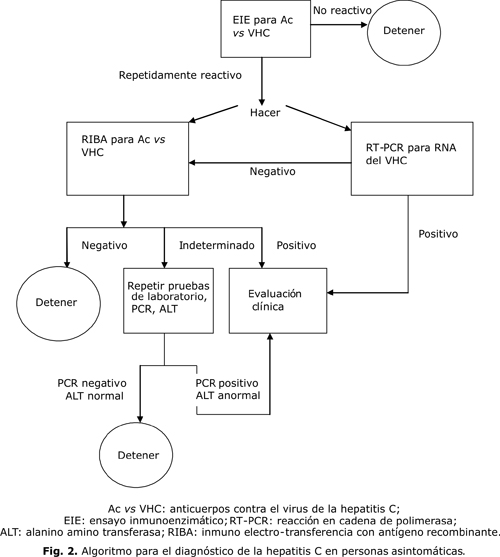
Todos los pacientes que han recibido tratamiento con concentrados de factor o crioprecipitado, se deben someter a una prueba de Ac vs. VHC de tercera generación, según el algoritmo de diagnóstico de la figura 2.10 También se recomienda la evaluación de todos los pacientes en busca de infecciones existentes, mediante la prueba de reacción en cadena de la polimerasa (PCR), para detectar ARN del VHC (prueba confirmatoria). Se recomienda realizar pruebas y seguimiento cada 6 meses a todas las personas que han recibido concentrados de factores de la coagulación, en particular a quienes recibieron tratamiento antes de 1985, y a los que reciben otros hemocomponentes no inactivados en la actualidad. Los pacientes infectados con VHC y niveles séricos de aspartato alanino-transferasa (ALT) o aspartato amino-transferasa (AST) anormales, se deben someter a revisiones periódicas en intervalos de aproximadamente 4-6 meses. La revisión debe incluir un examen clínico y la determinación de laboratorio de por lo menos, el nivel sérico de albúmina y el tiempo de protrombina.10
En el caso de pacientes que presentan anticuerpos del VHC para los que no se han documentado resultados anormales de bioquímica hepática, se deben determinar niveles séricos de ALT/AST y realizarse la prueba de PCR para detectar ARN del VHC, para determinar si el paciente tiene viremia detectable a pesar de los niveles séricos de ALT normales, como ocurre en algunos pacientes con infección crónica. Si se detectara ARN del VHC, los resultados, las implicaciones y las opciones terapéuticas se deben discutir con un hepatólogo.10
La cuantificación y genotipo del VHC se deberá considerar en todos los pacientes antes de iniciar el tratamiento, ya que esto altera la duración recomendada de la terapia combinada.10 Los pacientes con enfermedad de von Willebrand, hemofilia leve y portadoras de hemofilia, posiblemente constituyan un grupo importante de pacientes a quienes aún no se les han realizado esas pruebas.10
Además de la transmisión sanguínea, el VHC puede tener una transmisión sexual y vertical. La transmisión sexual de la hepatitis C es poco frecuente, pero llega a ocurrir. El riesgo se estima en menos del 3 % en el caso de parejas sexuales estables,11 aunque no se puede excluir la posibilidad de un mayor riesgo de transmisión bajo ciertas circunstancias. Los datos actuales sobre la tasa de transmisión sexual y las ventajas de la anticoncepción mediante barreras (preservativo o condón), se deben discutir con los pacientes. Asimismo, se debe animar a los pacientes a tomar decisiones conjuntas con sus parejas sexuales. Se deben ofrecer pruebas de detección del VHC a todas las parejas sexuales de pacientes que presentan anticuerpos del VHC. Si bien la transmisión vertical del VHC ocurre muy raramente, se deben ofrecer pruebas de detección del VHC para todos los niños de madres que son VHC positivas, aunque la interpretación de estas en menores de un año puede ser difícil.10
Seroepidemiología en países de América Latina y otras regiones del mundo
En América Latina, varios estudios epidemiológicos realizados en años recientes para determinar la seroprevalencia de Ac vs. VHC en hemofílicos, usando métodos basados en EIE de 3ra. generación revelaron las tasas de contaminación con VHC en estos pacientes: Argentina (42,7 % en 96 pacientes),12 Brasil (64,3 % en 28 pacientes),13 Colombia (32,2 % en 90 pacientes),14 Honduras (26,9 % en 63 pacientes, todos pediátricos),15 Perú (56,6 % en 84 pacientes, la mayoría adultos),16 Uruguay (60 % en 75 pacientes)17 y Cuba (59 % en 87 pacientes).18
En otros estudios realizados en Cuba con anterioridad, las tasas habían sido también elevadas. Por ejemplo, en un estudio llevado a cabo una década antes en 370 pacientes hematológicos politransfundidos procedentes de 5 provincias, se encontró una seroprevalencia de Ac vs. VHC de 50 % en hemofílicos.19 Otra encuesta realizada por aquella época en los hemofílicos de Ciudad de La Habana reveló que tenían un 44,4 % de individuos reactivos.20
Esto se debe a que la mayoría de los pacientes cubanos se tratan fundamentalmente con productos derivados de la sangre no inactivados, como el crioprecipitado.
Los pacientes con hemofilia y otras coagulopatías crónicas, son el mejor ejemplo para demostrar que la diseminación sanguínea del VHC continúa ocurriendo a pesar del pesquisaje de los donantes en Cuba.
En este sentido, los trabajos internacionales sugieren que 4 factores podrían estar desempeñando un rol importante en la diseminación sanguínea del VHC: un ineficiente trabajo de promoción, captación y retención de donantes voluntarios y altruistas, problemas con la sensibilidad y especificidad del diagnosticador que se ha estado usando en las distintas etapas desde la implementación del escrutinio a los donantes, errores humanos durante la pesquisa o exclusión de los donantes reactivos y, como ya se mencionó, el período de ventana prolongado (70 días) para los Ac vs. VHC cuando se aplican los sistemas de EIE de 3ra. generación,21 como el UMELISA HCV. En otros países, se han aplicado sistemas de escrutinio de donantes basados en una PCR automatizada, lo cual ha reducido de forma significativa este período de ventana de 70 a 14 días.22
Por otra parte, estudios de serología, confirmación molecular y genotipificación del VHC se llevaron a cabo en 69 hemofílicos brasileños (82,6 % con hemofilia A y 17,4 % con hemofilia B) atendidos en el Hospital Universitario y el Hemocentro regional de Maringá, Brasil, con un rango de edad entre 1 y 67 años (promedio 22 años), la seroprevalencia de anticuerpos vs. VHC fue de 37,7 % por inmunoensayos de 3ra. generación, y la confirmación por VHC-ARN se logró en el 21,7 %. Los genotipos predominantes fueron el genotipo 1 (53,3 %), el 3 (40,0 %) y el 2 (6,7 %), aunque la infección no se detectó en los menores de 17 años de edad.23
En otras latitudes, el problema de la hepatitis C también está presente. Por ejemplo, los receptores de sangre en Luxemburgo, incluidos los hemofílicos, estaban contaminados con el VHC, que se reveló en un estudio de esta población de pacientes que buscaba identificar los genotipos virales más comunes. De 802 pacientes recientemente diagnosticados con el VHC, el genotipo 1 fue el predominante (53,4 %) seguido del 3 (33 %). Entre los factores de riesgo, el uso de drogas endovenosas (EV) fue el más reportado (71,4 % de los pacientes), seguido de la transmisión provocada por tratamientos médicos (17,6 % de los pacientes), como los hemofílicos y otros receptores de sangre. Mientras que el genotipo 3 se asoció estadísticamente con el uso de drogas EV, el genotipo 1 se encontró más asociado con los tratamientos médicos.24
Para conocer el estado de la infección por VHC en hemofílicos de Letonia, se efectuó un estudio en 61 pacientes, 38 adultos y 23 menores de 18 años. La presencia de anticuerpos vs. VHC se encontró en el 74 % de los pacientes (45 de 61), pero se comprobó que en 41 % de los pacientes la infección se resolvió de forma espontánea, con más frecuencia en los niños que en los adultos (7 de 11, comparado con 11 de 33, p= 0,05).
La eliminación natural de la infección por el VHC es frecuente en los hemofílicos de Letonia, al evaluar la presencia del ARN viral en las muestras de sueros. Los niños eliminan naturalmente el virus con más frecuencia que los adultos y hay una asociación entre la eliminación natural del virus y el alelo HLA DRB1*07 en los pacientes hemofílicos.25
En estudios llevados a cabo en Irán, en pacientes multitransfundidos durante 9 años, se encontró que el VHC es el más prevalente y constituye un serio problema de salud. En Zahedan, Irán, entre marzo del 2003 y enero del 2006, se llevó a cabo un estudio de 81 hemofílicos y se encontró el 29,6 % de seroprevalencia de Ac vs. VHC y 4,9 % de VHB (HBsAg positivos), con 4 casos de co-infección VHB-VHC. Todos los pacientes habían recibido terapia con factores de la coagulación no inactivados antes de 1996.25-27
Como se observa en estos estudios, en todos los países donde se han realizado estudios seroepidemiológicos para el VHC, los pacientes con hemofilia constituyen un grupo de elevado riesgo para esta infección, y se hace necesario profundizar en la historia natural de la infección y en su tratamiento.
REFERENCIAS BIBLIOGRÁFICAS
1. Batlle J, Villar A, Liras A, Alonso C, Altisent C, Brito D, et al. Consensus opinion for the selection and use of therapeutic products for the treatment of haemophilia in Spain. Blood Coagul Fibrinol 2008;19:333-40.
2. Parodi C, Culasso A, Aloisi N, García G, Bastón M, Corti M, et al. Evidence of occult HCV genotypes in haemophilic individuals with unapparent HCV mixed infections. Haemophilia 2008 [en prensa].
3. Tanaka Y, Hanada K, Hanabusa H, Kurbanov F, Gojobori T, Mizokami M. Increasing genetic diversity of hepatitis C virus in haemophiliacs with human immunodeficiency virus coinfection. J Gen Virol 2007;88(Pt 9):2513-9.
4. Watson HG, Ludlam CA, Rebus S, Zhang LQ, Peutherer JF, Simmonds P. Use of several second generation serological assays to determine the true prevalence of hepatitis C virus infection in haemophiliacs treated with non-virus inactivated factor VIII and IX concentrates. Br J Haematol 1992;80:514-8.
5. Telfer P, Sabin C, Devereux H, Scott F, Dusheiko G, Lee C. The progression of HCV-associated liver disease in a cohort of haemophilic patients. Br J Haematol 1994;87:555-61.
6. Makris M, Preston FE, Rosendaal FR, Underwood JC, Rice KM, Triger DR. The natural history of chronic hepatitis C in haemophiliacs. Br J Haematol 1996;94:746-52.
7. Colombo M, Mannucci PM, Brettler DB, Girolami A, Lian EC, Rodeghiero F, et al. Hepatocellular carcinoma in hemophilia. Am J Hematol 1991;37:243-6.
8. Darby SC, Ewart DW, Giangrande PL, Spooner RJ, Rizza CR, Dusheiko GM, et al. Mortality from liver cancer and liver disease in haemophilic men and boys in UK given blood products contaminated with hepatitis C. UK Haemophilia Centre Directors' Organisation. Lancet 1997;350:1425-31.
9. Rumi MG, De Filippi F, Santagostino E, Colombo M. Hepatitis C in haemophilia: Lights and shadows. Haemophilia 2004;10(Suppl 4):211-5.
10. Markis M, Baglin T, Dusheiko G, Giangrande PLF, Lee CA, Ludlam CA, et al. (A nombre del grupo de Trabajo sobre Infecciones Transmitidas por Transfusiones, de la Organización de Directores de Centros de Hemofilia del Reino Unido). Guías para el diagnóstico, manejo y prevención de la hepatitis en hemofilia. Hemofilia 2001;7:339-45.
11. Hallam NF, Fletcher ML, Read SJ, Majd AM, Kurtz JB, Rizza CR. Low risk of sexual transmission of hepatitis C virus. J Med Virol 1993;40:251-3.
12. Remesar M, Gamba C, Kuperman S, Marcos MA, Miguez G, Caldarola S, et al. Antibodies to hepatitis C and other viral markers in multi-transfused patients from Argentina. J Clin Virol 2005;34(Suppl 2):S20-S26.
13. De Paula EV, Gonçalez NSL, Xueref S, Addas-Carvahlo M, Gilli SCO, Angerami RM, et al. Transfusion-transmitted infections among multi-transfused patients in Brazil. J Clin Virol 2005;34(Suppl2):S27-S32.
14. Beltrán M, Navas MC, de la Hoz F, Muñoz MM, Jaramillo S, Estrada C, et al. Hepatitis C virus seroprevalence in multi-transfused patients in Colombia. J Clin Virol 2005; 34(Suppl 2):S33-S38.
15. Vinelli E, Lorenzana I. Transfusion transmitted infections in multi-transfused patients in Honduras. J Clin Virol 2005;34(Suppl 2):S53-S60.
16. Laguna-Torres VA, Pérez-Bao J, Chauca G, Sobero M, Blistein D, Chunga A, et al. Epidemiology of transfusion transmitted infections among multi-transfused patients in seven hospitals in Perú. J Clin Virol 2005;34(Suppl 2):S61-S68.
17. López L, López P, Arango A, Rodríguez I, López J, Lima E, et al. Risk factors for hepatitis B and C in multi-transfused patients in Uruguay. J Clin Virol 2005;34(Suppl 2):S69-S74.
18. Ballester JM, Rivero RA, Villaescusa R, Merlín JC, Arce AA, Castillo D, et al. Hepatitis C virus antibody and other blood-transfusion-transmitted infection markers in multi-transfused Cuban patients. J Clin Virol 2005;34(Suppl 2):S39-S46.
19. Rivero RA, Yamagushi K, Góngora M, Hidalgo-Gato R, Almagro D, Hernández P, et al. Prevalencia de anticuerpos contra el virus de la hepatitis C en pacientes cubanos con enfermedades hematológicas. Rev Cubana Hematol Inmunol Hemoter 1993;9(2):127-30.
20. Padrón G, Aruz E, Roca J, Viña A, Lemus G, Bacallao J. The Hepatitis C in Cuba: Prevalence, antibody pattern, genotype and risk factor. Hepatology 1994;19:1141.
21. Busch MP, Glynn SA, Stramer SL, Orland J, Murphy EL, Wright DJ, et al. Correlates of hepatitis C virus (HCV) RNA negativity among HCV-seropositive blood donors. Transfusion 2006;46(3):469-75.
22. Kleinman S, Busch M. The risks of transfusion-transmitted infection: Direct estimation and mathematical modelling. En: Contreras M, ed. New aspects of blood transfusion. London: Bailliere Tindall Publishing; 2000. pp. 631-49.
23. Ferreira MR, Lonardoni MV, Bertolini DA. Hepatitis C: Serological and molecular diagnosis and genotype in haemophilic patients at the Regional Hemocenter of Maringá, Maringá PR Brazil. Haemophilia 2008; Mar 19 [en prensa].
24. Roman F, Hawotte K, Struck D, Ternes AM, Servais JY, Arendt V, et al. Hepatitis C virus genotypes distribution and transmission risk factors in Luxembourg from 1991 to 2006. World J Gastroenterol 2008;14(8):1237-43.
25. Simanis R, Lejniece S, Sochnevs A, Eglite J, Chernevska G, Kovalova Z, et al. Natural clearance of hepatitis C virus in hemophilia patients. Medicina (Kaunas) 2008;44(1):15-21.
26. Rezvan H, Abolghassemi H, Kafiabad SA. Transfusion-transmitted infections among multitransfused patients in Iran: A review. Transfus Med 2007;17(6):425-33.
27. Sharifi-Mood B, Eshghi P, Sanei-Moghaddam E, Hashemi M. Hepatitis B and C virus infections in patients with hemophilia in Zahedan, southeast Iran. Saudi Med J 2007;28(10):1516-9.
Recibido: 6 de abril del 2009.
Aprobado: 10 de abril del 2009.
DrC. René A. Rivero Jiménez. Instituto de Hematología e Inmunología. Apartado 8070, Ciudad de La Habana, CP 10800, Cuba. e-mail: ihidir@hemato.sld.cu