Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.25 n.3 Ciudad de la Habana sep.-dic. 2009
MINI-REVISIÓN
Matriptasa 2: nuevo eslabón en el metabolismo del hierro
Matriptase 2: a new link in iron metabolism
MsC. Mariela Forrellat Barrios I; Dra. Norma Fernández Delgado I; Prof. DrC. Porfirio Hernández RamírezI
IInstituto de Hematología e Inmunología. Ciudad de La Habana, Cuba.
RESUMEN
El mantenimiento de la homeostasia del hierro es esencial para el funcionamiento fisiológico normal de los seres vivos. Recientemente se descubrió que la matriptasa 2, una serin proteasa transmembrana tipo II, también conocida por las siglas en inglés TMPRSS6, tiene una función esencial en la homeostasis de este mineral. Este hallazgo derivó inicialmente de la observación de que ratones con deficiencia de esta proteína presentaban anemia como consecuencia de la elevación de los niveles de hepcidina y la interrupción de la absorción intestinal de hierro. Los análisis posteriores in vitro demostraron que la matriptasa 2 suprime la vía de estimulación de la transcripción de la hepcidina que implica a la hemojuvelina como co-receptor. En concordancia con el patrón de anemia de los ratones mutantes, se encontró que el patrón de individuos con anemia por deficiencia de hierro resistente al hierro (en inglés IRIDA), era ocasionado por mutaciones del gen Tmprss6 que implican anulación de la actividad proteolítica de la enzima. En este trabajo se presentan aspectos relacionados con la identificación y caracterización de la matriptasa 2, así como su participación en el metabolismo del hierro.
Palabras clave: homeostasia del hierro, matriptasa 2, IRIDA.
ABSTRACT
The maintenance of iron homeostasis is essential for the normal physiological functioning of the living beings. Recently, it was discovered the Matriptase 2, a type II trans-membrane serine protease, also known by English acronyms TMPRSS6, having an essential function in homeostasis of this mineral. This finding initially derived from the observation that mice deficient of this protein had anemia as consequence of rise of hepcidine levels and the interruption of iron intestinal absorption. The in vitro later analyses showed that 2 Matriptase suppress the stimulation way of hepcidine transcription involving to hemojuvelin as a co-receptor. In agreement with the anemia pattern of mutant mice, we founded that pattern from subjects presenting with iron-deficiency anemia and iron-resistant (IRIDA) was created by Tmprsst gen mutations involving the elimination of enzymatic proteolytic activity. In present paper are showed the features related to identification and characterization of the 2 Matriptase, as well as, its involvement in iron metabolism.
Key words: Iron homeostasis, 2 Matriptase, IRIDA.
INTRODUCCIÓN
La deficiencia de hierro continúa siendo uno de los principales problemas de salud pública en el mundo actual y se estima que unos 3 billones de personas están afectados por este déficit nutricional. Generalmente, esta deficiencia es la consecuencia de una ingesta o absorción deficientes, de una pérdida de sangre, o de ambos. 1 La deficiencia suele corregirse con la eliminación de la causa primaria y la aplicación de la ferroterapia correspondiente. Sin embargo, algunos pacientes no resuelven con el tratamiento, lo que ha llevado a definir el término anemia por deficiencia de hierro resistente al hierro (conocido por sus siglas en inglés IRIDA, iron refractory iron deficiency anemia). 2
En la actualidad, se reconocen una serie de defectos genéticos raros que pueden también causar anemia por deficiencia de hierro. Así, se ha descrito que las mutaciones de los genes que codifican las proteínas DMT1 y glutarredoxina 5 se asocian con anemia microcítica hipocrómica autosómica recesiva, mientras que las mutaciones de la transferrina y la ceruloplasmina provocan anemia ferropénica con sobrecarga de hierro fuera del eritrón, que podría confundirse con hemocromatosis hereditaria. También se ha observado que algunos pacientes presentan una IRIDA congénita que no puede explicarse por mutaciones en ninguno de estos genes. 1 Estos individuos parecen tener un defecto en la exportación de hierro celular con un patrón de herencia autosómico recesivo sin que se hayan detectado mutaciones en la ferroportina o en las proteínas reguladoras del gen de la hepcidina. Finalmente, se encontró que las mutaciones del gen Tmprss6 (siglas procedentes del término en inglés serin protease transmembrane S6), que codifica la proteína llamada matriptasa-2, también conocida como TMPRSS6, siglas derivadas del nombre del gen, estaban presentes en todas las familias con este desorden. 1,2
Se ha observado que la deficiencia de la proteína TMPRSS6 conduce a una elevada producción de hepcidina, la hormona peptídica encargada de la regulación del metabolismo del hierro. Adicionalmente, estos pacientes no pueden producir eficientemente nuevos eritrocitos debido a la imposibilidad de movilizar el hierro proveniente de los macrófagos como consecuencia de la superproducción de hepcidina, lo que explica la pobre respuesta al hierro parenteral, que al quedar atrapado en los macrófagos, no puede ser utilizado para la eritropoyesis. 3 En este trabajo se exponen aspectos relacionados con la identificación y caracterización de la matriptasa 2, así como su participación en el metabolismo del hierro y en la fisiopatología de la IRIDA.
MATRIPTASA 2, UN MIEMBRO DE LA FAMILIA SERIN PROTEASA
Las enzimas proteolíticas o proteasas actúan como efectores de numerosos eventos biológicos. Estas enzimas se clasifican en base a su mecanismo catalítico e incluyen las clases serino, cisteíno, aspartato, glutámico, metalo y treonino. La clase serino es la más amplia de todas con una expresión en todos los organismos, tanto en virus como en bacterias y eucariotas; abarca más de 20 familias agrupadas sobre la base de sus semejanzas estructurales y evidencias de actividad funcional. 3
La matriptasa 2 pertenece a la familia de las serin proteasas transmembrana tipo 2, que son proteínas ancladas a membrana con elementos estructurales semejantes, que incluyen un tallo citoplasmático corto donde se encuentra el amino terminal, un dominio transmembrana simple, una región central con dominios moduladores implicados en la interacción proteína-proteína, y un dominio catalítico carboxilo terminal. Estas proteínas tienen diferentes patrones de expresión tisular, lo que sugiere que los diversos miembros de la familia tienen diferentes funciones fisiológicas. 3-5
La matriptasa 2 se expresa primariamente en hígado y es capaz de degradar algunos componentes de la matriz extracelular, según se ha comprobado en los estudios in vitro. Sin embargo, su función in vivo aún no ha sido del todo dilucidada.4 Se plantea que esta proteasa suprime la transcripción de la hepcidina a través del procesamiento proteolítico de la hemojuvelina de la superficie celular y en consecuencia, regula indirectamente los niveles sistémicos de hierro. 3,6
El gen Tmprss6 está muy conservado entre los mamíferos con rasgos estructurales también muy conservados entre especies. La proteína de humanos y ratones tiene una masa molecular de aproximadamente 90 kDa y todos los rasgos estructurales de la familia de proteasas serino S1. En adultos de ambas especies, el sitio de expresión primario es el hígado, mientras que en el riñón también se encuentra alta transcripción del RNAm. Se han detectado niveles importantes en otros tejidos, lo que sugiere que la enzima podría tener determinada función en la embriogénesis y en procesos olfatorios.
A partir de su elevada expresión hepática, estudios recientes le han atribuido una actividad reguladora esencial en la homeostasia del hierro. 3
MATRIPTASA 2 Y HOMEOSTASIA DEL HIERRO
La capacidad de generar radicales libres y especies reactivas del oxígeno a partir del hierro, hacen que sea imprescindible mantener un estricto control de sus niveles para evitar el daño secundario a su elevada reactividad, sin afectar los importantes procesos biológicos en los que interviene este elemento esencial. Este control se centra en la regulación de las cantidades de hierro que se absorben en los enterocitos duodenales y las que se movilizan de las reservas para garantizar las necesidades del mineral. 7 Hace menos de una década se descubrió que un elemento clave en esta regulación es la hepcidina, pequeña hormona peptídica secretada por el hígado que media la internalización y degradación de la ferroportina, que es la molécula exportadora de hierro responsable de la entrada de hierro al plasma a partir de los enterocitos, los macrófagos y los hepatocitos. En consecuencia, el control de la expresión de la hepcidina representa el punto crítico para mantener el balance del hierro. 3,7 En estudios recientes se ha sugerido que la matriptasa 2 funciona como un regulador negativo de la expresión de la hepcidina. Esta regulación está mediada por la proteólisis de la hemojuvelina, proteína transmembrana sintetizada por el hepatocito que actúa como co-receptor de proteínas que activan la expresión de hepcidina. 8,9
La función de la TMPRSS6 en el mantenimiento de la homeostasia del hierro emerge del análisis de modelos murinos de mutaciones de la matriptasa. Se ha observado que los ratones con deficiencia en el gen Tmprss6 tienen una marcada elevación de la transcripción de hepcidina y muestran un evidente fenotipo de alopecia, anemia microcítica, bajos niveles de hierro plasmático y de las reservas corporales de hierro. 8,9 En humanos, se han identificado mutaciones heterocigóticas y homocigóticas bialélicas de la matriptasa en 14 pacientes en 3 estudios independientes. 2,10,11 Las sustituciones encontradas son múltiples y codifican proteínas con pérdida del dominio funcional proteasa. 3
Se estudiaron los defectos genéticos de 5 familias que presentaban anemia microcítica hipocrómica congénita, con volumen corpuscular medio (VCM) y saturación de la transferrina disminuidos. En estos pacientes, la anemia no se resuelve con el tratamiento con hierro oral y la respuesta a la administración de hierro parenteral es incompleta, de ahí la denominación de IRIDA. El análisis genético de estas familias indicó vinculación de esta anemia al cromosoma 22q12-13. Coincidentemente, el gen Tmprss6 está localizado dentro de este intervalo crítico y las mutaciones detectadas en la totalidad de las 5 familias estudiadas y en 2 individuos no relacionados con IRIDA, estaban localizadas en la región crítica para la supresión de la hepcidina mediada por la TMPRSS6. 7
Se ha demostrado que los pacientes con IRIDA por mutaciones de la TMPRSS6 se caracterizan por tener anemia microcítica hipocrómica y valores de hierro sérico muy bajos, siempre en el intervalo entre 2-5 µmol/L con niveles de hepcidina normales o ligeramente elevados, a pesar de la anemia severa. Estos individuos son refractarios a la ferroterapia y muestran una utilización anormal del mineral, evidenciada por una respuesta lenta e incompleta al hierro parenteral. En la mayoría de los casos, la anemia no fue detectada al nacimiento. 2,10,11 Los niveles de hepcidina inadecuadamente elevados en estos pacientes explican la fisiopatología de este desorden y la causa del fallo de la absorción del hierro de la dieta con un hierro sistémico deficiente, así como el fallo de la respuesta a los diferentes compuestos de hierro parenteral que debe ser procesado y exportado por los macrófagos antes de su utilización.5
Aunque la hepcidina es típicamente indetectable en pacientes con deficiencia de hierro, en los individuos con IRIDA sus niveles son inusualmente elevados, lo que concuerda con lo hallado en los ratones con mutaciones de Tmprss6. Esta elevada expresión crónica es la que previene la liberación de hierro de los enterocitos y macrófagos y explica por qué el hierro aplicado, tanto oral como parenteralmente, no es adecuadamente utilizado por estos pacientes. 7
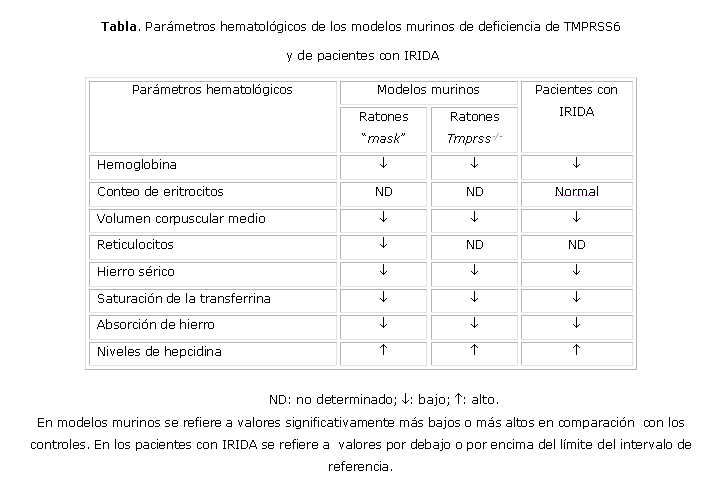
Aunque en muchos aspectos el fenotipo de los pacientes con IRIDA se asemeja al de los ratones deficientes de Tmprss6 2,8,9 (tabla), aún no está esclarecido por qué la aplicación del hierro oral y parenteral no logra normalizar la deficiencia de hierro en estos individuos, mientras que la anemia y la pérdida de pelo son resueltas con el tratamiento con hierro en ambos modelos murinos de deficiencia de Tmprss6. 7
Estudios recientes sugieren que la matriptasa 2 suprime la producción de hepcidina para permitir la incorporación adecuada de hierro. Por lo tanto, si la supresión de hepcidina activa falla por inactivación de la TMPRSS6 entonces la deficiencia de hierro prevalece. 7
Aún quedan muchas interrogantes acerca de la intervención de la matriptasa 2 en la homeostasia del hierro, pero parece que la modulación de esta serin proteasa tendría un futuro promisorio en el tratamiento clínico de desórdenes del metabolismo del hierro asociados con la desregulación de la expresión de la hepcidina. 4 Con la reciente identificación de la supresión de la expresión de la hepcidina a través de la proteólisis de la proteína de membrana, hemojuvelina, por la matriptasa 2, sería de gran interés confirmar en estudios futuros el estado in vivo de la hemojuvelina en pacientes con IRIDA en comparación con sujetos sanos. En conjunto, estos datos sugieren que la restauración de los niveles de hepcidina abre nuevas perspectivas clínicas para el tratamiento de la IRIDA u otros desórdenes en el metabolismo del hierro relacionados con alteraciones de la expresión de la hepcidina. 3
REFERENCIAS BIBLIOGRÁFICAS
1. Andrews NC. Forging a field: The golden age of iron biology. Blood 2008;112:219-30.
2. Finberg KE, Heeney MM, Campagna DR, Aydinok Y, Pearson HA, Hartman KR, et al. Mutations in TMPRSS6 cause iron-refractory iron deficiency anemia (IRIDA). Nat Genet 2008;40:569-71.
3. Ramsay AJ, Hooper JD, Folgueras AR, Velasco G, López-Otín C. Matriptase-2 (TMPRSS6): A proteolytic regulator of iron homeostasis. Haematologica 2009;94:840-9.
4. Finberg KE. Iron homeostasis: Casting new roles. Blood 2008;112:2181-3.
5. Iolascon A, De FLCO l, Beaumont C. Molecular basis of inherited microcytic anemia due to defects in iron acquisition or heme synthesis. Haematologica 2009;94:395-408.
6. Silvestri L, Pagani A, Nai A, De Domenico I, Kapplan J, Camaschella C. The serin protease matriptase-2 (TMPRSS6) inhibits hepcidin activation by cleaving membrane hemojuvelin. Cell Metab 2008;8:502-11.
7. Muckenthaler MU. Fine tuning of hepcidina expression by positive and negative regulators. Cell Metab 2008;8:1-3.
8. Folgueras AR, de Lara FM, Pendas AM, Garabaya C, Rodríguez F, Astudillo A, et al. Memebrane bound serin protease matriptase-2 (Tmprss6) is an esencial regulador of iron homeostasis. Blood 2008;112:2539-45.
9. Du X, She E, Gelbart T, Truksa J, Lee P, Xia Y, et al. The serin protease TMPRSS6 is required to sense iron deficiency. Science 2008;320:1088-92.
10. Miles MA, Can M, Congui R, Sale G, Barell S, Cao A, et al. A mutation in the TMPRSS6 gene, encoding a transmembrana serin protease that suppresses hepcdin production in familial iron deficiency anemia refractory to oral iron. Haematologica 2008;93:1473-9.
11. Guillem F, Lawson S, Kannengiesser C, Westerman M, Beaumont C, Grandchamp B. Two nonsense mutations in the TMPRSS6 gene in a patient with microcytic anemia and iron deficiency. Blood 2008;112:2089-91.
Recibido: 14 de septiembre del 2009.
Aprobado: 30 de septiembre del 2009.
MsC. Mariela Forrellat Barrios. Instituto de Hematología e Inmunología. Apartado 8070. Ciudad de La Habana, CP 10800, Cuba. Tel (537) 643 8268, 643 8695, Fax (537) 644 2334. e-mail: ihidir@hemato.sld.cu