Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.25 n.3 Ciudad de la Habana sep.-dic. 2009
PRESENTACIÓN DE CASOS
Asociación del virus herpes humano 8 y la hiperplasia linfoide nodular difusa del intestino delgado en la inmunodeficiencia variable común
Association between the human herpesvirus 8 and the diffuse nodular lymphoid hyperplasia of the small intestine in common variable immunodeficiency
Dra. Elena Kokuina I; Dr. Carlos Domínguez Álvarez I; Dr. Guillermo Noa Pedroso I; Dr. Pedro Ariel Martínez Rodríguez II; Dra. Vivian Kourí Cardellá II; Dr. Yoan Gutiérrez Pérez I; Dr. Agustín Chong López I; Dra. Delsy Marrero Hernández I; Dr. Guillermo Pérez Román I
I Hospital Clinicoquirúrgico "Hermanos Ameijeiras". Ciudad de La Habana, Cuba.
II Instituto de Medicina Tropical "Pedro Kourí". Ciudad de La Habana, Cuba.
RESUMEN
La inmunodeficiencia variable común (IDVC) es la inmunodeficiencia primaria más frecuente en el terreno clínico y sus formas de presentación son muy variables. Se describe una paciente con IDVC de adulto con síndrome diarreico crónico, pérdida de peso y linfoadenopatías difusas. Sus características inmunológicas más notables fueron una profunda hipogammaglobulinemia de las 3 clases mayores de inmunoglobulinas y la disminución numérica de las células B (CD19+) y células NK (CD3-CD56+) en sangre periférica. La biopsia del intestino delgado obtenida por panendoscopia asistida por video, reveló hiperplasia linfoide multinodular con atrofia parcial de las vellosidades. La inmunohistoquímica mostró que los nódulos consistían en centros germinales aumentados de tamaño con una distribución de células B (CD20+) y células T (CD3+), similar a la del folículo normal. No se encontró expresión diferencial de cadenas ligeras κ y λ. El método de la reacción en cadena de la polimerasa en tiempo real (QRT-PCR) detectó un número apreciable de copias del genoma del virus del herpes humano tipo 8 (VHH-8) (133 copias/µL de ADN) en el ADN del nódulo intestinal biopsiado. La infección con el VHH-8 puede ser un factor importante en la patogenia de los trastornos linfoproliferativos en pacientes con IDVC.
Palabras clave: inmunodeficiencia variable común (IDVC), virus herpes humano 8, hiperplasia linfoide del intestino.
ABSTRACT
The common variable immunodeficiency (CVID) is the more frequent primary immunodeficiency in clinical field and its presentation forms are very variable. We describe the case of a women presenting with adult CVID with chronic diarrhea syndrome, weight loss and diffuse lymphadenopathies, where the more marked immunologic features were a deep hypogammaglobulinemia of the three major kinds of immunoglobulins and numerical decrease of B cells (CD19+) and NK cells (CD3-CD56+) in peripheral blood. Biopsy of small intestine obtained by video-assisted panendoscope, showed the presence of a multinodular lymphoid hyperplasia with partial atrophy of hairinesses. Immunohistochemistry showed that nodules were high germinal centers with distribution of B cells (CD20+) and T cells (CD3+), similar to that of normal follicle. There was not differential expression of the K and λ light chains. The real time polymerase chain reaction (QRT-PCR) method detected many copies from the genome of type 8 human herpesvirus (VHH-8) (133 copies/µL of DNA) in biopsy of intestinal nodule DNA. VHH-8 infection may to be a significant factor in pathogenesis of lymphoproliferative disorders in patients presenting with CVID.
Key words: Common variable immunodeficiency (CVIN), human herpesvirus 8, intestine lymphoid hyperplasia.
INTRODUCCIÓN
La inmunodeficiencia variable común (IDVC) es una de las inmunodeficiencias primarias más frecuentes, con una incidencia entre 1 en 250 000 y 1 en 100 000 de individuos en los diferentes países.1 La IDVC afecta por igual a ambos sexos y tiene una distribución por edad bimodal, con un pico entre 1 y 5 años y otro entre 18 y 25 años de edad.2 Su patogénesis aún no ha sido establecida, pero se ha relacionado con defectos en la presentación antigénica,3 diferenciación de células B,4,5 y funcionamiento y activación de células T,6 lo cual da lugar a la hipogammaglobulinemia característica de la IDVC. La heterogeneidad de los defectos inmunológicos probablemente sea consecuencia de múltiples mutaciones génicas, las cuales podrían determinar también, al menos parcialmente, la variabilidad clínica de la IDVC.7 Aunque la presentación clínica varía ampliamente entre los pacientes, son las vías respiratorias y el tracto gastrointestinal los que reciben con mayor frecuencia y gravedad los embates de la IDVC.8
La afectación gastrointestinal (GI) se presenta hasta en el 62 % de los pacientes con IDVC y la manifestación más frecuente es la diarrea crónica con malabsorción.9 Se ha señalado que la enfermedad inflamatoria intestinal es la forma de presentación del 20 % de los pacientes con IDVC.10 La etiología de las manifestaciones GI no siempre ha podido ser demostrada, pero se ha atribuido a la presencia de infección, granulomas, trastornos linfoproliferativos y enfermedades autoinmunes del tracto GI.8,9,11,12 La infección con el virus herpes humano tipo 8 (VHH-8) se ha detectado en pacientes con IDVC afectados de enfermedad pulmonar intersticial y granulomatosa,13 pero el VHH-8 no ha sido asociado aún con la proliferación linfoide hiperplásica del tracto GI de pacientes con IDVC.
En este trabajo se describe una paciente con IDVC con síndrome de malabsorción asociado con una hiperplasia linfoide nodular difusa del intestino delgado y presencia del VHH-8 en el tejido hiperplásico intestinal.
PRESENTACIÓN DEL CASO
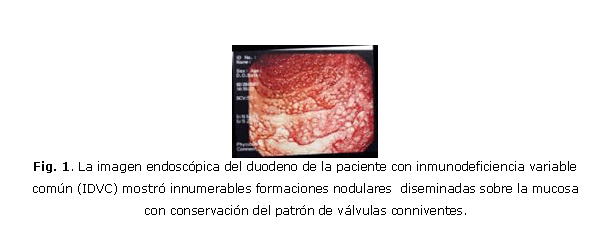
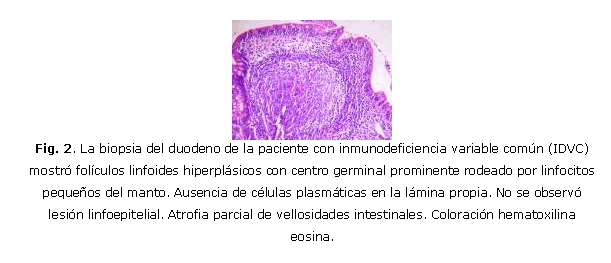
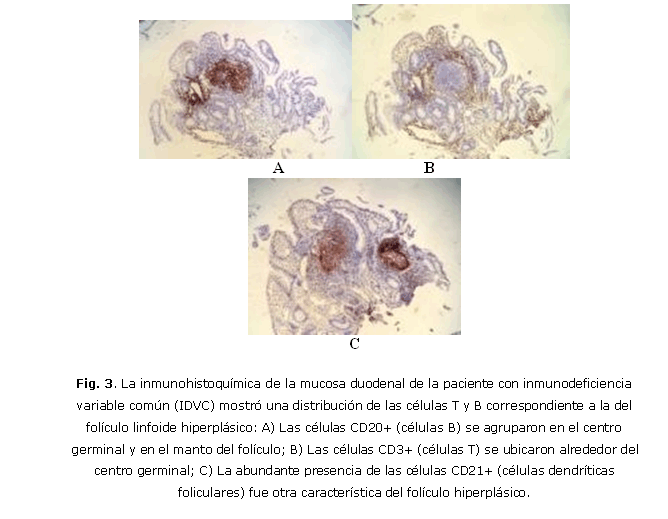
Paciente femenina, MBH, de 26 años, de raza caucásica según rasgos y color de piel, con historia de infecciones recurrentes de las vías respiratorias altas y bajas que desde hace 8 años presentó dispepsia seguida de dolor abdominal, deposiciones líquidas y pérdida de 25 libras de peso corporal en los últimos 6 meses. La tos productiva y un abdomen distendido saltaban a la observación. El examen físico reveló abdomen no doloroso; esplenomegalia ligera, sin hepatomegalia. Adenopatías palpables en regiones cervical, axilar e inguinal de 1,0-1,5 cm de diámetro, no adheridas ni dolorosas, confirmadas como inflamatorias por ecografía. Se evidenciaron lesiones inflamatorias bibasales por radiología simple de tórax y bronquiectasias bibasales por TAC. Los resultados de las pruebas funcionales respiratorias se correspondieron con una capacidad vital reducida asociada con enfermedad pulmonar restrictiva. Las cifras de hemoglobina fueron de 104 g/L; leucocitos: 7,8 x 103/ìL (segmentados: 73 %; linfocitos: 24 %; monocitos: 1 %; y eosinófilos: 2 %); plaquetas: 255 x 103/µL. El examen microbiológico de esputo para BAAR fue negativo. Las serologías de VIH, VDRL, los virus de hepatitis B y C, citomegalovirus humano (CMV) y virus de Epstein Barr (EBV) fueron negativas. Los exámenes inmunológicos mostraron: IgG: 0,53 g/L; IgA: 0,02 g/L; IgM: 0,04 g/L; C3: 1,357 g/L; C4: 0,315 g/L; y título de isohemaglutininas beta: 1:8. Las células fagocíticas en sangre periférica (SP) constituyó el 21 % (37-62 %). La citometría de flujo de SP cuantificó las siguientes subpoblaciones celulares: CD3+: 95 %(1672/µL); CD4+: 40 %(704/µL); CD8+: 49 %(862/µL); CD25+ (CD4+): 26 %(183/µL); CD45RA+(CD4+): 56 % (394/µL); CD19+: 2 %(35/µL); CD27+(CD19+): 57 %(20/µL); CD3-CD56+: 4 %(70/µL). Proteínas séricas totales: 53g/L; albúmina sérica: 37g/L, ASAT: 63u/L; ALAT: 100u/L; creatinina sérica: 57µmol/L. La excreción urinaria de proteínas fue negativa. Las infecciones recurrentes de las vías respiratorias altas y bajas con lesiones permanentes de bronquiectasia y la marcada disminución de las 3 clases mayores de Igs séricas, determinaron el diagnóstico de IDVC. Las cifras normales de albúmina sérica y la ausencia de proteínas en la orina descartaron la hipogammaglobulinemia secundaria a enteropatía y nefropatía. La laparoscopia mostró hígado de tamaño normal con aspecto congestivo y bazo ligeramente aumentado de tamaño. En la biopsia hepática se encontró esteatosis severa, sin granulomas ni infiltración linfomatosa. Los resultados de colonoscopia y rectoscopia fueron normales. Se realizó panendoscopia asistida por vídeo que mostró esófago normal; estómago con zonas eritematosas correspondientes con gastritis eritematosa del antro y cuerpo de moderada intensidad asociada con la presencia de Helicobacter pylori diagnosticado por histología. La mucosa del duodeno y asas yeyunales proximales se encontró cubierta en toda su extensión por innumerables formaciones nodulares de diámetro ~ 5mm, de coloración de la mucosa adyacente (fig. 1). Los pliegues y el peristaltismo se mantuvieron en ambas regiones. La biopsia mostró una duodeno-yeyunitis crónica folicular (hiperplasia linfoide multifocal polipoidea) con atrofia parcial de vellosidades intestinales y marcada disminución del número de células plasmáticas en la lámina propia (fig. 2). No se encontró lesión linfoepitelial para plantear linfoma de tipo MALT (del inglés, tejido linfoide asociado a mucosa). No se detectó Giardia L. en la biopsia de duodeno y yeyuno. La inmunohistoquímica mostró una hiperplasia linfoide nodular severa con conservación de la arquitectura y notable proliferación de células T (CD3+) y células B (CD20+) (figs. 3A, 3B y 3C). La presencia simultánea de las cadenas kappa y lambda desestimó la clonalidad. Se instauró tratamiento con metronidazol (4 x2 50mg/día), amoxicilina (2 x 000mg/día) y omeprazol (2 x 20mg/día) durante 15 días, para erradicar H. pylori. Se inició la administración endovenosa de gammaglobulinas humanas (IGEV) (400 mg/kg/mes) (Intacglobin 5 %, La Habana). La administración de IGEV elevó las cifras de IgG sérica a 7,02 g/L , que decayeron a 4,82 g/L a las 4 semanas. La evolución clínica fue favorable, la dispepsia y la diarrea desaparecieron, la paciente recuperó su peso corporal. Dos meses después se repitió la panendoscopia, la cual mostraba a nivel del estómago, gastritis leve y ausencia del H pylori, y en duodeno y yeyuno, la morfología de la hiperplasia linfoide nodular difusa macro y microscópicamente observada en la endoscopia anterior. El estudio inmunohistoquímico mostró iguales características que el anterior. Un fragmento de tejido de yeyuno biopsiado fue analizado por el método de la reacción en cadena de la polimerasa (PCR) anidada múltiple para la presencia de los virus del herpes simple 1 y 2 (VHS1 y VHS2), virus del herpes zóster (VHZ), CMV, virus del herpes humano 6 (VHH-6) y EBV, con resultados negativos. La técnica de la reacción en cadena de la polimerasa en tiempo real (PCR-QRT) detectó 133 copias del genoma del virus del herpes humano tipo 8 (VHH-8)/µL de ADN del tejido yeyunal. Durante este corto tiempo de evolución (cerca de 3 meses), la paciente ha continuado con buen estado de salud, sin administración de antibióticos ni otros fármacos. Los resultados evolutivos del hemograma, leucograma y química sanguínea se encontraban en el rango normal.
DISCUSIÓN
Se ha descrito una paciente con diagnóstico de IDVC de adulto con hiperplasia linfoide nodular difusa del intestino delgado asociada con la presencia del VHH-8 en el tejido intestinal hiperplásico. A diferencia de otros virus, cuya presencia ha sido bien reconocida en los pacientes con IDVC, como los virus de la hepatitis, CMV, EBV y VHZ,14 el VHH-8 solo recientemente ha sido vinculado con la IDVC.13 El VHH-8 es un virus herpes- γ, que también se conoce como el virus asociado con el sarcoma de Kaposi.15 En los estados de inmunodeficiencia secundaria, como en los pacientes con VIH y transplantados, el VHH-8 representa un patógeno oportunista que se asocia con el desarrollo de enfermedades linfoproliferativas como el linfoma de efusión primario y la enfermedad de Castleman.16 El VHH-8 pudiera también invadir de forma oportunista los tejidos de los pacientes con IDVC, en virtud de la linfopenia y de la disfunción de células T que en ocasiones acompañan esta inmunodeficiencia. Aunque nuestra paciente tenía valores normales de linfocitos CD3+ y CD4+ circulantes, el carácter oportunista de la infección del VHH-8 del tracto intestinal puede estar justificado por su profunda inmunodeficiencia humoral, dada por la ausencia casi absoluta de las 3 clases mayores de Igs, y en particular, de la IgA, cuya presencia es esencial en la defensa de las mucosas, y además, por el déficit relativo y absoluto de las células NK (CD3-CD56+) especializadas en la protección frente a los virus.
La presencia del VHH-8 en la mucosa intestinal constituye un ejemplo de la amplitud del rango tisular de infección de este virus, lo cual ya se había advertido en estudios anteriores, en los que se detectó la presencia del VHH-8 en diversos tipos de tejidos humanos como pulmón, SP, ganglio linfático, médula ósea, hígado, colon e intestino delgado.13
Por el método PCR-QRT se ha detectado un número apreciable de copias (133/ copias/µL) del genoma del VHH-8 en el ADN del tejido yeyunal, aunque este fue inferior a las cifras medias de copias del VHH-8 en los tumores malignos inducidos por este virus, que alcanzan el orden de miles.17 No obstante, si consideramos el carácter masivo y la extensión de los nódulos hiperplásicos en toda la longitud del duodeno y al menos gran parte del yeyuno, la carga viral total del intestino cobra una gran magnitud. Esta considerable carga viral probablemente haya invertido el balance de las células CD4+/CD8+ a favor de las CD8+, las cuales predominaron en la SP de la paciente.
No creemos que la IGEV haya sido una fuente de transmisión de la infección del VHH-8, primeramente, porque la lesión hiperplásica estaba presente con anterioridad a la administración de la IGEV. Además, porque solo se administraron 2 dosis de IGEV antes de la detección del VHH-8, porque la prevalencia del virus en la población es baja (1,2 % de positivos de VHH-8 entre donantes de sangre negativos de VIH),18 y por la bioseguridad de la IGEV administrada. Para definir el modo de transmisión del VHH-8 podría ser útil realizar estudios de prevalencia del virus en mayor número pacientes con IDVC y otras inmunodeficiencias primarias.
La hiperplasia linfoide nodular del intestino se presenta en una parte importante (8-30 %) de los pacientes con IDVC 8,12,19,20 y representa una lesión proliferativa policlonal que en ocasiones antecede al desarrollo del linfoma del intestino delgado.9,21 Existen evidencias circunstanciales que indican que la estimulación antigénica crónica, oculta, producida por una infección, puede conducir a la proliferación linfocítica anormal y finalmente, al desarrollo de la neoplasia linfoide.21-23 En este contexto, la hiperplasia linfoide podría representar un estado de transición a la malignidad. Wheat y colaboradores, han hecho un aporte importante respecto al papel de los virus en la linfoproliferación al demostrar la presencia del VHH-8 en 6 de los 9 pacientes con la enfermedad pulmonar granulomatosa y linfomatosa de la IDVC.13 Se ha descrito también la proliferación benigna reactiva del tejido linfoide del bronquio asociada con la presencia del EBV en un paciente con IDVC.24 Y más recientemente, se han aportado evidencias acerca de la estimulación de la respuesta celular T específica de otro virus herpes, el CMV, en pacientes con IDVC con complicaciones inflamatorias del intestino y linfoma.25 La infección por el VHH-8 demostrada en los nódulos intestinales hiperplásicos pudo haber contribuido a otras manifestaciones linfoproliferativas de nuestra paciente, como la esplenomegalia y las linfadenopatías difusas. La IDVC se considera una enfermedad compleja con riesgo elevado de padecer linfoma. Como es reconocido por varios modelos tumorales, se requieren múltiples hits o eventos para inducir una clona de células malignas.23 La identificación de la asociación entre hiperplasia linfoide difusa del intestino y el VHH-8, señala que este virus pudiera ser un factor importante en las alteraciones linfoproliferativas de la IDVC. Una definición más exacta del papel del VHH-8 en la patogénesis de los trastornos linfoproliferativos de la IDVC, requiere de diseños clínicos y experimentales adicionales. El déficit cuantitativo de las células NK encontrado en la paciente sugiere que la presencia y función de estas células deben ser consideradas, además de las células B y T, para la clasificación de los pacientes con IDVC.
REFERENCIAS BIBLIOGRÁFICAS
1. Hammarstrom L, Vorechovsky I, Webster D. Selective IgA deficiency (SIgAD) and common variable immunodeficiency (CVID). Clin Exp Immunol 2000;120:22531. 2. Hermaszewski RA, Webster AD. Primary hypogammaglobulinaemia: A survey of clinical manifestations and complications. Q J Med 1993;86:31-42.
3. Bayry J, Lacroix-Desmazes S, Kazatchkine MD, Galicier L, Lepelletier Y, Webster D, et al. Common variable immunodeficiency is associated with defective functions of dendritic cells. Blood 2004;104:24413.
4. Wehr C, Kivioja T, Schmitt C, Ferry B, Witte T, Eren E, et al. The EUROclass trial: Defining subgroups in common variable immunodeficiency Blood 2008;111:77-85.
5. Taubenheim N, von Hornung M, Durandy A, Warnatz K, Corcoran L, Peter HH, et al. Defined blocks in terminal plasma cell differentiation of common variable immunodeficiency patients. J Immunol 2005;175:5498503.
6. Boncristiano M, Majolini MB, D'Elios MM, Pacini S, Valensin S, Ulivieri C, et al. Defective recruitment and activation of ZAP-70 in common variable immunodeficiency patients with T cell defects. Eur J Immunol 2000;30: 26328.
7. Casanova JL, Fieschi C, Zhang SY, Abel L. Revisiting human primary immunodeficiencies. J Intern Med 2008; 264:11527.
8. Cunningham-Rundles C, Bodian C. Common variable immunodeficiency: Clinical and immunological features of 248 patients. Clin Immunol 1999;92:34-48.
9. Washington K, Stenzel TT,Buckley RH, Gottfried MR. Gastrointestinal pathology in patients with common variable immunodeficiency and X-linked agammaglobulinemia. Am J Surg Pathol 1996;20:1240 52. 10. Kutukculer N, Yagci RV, Aydogdu S, Aksu G, Genc B. Chronic inflammatory bowel disease in a patient with common variable immunodeficiency. Turk J Pediatr 2001; 43: 8890.
11. Knight AK, Cunningham-Rundles C. Inflammatory and autoimmune complications of common variable immunodeficiency. Autoimmun Rev 2006;5:1569.
12. Quinti I, Soresina AR, Spadaro G, Martino S, Donnanno S, Agostini C et al. Long-term follow-up and outcome of a large cohort of patients with common variable immunodeficiency. J Clin Immunol 2007;27:308-16.
13. Wheat W, Cool C, Morimoto Y, Rai PR, Kirkpatrick CH, Lindenbaum BA, et al. Possible role of human herpes virus 8 in the lymphoproliferative disorders in common variable immunodeficiency. J Exp Med 2005;202:479- 84.
14. Park MA, Li JT, Hagan JB, Maddox DE, Abraham RS. Common variable immunodeficiency: A new look at an old disease. Lancet 2008;372:489502.
15. Chang Y, Cesarman E, Pessin MS, Lee F, Culpepper J, Knowles DM et al. Identification of new herpes-like DNA sequences in AIDS associated Kaposi's sarcoma. Science 1994;266:18659.
16. Parravicini C, Chandran B, Torbellino M, Berti E, Paulli M, Moore PS, et al. Differential viral protein expression in Kaposi's sarcoma-associated herpesvirus-infected diseases: Kaposi's sarcoma, primary effusion lymphoma, and multicentric Castleman's disease. Am J Pathol 2000;156:7439.
17. Kouri V, Martinez P A, Acosta B, Rodriguez M E, Blanco O, Capo V, et al. First report of Kaposi's sarcoma-associated herpesvirus DNA sequences from Cuban Kaposi's sarcoma patients without HIV infection. AIDS 2007; 21:2113-5.
18. Kouri V, Marini A, Nambiar S, Rodriguez ME, Capo V, Resik S, et al. Nearly identical strains of human herpesvirus 8 in couples discordant for Kaposi´s sarcoma. AIDS 2007; 21: 765-8.
19. Ensoli B, Sturzl M, Monini P. Cytokine-mediated growth promotion of Kaposi's sarcoma and primary effusion lymphoma. Semin Cancer Biol 2000;10:367-81.
20. Sander C, Medeiros LJ, Weiss L M, Yano T, Sneller MC, Jaffe ES. Lymphoproliferative lesions in patients with common variable immunodeficiency syndrome. Am J Surg Pathol 1992;16:1170-82. 21. Castellano G, Moreno D, Galvao O, Ballestin C, Colina F, Mollejo M, et al. Malignant lymphoma of jejunum with common variable hypogammaglobulinemia and diffuse nodular hyperplasia of the small intestine: A case study and literature review. J Clin Gastroenterology 1992;15:128-35.
22. Cunningham-Rundles C, Cooper DL, Duffy TP, Strauchen J. Lymphomas of mucosal associated lymphoid tissue in common variable immunodeficiency. Am J Hematol 2002;69:171-8.
23. Chua I, Quinti I, Grimbacher B. Lymphoma in common variable immunodeficiency: Interplay between immune dysregulation, infection and genetics. Curr Opin Hematol 2008;15:36874.
24. Collins J, Muller NL, Leung AN, McGuiness G, Mergo PJ, Flint JD, et al. Epstein-Barr virus-associated lymphoproliferative disease of the lung: CT and histological findings. Radiology 1998;208:74959.
25. Raeiszadeh M, Kopycinski J, Paston S, Diss T, Lowdell M, Hardy GAD, et al. The T cell response to persistent herpes virus infections in common variable immunodeficiency. Clin Exp Immunol 2006;146:23442.
Recibido: 14 de agosto del 2009.
Aprobado: 30 de agosto del 2009.
Dra. Elena Kokuina. Hospital Clinicoquirúrgico «Hermanos Ameijeiras». San Lázaro, Nº 701, Centro Habana, 10300. Ciudad de La Habana, Cuba. E-mail: inmunologia@hha.sld.cu