Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.26 n.1 Ciudad de la Habana ene.-mar. 2010
ARTÍCULO ORIGINAL
Detección de anticuerpos contra la proteína de fusión PML/RARa en la leucemia promielocítica
Detection of antibodies to PM:/RARa fusion protein in promyelocytic leukemia
DrC. Rinaldo Villaescusa BlancoI; Lic. Ada A. Arce HernándezI; Lic. Julio C. Merlín LinaresI; Lic. Ana M. Guerreiro HernándezI; Lic. Beatriz Socarrás FerrerI; Lic. Lázaro O. del Valle PérezI; DraC. Consuelo Macías AbrahamI; Dra. Rosa M. Lam DíazI; DrC. Porfirio Hernández RamírezI
IInstituto de Hematología e Inmunología. Ciudad de La Habana, Cuba.
RESUMEN
La leucemia promielocítica (LPM) está asociada con características genéticas únicas que incluyen la translocación recíproca t(15;17)(q22;q12) con la formación del complejo PML-RARa, el cual representa más del 95 % de las proteínas de fusión en la LPM y resulta una diana potencial de la respuesta inmune. Los tratamientos actuales conocidos por terapias de diferenciación combinan el ácido trans retinoico (ATRA) y las antraciclinas, así como el trióxido de arsénico; resultan en una sobrevida a largo plazo y la cura potencial aproximadamente entre el 70 y 80 % de los pacientes. En estudios realizados en ratones con LPM inmunizados con una vacuna de ADN elaborada mediante la fusión del oncogen PML-RARa al fragmento C de la toxina tetánica como adyuvante, conjuntamente con ATRA, se produjeron títulos elevados de anticuerpos. Se logró una sobrevida significativa, entre 120-300 días, comparada con la de ratones a los que se administró placebo. En nuestro trabajo se detectó la presencia de anticuerpos contra la proteína de fusión PML-RARa en diferentes fases del tratamiento, lo que indica la capacidad de respuesta de estos pacientes frente al antígeno tumoral. Los anticuerpos anti PML-RARa se detectaron en aquellos pacientes sin tratar y en fase de inducción, no así en la consolidación y mantenimiento, de ahí su posible utilidad como marcador de diferenciación celular a partir de la presencia o ausencia de la proteína de fusión en la célula leucémica.
Palabras clave: leucemia promielocítica, proteína de fusión PML-RARa, anticuerpos anti PML-RARa.
ABSTRACT
Promyelocytic leukemia (PML) is associated with unique genetic features including the t reciprocal translocation (15; 17) (q22; q22) with PML-RARa, which accounted for more than 95 % of fusion protein in PML and is a potential target of immune response. The current treatments known as differentiation therapies combine the trans-retinoic acid (TRA) and the anthracyclines, as well as the trioxide arsenic (As203); become in a long-term survival and the potential cure in about the 70 to 80 % of patients. In studies conducted in LPM-mice immunized with a DNA vaccine made the PML-RARa oncogene fusion to C fragment of tetanus toxin as coadjuvant together with TRA were antibodies high titers. It was possible to achieve a significant survival among 120-130 days compared with that of placebo-mice. In our paper it was detected the presence of antibodies to PML-RARa fusion protein in different phases of treatment indicating the response to these patients to tumor antibody. The anti-PML-RARa were detected in those non-treated patients and in induction fusion, but not in consolidation and maintenance, thus its potential usefulness as cellular differentiation marker from presence or absence of fusion protein un leukemic cell.
Key words: Promyelocytic leukemia, PML-RARa fusion protein, anti-PML-RARa antibodies.
INTRODUCCIÓN
La leucemia promielocítica (LPM) subtipo M3 en la clasificación FAB de las leucemias mieloides agudas (LMA), representa del 5-15 % de estas.1 Ha devenido en la enfermedad más curable de todos los subtipos de LMA. Los tratamientos actuales que combinan el ácido trans retinoico (ATRA), las antraciclinas y el trióxido de arsénico, resultan en una sobrevida a largo plazo y la cura potencial en alrededor del 70 al 80 % de los pacientes (terapia de diferenciación).2-4
La enfermedad está asociada con características genéticas únicas que incluyen la translocación recíproca t(15;17)(q22;q12) con la formación del complejo PML-RARa, cuya detección permite un diagnóstico preciso. Este complejo se considera, además, el marcador para la identificación de enfermedad mínima residual y recurrente.5 El mecanismo por el que ocurre la translocación t(15;17) no se conoce.
Existe poca información acerca de la respuesta inmune de pacientes con LPM dirigida contra las células tumorales. No se conoce hasta el momento si la proteína PML-RARa puede ser presentada y procesada correctamente por las células leucémicas o por células presentadoras de antígenos a través de moléculas del complejo principal de histocompatibilidad.6,7
En las leucemias de estirpe mieloide en humanos, las proteínas de fusión que resultan de translocaciones recíprocas son una fuente de antígenos específicos asociados con el tumor. El complejo proteico PML-RARa representa más del 95 % de las proteínas de fusión en la LPM y resulta una diana potencial de la respuesta inmune, de ahí que nos propusiéramos estudiar la posible presencia de anticuerpos contra el complejo de fusión PML-RARa en pacientes con diagnóstico de LPM.
MÉTODOS
Se estudiaron 19 pacientes con diagnóstico de LMA-M3, de acuerdo con el criterio morfológico y citoquímico establecido en la clasificación FAB y que eran PML-RARa positivos en el estudio molecular, todos provenientes de los servicios de clínica de adultos y clínica pediátrica del Instituto de Hematología e Inmunología.
La detección de anticuerpos contra el complejo de fusión PML-RARa en el suero de pacientes con LPM se realizó mediante inmunofluorescencia indirecta, empleando como diana un extendido de células mononucleares aisladas de la sangre periférica de un paciente PML-RARa (+).8 Como controles positivos se utilizaron células aisladas de un paciente PML-RARa (+) incubadas con suero de paciente con cirrosis biliar primaria (anti PML); y como controles negativos, células aisladas de paciente PML-RARa (+) incubadas con suero de pacientes PML/RARa (-) y con suero de donantes sanos.
RESULTADOS
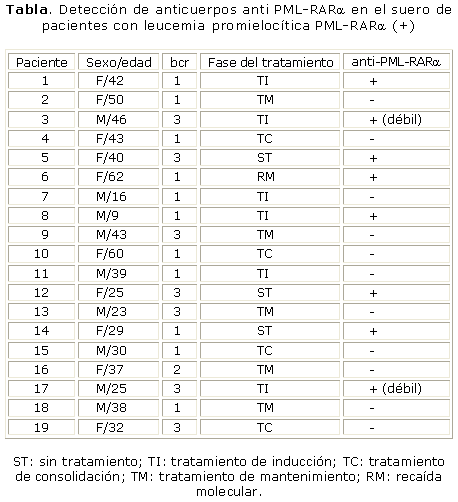
Se demostró la presencia de anticuerpos anti PML-RARa en 7 pacientes con LPM PML-RARa (+): 3 sin tratamiento y 4 en fase de inducción, no así en los pacientes estudiados que estaban en fase de mantenimiento y consolidación (tabla).
DISCUSIÓN
En estudios realizados en ratones con LPM inmunizados con una vacuna ADN elaborada por la fusión del oncogen PML-RARa al fragmento C de la toxina tetánica como adyuvante conjuntamente con ATRA, se produjeron títulos elevados de anticuerpos, con lo que se logró una sobrevida significativa, entre 120-300 días, en comparación con los ratones no tratados, en los que no se demostró la presencia de anticuerpos. Estos resultados sugieren el posible efecto protector de los anticuerpos al prolongar la remisión clínica.9
En nuestro trabajo se detectó la presencia de anticuerpos contra la proteína de fusión PML-RARa en diferentes fases del tratamiento, lo que indica la capacidad de respuesta de estos pacientes frente al antígeno tumoral. Es de señalar que los anticuerpos se detectaron, fundamentalmente, en los pacientes sin tratar y en fase de inducción, no así en la consolidación y mantenimiento, de ahí su posible utilidad como marcador de la presencia o ausencia de la proteína de fusión en la célula leucémica. La paulatina desaparición o ruptura de la proteína de fusión PML-RARa debida al tratamiento empleado, puede provocar la disminución en la síntesis de anticuerpos específicos en estos pacientes.
No se demostró correlación entre las diferentes isoformas del complejo de fusión PML-RARa, bcr1, bcr2, bcr3 y la presencia de anticuerpos específicos, lo que pudo deberse al pequeño tamaño de la muestra estudiada.
Resultaría importante profundizar en el estudio de la respuesta inmune en esta enfermedad en un número mayor de pacientes, así como el estudio longitudinal que permita establecer un posible efecto protector de los anticuerpos estudiados que favorezca la diferenciación celular.
REFERENCIAS BIBLIOGRÁFICAS
1. Avvisati G, Lo Coco F, Mandelli F. Acute promyelocytic leukemia: Clinical and morphologic features and prognostic factors. Sem Hematol 2001;38:4-12.
2. Degos L, Wang ZY. All trans retinoic acid in acute promyelocytic leukemia. Oncogene 2001;20:7140-5.
3. Jing Y. The PML-RAR alpha fusion protein and targeted therapy for acute promyelocytic leukemia. Leuk Lymphoma 2004;45:639-48.
4. Tallman MS. What is the role of arsenic in newly diagnosed APL? Best Pract Res Clin Haematol 2008;21:659-66.
5. Gameiro P, Vieira S, Carrara P. The PML-RARa transcript in long term follow-up of acute promyelocytic leukemia patients. Haematologica 2001;86:577-85.
6. Dermime S. Lack of T-cell mediated recognition of the fusion region of the PML-RARa hybrid protein by lymphocytes of acute promyelocytic leukemia patients. Clin Cancer Res 1996;2:593-600.
7. Gambacorti-Passerini C. Human CD 4 lymphocytes specifically recognize a peptide representing the fusion region of the hybrid protein PML-RARa present in acute promyelocytic leukemia cells. Blood 1993;81:1369-75.
8. Gomis F, Sanz J, Sempere A, Plume G, Senent ML, Pérez ML, et al. Immunofluorescent analysis with the anti PML monoclonal antibody PG-M3 for rapid and accurate genetic diagnosis of acute promyelocytic leukemia. Ann Hematol 2004;83:687-90.
9. Padua RA, Larghero J, Robin M, le Pogam C, Schlageter MH, Muszlak S, et al. PML-RARa-targeted DNA vaccine induces protective immunity in mouse model of leukemia. Nature Medicine 2003;10:1-4.
Recibido: 6 de noviembre de 2009.
Aprobado: 27 de noviembre de 2009.
DrC. Rinaldo Villaescusa Blanco. Instituto de Hematología e Inmunología. Apartado 8070. Ciudad de La Habana, CP 10800, Cuba. Tel (537) 643 8268, Fax (537) 644 2334. E-mail: ihidir@hemato.sld.cu y http://www.sld.cu/sitios/ihi