Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión impresa ISSN 0864-0289
Rev Cubana Hematol Inmunol Hemoter vol.27 no.4 Ciudad de la Habana oct.-dic. 2011
ARTÍCULO ORIGINAL
Algunas variables clínicas y de laboratorio en pacientes adultos con leucemia mieloide crónica tratados con interferón alfa recombinante + citosina arabinósido
Some clinical and laboratory variables in adult patients with chronic myeloid leukemia treated with recombinant alpha interferon + cytosine arabinoside
Dr. Edgardo Espinosa MartínezI, Dra. Carmen Virginia Díaz DuránII, Dr. Onel Ávila CabreraI, Dr. Carlos Hernández PadrónI, Dr. Luis Ramón RodríguezI, Dra. Lisset Izquierdo CanoI, Dra. Ana María Amor VigilI, Dra. Kalia Lavaut SánchezI, Dr. Edgardo Espinosa EstradaI, Dra. Maura Wade MateoI, DraC. Marianela Estrada del CuetoI
I Instituto de Hematología e Inmunología. La Habana, Cuba.
II Policlínico Docente La Rampa. La Habana, Cuba.
RESUMEN
La leucemia mieloide crónica del adulto es la hemopatía maligna más frecuente dentro de los síndromes mieloproliferativos. En un estudio retrospectivo longitudinal realizado entre enero de 1985 y diciembre de 2009, se evaluaron 46 pacientes en fase crónica atendidos en el Instituto de Hematología e Inmunología. Todos recibieron tratamiento inicial citorreductor y posteriormente interferón a recombinante (INFar) + citosina arabinósido. El 41,0 % de los enfermos presentó un índice pronóstico de Sokal de alto riesgo. Las manifestaciones clínicas más frecuentes al diagnóstico fueron astenia (37 %), esplenomegalia (31 %) y pérdida de peso (28,3 %). La respuesta hematológica parcial y completa fue del 26,8 % y 65,9 % a los 6 meses; la respuesta citogenética y molecular completa de 9,1 % y 16,3 %, respectivamente. Las reacciones adversas más frecuentes fueron fiebre (34,9 %), trombocitopenia (26,2 %) y síndrome general (23,8 %). El 47,8 % de los casos mostraron resistencia o intolerancia al INFar y el 90,9 % falleció por progresión de la enfermedad. La sobrevida global a los 5 años fue del 63,8 % y la sobrevida libre de eventos a los 3 años fue del 68,9 %. Según el índice pronóstico de Sokal, la sobrevida global mostró diferencia significativa entre los 3 grupos (p= 0,005), no así para la sobrevida libre de eventos (p= 0,165). El tratamiento con INFar mostró resultados superiores a los de algunos países desarrollados y constituye una opción terapéutica eficaz en Cuba.
Palabras clave: Leucemia mieloide crónica, interferón a recombinante, citosina arabinósido.
ABSTRACT
Chronic myeloid leukemia is the most frequent myeloproliferative syndrome in adults. In a longitudinal retrospective study performed between January 1985 - December 2009, 46 patients in chronic phase diagnosed at the Institute of Hematology and Immunology were evaluated. They received cytoreductor agent as first treatment followed by interferon a2 + cytosar. Forty one percent showed high risk Sokal prognosis score. The most frequent clinical manifestations at diagnosis were asthenia (37 %), splenomegaly (31 %) and weigh lost (28.3 %). The partial and complete hematological response was of 26,8 % and 65.9 % after 6 months and the complete cytogenetic and molecular response was of 9.1 % and 16.3 %. The most frequent adverse reactions were: fever (34.9 %), thrombocytopenia (26.3 %) and general syndrome (23.8 %). Resistance or intolerance to INFa2 was found in 47.8 % of the patients and 90.0 % died due to progression of the disease. The 5 year overall survival was of 63.8 % and the 3 years free event survival was of 68.9 %. According to Sokal prognosis score the overall survival showed significant difference between groups (p= 0.005) but there was no significant difference for free event survival (p= 0.165). The INFa2 treatment in our patients showed better results than those obtained in different developed countries and is an effective therapeutic option in Cuba.
Key words: Chronic myeloid leukemia, recombinant interferon, cytosine arabinoside.
INTRODUCCIÓN
La leucemia mieloide crónica (LMC) es una enfermedad clonal de las células madre hematopoyéticas en la cual la traslocación recíproca t(9; 22)(q34;q11) forma el cromosoma Filadelfia (Ph) y crea un nuevo gen fusionado BCR-ABL.1
Representa el 715 % de las leucemias en el adulto y es la primera enfermedad en la que se demostró que una alteración cromosómica específica estaba directamente unida con la patogénesis.2,3
Desde el punto de vista hematológico y clínico, se caracteriza por leucocitosis, trombocitosis y esplenomegalia, aunque en algunos pacientes se puede presentar sin síntomas ni signos evidentes de la enfermedad. Presenta 3 fases: crónica, acelerada y crisis blástica. La historia natural de la progresión de la fase crónica "benigna" a la crisis blástica fatal, demora como promedio de 3 a 5 años.3,4
En la literatura se describe que alrededor del 50 % de los pacientes presentan leucocitosis a expensas de neutrófilos y mielocitos con representación de todos los estados de maduración. También se puede encontrar basofilia absoluta, anemia y trombocitosis.2,4-6
El índice más utilizado para evaluar el pronóstico de la enfermedad es el de Sokal, aunque también de emplean los de Kantarjian y Hasford.7-9
A partir de 1856 se han aplicado diferentes tratamientos para estos pacientes (solución de Fowler, radioterapia, entre otros).3,5,6 En 1953 surgió el busulfán; la hidroxiurea (HU) se comenzó a administrar a partir de 1972 y a inicios de la década de los 80 del siglo pasado, el interferón (IFN) y el INFa recombinante (INFar). Ambos demostraron ser más efectivos y menos tóxicos que los empleados con anterioridad. El INFar comenzó a utilizarse solo o en combinación con un citostático ya conocido: la citosina arabinósido (CA). A finales del siglo XX se desarrolló una nueva droga, el mesilato de imatinib (Glivec), con la cual se alcanzó una respuesta hematológica, clínica y molecular superior a la alcanzada con el IFNar,6,10 y en la actualidad se utiliza con resultados alentadores en pacientes que presentan resistencia o intolerancia al INFar. A inicios de la primera década del siglo XXI se comenzaron a utilizar otros 2 nuevos medicamentos cuya eficacia se ha demostrado en pacientes resistentes al Glivec: el Dasatinib y el Nilotinib.11,12
Los resultados de diversos investigadores indican que el IFNar induce la remisión hematológica en el 70-80 % de los pacientes con LMC no tratados y que se alcanza la remisión completa (remisión hematológica, citogenética y molecular) en el 5 25 % de los casos. La sobrevida global (SG) a los 5 años es del 42 % en los pacientes que recibieron quimioterapia, mientras que en los que fueron tratados con INFar alcanza el 57 %.13,14
El objetivo de este trabajo es la caracterización hematológica y clínica de los pacientes tratados con INFar + CA en el Instituto de Hematología e Inmunología (IHI) y la evaluación de la efectividad de este tratamiento en la SG y sobrevida libre de eventos (SLE).
MÉTODOS
Se realizó un estudio retrospectivo longitudinal en el que se revisaron las historias clínicas de pacientes adultos diagnosticados con LMC Ph+ en fase crónica (FC), atendidos en el IHI en el período comprendido entre enero de 1985 y diciembre de 2009, y que recibieron tratamiento inicial citorreductor y posteriormente INFar en combinación con CA.
El INFar fue suministrado por el Centro de Ingeniería Genética y Biotecnología (CIGB) de La Habana, Cuba.15
El diagnóstico de LMC Ph+ se realizó al inicio de la enfermedad mediante interrogatorio y examen físico, hemograma completo,16 aspirado y biopsia de médula ósea,17 estudio citogenético en médula ósea por la técnica de banda G para detectar la presencia del cromosoma Ph,18 estudio molecular para confirmar fusión del gen BCR-ABL.19
Se determinó el índice pronóstico de Sokal que clasifica a los pacientes de acuerdo con variables clínicas y de laboratorio en: bajo riesgo (BR), riesgo intermedio (RI) y alto riesgo (AR).7
Criterios de inclusión14
Pacientes adultos que se encontraban en FC al inicio de la enfermedad (menos de 10 % de blastos y promielocitos en médula ósea) y que recibieron tratamiento con INFar después del tratamiento citorreductor inicial. Presencia de reordenamiento del gen BCR/ABL. Presencia del cromosoma Ph.
Criterios de exclusión
Pacientes que estaban al inicio en fase acelerada (FA) o en crisis blástica (CB); pacientes que recibieron previamente tratamiento con régimen de quimioterapia intensiva.
Criterios de resistencia al IFNar
Ausencia de remisión hematológica completa a los 6 meses de tratamiento. Recaída hematológica con conteo de leucocitos igual o mayor a 20 × 109/L. Aparición o aumento de la esplenomegalia. Fallo citogenético: ausencia de respuesta citogenética mayor (RCM) en 12 meses o pérdida de la RCM con 36 % o más de incremento de metafases Ph+ (respuesta citogenética menor; RCm) o ausencia de respuesta citogenética.18,19
Criterios de intolerancia al IFNar
Toxicidad hematológica o no hematológica que persista por un mes o más.20
Esquema terapéutico
Se inició tratamiento de citorreducción con uno o más de los siguientes medicamentos: HU (50100 mg/kg de peso) de acuerdo con la cifra de leucocitos; busulfán (28 mg/día); ciclofosfamida (12 g/día, 2 dosis); leucoféresis (23 recambios); radioterapia esplénica o combinación de 2 de ellos; y se mantuvo hasta lograr disminución de los leucocitos a valores inferiores a 20 × 109/L. En este momento se inició terapéutica con INFar en una dosis de 3 millones de unidades/m2 de superficie corporal, en días alternos, por vía subcutánea o intramuscular en combinación con CA (10 25 mg/m2 de superficie corporal) de 10 a 21 días/mes. La dosis de INFar se redujo o se suspendió ante la aparición de neutropenia o trombocitopenia severa (neutrófilos entre 1-1,4 × 109/L y plaquetas 55-90 × 109/L) o ante cualquier reacción adversa grado 3-4.20
Exámenes complementarios evolutivos
Hemograma mensual, aspirado de médula ósea cada 6 meses, biopsia de médula ósea anual, cariotipo a los 6 meses de iniciado el tratamiento y después cada 12 meses, reordenamiento BCR-ABL una vez que se logró la respuesta citogenética completa (RCC).
Criterios de evaluación de los resultados 13,18,21,22
Respuesta hematológica
- Respuesta hematológica completa (RHC): leucocitos < 10 × 109/L, diferencial normal; plaquetas < 450 × 109/L; ausencia de células inmaduras en lámina periférica; no signos y síntomas de enfermedad y ausencia de esplenomegalia palpable.
- Respuesta hematológica parcial (RHP): alguna respuesta hematológica excepto para: presencia de células inmaduras en sangre periférica < 50 % de reducción del conteo de plaquetas (pretratamiento > 450 × 109/L). Reducción de la esplenomegalia en < 50 %.
- No respuesta hematológica (NRH): no cumple con los requisitos mencionados anteriormente.
Respuesta citogenética13,18,21
- Respuesta citogenética mayor (RCM): RCC (0 % de cromosoma Ph en 20 o más metafases analizadas) o respuesta citogenética parcial (RCP), (1 a 35 % Ph + en 20 o más metafases analizadas).
- Respuesta citogenética menor (RCm): 36 a 65 % Ph + en 20 o más metafases analizadas.
- No respuesta citogenética (NRC): > 95 % de Ph + en 20 o más metafases analizadas.
Definición de variables de sobrevida
Sobrevida global (SG): tiempo transcurrido desde el inicio de la enfermedad hasta la última evaluación realizada (diciembre 2009).
Sobrevida libre de eventos (SLE): tiempo transcurrido desde el inicio del tratamiento citorreductor hasta la aparición del primer evento adverso (recaída hematológica en FC, FA, o CB).
Análisis estadístico
El punto referente para este estudio fue la fecha de diagnóstico y el punto final fue la sobrevida, la muerte o la fecha de la última entrevista en consulta externa. El tiempo de sobrevida se calculó por el método de Kaplan-Meier. La comparación de medianas de sobrevida se determinó mediante la prueba del logaritmo del rango. Se usó el software SPSS versión 16.5. Se calcularon las tablas de contingencia, se empleó el Chi cuadrado o cálculo de probabilidades exactas según los tipos de variables y el valor de las frecuencias relativas. Se consideró el nivel de significación como p ≤ 0,05.23
RESULTADOS
La muestra estuvo constituida por 46 pacientes (24 del sexo femenino y 22 del sexo masculino; 35 blancos y 11 no blancos) con LMC en FC. La edad promedio fue de 41,3 años para las mujeres y 40 años para los hombres. No se encontró diferencia significativa entre sexo, color de la piel ni edad (p> 0,05).
En 39 enfermos se calculó el índice pronóstico utilizando las variables: esplenomegalia, edad, porcentaje de blastos, basófilos, y eosinófilos en periferia y conteo de plaquetas al inicio de la enfermedad. El mayor porcentaje (41,04 %) correspondió al grupo de AR (n= 16); 33,33 % (n= 13) eran BR y 25,64 % (n= 10) RI.
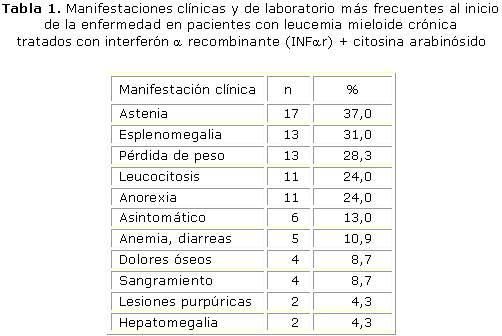
Las manifestaciones clínicas al inicio de la enfermedad se presentan en la tabla 1. En 6 casos (13 %) el diagnóstico se realizó por un chequeo médico fortuito.
En la tabla 2 se presenta la caracterización de algunas variables hematológicas y clínicas al inicio de la enfermedad en los pacientes estudiados. Todos los enfermos tuvieron presencia del cromosoma Ph, aunque solo en 38 se pudo demostrar al inicio de la enfermedad; el resto se confirmó por el estudio molecular o posteriormente durante la evolución.
El estudio del reordenamiento del gen BCR/ABL al diagnóstico fue positivo en los 16 casos evaluados.
En algunos pacientes fue necesario el empleo de combinación de agentes citorreductores y en un caso no se pudo obtener la información del medicamento empleado.
En la tabla 3 se muestra el tiempo en alcanzar la RH en los pacientes evaluados.
En los estudios citogenéticos evolutivos encontramos que ningún paciente alcanzó la RCm antes de los 12 meses del diagnóstico de la enfermedad. Se observó RCC en 3 pacientes (9,1 %), RCP en 10 (30,3 %) y RCm en 5 (15,2 %). Cuatro enfermos mostraron respuesta molecular completa (RMC) (15,3 %).
En la tabla 4 se representan las reacciones adversas al tratamiento con INFar.
De los 22 pacientes (47,8 %) que mostraron intolerancia al INFar, en 10 (45,4 %) fue necesario disminuir dosis y en 12 (54,6 %), suspender transitoriamente el tratamiento. El 47,8 % de los enfermos presentaron resistencia al INFar.
Durante el período evaluado fallecieron 33 enfermos, 3 de causa no precisada (tabla 5).
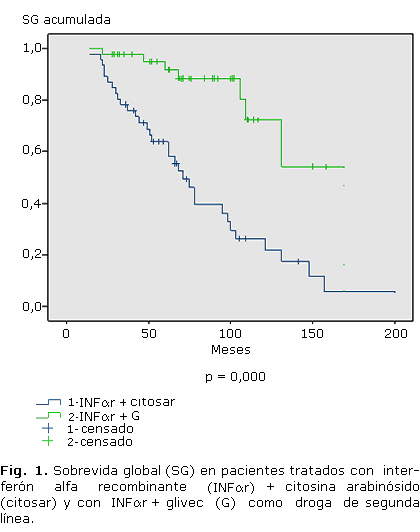
En la figura 1 se presentan las curvas de SG en 2 grupos de pacientes estudiados en el IHI en diferentes etapas: 1) tratados con INFar y posteriormente con Glivec; y 2) tratados solo con INFar + CA. Se observó diferencia significativa entre ambos grupos (p= 0,000). La SG a los 5 años para nuestro grupo fue del 63,8 %, mientras que para los que recibieron Glivec como segunda línea de tratamiento fue del 90,7 %.
La SG a los 5 años de pacientes con LMC tratados con diferentes regímenes terapéuticos, oscila entre el 32 y el 90,7 %.12,24-28 En nuestro caso, el valor de la SG fue de 63,8 %.
En la figura 2 se observan las curvas de SLE en los 2 grupos de pacientes evaluados. Se encontró diferencia significativa entre los 2 grupos (p= 0,008).
La SLE a los 3 años de evolución de la enfermedad fue del 68,9 % y en los que recibieron Glivec como tratamiento de segunda línea, 81,8 %; estos valores se encuentran dentro del rango de SLE a los 3 años reportados en la literatura empleando diferentes regímenes de tratamiento, que oscilan entre el 58 y el 90 %.
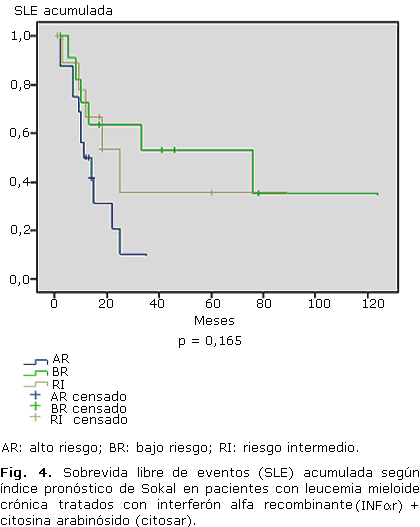
En las figuras 3 y 4 se muestra la SG (p= 0,005) y SLE (p= 0,165) según el índice de pronóstico en pacientes tratados con INFar. La SG a los 5 años fue: BR 81,8 %; RI 77,1 %; y AR 42,2 %; mientras que la SLE a los 5 años fue: BR 53 %; RI 35,6 %; y AR 0 %.
DISCUSIÓN
La LMC es una enfermedad fundamentalmente del adulto y que no presenta diferencias significativas entre sexos ni etnias. Sin embargo, en un estudio reciente realizado en Estados Unidos, se encontraron diferencias entre la edad, el sexo y la respuesta al tratamiento en diferentes etnias, género y nivel socio-económico.29 En nuestro estudio no se observaron diferencias significativas para ninguna de estas variables.
Diversos investigadores refieren una mayor incidencia de esta enfermedad por encima de los 60 años.14 La media de 40,71 años observada en nuestros casos se asemeja más a los resultados de Rosti y otros,30 y Yong y otros.31
El índice de Sokal es el más utilizado como pronóstico para evaluar la evolución de la enfermedad.7 O´Brien y otros,21 encontraron mayor incidencia de casos con BR; Berger y otros24 y Espinosa y otros25 observan una mayor frecuencia de RI, mientras que los casos con AR predominaron en el grupo evaluado por Hehlmann y otros (37,6%).32 Nuestros resultados son similares a los encontrados por el grupo de estudio de la LMC en Alemania.32
Las manifestaciones hematológicas y clínicas de los pacientes con LMC al inicio son muy variables. En nuestra casuística, 6 casos (13 %) se diagnosticaron durante un chequeo médico de rutina. La frecuencia de síntomas y signos encontrada en este trabajo fue menor en comparación con la observada por otros investigadores, excepto para la presencia de síntomas generales. Esto puede deberse a las características de nuestro sistema nacional de salud. En Cuba, la población recibe atención médica gratuita, lo que permite que las personas acudan inmediatamente al médico cuando comienzan a presentar las primeras manifestaciones de enfermedad, por lo que su detección se produce en muchos casos de forma precoz. No obstante, los síntomas generales y la vísceromegalia fueron los eventos más frecuentes, lo que coincide con lo reportado la literatura internacional.14,32,33
Las características hematológicas y clínicas observadas son similares a las encontradas en otros estudios.24,31,32,34,35 Al diagnóstico, la mayoría de nuestros enfermos tenían niveles de hemoglobina por debajo del límite inferior normal, hallazgo que también reportan otros investigadores.32 La media del conteo de leucocitos y plaquetas encontrada fue inferior a lo comunicado en la literatura. Este resultado puede deberse también al diagnóstico más temprano de la enfermedad.
Aunque otros investigadores emplearon esquemas terapéuticos diferentes al utilizado por nosotros,24,31,35 combinando siempre el INFar + CA, los resultados de este trabajo son superiores a los encontrados por otros autores y ligeramente inferiores a los obtenidos por Kantarjian y otros.34
El estudio citogenético es fundamental para evaluar la respuesta al tratamiento. Helhmann y otros encontraron que el 7,2 % de los casos alcanzaron una RCC.32 En los enfermos menores de 60 años evaluados por Berger y otros se obtuvo el 8 % de RCC,24 mientras que Kantarjian y otros encontraron el 31 % de RCC, el 19 % de RCP y el 24 % de RCm, en pacientes con INFar y dosis diaria de CA.34 Nuestros resultados son similares a los encontrados por Helhmann y otros.32
Para determinar la respuesta molecular (RM) se emplea actualmente el PCR en tiempo real (Q-PCR). 26,34 La técnica que empleamos fue el PCR cualitativo, que tiene una alta sensibilidad, por lo que un resultado positivo al diagnóstico y uno negativo posteriormente, indica una respuesta molecular al tratamiento. En el 15,3 % de los casos (4/26) se alcanzó la RM. En el estudio realizado por Espinosa y otros25 empleando la misma técnica, el 20,3 % de los pacientes obtuvieron RM a los 2 años de tratamiento con Glivec.
Las reacciones adversas al tratamiento con INFar han sido señaladas por muchos autores.27,30,34 Contrariamente a lo que encuentra la mayoría de los investigadores, la reacción adversa más frecuente en nuestro estudio fue la fiebre (35,7 %). El Grupo de Estudio Cooperativo Italiano para la LMC encontró que el 37 % de los pacientes presentaron fatiga, fiebre, dolor y cefalea,36 resultado que se asemeja al observado en nuestro estudio. Otras reacciones como los dolores óseos, trombocitopenia, complicaciones autoinmunes y la anemia, fueron también relativamente frecuentes, y su presencia motivó en algunos pacientes la reducción de la dosis del INFar o la suspensión transitoria del tratamiento.
La resistencia hematológica, citogenética y la intolerancia al INFar ha sido evaluada por diversos autores.24,32,35 Nuestros resultados son similares a los descritos por Kantarjian y otros.35
De los 33 (71,7 %) pacientes fallecidos, el 90,9 % fue por progresión de la enfermedad. La CB fue la causa más frecuente, y dentro de ellas, la de tipo mieloide. Resultados similares encontraron Berger y otros.24
Lograr una mayor sobrevida de la enfermedad con adecuada calidad de vida es uno de los aspectos más importantes del tratamiento. La SG y SLE de los pacientes con LMC ha sido evaluada por muchos investigadores.12,25,27,30,36 En un estudio realizado por Kartarjian y otros,28 en pacientes que recibieron INFar y posteriormente Glivec como droga de segunda línea, los resultados mostraron una SG del 86 % a los 4 años; mientras que Espinosa y otros25 encontraron una SG de 90,7 % a los 5 años. La SG de nuestros enfermos es similar a la del Grupo de Estudio Cooperativo Italiano para la LMC.36
La SLE también ha mostrado un incremento significativo con el tratamiento con INFar, y es aún más elevada en pacientes que han recibido tratamiento con Glivec como droga de primera o segunda líneas. 25,27,28,32,35 En este trabajo, la SLE a los 3 años de evolución fue superior a la encontrada con HU (58 %),12 a la reportada con busulfán (56,0 %)37 y con IFNar (54 %),27 e inferior a la señalada con el empleo de INFar y posteriormente del Glivec como droga de segunda línea.25,37 Se encontró diferencia significativa entre los 2 grupos estudiados en el IHI, siendo mayor a los 3 años en los que iniciaron tratamiento con Glivec como droga de segunda línea (p= 0,008).
Cuando se evaluó la SG a los 5 años según el índice de Sokal, se observó una diferencia significativa entre los 3 grupos (p= 0,005), con una mayor SG en aquellos que presentaron un índice pronóstico de BR. El análisis de la SLE no mostró diferencia significativa (p= 0,165). Mahon y otros,38 Kloke y otros,39 al igual que O´Brien y otros,21 utilizaron Glivec como droga de primera o segunda líneas, y encontraron una mayor SLE en los pacientes con BR.
Los resultados de este trabajo evidencian que el empleo del INFar + CA en el tratamiento de la LMC es un logro muy importante para los pacientes con esta enfermedad en Cuba. La sobrevida y calidad de vida de estos enfermos se ha elevado considerablemente en los últimos años y los resultados con este tratamiento son similares o superiores a los que se reportan en otros países.
En la actualidad, a nivel internacional se desarrollan ensayos clínicos en los que se emplea INFar o INFar pegilado y Glivec.40-42 Los pacientes que han recibido estos esquemas muestran mejor respuesta citogenética a los 6 meses; y a los 18 meses, mejor respuesta molecular que los tratados solamente con Glivec.41-45
Esto evidencia que aunque se ha logrado desarrollar nuevos medicamentos para el tratamiento de la LMC, el INFar continúa siendo una medida terapéutica en los pacientes con síndromes mieloproliferativos cónicos y dentro de ellos, la LMC.45,46
REFERENCIAS BIBLIOGRÁFICAS
1. Sawyers CL. Chronic myeloid leukemia. N Engl J Med. 1999 Apr 29;340(17):1330-40. PMID: 10219069.
2. Lugo T, Pendergast A, Muller A, Witte O. Tyrosine kinase activity and transformation potency of bcr/abl oncogene products. Science. 1990 Mar 2;247(4946):1079-82. PMID: 2408149.
3. Karridge I. Treatment of adult leukemias. Austr Prescr [serial on the Internet]. 2006 [cited 2011 May 23];29:76-9. Disponible en: http://www.australianprescriber.com/magazine/29/3/76/9
4. Goldman JM, Melo JV. Chronic myeloid leukemia advances in biology and new approaches to treatment. N Engl J Med. 2003 Oct 9;349(15):1451-64. PMID: 14534339.
5. Pavithran K. Treatment of chronic myeloid leukemia. Medicine on line. Intern J Med. Priory.com [serial on the Internet]. 2006 [cited 2011 May 23]. Disponible en: http://www.priory.com/med/leuk.htm
6. Melo JV, Hughes TP, Apperley JF. Chronic myeloid leukemia. Hematology. Hematology Am Soc Hemato Educ Program 2003:132-52. PMID: 14633780.
7. Sokal JE, Cox EB, Baccarani M, Tura S, Gómez GA, Robertson JE, et al. Prognostic discrimination in "good risk" chronic granulocytic leukemia. Blood. 1984 Apr;63(4):789-99. PMID: 6584184.
8. Kantarjian HM, Keating MJ, Smith TL, Talpaz M, McCredie KB. Proposal for a simple synthesis prognostic staging system in chronic myelogenous leukemia. Amer J Med. 1990 Jan;88(1):1-8. PMID: 2294759.
9. Hasford J, Pfirrmann M, Hehlmann R, Allan NC, Baccarani M, Kluin-Nelemans JC, et al. A new prognostic score for survival of patients with chronic myeloid leukemia treated with interferon alfa. Writing Committee for the Collaborative CML Prognostic Factors Project Group. J Natl Cancer Inst. 1998 Jun;90(11):850-8. PMID: 9625174.
10. Huges TP, Kaeda J, Brandford S, Rudzki Z, Hochhaus A, Hensley ML, et al. Frequency of major molecular responses to imatinib or interferon alfa plus cytarabine in newly diagnosed chronic myeloid leukemia. N Engl J Med. 2003 Oct9;349(15):1423-32. PMID: 14534335.
11. Talpaz M, Shah NP, Kantarjian H, Donato N, Nicoll J, Paquette R, et al. Dasatinib in Imatinib-resistant Philadelphia chromosome-positive leukemias. N Engl J Med. 2006 Jun 15;354(24):2531-41. PMID: 16775234.
12. Hehlmann R, Heimpel H, Hasford J, Kolb HJ, Pralle H, Hossfeld DK, et al. Randomized comparison of interferon alpha with busulfan and hydroxyurea in chronic myelogenous leukemia. The German CML study group. Blood. 1994 Dec 15;84(12):4064-77. PMID: 7994025.
13. Kantarjian HM, Smith TL, O´Brien S, Beran M, Pierce S, Talpaz M. Prolonged survival in CML after cytogenetic response to interferon-a therapy. Ann Intern Med. 1995 Feb 15;122(4):254-61. PMID: 7825760.
14. Greer JP, Foerster J, Lukens JN, Rodgers GM, Parackevas F, Glader B. editors. Wintrobe´s Clinical Hematology. 12 ed. Vol 2. Philadelphia: Lippincott Williams & Wilkins; 2009.
15. Heberon alfa R. Recombinant INF alfa-2b. Heber Biotech SA. Disponible en: http://www.heber-biotech.com/farma-bio.html/59
16. International Committee for standardization in Hematology. Recommendation of measurement of human blood. Am J Clin Pathol. 1977 Oct;68(4):505-7. PMID: 906981.
17. Hochhaus A. Minimal residual disease in chronic myeloid leukemia patients. Best Practice Res Clin Haematol. 2002 Mar;15(1):159-78. PMID: 11987922.
18. Kantarjian H, Sawyers C, Hochhaus A, Guilhot F, Shiffer C, Gambacorti-Passerini C, et al. Hematologic and cytogenetic responses to imatinib mesylate in chronic myelogenous leukemia. N Engl J Med. 2002 Feb 28;346(9):645-52. PMID: 11870241.
19. Van Dongen JJM, Macintyre EA, Gabert JA, Delabesse E, Rossi V, Saglio G, et al. Standardized RT-PCR analysis of fusion gene transcripts from chromosome aberrations in acute leukemia for detection of minimal residual disease. Report pf the BIOMED-1 concerted action: investigation of minimal residual disease in acute leukemia. Leukemia. 1999 Dec;13(12):1901-28. PMID: 10602411.
20. National Cancer Institute. Cancer therapy evaluation program. Common terminology criteria of adverse events (CTAE) v3.0. 2006. Disponible en: http://ctep.cancer.gov
21. O´Brien SG, Guilhot F, Larson RA, Gathmann I, Baccarani M, Cervantes F, et al. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med. 2003 March 13;348(11):994-1004. PMID:12637609.
22. Goldman J. Recommendations for the management of BCR-ABL-positive chronic myeloid leukemia. London (UK): British Committee for Standards in Haematology; 2007: 14 p. Disponible en: http://www.guideline.gov/content.aspx?id=11991&search=DNA+Mutational+Analysis
http://www.bcshguidelines.com/documents/CML_BCR-ABL_270707.pdf
23. Berry G, Mathews JNS. Statistical methods in medical research. 4th ed. Massachussets: Blackwell Science; 2002.
24. Berger U, Engelich G, Maywald O, Pfirmann M, Hochhaus A, Reiter A, et al. Chronic myeloid leukemia in the elderly: long term results from randomized trials with interferon a. Leukemia. 2003 Sept;17(9):1820-6. PMID: 12970782.
25. Espinosa E, Espinosa EE, Pavón V, Hernández C, Ávila O, Ramón L, et al. Tratamiento de la leucemia mieloide crónica con mesilato de imatinib en pacientes resistentes o intolerantes al interferon a recombinante. Resultados preliminares. Rev Cubana Hematol Inmunol Hemoter [serie en internet]. 2010;[citado 23 de mayo 2011];26(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-02892010000100002&lng=es&nrm=iso&tlng=es
26. Faderl S, Hochhaus A, Hughes T. Monitoring of minimal residual disease in chronic myeloid leukemia. Hematol Oncol Clin North Am. 2004 Jun;18(3):657-70, IX-X. PMID: 15271398.
27. Steegmann JL, Odriozola J, Rodríguez-Salvanes F, Giraldo P, García-Laraña J, Ferro MT, et al. Stage, percentage of basophils at diagnosis, hematologic response with-in six months, cytogenetic response in the first year: the main prognostic variables affecting outcome in patients with chronic myeloid leukemia in chronic phase treated with interferon-a. Results of the CML89 trial of the Spanish Collaborative Group on interferon-a and CML. Haematologica. 1999 Nov;84(11):978-87. PMID:10553157.
28. Kantarjian HM, Cortes JE, O´Brien S, Luthra R, Giles F, Verstovsek S, et al. Long-term survival benefit and improved complete cytogenetic and molecular response rates with imatinib mesylate in Philadelphia chromosome-positive chronic-phase chronic myeloid leukemia after failure of interferon-a. Blood. 2004 Oct 1;104(7):1979-88. PMID: 15198956.
29. Lee JP, Bernstein E, Masiello D, Yang D, Yang AS. Gender and ethnic differences in chronic myelogenous leukemia prognosis and treatment response: a single-institution retrospective study. J Hematol Oncol. 2009 Jul 24;2:30-6. PMID: 19630970.
30. Rosti G, Lacobucci L, Bassi S, Castagnetti F, Amabile M, Cilloni D. Impact of age on the outcome of patient with CML in late chronic phase: results of a phase II study of the GINEMA CML Working party. Haematologica. 2007 Jan;92(1):101-5. PMID: 17229641.
31. Yong ASM, Szydlo RM, Goldman JM, Apperley JF, Melo JV. Molecular profiling of CD34+ cells identifies low expression of CD7, along with high expression of proteinase 3 or elastase, as predictors of longer survival in patients with CML. Blood. 2006 Jan 1;107(1):205-11. PMID: 16144796.
32. Hehlmann R, Berger U, Pfirmann M, Hochhaus A, Metzgeroth G, Maywald O, et al. Randomized comparison of interferon a and hydroxyurea with hydroxyurea monotherapy in chronic myeloid leukemia (CML-study II): prolongation of survival by the combination of interferon a and hydroxyurea. Leukemia. 2003 Aug;17(8):1529-37. PMID:12886239.
33. Report of the medical research council´s working party for therapeutic trials in leukemia. Chronic granulocytic leukemia: comparison of radiotherapy and busulphan therapy. Br Med J. 1968 Jan 27;1(5586):201-8. PMCID: PMC1984763.
34. Kantarjian HM, O´Brien S, Smith T, Rios MB, Cortes J, Beran M, et al. Treatment of Philadelphia chromosome-positive early chronic phase chronic myelogenous leukemia with daily doses of interferon alfa and low-dose cytarabine. J Clin Oncol.1999 Jan;17(1):284-92. PMID:10458244.
35. Kantarjian HM, Talpaz M, O´Brien S, Smith T, Giles FJ, Faderl S, et al. Imatinib mesylate for Philadelphia chromosome-positive, chronic-phase myeloid leukemia after failure of interferon-a: follow-up results. Clin Cancer Res. 2000 Jul;8(7):2177-87. PMID:12114418.
36. The Italian Cooperative Study Group in Chronic Myeloid Leukemia. Long-term follow-up of the Italian trial of interferon-a versus conventional chemotherapy in chronic myeloid leukemia. Blood. 1998 Sept 1;92(5):1541-8. PMID: 9716581.
37. Busuflex Oficial Drug Information, side effects and uses. Micromedex Updated 2 July 2010; Cerner MultumTM updated 24 august 2010; Wolters KluwersTM updated 2 september 2010. Disponible en: http://www.drugs.com/pro/busulfex.html#skipContent
38. Mahon FX, Delbrel F, Mahon X, Delbrel P, Cony-Makhoul C, Faberes J, et al. Follow-up of complete cytogenetic remission in patients with chronic myeloid leukemia after cessation of interferon alfa. J Clin Oncol. 2002 Jan 1;20(1):214-20. PMID: 11773172.
39. Kloke O, Opalka B, Niederle N. Interferon alfa as primary treatment of chronic myeloid leukemia: long-term follow up of 71 patients observed in a single center. Leukemia. 2000 Mar;14(3):389-92. PMID: 10720131.
40. Hehlmann R, Saussele S, Laiseker M, Leitner A, Pletsch N, Haferlach C, et al. Randomized clinical trial for the optimization of imatinib therapy by combination, dose escalation and transplantation. Designed first interim analysis of the German CML study. Haematologica. 2009;94(suppl 2):193 abs. 0478.
41. Palandri F, Castagnetti F, Iacobucci I, Martinelli G, Amabile M, Gugliotta G, et al. The response to imatinib and interferon-a is more rapid than the response to imatinib alone: a retrospective analysis of 495 philadelphia-positive chronic myeloid leukemia patients in early phase. Haematologica. 2010 Aug;95(8):1415-9. PMID: 20305139.
42. Palandri F, Iacobucci I, Castagnetti F, Testoni N, Poeiro A, Amabile M, et al. Front-line therapy fo philadelphia positive chronic myeloid leukemia with imatinib and interferon-a 5-year outcome. Haematologica. 2008 May;93(5):770-4. PMID: 18367490.
43. Preudhomme C, Guillot J, Nicolini FE, Guerci-Bresler A, Rigal-Huguet F, Maloisel F, et al. Imatinib plus peginterferon alfa-2a in chronic myeloid leukemia. N Engl J Med. 2010 Dec;363(2):2511-21. PMID: 21175313.
44. Baccarani M, Martinelli G, Rosti G, Trabacchi E, Testoni N, Bassi S, et al. Imatinib and pegylated human recombinant interferon-alpha-2b in early chronic phase chronic myeloid leukemia. Blood. 2004 Dec 15;104(13):4245-51. PMID: 15319292.
45. Burchert A, Müller MC, Kostrewa P, Erben P, Bostel T, Liebler S, et al. Sustained molecular response with interferon alfa maintenance after induction therapy with imatinib plus interferon alfa in patients with chronic myeloid leukemia. J Clin Oncol. 2010 Mar 10;25(8):5075-81. PMID: 20142590.
46. Kiladjian J-C, Mesa RA, Hoffman R. The renaissance of interferon therapy of myeloid malignancies. Blood. 2011 May 5;117(18):4706-15. PMID: 21389325.
Recibido: 7 de junio de 2011.
Aprobado: 25 de junio de 2011.
Dr. Edgardo Espinosa Estrada. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, La Habana, Cuba. Tel (537) 643 8695, 8268, Fax (537) 644 2334. Correo electrónico: ihidir@hemato.sld.cu
Website: http://www.sld.cu/sitios/ihi