Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión impresa ISSN 0864-0289
Rev Cubana Hematol Inmunol Hemoter vol.27 no.4 Ciudad de la Habana oct.-dic. 2011
ARTÍCULO ORIGINAL
Comparación de la actividad de 2 factores estimuladores de colonias de granulocitos de producción nacional: Hebervital y Leukocim
Comparison of the activity of 2 domestic- production factors for granulocyte colonies: Hebervital and Leukocim
Lic. Bertha Beatriz Socarrás FerrerI, DraCM. Consuelo Macías AbrahamI, Lic. Lázaro del Valle PérezI, Dra. Vianed Marsán SuárezI, Dra. Janet Vergara CastellanosI, Dra. Rosa María Lam DíazI, Lic. Ana Iris González IglesiasI, Lic. María de los Angeles MatamorosI, Dra. Ena Infante CristiáII, Dr. Osmel Guerra SeguraII, Lic. Vladimir Mulens AriasIII, Prof. DrC. Porfírio Hernández RamírezI
I Instituto de Hematología e Inmunología. La Habana, Cuba.
II Centro de Ingeniería Genética y Biotecnología. La Habana, Cuba.
III Centro de Inmunología Molecular. La Habana, Cuba.
RESUMEN
En 35 pacientes que debían recibir terapia celular regenerativa se evaluó el efecto estimulante de 2 factores estimuladores de colonias de granulocitos de producción cubana: Hebervital y Leukocim, para la movilización de células madre hematopoyéticas hacia la sangre periférica. Los pacientes se seleccionaron de forma aleatoria en 2 grupos de tratamiento y se les suministró por vía subcutánea una dosis total de 40 mg/kg distribuidos en 4 subdosis de 10 mg/kg administrados cada 12 horas. Se realizó el conteo de las células mononucleares y células CD34+ en sangre periférica mediante citometría de flujo, antes y después de la estimulación. No se encontraron diferencias estadísticamente significativas en los conteos de las células CD34+ obtenidas posestimulación con el Hebervital y el Leukocim.
Palabras clave: Factor estimulador de colonias de granulocitos, FEC-G, células CD34+, células mononucleares.
ABSTRACT
In 35 patients who should have received regenerative cell therapy, it was evaluated the effect of 2 domestic production granulocyte colony stimulating factors: Leukocim and Hebervital for the mobilization of hematopoietic stem cells into peripheral blood. Patients were randomly selected into 2 treatment groups and were given a total dose of 40 mg/kg in 4 sub-doses of 10 mg/kg subcutaneously administered every 12 hours. Count was performed for mononuclear cells and CD34+ cells in peripheral blood by flow cytometry before and after stimulation. There were no statistically significant differences in the counts of CD34+ cells obtained after stimulation with Hebervital and Leukocim.
Key words: Granulocyte colony stimulating-factor, G-CSF, CD34+ cells, mononuclear cells.
INTRODUCCIÓN
El factor estimulador de colonias de granulocitos (FEC-G) es producido por monocitos, fibroblastos y células endoteliales, y el recombinante se obtiene mediante la inserción en la bacteria Escherichia coli del gen humano que lo codifica.1
El FEC-G es un estimulante de la proliferación y diferenciación de los progenitores hematopoyéticos hacia las líneas celulares de polimorfonucleares neutrófilos, eosinófilos y monolitos, y un regulador importante tanto de la respuesta inmune como de la homeostasis tisular.2,3 Este efecto da lugar a un aumento en el número de células CD34+ en sangre periférica posterior a la estimulación de la médula ósea con FEC-G.
El FEC-G es un producto de alto costo en el mercado internacional, de ahí la gran importancia de su obtención en nuestro país. El uso de tecnologías de ADN recombinante permite su producción a gran escala, con los nombres comerciales de Hebervital (Heber Biotec, SA, La Habana, Cuba) y Leukocim (CIMAB, SA, La Habana, Cuba), respectivamente.1
Por sus propiedades estimulantes sobre la diferenciación celular el FEC-G tiene diferentes usos: en el tratamiento de enfermedades infecciosas, como adyuvante de algunas vacunas, y se plantea su aplicación local en la mucositis después de la quimioterapia y de la radioterapia o de ambos tratamientos, en las úlceras crónicas y en la medicina regenerativa, con un buen margen de seguridad y pocos efectos adversos conocidos.4-8 El objetivo de este trabajo fue comparar los resultados obtenidos en el recuento de las células movilizadas por el Hebervital y el Leukocim.
MÉTODOS
En el Instituto de Hematología e Inmunología se realizó un estudio aleatorizado y controlado, que incluyó un total de 35 pacientes en condiciones de movilización de células progenitoras hematopoyéticas (CPH) para uso en trasplante autólogo. Los pacientes fueron aleatorizados en 2 grupos: grupo I (n= 18), Hebervital y grupo II (n= 17) Leukocim. El FEC-G se administró por vía subcutánea en una dosis total de 40 mg/kg dividido en 4 dosis de 10 mg/kg cada una, inyectada cada 12 horas. Tres horas después de la última dosis, se procedió a la realización de una flebotomía y concentración posterior de las células mononucleares (CMN) de acuerdo con el método establecido en nuestra institución.9
En las muestras de sangre periférica de cada paciente los leucocitos obtenidos se cuantificaron en un contador automático de células sanguíneas (SEAC, Genius, Italia). El recuento diferencial se realizó con microscopio óptico en extensiones de estas células en láminas de cristal teñidas con May-GrünwaldGiemsa (se consideraron CMN: células indiferenciadas, linfocitos, monocitos, promielocitos, mielocitos y juveniles). El valor absoluto de CMN posmovilización y en el concentrado se obtuvo de acuerdo con el porcentaje de estas células presentes en el conteo de leucocitos posmovilización y en el volumen del concentrado final. El recuento de células CD34+ se realizó de sangre periférica, antes del tratamiento, posestimulación con los FEC-G y en el concentrado final. Para esto el marcaje celular se llevó a cabo con el anticuerpo monoclonal anti-CD34 conjugado con ficoeritrina (Serotec, Ltd, Reino Unido) y la determinación se hizo por citometría de flujo.10 La lectura de 10 000 células en cada tubo se realizó en un citómetro FaCScan (Benton Dickinson, EE. UU.).
El procesamiento de los datos se realizó con el empleo del programa estadístico SPSS versión 11.5, previa confección de una base de datos. Como medida de resumen de los datos cuantitativos se utilizó la media y la desviación estándar para los conteos de leucocitos y el volumen del concentrado; la mediana para los conteos de CMN, CD34+ y para los porcentajes de las células CD34+. La comparación se hizo mediante la t de Student en los casos de promedios y con la prueba de Mann Withney cuando se usó la mediana. Se consideró significativo un valor de p ≤ 0,05.
RESULTADOS
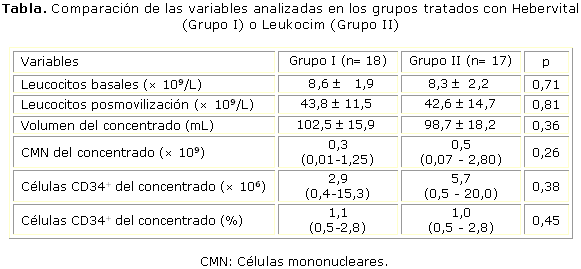
La comparación de las variables analizadas en los grupos tratados con el Hebervital o el Leukocim no mostró diferencias estadísticamente significativas, como se observa en la tabla.
DISCUSIÓN
El FEC-G permite la movilización de CPH desde la médula ósea a la sangre periférica. La magnitud de esta movilización puede medirse mediante la cuantificación de un marcador específico, la molécula de superficie CD34. Las células que expresan este marcador poseen un gran potencial de repoblación in vivo y tienen la capacidad de generar progenies eritroides y mieloides,10-14 y recientemente también se les ha atribuido potencialidad regenerativa de algunos tejidos dañados.2,3,7,9
La terapéutica con el FEC-G permite manipular y regular el sistema hematopoyético al aumentar el número de CPH circulantes, de forma dosis dependiente; modular la capacidad funcional de los leucocitos maduros por sus acciones sobre las células fagocíticas incrementando la síntesis de citocinas que potencian la capacidad fagocítica (como la interleucina 1 y el factor de necrosis tumoral a), la destrucción de patógenos (por el aumento de la generación de radicales del oxígeno y la citotoxicidad dependiente de anticuerpos); y el tráfico de leucocitos.15-17
En ensayos preclínicos de toxicidad aguda y tolerancia con el empleo de FEC-G en animales (perros y ratas)18,19 y en estudios comparativos con el Neupogenâ (Amgen INC, California, EE. UU.), se ha demostrado la ausencia de toxicidad y una tolerancia adecuada para su empleo en humanos.2,19,20
En los pacientes de nuestro estudio no se reportaron signos de toxicidad y los efectos secundarios más frecuentes fueron dolores óseos y cefalea.
Estos factores estimuladores producidos en 2 instituciones cubanas: Centro de Ingeniería Genética y Biotecnología (Hebervital) y Centro de Inmunología Molecular (Leukocim), mostraron resultados similares durante su uso clínico, lo que es de gran importancia para su empleo terapéutico y comercial. Esto pudiera constituir un pilar fundamental en la economía nacional, ya que estos factores, aunque altamente costosos, son de gran demanda a escala internacional.
REFERENCIAS BIBLIOGRÁFICAS
1. Aldana L, Bacardí D, Merino N, Cosme K, Porras D, Carreras I, et al. Evaluación de la seguridad del factor estimulador de colonias de granulocitos producido por el CIGB. Biotecnología Aplicada. 2005 ene-mar;22(1):45-9.
2. Verfaillie CM, Pera MF, Lansdorp PM. Stem cells: Hype and Reality. Hematology Am Soc Hematol Educ Program. 2002:369-91.
3. Körbling M, Estrov Z. Adult stem cells for tissue repair- A new Therapeutic concept? N Engl J Med. 2003 Aug 7;349(6):570-82.
4. Zsebo KM, Cohen AM, Murdock DC, Boone TC, Inoue H, Chazin VR, et al. Recombinant human granulocyte colony-stimulating factor: Molecular and biological characterization. Immunobiology. 1986 Sep;172(3-5):175-84.
5. Haas R, Murea S. The role of granulocyte colony-stimulating factor in mobilization and transplantation of peripheral blood progenitor and stem cells. Cytokines Mol Ther. 1995 Dec;1(4):249-70.
6. Daley GQ, Goodell MA, Snyder EY. Realistic prospects for stem cell therapeutics. Hematology Am Soc Hematol Educ Program. 2003:398-418.
7. Huang PP, Li SZ, Han MZ, Xiao ZJ, Yang RC, Qui Y, et al. Autologous transplantation of peripheral blood stem cells as an effective therapeutic approach for severe arteriosclerosis of lower extremities. Thromb Haemost. 2004 Mar;91(3):606-9.
8. Zohlnhöfer D, Dibra A, Koppara T, de Waha A, Ripa RS, Kastrup J, et al. Stem cell mobilization by granulocyte colony-stimulating factor for myocardial recovery after acute myocardial infarction: a meta analysis. J Am Coll Cardiol. 2008 Apr 15;51(15):1429-37.
9. Hernández P, Artaza H, Díaz AJ, Cortina LD, Lam RM, Pol N, et al. Autotrasplante de células madre adultas en miembros inferiores con isquemia crítica. Rev Esp Invest Quirúr. 2007;10(4):204-11.
10. Craig FE, Foon KA. Flow cytometric immunophenotyping for hematologic neoplasm. Blood. 2008 Apr; 111(8):3941-67.
11. Janowska-Wieczorek A, Márquez LA, Nabholtz JM, Cabuhat ML, Montaño J, Chang H, et al. Growth factors and cytokines upregulate gelatinese expression in bone marrow CD34 (+) cells and their transmigration through reconstituted basement membrane. Blood. 1999 May;93(10):3379-90.
12. Pei X. Who is hematopoietic stem cell: CD34+ or CD34-? Int J Hematol. 1999 Dec;70(4):213-5.
13. Engelhardt M, Lübbert M, Guo Y. CD34(+) or CD34(-): which is the more primitive? Leukemia. 2002 Sep;16(9):1603-8.
14. Bruns I, Steidl V, Fischer JC, Czibere A, Kobbe G, Raschke S, et al. Pegylated granulocyte colony-stimulating factor mobilizes CD34+ cells with different stem and progenitor subsets and distinct functional properties in comparison with unconjugated granulocyte-colony-stimulating factor. Haematologica. 2008 Mar;93(3):347-55.
15. Lapidot T, Petit I. Current understanding of stem cells mobilization: the roles of chemokines, proteolytic enzymes, adhesion molecules, cytokines and stromal cells. Exp Hematol. 2002 Sep;30(9):973-81.
16. Kurdi M, Booz GW. G-CSF based stem cell therapy for the heart-unresolved issues part A: paracrine actions, mobilization and delivery. Congest Heart Fail. 2007 Jul-Aug;13(4):221-7.
17. Filshie RJ. Cytokines in haemopoietic progenitor mobilization for peripheral blood stem cell transplantation. Curr Pharm Des. 2002;8(5):379-94.
18. Porada C, Harrison-Findik D, Sanada CH, Valiente V, Thain D, Simmons P, et al. Development and characterization of a novel CD34 monoclonal antibody that identifies sheep hematopoietic stem/progenitor cells. Exp Hematol. 2008 Dec;36(5):1739-49.
19. Barcew K, Paczkowska E, Dabkowska E, Baskiewicz-Masiuk M, Marchlewicz M, Domanki L, et al. The effect of stem cell mobilization with granulocyte colony-stimulating factor on the morphology of the haematopoietic organs in mice. Folia Morphol. (Warsz) 2007 Feb;66(1):1-9.
20. Jackson KA, Mi T, Goodell MA. Hematopoietic potential of stem cells isolated from murine skeletal muscle. Pro Natl Acad Sci USA. 1999 Dec;96(25):14482-6.
Recibido: 7 de junio de 2011.
Aprobado: 25 de junio de 2011.
Lic. Bertha Beatriz Socarrás Ferrer. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, La Habana, Cuba. Tel (537) 643 8695, 8268, Fax (537) 644 2334. Correo electrónico: ihidir@hemato.sld.cu
Website: http://www.sld.cu/sitios/ihi