Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión impresa ISSN 0864-0289
Rev Cubana Hematol Inmunol Hemoter vol.28 no.1 Ciudad de la Habana ene.-mar. 2012
ARTÍCULO ORIGINAL
Caracterización de los autoanticuerpos en la anemia hemolítica autoinmune secundaria al tratamiento con interferón alfa
Characterization of autoantibodies in autoimmune hemolytic anemia following treatment with interferon alfa
DrCs. Antonio Bencomo-Hernández, Dra. Adys Gutiérrez-Díaz, Dr. Onel Ávila-Cabrera, Dr. Luis Ramón-Rodríguez
Instituto de Hematología e Inmunología. La Habana, Cuba.
RESUMEN
Se estudiaron 13 pacientes con leucemia mieloide crónica y anemia hemolítica autoinmune inducida por el interferón alfa, a quienes se les realizó la detección de inmunoproteínas y la caracterización de las subclases de IgG en los hematíes mediante la prueba de antiglobulina directa (PAD) y la técnica de microplacas. Se aplicó además un ELISA para la cuantificación de inmunoglobulinas en los hematíes. Se detectó la presencia de IgG y C3 en el 53,84 % de los casos, IgG sola en el 23,07 % y en el 15,38 % se identificaron autoanticuerpos IgG e IgA. En 11 pacientes se demostró la presencia de IgG1 y en un caso se identificaron además autoanticuerpos de la subclase IgG3. El ELISA detectó autoanticuerpos en concentraciones de 183 moléculas de IgG por hematíe en un paciente con PAD negativa. En los pacientes con hemólisis de alto grado se encontró una concentración de autoanticuerpos entre 1 500 y 3 180 moléculas de IgG por hematíe, mientras que en los casos con hemólisis de bajo grado se comportó entre 183 y 1 000 moléculas. Se observó una correlación negativa entre las cifras de Hb y los valores de haptoglobina plasmática con el número de moléculas de IgG por hematíe y una correlación positiva entre este último con el conteo de reticulocitos.
Palabras clave: anemia hemolítica autoinmune, interferón alfa, leucemia mieloide crónica, sublclases de IgG.
ABSTRACT
We studied 13 patients with chronic myeloid leukemia and autoimmune hemolytic anemia induced by interferon alfa. They underwent tests for immune protein detection and characterization of IgG subclasses in RBCs by direct antiglobulin test (PAD) and the microplate technique. Also they were applied ELISA test for quantifying immunoglobulins in the red blood cells. It was detected the presence of IgG and C3 in 53.84 % of cases, IgG alone in 23.07 % and in 15.38 % were identified IgG and IgA autoantibodies. In 11 patients the presence of IgG1 was showed and also in one case the subclass IgG3 autoantibodies was identified. The ELISA detected antibodies at concentrations of 183 IgG molecules per erythrocyte in a patient with negative PAD. In high-grade hemolysis patients, it was found a concentration of autoantibodies between 1 500 and 3 180 molecules of IgG per erythrocyte, while in low-grade hemolysis patients it behaved between 183 and 1 000 molecules. There was a negative correlation between Hb and plasma haptoglobin values with the number of IgG molecules per erythrocyte and a positive correlation between the latter with the reticulocyte count.
Key words: autoimmune hemolytic anemia, interferon alpha, chronic myeloid leukemia, sublclases IgG.
INTRODUCCIÓN
Antes de la aparición de los inhibidores de la tirosinquinasa,1 el interferon alfa (IFNa) era el fármaco de elección para el tratamiento de la leucemia mieloide crónica (LMC).2 En la actualidad, el IFNa se indica en la LMC durante el embarazo3 y en combinación con el imatinib para lograr un porcentaje mayor de pacientes con respuesta molecular.4
Asociado con la terapia, con esta citocina se han diagnosticado enfermedades autoinmunes como tiroiditis, trombocitopenia y anemia hemolítica, entre otras.5,6 La anemia hemolítica autoinmune (AHAI) secundaria al tratamiento con IFNa se ha evidenciado en un reducido número de pacientes que han recibido este medicamento para el tratamiento de la hepatitis viral o de enfermedades neoplásicas.7,8
La terapia con IFNa provoca efectos secundarios, algunos de los cuales se deben a su acción sobre el sistema inmune. Los más reconocidos se asocian con un incremento en la actividad de las células asesinas naturales, las alteraciones en el balance de las subpoblaciones linfocitarias y un aumento de la expresión de las moléculas de clase I del sistema principal de histocompatibilidad.9 Estos efectos se invocan para explicar la inducción de autoinmunidad durante el tratamiento con este fármaco.
En los pacientes con LMC es frecuente detectar la presencia de autoanticuerpos eritrocitarios inducidos por el tratamiento con IFNa, pero por factores aún no conocidos, en muy pocos casos hay evidencias clínicas de hemólisis inmune.10,11 Por otra parte, en el estudio de los pacientes con LMC y AHAI, en el curso del tratamiento con este fármaco, no se han caracterizado apropiadamente los isotipos y las subclases de IgG de los autoanticuerpos eritrocitarios involucrados en el proceso hemolítico, y en su investigación no se han aplicado ensayos más sensibles que la prueba de antiglobulina.6
Este trabajo describe la caracterización de los isotipos y de las subclases de IgG de los autoanticuerpos eritrocitarios, así como la aplicación de ensayos de cuantificación de anticuerpos asociados con los hematíes en el estudio de la AHAI en pacientes con LMC que recibieron IFNa como primera linea de tratamiento.
MÉTODOS
En el período comprendido entre octubre de 1995 y septiembre del 2003, fueron remitidos para investigaciones inmunohematológicas 13 pacientes con LMC que recibían tratamiento con IFNa (IFNa2b recombinante, CIGB, IMEFA, Cuba) y que además presentaron anemia hemolítica con sospecha de etiología autoinmune.
Los datos generales de los pacientes estudiados, las cifras de hemoglobina, el conteo de reticulocitos, el tiempo de tratamiento y la dosis del IFNa administrada, así como la conducta terapéutica para el tratamiento del proceso hemolítico, se obtuvieron mediante la revisión de las historias clínicas. Los resultados de la prueba de antiglobulina directa (PAD) y de la prueba de antiglobulina indirecta (PAI) previos al tratamiento con IFNa, se obtuvieron de los registros del laboratorio.
Las muestras de sangre se extrajeron por punción venosa que se colectaron en tubos con anticoagulante (EDTA al 5 %) y en tubos secos para la obtención de suero. Posteriormente, la sangre total se centrifugó a 270 x g durante 8 minutos a temperatura ambiente, se transfirió el plasma a un tubo limpio y se eliminó la capa leucoplaquetaria. En todos los casos se obtuvo el eluato a partir de 1 mL de hematíes por el método del éter.12
A los pacientes se les realizaron las siguientes determinaciones: prueba de antiglobulina directa (Coombs) con suero de Coombs poliespecífico y monoespecifico anti-IgG,-IgA y anti-C3 (Behring); y la prueba de antiglobulina indirecta (PAI). La especificidad de los autoanticuerpos eritrocitarios se determinó en la PAl enfrentando el eluato a un panel de eritrocitos de 12 células.12
La detección de inmunoglobulinas de los isotipos IgG, IgA e IgM en los hematíes, así como su caracterización en las subclases de IgG, se investigó en los eluatos en la técnica de microplacas (Mp).13 En todos los casos se realizó, además, la detección y cuantificación de IgG, IgA e IgM en los hematíes mediante un ensayo inmunoenzimático (ELISA) tipo sandwich de doble anticuerpo, de acuerdo con lo publicado previamente.14 Se consideró como valor positivo en el ELISA un número de moléculas por hematíe de IgG³163, de IgA³90 y de IgM³20 moléculas, que corresponde con la media más 3 desviaciones estándar de los valores obtenidos en los individuos normales.
A los pacientes se les determinaron los valores de haptoglobina plasmática a través de la capacidad de unión de esta a la hemoglobina y su posterior separación por filtración en gel (Sephadex G-100, Pharmacia).15 Los valores normales de haptoglobina plasmática de referencia oscilan entre 0,4 y 2,4 g/L.
La intensidad de la hemólisis se clasificó según la concentración de hemoglobina (Hb), el conteo de reticulocitos y las cifras de haptoglobina plasmática (Hp). Se consideró en el grupo con hemólisis de alto grado a aquellos casos que presentaron cifras de Hb menores de 90 g/L, conteo de reticulocitos superiores al 5 % y valores de Hp menores de 0,4 g/L; y en el grupo con hemólisis de bajo grado, a aquellos casos que presentaron cifras de Hb mayor o igual a 90 g/L, conteo de reticulocitos entre el 3 y el 5 % y valores normales de Hp.
Se estratificaron los resultados del número de moléculas de IgG por hematíe en los pacientes de los grupos de alto y bajo grado de hemólisis. El grado de asociación entre las cifras de Hb, el conteo de reticulocitos y las cifras de Hp con el número de moléculas de IgG por hematíe, se estimó por el coeficiente de correlación de Pearson. Se consideró significativa una probabilidad (p) menor de 0,05 que se determinó con el programa Statistica versión 6.1, StatSoft, Inc, USA.
RESULTADOS
El rango de edad de los pacientes estudiados fue de 20 a 73 años (mediana de 56 años). La duración media del tratamiento con IFNa fue de 21 meses (rango de 1-84) y la dosis administrada fue de 3 millones de unidades 3 veces a la semana (tabla 1). En todos los casos la PAD y la PAI fueron negativas en los estudios previos al tratamiento con el fármaco.
La PAD y la Mp fueron positivas en 12 pacientes (92,3 %), lo que reveló la presencia de IgG y C3 en los eritrocitos de 7 casos (53,84 %). En 3 pacientes (23,07 %) se detectó IgG sola y en 2 casos (15,38 %) se identificaron autoanticuerpos de la clase IgG e IgA. La PAD y la Mp fueron negativas en un caso. La caracterización de los autoanticuerpos en subclases se investigó en 11 pacientes en los que se demostró la presencia de IgG1 y en un caso se identificaron también autoanticuerpos de la subclase IgG3 (tabla 1).
Los autoanticuerpos en todos los pacientes se comportaron como panaglutininas por su reacción de aglutinación en la fase de antiglobulina con todas las células del panel de hematíes, sin mostrar especificidad para un antígeno de grupo sanguíneo en particular. No se detectó la presencia de autoanticuerpos séricos en la PAI.
El patrón de inmunoglobulinas de los autoanticuerpos en los hematíes revelados en la PAD y la Mp se corroboró en el ELISA. Esta técnica, además, detectó la presencia de autoanticuerpos en concentraciones de 183 moléculas de IgG por hematíe en un paciente con resultados negativos en la PAD y la Mp (caso 13) (tabla 2).
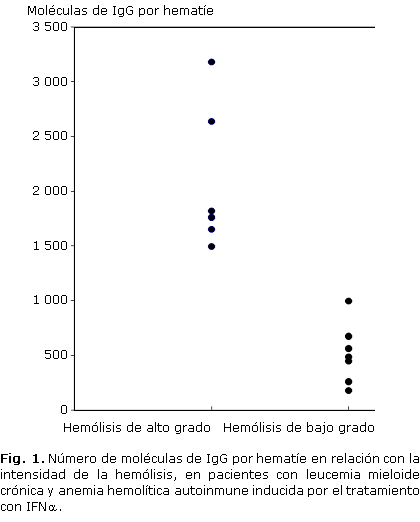
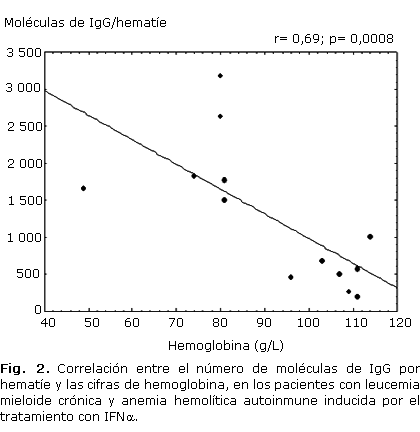
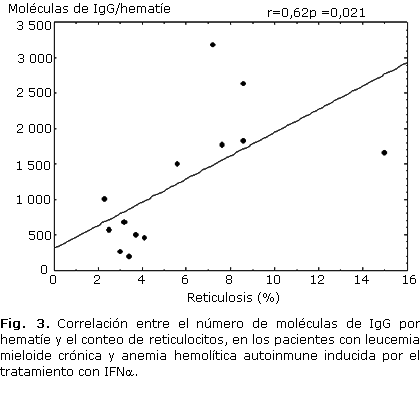
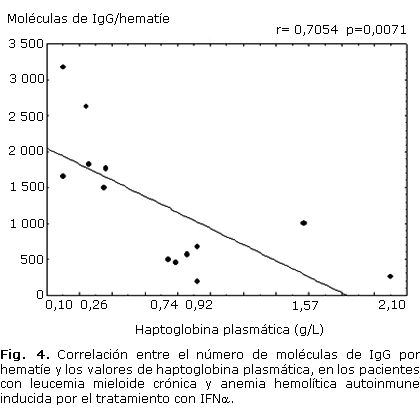
La estratificación de los resultados obtenidos en el ELISA en relación con la intensidad de la hemólisis, mostró un rango de valores entre 1 500 y 3 180 moléculas de IgG por hematíe en los pacientes con hemólisis de alto grado (6 casos); mientras que en los casos con hemólisis de bajo grado (7 pacientes) se comportó entre 183 y 1 000 moléculas por hematíe (tabla 2, fig. 1). Debido al número limitado de pacientes estudiados no fue posible aplicar una prueba estadística para investigar las diferencias entre el número de moléculas de IgG por hematíe en ambos grupos de hemólisis. No obstante, se observó una correlación negativa entre las cifras de Hb (r= -0,69; p = 0,008) y los valores de haptoglobina plasmática (r= -0,705; p = 0,007) con el número de moléculas de IgG por hematíe; y una correlación positiva entre este último con el conteo de reticulocitos ( r= 0,62 ; p = 0,021) (figuras 2, 3 y 4).
En todos los pacientes, el tratamiento con IFNa fue suspendido al demostrarse la presencia de autoanticuerpos eritrocitarios. En algunos casos con hemólisis de alto grado fue necesaria la transfusión de 500 mL de concentrado de hematíes y en todos los pacientes de este grupo se inició tratamiento con prednisona oral en dosis de 1 mg/kg/día durante 2 semanas, que se fue disminuyendo en un intervalo de 1 mes (tabla 2).
Después del tratamiento inmunosupresor se observó un incremento de las cifras de Hb y una disminución del conteo de reticulocitos con valores similares a los mostrados previo a la administración del IFN. En 6 de los 7 pacientes con hemólisis de bajo grado, la interrupción del IFN fue suficiente para restaurar la Hb y los reticulocitos a las cifras previas al tratamiento con IFN, en un intervalo de 1 a 2 meses (datos no mostrados).
DISCUSIÓN
La anemia hemolítica autoinmune inducida por fármacos se reconoció por vez primera en pacientes tratados con alfa metildopa.16 Después de esta observación, otras drogas han sido identificadas como inductoras de autoinmunidad contra los eritrocitos, entre las que se encuentra el IFNa.17
El IFN provoca alteraciones del sistema inmune que favorecen la aparición de autoinmunidad. El mecanismo más invocado se relaciona con la diferenciación Th1 de los linfocitos CD4 estimulada por el IFNa, al provocar un aumento en la expresión de los receptores para la interleucina (IL)-12 en estas células.9 Las citocinas Th1 (IL-2, interferón gamma [IFNg] y factor de necrosis tumoral beta) favorecen la inmunidad mediada por células, la activación de los macrófagos y la producción de anticuerpos opsonizantes y fijadores del complemento que median la hemólisis inmune de los hematíes.18 Por otra parte, en los pacientes con LMC el IFNa promueve la diferenciación de las células mononucleares en células dendríticas capaces de presentar péptidos específicos de la LMC y de esta forma, inducir la producción de autoanticuerpos.19
Al parecer, la aparición de las manifestaciones de hemólisis inducida por el tratamiento con IFNa presenta un patrón dual. En pacientes con autoanticuerpos previos a la administración del fármaco, la anemia hemolítica aparece entre los primeros 21 días después de comenzado el tratamiento tras la exacerbación de la enfermedad autoinmune latente. Sin embargo, en el resto de los pacientes, ocurre después de los 3 meses, como resultado de la inducción de la autoinmunidad.17 En los casos estudiados no se detectaron autoanticuerpos eritrocitarios con anterioridad al tratamiento; de esta forma y en correspondencia con lo sugerido previamente, en 12 de los 13 casos la anemia hemolítica apareció en un intervalo entre 3 y 84 meses de iniciada la terapia. Nuestros resultados indican que, aunque poco frecuente, puede también observarse la aparición de la AHAI al mes de tratamiento en pacientes sin antecedentes de hemólisis inmune.
El patrón de inmunoproteínas detectadas en los eritrocitos de los pacientes estudiados no difiere de los observados en la anemia hemolítica autoinmune común.16 Otros autores han encontrado resultados similares en este grupo de pacientes con la identificación en los hematíes de IgG, C3 o de ambas, y de AHAI con PAD negativa.7,8,11,17
La presencia de autoanticuerpos de clase IgA no se ha dilucidado en la mayoría de los casos. Una comunicación previa identificó anticuerpos de este isotipo en los hematíes de un paciente en una serie de 5 casos analizados.17 Los autoanticuerpos IgA son infrecuentes y se identifican entre el 1,5 y el 14 % de los pacientes con AHAI, lo que es similar a la frecuencia del 15,3 % encontrado en esta serie.16,20
Hasta donde conocemos, no se han realizado estudios previos que caractericen las subclases de IgG de los autoanticuerpos eritrocitarios inducidos por el IFNa. Los hallazgos en este grupo de pacientes demuestran que los autoanticuerpos son predominantemente de la subclase IgG1 y en menor frecuencia, en combinación con la subclase IgG3. Estos resultados son similares a los obtenidos en los pacientes con AHAI y en la anemia autoinmune secundaria al tratamiento con alfa metildopa.16
La gran mayoría de los pacientes con AHAI presenta una PAD positiva, pero una PAD negativa no excluye la enfermedad. Una de las explicaciones de este fenómeno es que el límite de detección de anticuerpos por esta técnica es entre 200 y 500 moléculas de IgG por hematíe, por lo que es necesario el empleo de técnicas de mayor sensibilidad, como el ELISA, para detectar bajas concentraciones de autoanticuerpos causantes de la hemólisis.21 La aplicación del ELISA cuantitativo en este estudio permitió la detección de autoanticuerpos en concentraciones de 183 moléculas por hematíe en un paciente con AHAI y PAD negativa. Estos resultados corroboran que un número inferior a 200 de moléculas de IgG por hematíe puede ocasionar un resultado negativo en las técnicas convencionales de diagnóstico inmunohematológico, también en pacientes con AHAI inducida por el IFNa. De esta forma, es recomendable el empleo de ensayos más sensibles que la PAD para el diagnóstico de la hemólisis inmune mediada por autoanticuerpos estimulados por el tratamiento con este fármaco.
Generalmente, la destrucción inmune de los hematíes es proporcional a la cantidad de anticuerpos unidos con estas células, aunque los estudios muestran resultados contradictorios al tratar de predecir la gravedad de la hemólisis a través de la concentración de IgG en los hematíes.21 En los pacientes analizados se observó una relación entre la intensidad de la hemólisis con la concentración de IgG, principalmente de la subclase IgG1. De esta forma, los pacientes con hemólisis de alto grado presentan más de 1 500 moléculas de IgG por hematíe, a diferencia del grupo con hemólisis de bajo grado, que se distribuyeron en un rango entre 183 y 1 000 moléculas de IgG. En apoyo a estas observaciones se encontró también correlación entre las cifras de Hb, el conteo de reticulocitos y las cifras de Hp, con el número de moléculas de IgG por hematíe.
Estos hallazgos coinciden con los comunicados previamente por Meulen y otros,22 que obtuvo evidencias a favor de que la cantidad de anticuerpos IgG1 en pacientes tratados con alfa metildopa es un factor determinante en la ocurrencia de la hemólisis in vivo. Al respecto, se ha invocado un mecanismo similar al del IFNa para la inducción de autoinmunidad por alfa metildopa que podría explicar las coincidencias entre estas observaciones. Los autores sugieren que la alfa metildopa estimula la secreción de IFNg por las células T y con ello la diferenciación Th1 de las células CD4 que favorece la aparición de la autoinmunidad.23
Por otra parte, es conocido que la destrucción inmune de los hematíes es mediada por los receptores para el fragmento Fc de la IgG presentes en los fagocitos, y que se requieren más de 1 200 moléculas de IgG1 para que ocurra una eritrofagocitosis eficiente.24 Estas observaciones apoyan nuestros resultados en cuanto a que la hemólisis de alto grado se manifiesta cuando existen más de 1 500 moléculas de IgG por hematíe. Sin embargo, otros estudios realizados en pacientes con AHAI idiopática e inducida por alfa metildopa, no han podido definir un valor umbral de concentración de IgG para la ocurrencia de hemólisis,25 aunque se reconoce que la concentración de IgG en los hematíes es un factor determinante en el proceso hemolítico.20 Las divergencias con estos resultados pudieran estar relacionadas con el tamaño de la muestra analizada. Es probable que este último factor tenga gran influencia, ya que la mayoría de las investigaciones antes mencionadas analizan una casuística mayor. El número reducido de pacientes investigados en esta serie se relaciona con la baja frecuencia de AHAI, que se presenta en alrededor del 1 % de los enfermos con LMC tratados con IFNa.6
Los efectos adversos que sobre el sistema inmune provoca el IFNa desaparecen después de descontinuado el tratamiento. Al igual que en nuestra serie, las investigaciones realizadas en pacientes con AHAI mediada por este fármaco consideran, en primer lugar, la interrupción de la terapia y en algunos casos, la administración de inmunosupresores para lograr la remisión del proceso hemolítico.6,26
Los resultados de este trabajo permiten recomendar la cuantificación de autoanticuerpos en los hematíes como una herramienta para la evaluación de la hemólisis inmune y en la decisión de la conducta terapéutica. Con este ensayo es posible determinar la concentración de autoanticuerpos en los hematíes en estudios longitudinales, de forma tal que podrían evaluarse en cada paciente los efectos inmunes adversos del tratamiento con el fármaco.
REFERENCIAS BIBLIOGRÁFICAS
1. Wei G, Rafiyath S, Liu D. First-line treatment for chronic myeloid leukemia:dasatinib, nilotinib, or imatinib. J Hematol Oncol. 2010 Nov 26; 3:47 doi:10.1186/1756-8722-3-47. PMID: 21108851.
2. Guilhot F, Roy L, Saulnier PJ, Guilhot J. Interferon in chronic myeloid leukaemia: past and future. Best Pract Res Clin Haematol. 2009 Sep; 22(3):315-29. PMID:19959083.
3. Mubarak AA, Kakil IR, Awidi A, AI-Homsi U, Fawzi Z, Kelta M, et al. Normal outcome of pregnancy in chronic myeloid leukemia treated with interferon-alpha in 1st trimester: report of 3 cases and review of the literature. Am J Hematol. 2002 Feb;69(2):115-18. PMID: 11835347.
4. Preudhomme C, Guilhot J, Nicolini FE, Guerci-Bresler A, Rigal-Huguet R, Maloisel F, et al. Imatinib plus peginterferon alfa-2a in chronic myeloid leukemia. N Engl J Med. 2010 Dec 23;363(26):2511-21. PMID: 21175313.
5. Jonasch E, Haluska FG. Interferon in oncology practice: review of interferon biology, clinical applications, and toxicities. Oncologist. 2001;6(1):34-55. PMID: 11161227.
6. Sacchi S, Kantarjian H, O´Brien S, Cohen PR, Pierce S, Talpaz M. Immune-mediated and unusual complications during interferon alpha therapy in chronic myelogenous leukemia. J Clin Oncol. 1995 Sep;13:401-7. PMID:7666100.
7. Barbolla L, Paniagua C, Outeriño J, Prieto F, Sánchez Fayos J. Haemolytic anemia to the alpha interferon treatment: a proposal mechanism. Vox Sang. 1993;65(2):156-7. PMID: 8212670.
8. Fornaciarri G, Bassi C, Beltrami M, Castaginetti E, Maccari S, Plancher AC. Hemolytic anemia secondary to interferon treatment for chronic B hepatitis. J Clin Gastroenterol.1991 Oct;13(5):596-7. PMDI: 1744407.
9. Abbas AK, Lichtman AH, Pillai S. Inmunologia celular y molecular. 6ta. ed. Madrid: Elsevier Saunders; 2008. pp. 285-7.
10. Bencomo-Hernández A, Alfonso-Valdés ME, Munster-Infante A, Basanta-Otero P, Espinosa- Martínez E, Hernández-Ramírez P. Autoanticuerpos en pacientes hematológicos tratados con interferón alfa. Rev Cubana Hematol Inmunol Hemoter. [serie en internet]. 2000; 16(1):49-55. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-02892000000100006&lng=es&nrm=iso&tlng=es
11. Steegmann JL, Requena MJ , Martín-Regueira P, de la Cámara R, Casado F, Rodriguez F, et al. High incidence of autoimmune alterations in chronic myeloid leukemia patients treated with interferon-a. Am J Hematol. 2003 Mar;72(3):170-6. PMDI: 12605388.
12. Brecher ME, ed. Technical manual. 14th. ed. Bethesda, MD: American Association of Blood Banks; 2002.
13. Alfonso Y, Bencomo AA, Diaz M, Alfonso ME. Micrométodo para la detección de clases y subclases de inmunoglobulinas en el eluido de eritrocitos de pacientes con anemia hemolítica autoinmune. Rev Cub Hematol Inmunol Hemoter. 2002 Dic;18(3):20-26. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-02892002000300010&lng=es
14. Bencomo AA, Díaz M, Alfonso Y, Valdés O, Alfonso ME. Quantitation of red cell-bound IgG, IgA, and IgM in patients with autoimmune hemolytic anemia and blood donors by enzyme-linked immunosorbent assay. Immunohematology. 2003;19(2):47-53. PMID:15373694.
15. Delores M, ed. Immunohematology: methods and procedures. Rockville, MD: American Red Cross; 1993.
16. Petz LD, Garraty G. Immune hemolytic anemias. 2nd. ed. Philadelphia: Churchill Livingstone; 2004.
17. Adriani A, Bibas M, Callea V, De Renzo A, Chiurazzi F, Marceno R, et al. Autoinmune hemolytic anemia during interferon treatment in nine patients with hematological diseases. Haematologica. 1996 May-Jun;81(3):258-60. PMID:8767532.
18. Barker RN, Vickers MA, Ward FJ. Controlling autoimmunity--Lessons from the study of red blood cells as model antigens. Immunol Lett. 2007 Jan 15;108(1):20-6. PMID: 17134764.
19. Paquette RL, Hsu N, Said J. Interferon-alpha induces dendritic cell differentiation of CML mononuclearcells in vitro and in vivo. Leukemia. 2002 Aug;16(8):1484-9. PMID:12145689.
20. Bencomo AA, Alfonso ME, Ávila OM, Espinosa E, Jaime JC, Hernández P. Relación entre hemólisis con la presencia y cuantificación de inmunoglobulinas en hematíes, en la anemia hemolítica autoinmune. Rev Cubana Hematol Inmunol Hemoter. [serie en internet]. 2010;26 (4). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-02892010000400007&lng=es&nrm=iso&tlng=es
21. Garraty G. The James Blundell Award Lecture 2007: Do we really understand immune red cell destruction? Transf Med. 2008 Dec;18(6):321-34. PMID:19140815.
22. Meulen FW. Quantitation aspect of destruction of red cell sensitized with IgG1 autoantibodies an aplication of flow cytofluorometry. Brit J Haematol. 1980 Sep;46(1):47-56. PMID:7000155.
23. Baier JE, Poehlau D. Is a-methyldopa-type autoimmune hemolytic anemia mediated by interferon-g? Ann Hematol. 1994 Nov;69(5):249-51. PMID: 7948314.
24. Zupanska B, Thompson E, Broker E, Ferry AH. Phagocytosis of erythrocytes sensitised with known amounts of IgG1 and IgG3 anti-Rh antibodies. Vox Sang. 1987;5 (2):96-101. PMID:3120411.
25. Garratty G, Nance S. Correlation between in vivo hemolysis and the amount of red cell-bound IgG measured by flow cytometry. Transfusion. 1990 Sep;30(7):617-21. PMID:2402775.
26. Raanani P, Ben-Bassat I. Immune-mediated complications during interferon therapy in hematological patients. Acta Haematol. 2002;107(3):133-44. PMID:11978934.
Recibido: 13 de septiembre del 2011.
Aprobado: 11 de octubre del 2011.
DrCs. Antonio Bencomo-Hernández. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800. La Habana, Cuba. Tel (537) 643 8695, 8268, Fax (537) 644 2334. Correo electrónico: ihidir@hemato.sld.cu Website: http://www.sld.cu/sitios/ihi