Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión impresa ISSN 0864-0289
Rev Cubana Hematol Inmunol Hemoter vol.28 no.1 Ciudad de la Habana ene.-mar. 2012
ARTÍCULO ORIGINAL
Cultivo de células estromales de rata. Influencia del suero fetal bovino
Stromal rat cell culture. Influence of fetal calf serum
Lic. Karelys de la Cuétara-Bernal,I Dr. MV. Alain García-VaronaI, Lic. Bertha Beatriz Socarrás-FerrerII
I Centro Internacional de Restauración Neurológica. La Habana, Cuba.
II Instituto de Hematología e Inmunología. La Habana, Cuba.
RESUMEN
Las células madre estromales humanas y de roedores cultivadas pueden ser inducidas a diferenciarse en neuronas, enfatizando su utilidad potencial en la terapia celular neurorrestaurativa. Los sistemas de cultivo para la expansión de estas células describen el uso de diferentes proporciones de suero fetal, lo que motivó a estudiar qué concentración de suero fetal bovino era capaz de garantizar un adecuado rendimiento celular. Las células de la médula ósea de rata se cultivaron en medio a-MEM suplementado con 10 y 20 % de suero fetal bovino y se subcultivaron hasta 3 veces. La viabilidad celular de los cultivos primarios y los subcultivos estuvo por encima del 98 % en ambos experimentos. Los cultivos primarios demoraron 17,4 días en confluir y los subcultivos 7,7 días. La concentración de suero fetal al 20 % no aumentó significativamente la velocidad de multiplicación celular; no obstante, se obtuvo un mayor número de células estromales. El sistema de expansión in vitro podría utilizarse en estudios futuros para la expansión de las células estromales humanas, lo que sienta mejores bases para su aplicación clínica.
Palabras clave: células estromales de médula ósea, cultivo, suero fetal bovino, viabilidad celular.
ABSTRACT
Cultured human and rodents stromal stem cells can be induced to differentiate into neurons, emphasizing its potential use in neurorestorative cell therapy. Cropping systems for the expansion of these cells describe the use of different ratios of fetal serum, which led to study what concentration of fetal calf serum was able to ensure an adequate cell yield. Cells from rat bone marrow were cultured in medium supplemented with a-MEM 10 and 20 % fetal bovine serum and subcultured up to 3 times. Cell viability of primary cultures and subcultures was above 98% in both experiments. Primary cultures converge delayed in 17.4 days and 7.7 days subcultures. The concentration of 20 % fetal calf serum did not significantly increase the speed of cell division, however, we obtained a greater number of stromal cells. The expansion in vitro system could be used in future studies for the expansion of human stromal cells, which feels better basis for clinical application.
Key words: bone marrow stromal cells, culture, fetal bovine serum, cell viability.
INTRODUCCIÓN
Las células estromales de la médula ósea son de gran interés debido a que se pueden aislar fácilmente, expandirse y ser capaces de generar colonias in vitro a partir de células simples.1 En la médula ósea se han caracterizado al menos 2 tipos de células madre: las hematopoyéticas y las estromales, que pueden diferenciarse en osteoblastos, adipocitos, condrocitos, miocitos, astrocitos, oligodendrocitos, neuronas y otros linajes mesenquimales.2 Diferentes autores han demostrado que las células estromales cultivadas, tanto humanas como de roedores, pueden ser inducidas a diferenciar en neuronas,3-8 lo que enfatiza su utilidad potencial en el tratamiento de las enfermedades neurológicas.
De estos antecedentes surge el interés de explorar estas células como posible fuente para trasplantes experimentales y clínicos, y ser considera algo muy importante en el establecimiento de los sistemas de expansión in vitro.9-11 En los últimos años se ha visto un rápido avance en el aislamiento y caracterización de células progenitoras y células madre hematopoyéticas, fundamentalmente humanas, lo que ha facilitado y mejorado el desarrollo ex vivo de técnicas de expansión de células madre para su uso como fuente de células para diversas enfermedades.7,8,12-17 Sin embargo, esta tecnología no ha alcanzado el nivel de desarrollo necesario para que los progenitores y las células madre expandidos in vitro puedan ser usados en la terapia celular de remplazo.
Por otro lado, los estudios in vitro que se informan refieren el uso de diferentes medios de cultivo y diferentes sueros en diversas proporciones,1,5,9,10,14-16 de ahí el interés en estudiar cuál de las concentraciones de suero fetal bovino descritas en la literatura, resulta la óptima para obtener un crecimiento celular adecuado para propósitos experimentales y futura aplicación clínica.
MÉTODOS
Cultivo y expansión de células madre estromales de la médula ósea
Las ratas (Sprague Dawley) se anestesiaron y se sacrificaron cumpliendo las normas éticas para el trabajo con animales de laboratorio. Se extrajeron ambos fémures, se lavaron con solución tampón de fosfato salino y se cortaron las epífisis. Las células de la médula ósea se perfundieron con una jeringuilla con medio de cultivo a-MEM. El contenido extraído de la médula ósea se centrifugó a 1 000 rpm durante 5 min. Se resuspendió el pellet y las células aisladas se inocularon en una placa de 6 pozos con a-MEM suplementado con 10 y 20 % de suero fetal bovino (SFB), 2 mM L-glutamina, 100 U/mL penicilina, 100 µg/mL estreptomicina. Después de 24 h de cultivo, las células no adherentes se eliminaron mediante un cambio de medio. Los cambios de medio se realizaron cada 2-3 días hasta cubrir totalmente la superficie del frasco de cultivo a lo que se le denomina confluencia del cultivo. Para subcultivar las células, la monocapa confluente se incubó a 37 °C con tripsina 0,25 % y 1 mM EDTA (0,02 %), se desprendieron las células y se efectuó su resiembra. Se realizaron 5 experimentos independientes donde se inocularon 3 pozos por cada variante: 10 y 20 % de suero fetal bovino, respectivamente, a razón de 13 x 106 células/pozo en el cultivo primario. Se realizaron hasta 3 subcultivos (pase) en cada experimento y se denominaron P1, P2 y P3. En cada subcultivo las células se sembraron a razón de 105 células/pozo.
Determinación de viabilidad y concentración celular
Se determinó por conteo en cámara de Neubauer, usando azul de tripán al 0,4 % como colorante vital. La viabilidad se expresó como porcentaje de células vivas con respecto al total (vivas + muertas), y la concentración de las células se expresó en células/mL.
Análisis estadístico
Los resultados se expresaron como la media ± desviación estándar. Las comparaciones entre los grupos se realizaron mediante la t de Student. Para el análisis de los resultados se utilizó un programa Statistica versión 4.0 para Windows (1993).
RESULTADOS
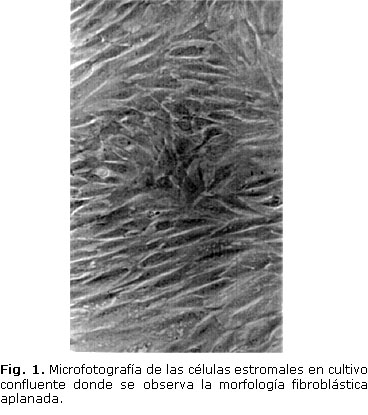
Las células estromales de rata cultivadas en las condiciones descritas mostraron una morfología fibroblástica aplanada típica (Fig. 1) descrita por otros autores.1,9,10 La viabilidad celular de los cultivos primarios y los subcultivos se mantuvo en el 98 % en los experimentos realizados en ambas variantes de suero.
Los cultivos primarios demoraron un tiempo promedio de 17,4 días en alcanzar la confluencia en ambas variantes, mientras que los subcultivos mostraron valores inferiores 7,7 días. Las concentraciones de suero fetal al 20 % no favorecieron un aumento de la velocidad de multiplicación de las células, por lo que no se observó un efecto directo de la concentración de suero empleado y la velocidad de crecimiento de las células capaz de modificar el tiempo que demoró el cultivo en alcanzar la confluencia.
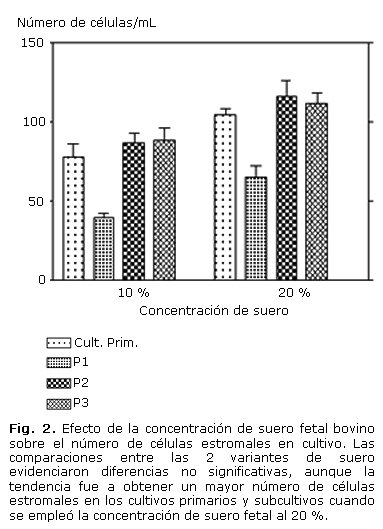
No se encontraron diferencias significativas (t = -1,319; p = 0,223) al comparar las concentraciones de células obtenidas en los cultivos con las variantes de suero fetal investigadas, aunque se observó un aumento del número de células cuando se empleó suero fetal al 20 % (Fig. 2).
DISCUSIÓN
La viabilidad celular es un parámetro que no se modificó ni en los cultivos primarios ni en los subcultivos realizados en ambas variantes de suero empleadas, aspecto muy favorable en la consideración de estas células para futuros estudios clínicos.
Los resultados demuestran que en las concentraciones de suero empleadas no se observó una influencia directa sobre la disminución del tiempo en que la monocapa alcanzaba la confluencia. En ambas concentraciones se alcanzó a un tiempo similar de forma general; sin embargo, el tiempo en alcanzar la confluencia en los pases fue menor que el tiempo que se observó en el cultivo primario. Esto pudiera deberse a la composición celular heterogénea de los aspirados de médula ósea reportado por otros autores,10 donde la concentración de células estromales es más baja, mientras que en los subcultivos esta población se va incrementando y purificando y alcanza la confluencia en menor tiempo, independiente de la concentración del suero.
En relación con la influencia de la concentración de suero sobre las células en cultivo (Fig. 2), podemos señalar que en la serie de experimentos donde se empleó el 10 % de suero fetal, se observan valores de concentración de células inferiores, tanto para los cultivos primarios como para los pases, si lo comparamos con la serie donde se empleó suero fetal al 20 %. A pesar de que estos resultados no mostraron diferencias significativas, se observó una tendencia a la obtención de un mayor número de células estromales cuando se empleó la mayor concentración de suero fetal.
La viabilidad celular en los cultivos primarios y los subcultivos no se modificó en las variantes de suero estudiadas y se mantuvo por encima del 98 %. La velocidad de multiplicación de las células no estuvo influenciada por la concentración de suero fetal al 20 %, aunque se observó una tendencia a la obtención de un mayor número de células estromales cuando se empleó este último.
Estos estudios de expansión de células estromales de médula ósea de rata sirven de base para futuros estudios de expansión de las células estromales derivadas de médula ósea humana, lo que reviste una importancia relevante si se tiene en cuenta la aplicación clínica de células madre cultivadas y la consecuente creación de bancos de células estromales crioconservadas.
El sistema de expansión in vitro aquí descrito se puede aplicar para la expansión de las células estromales humanas, lo que sienta mejores bases para la aplicación clínica en el tratamiento de diversas enfermedades.
REFERENCIAS BIBLIOGRÁFICAS
1. Hung SC, Cheng NJ, Hsieh SL, Li H, Ma HL, Lo WH. Isolation and characterization of size-sieved stem cells from human bone marrow. Stem Cells. 2002 Feb 7;20(3):249-58.
2. Zhao LR, Duan WM, Reyes M, Verfaillie CM, Low WC. Inmunohistochemical identification of multipotent adult progenitor cells from human bone marrow alter tranplantation into the rat brain. Brain Research Protocols. 2003 Mar;11(1):38-45.
3. Alexanian AR, Mainman DJ, Kurpad SN, Gennarelli TA. In vitro and in vivo characterization of neurally modified mesenchymal ítem cells induced by epigenetic modifiers and neural ítem cell environment. Stem Cells Dev. 2008 Dec;17(6):1-9.
4. Barzilay R, Kan I, Ben-Zur T, Bulvik S, Melamed E, Offen D. Induction of human mesenchymal ítem cells into dopamine-producing cells with different differentiation protocols. Stem Cells Dev. 2008 Jun;17(3):547-54.
5. Greco SJ, Zhou C, Ye JH, Rameshwar P. An interdisciplinary approach and characterization of neuronal cells transdifferentiated from Human mesenchymal stem cells. Stem Cells Dev. 2007 Oct;16(5):811-26.
6. Bonilla S, Silva A, Valdés L, Geijo E, García-Verdugo JM, Martínez S. Functional neural stem cells derived from adult bone marrow. Neuroscience. 2005;133(1):85-95.
7. Dezawa M, Kanno H, Hoshino M, Cho H, Matsumoto N, Itokazu Y, et al.Specific induction of neural cells from bone marrow stromal cells and appplication for autologous transplantation. J Clin Invest. 2004 Jun;113(12):1701-10.
8. Muñoz-Elías G, Woodbury D, Black IB. Marrow stromal cell, mitosis, and neuronal differentiation: Stem cell and precursor functions. Stem Cells. 2003 Feb 21;21(4):437-48.
9. Kitano Y, Radu A, Shaaban A, Flake AW. Selection, enrichment and culture expansion of murine mesenchymal progenitor cells by retroviral transduction of cycling adherent bone marrow cells. Exp Hematol. 2000 Dec;28(12):1460-69.
10. Bernardo ME, Cometa AM, Pagliara D, Vinti L, Rossi F, Cristantielli R, et al. Ex vivo expansion of mesenchymal stromal cells. Best Pract Res Clin Haematol. 2011 Mar;24(1):73-81.
11. Bernardo ME, Avanzini MA, Perotti C, Cometa AM, Moretta A, Lenta E, et al. Optimization of In vitro expansion of human multipotent mesenchymal stromal cells for cell-therapy approaches: further insights in the search for a fetal calf serum substitute. J Cell Physiol. 2007 Sept 13;211:121-30.
12. Zhang ZG, Zhang L, Jiang Q, Chopp M. Bone marrow-derived endotelial progenitor cells participate in cerebral ischemia in the adult mouse. Circ Res. 2002 Feb 22;90(3):284-88.
13. Neuhuber B, Himes T, Shumsky JS, Gallo G, Fischer I. Axon growth and recovery of function supported by human bone marrow stromal cells in the injured spinal cord exhibit donor variations. Brain Res. 2005 Feb 21;1035(1):73-85.
14. Lu P, Jones LL, Tuszynski. BDNF-expressing marrow stromal cells support extensive axonal growth at sites of spinal cord injury. Exp Neurol. 2005 Feb;191(2):344-60.
15. Lee PH, Park HJ. Bone marrow-derived mesenchymal stem cell as a candidate disease-modifying strategy in Parkinson´s disease and multiple system atrophy. J Clin Neurol. 2009 Mar;5(1):1-10.
16. Dezawa M, Hoshino M, Nabeshima YI, Ide C. Marrow stromal cells: implications in health and disease in the nervous system. Curr Mol Med. 2005 Nov;5(7):653-62.
17. Paul C, Samdani AF, Betz RR, Fischer I, Neuhuber B. Grafting of human bone marrow stromal cells into spinal cord injury: a comparison of delivery methods. Spine (Phila Pa 1976). 2009 February 15;34(4):328-34. doi:10.1097/BRS.0b013e31819403ce.
Recibido: 16 de noviembre del 2011.
Aprobado: 28 de noviembre del 2011.
Lic. Karelys de la Cuétara-Bernal. Centro Internacional de Restauración Neurológica (CIREN). Ave. 25 No.15805 e/ 158 y 160, Cubanacán, Playa. La Habana, Cuba. Tel.: 271 6385, 271 6844, 271 6841 ext 29, Fax: (537) 273 6028, 273 6339, 273 2420. Correo electrónico: karelys.cuetara@infomed.sld.cu, karelys@neuro.ciren.cu