Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión impresa ISSN 0864-0289
Rev Cubana Hematol Inmunol Hemoter vol.28 no.4 Ciudad de la Habana oct.-dic. 2012
ARTÍCULO ORIGINAL
Altas dosis de dexametasona en la trombocitopenia inmune primaria crónica
High-dose dexamethasone in chronic primary immune thrombocytopenia
Dr. Wilfredo Roque-García, Dra. Delfina Almagro-Vázquez, Dra. Dunia Castillo-González, Dra. Olga Agramonte-Llanes
Instituto de Hematología e Inmunología. La Habana, Cuba.
RESUMEN
Se realizó un estudio prospectivo, aplicado y analítico para determinar la efectividad del tratamiento con altas dosis de dexametasona en pacientes con trombocitopenia inmune primaria crónica atendidos en la consulta de hemostasia del Instituto de Hematología e Inmunología en el período comprendido entre abril de 2008 y abril de 2011. Se estudiaron 30 pacientes, 18 del sexo femenino y 12 del masculino, con una edad promedio de 37 años. Se alcanzó una respuesta favorable en 17 pacientes (68,0 %), de ellos, en 14 la remisión fue completa y en 3 parcial. No se obtuvo respuesta en 8 pacientes. Se observó un aumento significativo del recuento plaquetario entre el inicio y el final del tratamiento. Las remisiones se obtuvieron tempranamente, entre el primero y el tercer ciclo, y no se observaron respuestas tardías. La mayoría de los enfermos que respondieron a tratamientos previos con prednisona tuvieron una respuesta favorable a la dexametasona. Por lo general, los efectos adversos fueron leves y los más frecuentes fueron: mialgias, edemas y artralgias. En 3 pacientes fue necesario interrumpir el tratamiento por efectos indeseables y 9 mantuvieron la remisión durante el período de seguimiento. La dexametasona en altas dosis constituye una alternativa eficaz y segura en pacientes con trombocitopenia inmune primaria crónica.
Palabras clave: trombocitopenia inmune, prednisona, dexametasona.
ABSTRACT
A prospective, analytical and applied study was conducted to determine the effectiveness of treatment with high-dose dexamethasone in patients with chronic primary immune thrombocytopenia, who were assisted at the Hemostasis service of the Institute of Hematology and Immunology from April 2008 to April 2011. 30 patients, 18 females and 12 males with an average age of 37 years were studied. Favorable response was achieved in 17 patients (68.0%), out of them, 14 had complete and 3 had partial remission respectively. No response was obtained in eight patients. A significant increase in platelet count was observed during the whole therapy. Referrals are obtained early, from the first to the third cycle, and late responses were not observed. Most patients who responded to previous treatment with prednisone had a favorable response to dexamethasone. In general, adverse events were mild and the most frequent were myalgia, edema, and arthralgias. Three patients required stopping the treatment because of side effects and nine maintained remission during the follow-up period. High-dose dexamethasone is an effective and safe alternative treatment in patients with chronic primary immune thrombocytopenia.
Keywords: immune thrombocytopenia, prednisone, dexamethasone.
INTRODUCCIÓN
La trombocitopenia inmune primaria (PTI) es un trastorno autoinmune adquirido que afecta a adultos y niños. Se caracteriza por una disminución transitoria o persistente del recuento de plaquetas y un riesgo de sangramiento que se incrementa según el grado de trombocitopenia.1
Las manifestaciones de esta enfermedad son consecuencia de la destrucción de las plaquetas al estar unidas a anticuerpos específicos del propio paciente. Estos inmunocomplejos son captados por la fracción Fc de los macrófagos del sistema reticuloendotelial, principalmente del bazo, lo que produce la destrucción precoz de las plaquetas. La severidad de la trombocitopenia es reflejo del balance entre la producción por los megacariocitos y la destrucción acelerada de las plaquetas. Por otra parte, su producción está afectada ya sea por la destrucción intramedular de las plaquetas recubiertas de anticuerpos o por inhibición de la megacariopoyesis.2
En los casos crónicos, es universal el uso de esquemas terapéuticos desde el diagnóstico, debido a que las remisiones espontáneas son raras. Dentro de la primera línea de tratamiento se sitúan los corticoesteroides con los cuales responde aproximadamente el 70 % de los afectados.3
Desde hace décadas, la esplenectomía ha sido considerada una opción terapéutica de segunda línea para los pacientes que no responden a los glucocorticoides y los estudios realizados desde hace más de 50 años demuestran que es la medida con la que se alcanza el mayor número de remisiones mantenidas. Aproximadamente el 20 % de los pacientes son resistentes a los esteroides y a la esplenectomía y requieren otros regímenes de tratamiento, que en ocasiones pueden causar efectos adversos serios.4
Entre los múltiples esquemas utilizados se citan: el uso endovenoso de inmunoglobulinas,5 la vacunación anti D,6,7 drogas inmunosupresoras como la azatioprina y los alcaloides de la vinca,8 la ciclofosfamida,9 el danazol10-12 y el interferón alfa;13-15 todos con respuestas controvertidas, efectos adversos y recaídas al descontinuar el fármaco. Más recientemente se ha incorporado el uso del rituximab16-19 y los análogos de la trombopoyetina, como el tombopag y romiplostin,20-22 con resultados promisorios.
El uso de altas dosis de dexametasona es una alternativa para estos enfermos y constituye una opción antes que la esplenectomía en pacientes resistentes a la prednisona.23,24
El propósito de este trabajo fue evaluar los resultados del uso de altas dosis de dexametasona en un grupo de pacientes con PTI crónica.
MÉTODOS
Se realizó un estudio prospectivo, aplicado para determinar la efectividad y la seguridad del tratamiento con dosis altas de dexametasona en pacientes con PTI crónica, que fueron atendidos en la consulta de hemostasia del Instituto de Hematología e Inmunología en el período comprendido entre abril de 2008 y abril de 2011.
Se estudiaron 30 pacientes con PTI crónica sin respuesta a uno o varios esquemas terapéuticos y sin tratamiento, al menos un mes previo al estudio.
Criterios diagnósticos
• Trombocitopenia con integridad del sistema megacariopoyético.
• Ausencia de antecedentes de ingestión de drogas.
• No evidencias de una enfermedad de base que justificara la trombocitopenia.
A todos los pacientes se les administró una dosis única diaria de 40 mg de dexametasona por vía oral, durante 4 días consecutivos cada 28 días, hasta completar 6 ciclos de tratamiento.
Evaluación de la respuesta
La respuesta fue evaluada luego de la terminación del último ciclo de tratamiento. Se consideró:
• Remisión completa: cuando se alcanzaron recuentos plaquetarios de 150 x 109/L o más.
• Remisión parcial: cuando se obtuvieron recuentos de plaquetarios entre 50 y 100 x 109/L y al menos se duplicó el recuento inicial.
• No respuesta: conteos plaquetarios de menos de 50 x 109/ L.
• Respuesta favorable: se consideró a las remisiones completas y parciales.
• Recaída: disminución del número de plaquetas por debajo de 50 x 109/L después de haberse obtenido una respuesta favorable.
Análisis estadístico
Se realizó un análisis descriptivo de los datos utilizando tasas y porcentajes como medida de resumen para las variables cualitativas. Se empleó la media y la desviación estándar para describir el comportamiento de las variables cuantitativas.
Se efectuaron diferentes pruebas de hipótesis que permitieron probar correlaciones significativas (p< 0,05) entre las variables de estudio (Chi cuadrado, análisis de varianza, comparaciones múltiples).
Para el procesamiento de las variables en estudio, se empleó el paquete estadístico SPSS versión 17.0 sobre Windows.
RESULTADOS
En el estudio fueron incluidos 30 pacientes con una edad promedio de 37 años (rango de 18-70). El 56,6 % tenía menos de 40 años. Del total de la muestra, 18 (60 %) pacientes eran del sexo femenino.
Todos los pacientes presentaban trombocitopenia sintomática al comenzar el tratamiento, que incluyó equimosis en 14 casos, petequias en 10, metrorragia en 9, epistaxis en 5, gingivorragia en 4, y 3 pacientes presentaron hematomas. El promedio del número de plaquetas al comienzo fue de 13,8 x 109/ L con un rango entre 2 y 38 x 109/ L.
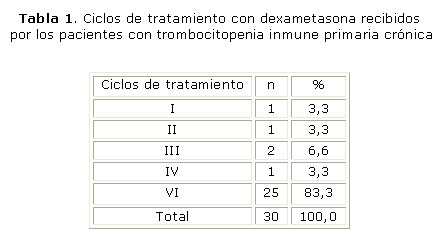
Se administró un promedio de 5 ciclos por paciente, con un rango entre 1 y 6. El 83,3 % de los pacientes recibió 6 ciclos de dexametasona (tabla 1). En 3 pacientes fue necesario suspender el tratamiento por efectos secundarios al medicamento, un paciente lo abandonó y una salió del estudio por estar embarazada.
En la figura 1 se muestra la distribución de la respuesta en los 25 pacientes que terminaron los 6 ciclos de dexametasona. El 68 % alcanzó una respuesta favorable, de ellos 14 (56 %) obtuvieron remisión completa y 3 (12 %) remisión parcial. No se obtuvo respuesta en 8 (32 %) pacientes.
La figura 2 muestra el valor promedio del recuento plaquetario al inicio, durante y al finalizar el tratamiento, con un intervalo de confianza del 95 %. Se observó un aumento sostenido del recuento de plaquetas a partir del tercer ciclo de tratamiento. Se encontró una diferencia estadísticamente significativa con respecto a la cifra inicial de plaquetas (p< 0,05). Mediante pruebas de comparaciones múltiples (LSD y Duncan) con 95 % de confianza, no se observó significación estadística entre los valores promedio de plaquetas del cuarto al sexto ciclos de tratamiento.
Se analizó la relación entre la respuesta al tratamiento y los grupos de edades. De los 15 (60 %) pacientes que se encontraban en el grupo de menos de 40 años, 13 (86,6 %) tuvieron una respuesta favorable: 10 remisiones completas (66,6 %) y 3 (20 %) parciales. En el grupo de mayores de 40 años respondió el 40 %. Se demostró relación significativa entre la edad y la respuesta al tratamiento (p = 0,012). No se observó una significación en la respuesta de acuerdo con el sexo (p = 0,9).
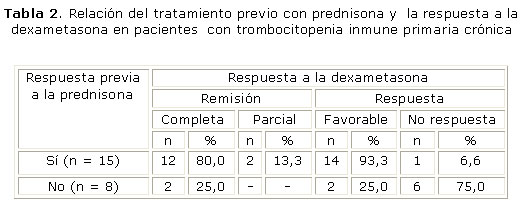
El 92 % (n = 23) de los pacientes estudiados habían utilizado prednisona como tratamiento de primera línea. Un paciente fue tratado de inicio con azatioprina sin obtenerse respuesta; y otro había realizado un ciclo de tratamiento con dexametasona, con una respuesta completa.
De los 23 casos tratados anteriormente con prednisona, 15 (65,2 %) habían respondido con recaída posterior, y no se había obtenido respuesta en 8 casos (34,7%). De los 15 pacientes que tuvieron alguna respuesta anterior a la prednisona, 12 (80 %) obtuvieron una remisión completa al tratamiento con dexametasona y 2 (13,3 %) una remisión parcial (p = 0,01). En los 8 pacientes sin respuesta previa a la prednisona solo 2 (25 %) mostraron respuesta favorable a la dexametasona (tabla 2).
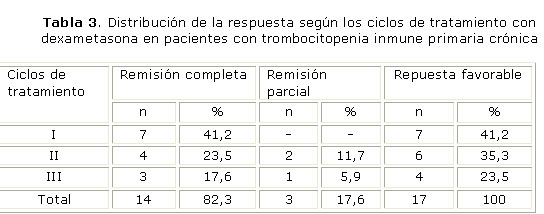
Los 17 pacientes que respondieron al tratamiento con dexametasona lo hicieron en los 3 primeros ciclos. El mayor número de respuestas favorables constituidas por 7 remisiones completas (41,2 %) se alcanzó al finalizar el primer ciclo (tabla 3). Entre los ciclos 4 y 6 ningún paciente obtuvo respuesta al tratamiento.
Los anticuerpos antiplaquetarios fueron determinados en 10 pacientes al inicio y al final del tratamiento. Antes de comenzar el tratamiento con dexametasona el 80 % (n = 8) de los pacientes resultaron positivos. Los anticuerpos más frecuentes fueron los de tipo IgG que estuvieron presentes en 6 (60 %) pacientes, y los de tipo IgA en 4 (40 %) casos; un paciente presentó anticuerpos de tipo IgM.
Al finalizar el tratamiento el 50 % (n = 4) de los pacientes habían negativizado los anticuerpos; de ellos, dos alcanzaron remisión completa y 2 remisión parcial. En los 4 casos restantes persistió la positividad. De estos, en 3 se obtuvieron respuestas favorables y uno no respondió. En un paciente cuya determinación fue negativa al inicio, los anticuerpos antiplaquetarios se demostraron al finalizar el tratamiento.
Los efectos adversos a la dexametasona por lo general fueron leves y se presentaron en 15 (60 %) pacientes; los más frecuentes fueron: edemas, mialgias y artralgias. En 3 (12 %) pacientes fue necesario suspender el tratamiento por intolerancia: uno en el primer ciclo por múltiples efectos adversos como urticaria, dolor abdominal, mialgias y cefalea, sin haberse logrado un aumento del número de plaquetas; un segundo caso en el cuarto ciclo por presentar un cuadro de psicosis luego de haber alcanzado la remisión completa; el tercero lo abandonó en el tercer ciclo luego de lograr recuentos plaquetarios cercanos a lo normal.
De los 17 pacientes respondedores a la dexametasona, 13 fueron seguidos durante un promedio de 14,2 meses (rango entre 1 y 24 meses); de ellos, 9 (69,2 %) mantuvieron la respuesta favorable distribuidos en: 7 con remisión completa y 2 obtuvieron remisión parcial con un recuento promedio de plaquetas de 192 x 109/L. En 4 pacientes (31 %) se observaron recaídas alrededor de los 3 meses, como promedio y con valores medios de plaquetas de 19,6 x 109/L.
Durante el tratamiento no se presentaron complicaciones hemorrágicas que hayan requerido otro tipo de terapia en ninguno de los pacientes estudiados.
DISCUSIÓN
La media de edad fue de 37 años (rango de 18-70 años) con un ligero predominio en menores de 40 años, similar a lo encontrado por Arruda y otros en un estudio que comprendió 18 pacientes con PTI crónica tratados con dexametasona, con una media de 42,5 años y un rango entre 16 y 77 años.25 Otros autores han hallado una mayor incidencia en pacientes mayores de 60 años.26,27 El 60 % de los pacientes eran del sexo femenino, con una relación hombre-mujer de 1,5:1, que coincide con lo que reportan otros autores.27-29
Al inicio de la enfermedad, todos los pacientes presentaron manifestaciones hemorrágicas cutáneas, mucosas o ambas, de leve a moderada intensidad. Las más frecuentes fueron las equimosis y petequias; le siguieron las metrorragias, lo cual concuerda con otros estudios que plantean que en el adulto la forma de presentación es insidiosa y con manifestaciones hemorrágicas de moderada intensidad. Stasi y otros describieron que el sangramiento gingival y las equimosis constituyen la forma más frecuente de presentación.30 En un estudio que incluyó a 10 pacientes con PTI crónica se encontró que 8 tenían síntomas hemorrágicos leves al inicio.31 Otros autores hallaron manifestaciones hemorrágicas en el 100 % de los pacientes y estas incluían, en orden decreciente: epistaxis, petequias, equimosis, gingivorragia y metrorragia severa.32 Estos hallazgos se asemejan a los encontrados en nuestra investigación.
En este estudio, el tratamiento con altas dosis de dexametasona demostró ser eficaz. El 68 % de los casos alcanzaron una respuesta favorable y más del 50 % se mantenía en remisión completa al finalizar el estudio. Estos resultados fueron superiores a los hallados por diferentes autores donde el rango de respuesta varía entre el 21 y el 62 %, y en la mayoría de los casos transitoria.3,24,33
Uno de los aspectos importantes del trabajo lo constituye el hecho de que la mayoría de los pacientes que mostraron alguna respuesta a tratamientos previos con prednisona, respondieron favorablemente a la administración de dexametasona. Por lo tanto, en aquellos enfermos que han respondido a la prednisona pudiera predecirse una respuesta favorable a la terapéutica con dexametasona. No obstante, en pacientes con pobre respuesta a la prednisona también es posible alcanzar algún grado de respuesta, como demostró un estudio que encontró respuestas a la dexametasona hasta en el 22 % de pacientes resistentes a la prednisona.24 Por lo tanto, este medicamento pudiera ser una opción terapéutica eficaz en los casos crónicos.
Los pacientes de reciente diagnóstico pudieran beneficiarse también con el empleo de la dexametasona. En investigaciones recientes se alcanzaron respuestas que oscilan entre el 83 y el 89 % en pacientes con trombocitopenia inmune sin tratamiento previo.33,34
De manera similar a lo que ocurre con la respuesta al tratamiento, se ha encontrado variabilidad en cuanto al número de ciclos de dexametasona que son necesarios para obtener una respuesta favorable. Caulier y otros reportaron una respuesta al tratamiento luego de la administración de 3 ciclos de dexametasona; el resto de los pacientes no respondieron luego de 6 ciclos.31 En una investigación del grupo italiano GIMEMA se alcanzaron respuestas en el 89 % de los casos luego de 4 ciclos de dexametasona, y el mayor rango de respuesta se produjo después del tercer ciclo.34
De manera similar, en el presente estudio los pacientes que respondieron lo hicieron en los 3 primeros ciclos. Se encontró diferencia significativa en el recuento de plaquetas entre el inicio del tratamiento y el tercer ciclo, no así entre el tercero y los ciclos subsiguientes. Estos resultados indican que más de 3 ciclos de dexametasona no reportan un beneficio adicional en el tratamiento de esta enfermedad.
Al correlacionar la edad con la respuesta al tratamiento se encontró una relación inversa significativa, con un mayor porcentaje de respuestas en los pacientes menores de 40 años, lo cual coincide con lo comunicado en la literatura revisada.23 No se encontró correlación significativa entre el sexo y la respuesta al tratamiento, lo cual coincide con los hallazgos de los estudios mencionados.34,35 Las recaídas se presentaron en el 30,7 % de los pacientes, resultado muy similar al encontrado en el estudio del grupo GIMEMA,34 aunque el tiempo de seguimiento de los pacientes en este reporte fue ligeramente superior al nuestro.
Los anticuerpos antiplaquetarios desaparecieron al final del tratamiento solamente en el 50 % de los casos, lo que pudiera estar relacionado con su determinación inmediatamente después de finalizado el estudio. Para valorar de una manera fidedigna esta variable se recomienda la investigación de los anticuerpos antiplaquetarios 6 meses después de terminado el tratamiento.24
En relación con la suspensión del tratamiento, solamente 3 (12 %) pacientes tuvieron que abandonarlo debido a efectos adversos producidos por el fármaco (2 en remisión completa y uno sin respuesta). En el estudio del grupo GIMEMA, el 13,5 % de los casos suspendieron el tratamiento por efectos adversos.34 En otro estudio, el 22 % de los pacientes presentaron efectos adversos que impidieron continuar el tratamiento.33 Sin embargo, en estos 2 estudios se concluyó que la dexametasona fue bien tolerada.
No se presentaron sangramientos severos con peligro para la vida de los pacientes. Las investigaciones realizadas apoyan el criterio de que en los pacientes con trombocitopenia severa los episodios hemorrágicos con riesgo para la vida son muy raros, particularmente en la forma crónica de la enfermedad. Un estudio de la Universidad de Michigan realizado hace más de 3 décadas demostró que los recuentos plaquetarios por debajo de 10 x 109/L únicamente producían sangramientos importantes de manera ocasional.36 Una revisión de 17 series, que incluyó un total de 1 817 pacientes, concluyó que el riesgo de hemorragia fatal fue entre 0,0162 y 0,0389 por paciente por año, con recuentos plaquetarios por debajo de 30 x 109/L.37 En otro estudio llevado a cabo en Italia, se realizó seguimiento durante 3 años, de 49 pacientes con trombocitopenia mayor de 30 x 109/L, sin que aparecieran sangramientos importantes. Ante estas evidencias, plantearon que los pacientes con trombocitopenia ligera o moderada pudieran no requerir intervención.38
La dexametasona en altas dosis puede ser el tratamiento de elección luego del fracaso inicial al tratamiento con la prednisona u otras alternativas terapéuticas, por lo que debe considerarse antes que la esplenectomía y otros tratamientos más tóxicos y costosos. La respuesta obtenida en pacientes resistentes a la prednisona pudiera sugerir su empleo como tratamiento de primera línea en pacientes con PTI; sin embargo, se deben realizar otras investigaciones que apoyen esta hipótesis. En la actualidad existen varios ensayos clínicos para determinar la efectividad y seguridad de la dexametasona como primera línea de tratamiento, aunque los resultados aún no están disponibles.39,40
Los hallazgos obtenidos demuestran la factibilidad de reducir el tratamiento con dexametasona a 3 ciclos, lo que contribuiría a la disminución de sus efectos adversos sin reducir su eficacia. La dexametasona en altas dosis es una opción efectiva y segura en pacientes con PTI que no responden a otras medidas terapéuticas.
REFERENCIAS BIBLIOGRÁFICAS
1. Cooper N, Bussel J. The pathogenesis of immune thrombocytopenic purpura. Br J Haematol. 2006 May;133(4):364-74.
2. Chu WY, Korb J, Sakamoto MK. Idiopathic thrombocytopenic purpura. Pediatr Rev. 2000;21:95-103.
3. British Committee for Standards in Haematology. Guidelines for the investigations and management of idiopathic thrombocytopenic purpura in adults, children and pregnancy. Br J Haematol. 2003 Feb;120(4):574-96.
4. Kojouri K, Vesely SK, Terrell DR, George JN. Splenectomy for adults patients with idiopathic thrombocytopenic purpura: a systematic literature review to assess long term platelet count responses, prediction of response and surgical complications. Blood. 2004 Nov;104(9):2623-34.
5. Mc Millan R. Therapy for adults with refractory chronic immune thrombocytopenic purpura. Ann Intern Med. 1997 Feb;126(4):307-14.
6. Blanchette V, Imbach P, Andrew M. Randomized trial of intravenous inmunoglobulin G, intravenous anti D and oral Prednisona in childhood thrombocytopenic purpura. Lancet. 1994 Sep;344(8924):703-7.
7. Ambriz R, Muñoz R, Pizzuto J, Quintanar E, Morales M, Avilés A. Low dose autologus in vitro opsonized erithrocytes for refractory autoimmnune thrombocytopenic purpura in adults. Arch Intern Med. 1987 Jan;147(1):101-8.
8. Vesely SK, Perdue JJ, Rizvi MA, Terrell DR, George JN. Management of adults patients with idiopathic thrombocytopenic purpura after failure of splenectomy. A systematic review. Ann Int Med. 2004 Jan;140(2):112-20.
9. Pizzuto J, Ambriz R. Therapeutic experience on 934 adults with idiopathic thrombocytopenic purpura: Multicentric trial of the Cooperative Latin America Group on Hemostasis and Thrombosis. Blood. 1984 Dec;64(6):1179-83.
10. Ahn YS, Harrington WJ, Simon SR, Mylvaganam R, Pall LM, So AG. Danazol for the treatment of idiopathic thrombocytopenic purpura. N Engl J Med. 1983 Jun;308(23):1396-9.
11. Almagro D, Crespo O, González X, Espinosa E. Dosis intermedias de Danazol en la púrpura trombocitopénica idiomática crónica. Rev Iberoamer Tromb Hemostasia. 1996;9:19-21.
12. Mc Verry BA, Auger M, Bellingham AJ. The use of Danazol in the management of chronic immune thrombocytopenic purpura. Br J Haematol. 1985 Sept;161(1):145-8.
13. Proctor SJ. Alpha interferon therapy in the treatment of idiopathic thrombocytopenic purpura. Eur J Cancer. 1991;27(suppl):S63-8.
14. Dikici B, Bosnak M, Kara IH, Dogru O, Alkaya A, Hasolat K. Interferon treatment of refractory idiopathic thrombocytopenic purpura. Pediatr Int. 2001 Dec;43(6):577-80.
15. Almagro D, Hernández P, López Saura P, Perea S, Apestegui I. Interferón-alfa recombinante en el tratamiento de la púrpura trombocitopénica idiopática crónica. Rev Iberoamer Tromb Hemost. 1990;3:39-41.
16. Sibilia J, Sordet C. Rituximab: a original biotherapy in autoimmune disorders. Rev Med Interne. 2005;26(6):485-500.
17. Semple JW. ITP Three RS: regulation routing, Rituximab. Blood. 2008;112(4):927-8.
18. Taube J, Schmid H, Reinhard H, von Stackelberg A, Overbeg VS. Effect of a single dose of Rituximab in chronic immune thrombocytopenic purpura in childhood. Haematologica. 2005;90:281-3.
19. Arnold DM, Dentali F, Crowther MA, Meyer RM, Cook RJ, Sigovin C. Systematic review: Efficacy and safety of Rituximab for adults with idiopathic thrombocytopenic purpura. Ann Intern Med. 2007;146(1):25-33.
20. Bussel JB, Kuter DJ, George JN, Mc Millan R, Aledort LM, Coklin CT. AMG 531, a thrombopoiesis-stimulating protein for chronic ITP. New Engl J Med. 2006;355(16):1672-81.
21. Kuter DJ. New thrombopoietic growth factors. Blood. 2007 Jun;109(11):4607-16.
22. Vicente V, Pérez-Andreu V, Rivera-Lozano ML. Análogos de la trombopoyetina en púrpura trombocitopénica inmune. Haematologica. 2008;93;434-9.
23. Andersen JC. Response to resistant idiopathic thrombocytopenic purpura to pulsed high dose Dexamethasone treatment. N Eng J Med. 1994;330:1560-4.
24. Dubbeld P, Van der Heul C, Hillen HF. Effect of high dose Dexamethasone in Prednisone - resistant autoinmune thrombocytopenic purpura. Neth J Med. 1991;39(1-2):6-10.
25. Arruda VR, Annichino-Bizzacchi JM. High-dose Dexamethasone therapy in chronic idiopathic thrombocytopenic purpura. Ann Hematol. 1996;73(4):175-7.
26. Neylon AJ, Saunders PW, Howard MR, Proctor SJ, Taylor PR. Clinically significant newly presenting autoimmune thrombocytopenic purpura in adults: A prospective study of a population-based cohort of 245 patients. Br J Haematol. 2003;122(6):966-74.
27. Frederiksen H, Schmidt K. The incidence of idiopathic thrombocitopenic purpura in adults increases with age. Blood.1999;94(3):909-13.
28. Portielje JE, Westendorp RG, Kluin-Nelemans HC, Brand A. Morbidity and mortality in adults with idiopathic thrombocytopenic purpura. Blood. 2001;97(9):2549-54.
29. Mc Farland J. Pathophysiology of platelet destruction in immune (idiopathic) thrombocytopenic purpura. Blood Rev. 2002;16:1-2.
30. Stasi R, Provan D. Management of immune thrombocytopenic purpura in adults. Mayo Clin Proc. 2004;79(4):504-22.
31. Caulier MT, Rose C, Roussel MT, Huart C, Bauters F, Fenaux P. Pulsed high-dose Dexamethasone in refractory chronic idiopathic thrombocytopenic purpura: a report on 10 cases. Br J Haematol. 1995;91(2):477-9.
32. Tsiara S, Kaiafas P, Kapsali H, Christou L, Bourantas KL. Pulsed high - dose Dexamethasone therapy in patients with chronic refractory idiopathic thrombocytopenic purpura. Haemato. 1998;1:48-51.
33. Borst F, Keuning JJ, van Hulsteijn H, Sinnige H, Vreugdenhil G. High-dose dexamethasone as a first- and second-line treatment of idiopathic thrombocytopenic purpura in adults. Ann Hematol. 2004 Dec;83(12):764-8.
34. Mazzuconi MG, Fazi P, Bernasconi S, De Rossi G, Leone Gi, Gugliotta L, et al. Therapy with high dose Dexametasone in previously untrated patients affected by idiopathic thrompocytopenic purpura: a GIMEMA experience. Blood. 2007 Feb;109(4):1401-7.
35. Li H, Zhang L, Zhao H, Ji L, Yang R. Chronic idiopathic thrombocytopenic purpura in Chinese patients: a retrospective single centered analysis of 1791 cases. Chin Med J (Engl). 2005 Jan;118(1):34-7.
36. Lacey JV, Penner JA. Managmement of immune thrombocytopenic purpura in the adult. Semin Thromb Hemost. 1977 Jan;3(3):160-74.
37. Cohen YC, Djulbegovic B, Sharnai-Lubovitz O, Mozes B. The bleeding risk and natural history of idiopathic thrombocytopenic purpura in patients with persistent low platelet counts. Arch Intern Med. 2000 Jun;160(11):1630-8.
38. Cortelazzo S, Finazzi G, Buelli M. High risk of severe bleeding in aged patients with chronic thrombocytopenic purpura. Blood 1991 Jan;77(1):31-3.
39. Bae SH, Lee J-H. High dose Dexamethasone vs. conventional dose Prednisolone in adult ITP. Clinical Trial. NCT00451594. Disponible en: http://clinicaltrials.gov/ct2/show/NCT00451594
40. Ming Hou, DR. High-dose Dexamethasone and conventional dose Prednisone, for the first-line treatment of adults with ITP: a multicenter, randomized controlled, Clinical Trial. NCT01356511. Disponible en: http://clinicaltrials.gov/ct2/results?term=NCT01356511
Recibido: 15 de agosto del 2012.
Aprobado: 15 de septiembre del 2012.
Dr. Wilfredo Roque-García. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, La Habana, Cuba. Tel (537) 643 8695, 8268, Fax (537) 644 2334. Correo electrónico: rchematologia@infomed.sld.cu
Website: http://www.sld.cu/sitios/ihi