Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter vol.32 no.3 Ciudad de la Habana jul.-set. 2016
ARTÍCULO ORIGINAL
Tratamiento con inmunoglobulina G subcutánea en enfermos con inmunodeficiencias primarias: resultados preliminares del estudio multicentrico cubano
Treatment with subcutaneous immunoglobulin G in patients with primary immunodeficiencies: preliminary results of cuban multicenter study
Consuelo Macías-Abraham1, Miriam Sánchez Segura2, Concepción Insua Arregui1, María del Carmen García Nieblas3, Gueimy Hernández Flores1, Ada Arce Hernández1, Julio César Merlín Linares1, Raúl Martínez Triana1
1 Instituto de Hematología e Inmunología, La Habana, Cuba.
2 Hospital Pediátrico Universitario "William Soler", La Habana, Cuba.
3 Hospital Pediátrico Provincial Octavio de la Concepción y la Pedraja, Holguín, Cuba
RESUMEN
Introducción : Estudios previos muestran que la infusión de inmunoglobulina G (IgG) subcutánea (SC) presenta una eficacia similar a la IgG endovenosa (EV)para prevenir las infecciones en enfermos con inmunodeficiencias primarias (IDP),predominantemente de anticuerpos con deficiencias de IgG y que este tratamiento es seguro y bien tolerado.
Objetivo : Evaluar la seguridad, efectividad y tolerancia del tratamiento con IgG SC en un grupo de pacientes con IDP con deficiencias de IgG demostrada, previamente tratados con IgG EV.
Métodos : Se realizó un estudio multicéntrico de remplazo en la administración de IgG EV (Intacglobin, de producción nacional) a IgG SC (Gammanorm, Octhapharma) en pacientes con IDP con deficiencia de IgG. Se incluyeron 6 enfermos; 3 niños y 3 adultos, procedentes de diferentes instituciones del país. La dosis de IgG SC fue similar a la dosis global mensual previa de IgG EV, administrada en 4 dosis divididas con valor promedio de 108 mg/kg (rango entre 100-200) semanal, durante 36 semanas.
Resultados : En los enfermos que no recibieron tratamiento con IgG EV y presentaban valores muy disminuidos, los niveles de IgG sérica alcanzaron valores normales para la edad. En el resto de los pacientes, que llevaban tratamiento con IgGEV en la semana anterior al estudio, los niveles de IgG sérica se incrementaron o se mantuvieron superiores a 7 g/Ldentro del rango normal. En todos los enfermos disminuyó la frecuencia y gravedad de las infecciones;durante el período de infusión de IgG SC,la tasa de infección disminuyóde 1.7 infecciones/sujeto/año a 0.5 y las infecciones fueron leves con buena respuesta al tratamiento. Todos los enfermos mantienen la administración de IgG SC domiciliaria con una buena respuesta.
Conclusiones: El tratamiento de remplazo es bien tolerado y constituye una alternativa terapéutica efectiva para los enfermos con IDP.
Palabras clave : tratamiento con IgG subcutánea, gammanorm, inmunodeficiencias primarias.
ABSTRACT
Introduction: Previous studies have shown that infusion of subcutaneous (SC) Immunoglobulin G (IgG) shows similar efficacy to intravenous IgG (IV) to prevent infections in IgG deficiency of primary immunodeficiencies (PID) patients and this treatment is safe and well tolerated.
Objective: To evaluate the safety and effectiveness of treatment with SC IgG in a group of PID patients demonstrated deficient IgG, IgG pretreated with EV.
Methods : This is the first multicenter study of SC (Gammanorm, Octhapharma) versus Intravenous (Intacglobín, national production) replacement therapy in PID patients in Cuba, 6 patients were included; 3 children and 3 adults, from different institutions in the country. SCIgG dose was similar to the previous month's overall dose of IgG IV, 4 doses divided, with a range of 108mg/ kg (range 100-200) administered weekly for 36 weeks.
Results: Patients who were not receiving treatment IgG IV with serum IgG levels greatly diminished reached normal values according to age range. In the patients who had treatment IgG IV in the week before the study, serum IgG levels were increased or superior to 7g/L. All the patients decreased the frequency and severity of infections, the infection rate of 1.7 infections / subject / year during the administration of IV IgG decreased to 0.5 during the infusion period of SC IgG infections and responded very well to treatment. All patients maintained the administration of SCIgG at home with a good answer.
Conclusions: The SCIgG replacement therapy in PID patients is well tolerated and effective therapeutic alternative for patients with PID.
Keywords : immunoglobulin subcutaneous therapy, Gammanorm, primary immunodeficiencies.
INTRODUCCIÓN
Las inmunodeficiencias primarias (IDP) incluyen un grupo de más de 250 enfermedades, genéticamente determinadas, que afectan el desarrollo, la función del sistema inmune, o ambos. Tienen una manifestación fenotípica heterogénea que depende de la variabilidad en la intensidad del defecto genético y de su expresión, así como de las interacciones entre los factores genéticos y ambientales 1-3.
Las IDP se clasifican de acuerdo al componente del sistema inmune que esté primariamente afectado 1-3. Las inmunodeficiencias humorales o predominantemente de anticuerpos (Acs) se caracterizan por una disminución parcial o total de anticuerpos, con fallas en la producción de anticuerpos específicos, lo que se refleja en una susceptibilidad incrementada a infecciones bacterianas, principalmente de la vía respiratoria 4.
En Cuba, no existen datos exactos sobre la prevalencia de las IDP, los resultados divulgados por el Registro Cubano de IDP entre los años 2011-2014 muestran que las inmunodeficiencias humorales, representan el 60 % del total de estas enfermedades5,6.
La deficiencia selectiva de IgA (1/700 nacidos vivos) y la inmunodeficiencia variable común (IDVC) (1/25000 nacidos vivos) son las IDP más frecuentes, las otras formas de IDP son poco frecuentes con una prevalencia global de 1/10000 nacidos vivos. Sin embargo, este índice aumenta en poblaciones con elevada consanguinidad 2,4.
Bruton y cols introdujeron la gammaglobulina humana como terapia de remplazo en pacientes con agammaglobulinemia desde hace más de 50 años 7. Este tratamiento es de por vida y consiste en la infusión de inmunoglobulina G humana (IgG) policlonal, extraída de plasma purificado de donantes sanos, por vía endovenosa (EV) o subcutánea (SC), en distintos intervalos de tiempo, a fin de lograr niveles plasmáticos de IgG en rango fisiológico para población sana.
Está comprobado que la terapia de remplazo con IgG reduce la frecuencia y la gravedad de las infecciones agudas y crónicas si se mantienen niveles séricos de IgG superiores a 750 mg/dL 8 y con niveles mayores que 800 mg/dL se previene la meningoencefalitis por enterovirus 9-15.
La primera vía de administración de gammaglobulina utilizada fue la intramuscular. Sin embargo, por no alcanzar niveles protectores de IgG plasmática, mantenidos o en meseta, fue remplazada por la vía de administración EV9 -11.
En la actualidad, la vía EV es la forma de infusión más utilizada para el tratamiento de pacientes con IDP 8,9. Sin embargo, esta resulta difícil para pacientes con pobre acceso venoso y aquellos que presentan reacciones adversas en forma recurrente. Además, requiere hospitalización al menos de medio día, los pacientes requieren transportarse cada 30 días o menos y deben ausentarse de su escuela o trabajo.
En diferentes países europeos, Estados Unidos, Canadá y algunos países latinoamericanos como Argentina y Brasil, se ha incrementado el empleo de la vía de administración subcutánea de IgG (IgSC) en pacientes con IDP 16-22. Para ello, se utiliza una presentación de IgG polivalente humana en solución, en una concentración de 16 % (16 mg/mL), que suele administrarse semanalmente; a diferencia de la Ig EV que suele presentarse al 5 % o 10% y se infunde cada 2 a 5 semanas.
La evidencia disponible en relación a la administración SC comparada con la EV muestra que la primera se asocia con niveles plasmáticos de IgG más elevados y estables durante todo el intervalo interdosis y con una menor incidencia de reacciones sistémicas adversas 23,24 lo que posiblemente se deba a que su tasa de absorción es más lenta. Con la administración SC han sido descritas reacciones locales, leves y autolimitadas, que reducen su ocurrencia a lo largo del tratamiento 23. Además, diversos análisis reportan que los costos de la terapia SC son inferiores a los de la infusión parenteral 22,25,26.
Desde que comenzó a utilizarse la IgG SC en el año 1991, se ha incrementado su uso, lo que permite que un mayor número de pacientes realicen esta forma de terapia en su domicilio, conmejora dela calidad de vida de ellosy sus familias; reduce el ausentismo escolar/laboral y minimiza los costos de hospitalización en las instituciones de salud 17-20,24-26.
La eficacia en la prevención de infecciones de IgG SC respecto a la EV, ha sido evaluada en unos pocos estudios comparativos, en adultos y niños, no se encuentran diferencias significativas en la gravedad y el número de infecciones por paciente y por año durante ambos tratamientos 17,24,26.
Se sugiere que el uso de la vía SC mejora la morbilidad en pacientes con IDP, al reducir los períodos con bajos niveles séricos de IgG, hacia el final del intervalo interdosis; sin embargo, existen escasos resultados disponibles que permitan comparar a largo plazo los efectos de las vías de administración SC y EV en el desarrollo, persistencia o progresión de sinusitis crónica o bronquiectasias u otros cambios en la tomografía pulmonar 24,26.
El objetivo de este trabajo es evaluar la seguridad y efectividad del tratamiento con IgG SCen un grupo de pacientes pediátricos y adultos con IDPcon deficiencias de IgG demostrada, previamente tratados con IgG EV (Intacglobín); así como la reducción de las infecciones, las reacciones adversas y la posiblemejoría en la calidad de vida y preferencias de los enfermos.
MÉTODOS
Muestra
Se incluyeron 6 pacientes,3 niños (media de edad 8,3 años) y 3 adultos (media de edad 34 años) con diagnóstico de IDP predominantemente de anticuerposde acuerdo a los criterios de la European Society Immunodeficiencies (ESID 2007, www.esid.org): 2 IDVC, 2agammaglobulinemia ligada al X (XLA) y 2 hipogammaglobulinemia congénita que requieren tratamiento sustitutivo de IgG; que no habían tenido buena respuesta al tratamiento con gammaglobulina EV, habían presentado reacciones adversas y mal acceso venoso que no les permitía continuar este tratamiento. Los pacientes procedían del Instituto de Hematología e Inmunología, del Hospital Pediátrico Docente William Soler y del Hospital Pediátrico Provincial "Octavio de la Concepción y la Pedraja" de Holguín. El seguimiento s mantuvo durante 36 semanas.
Criterios de exclusión
Se excluyeron de este estudio las mujeres en edad fértil que estuvieran embarazadas, los enfermos con alteraciones cutáneas que impedían la administración de IgG SC, historia de infecciones por hepatitis (A, B o C) o HIV, trastornos de la coagulación o trombocitopenia, tratamiento concomitante con drogas inmunosupresoras y antecedentes de reacciones de anafilaxia con hemoderivados.
Evaluación de respuesta o efectividad
Se seleccionaron diferentes variables como: número de infecciones bacterianas graves (neumonía, meningitis, sepsis, osteomielitis, abscesos profundos), de otras infecciones no bacterianas, episodios febriles, duración (días, semanas), niveles de IgG (g/L) intratratamiento (4, 8, 16, 24 y 36 semanas), eventos adversos, días de ausentismo escolar (niños) y laboral (adultos) y preferencia al tratamiento con IgG SC.
Reactogenicidad de los eventos adversos
Para su evaluación se clasificaron según su intensidad, gravedad y causalidad con la administración del producto.
Entrenamiento
Antes de iniciar la terapia en el domicilio se realizaron 4 a 6 sesiones de entrenamiento en el hospital. Se informó sobre el manejo de la técnica de perfusión, la importancia de escribir un diario durante el tratamiento y la técnica de administración de difenhidramina o hidrocortisona intramuscular o EV en caso de aparición de reacción adversa grave. Se realizaron consultas de seguimiento en las semanas 8, 16, 24 y 36 del tratamiento.
Preparación de IgG SC, técnica de infusión y dosis de tratamiento .
Se utilizó un preparado farmacéutico de IgG humana normal, Gammanorm (Octapharma) con una concentración de 16,50 mg/mL en 10 mL. La dosis de IgG SC se calculó a partir de la dosis y frecuencia de administración de las últimas 3 dosis de IgG EV recibidas por cada paciente. La dosis mensual total se dividió entre4, y se estableció la dosis inicial de IgGSC semanal, cuyamedia semanalfue de 108 mg/kg, rango entre 100 a 200 mg/kg/semana.
La infusión por vía SCse realizó mediante jeringuillas, con una velocidad de 10 a 20 mL/hora y un volumen máximo de 20 mL por sitio de infusión durante 1 hora aproximadamente. Dosis superiores se dividieron en dos lugares de punción, en la pared abdominal.
La primera infusión de IgG SC se administró en el hospital, por personal de enfermería entrenado del IHI, en presencia del médico tratante, a los 7 días de la última infusión de IgEV. Se premedicó con difenhidramina 1 amp, vía IM, 30 min antes. Se controlaron los signos vitales previo, durante y hasta 30 min después de finalizada la infusión. Se constató la presencia o no de reacciones adversas. Posterior a la cuarta dosis de IgG, todos los pacientes y su familia estaban en condiciones de iniciar la autoadministración domiciliaria.
En las semanas 8, 16, 24 y 36 el paciente fue evaluado clínicamente y se consideraron los datos registrados. Se realizó evaluación psico-socio-cultural, realizada por el Departamento de Psicología del IHI para establecer si el paciente y su familia reunían las condiciones necesarias para la práctica de la autoinfusión domiciliaria y evaluar la calidad de vida relacionada con la salud. Para ello, se utilizaron como instrumentos dos cuestionarios el PedQL27 para pacientes pediátricos y el SF36 28 para adultos aplicados a 5 pacientes en alguna de las visitas de las primeras 4 semanas y al finalizar las 36 semanas de tratamiento.
Determinaciones de laboratorio
Previo al estudio y en las semanas 4, 8, 16, 24 y 36 se realizaron las siguientes pruebas de laboratorio:
Previo a la inclusión del paciente : hemograma, química sanguínea que incluyó pruebas funcionales hepáticas (transaminasa glutámico pirúvica, fosfatasa alcalina y bilirrubina) y función renal (creatinina y urea), electroforesis de proteínas, cuantificación de IgG, IgA, IgM, coagulograma, evaluación de anticuerpos contra hepatitis viral B y C y VIH.En la visita final de la semana 36, se repitieron todos los estudios iniciales.
En la cuarta visita y en las semanas 8, 16 y 24,luegode la aplicación de gammaglobulina, se cuantificaron los niveles de IgG sérica.
Previo al estudio y en la semanas 8 y 24 se realizó la prueba de embarazo en muestra de orina a la paciente en edad fértil.
ANÁLISIS ESTADÍSTICO
Se elaboró una base de datos a partir de los datos de la historia clínica y diario de cada paciente que incluyó: identificación, diagnóstico, tipo de infecciones y frecuencia, tratamiento recibido, esquema y dosis de tratamiento de IgG SC, estudios evolutivos y sus resultados. Se evaluaron cualitativamente los síntomas clínicos y evolución, la frecuencia de los síntomas, signos y otras alteraciones asociadas, así como cuantitativamente los resultados de los estudios inmunológicos de acuerdo a los valores de referencia.Los valores de IgG (g/L) se expresaron como media ± desviación estándar ya que su distribución es normal. Los niveles de IgG sérica antes del tratamiento fueron comparados con la media y desviación estándar de los niveles alcanzados en las 4, 8, 16, 24 y 36 semanas, durante el estudio.El procesamiento de los datos se realizó utilizando el programa SPSS versión 11.5 para Windows. Se realizó un análisis comparativo de los resultados del cuestionario de calidad de vida registrado al inicio y al final del registro.
PROCEDIMIENTOS ÉTICOS
A los pacientes adultos y a los padres o tutores de los pacientes pediátricos incluidos en el estudio se les solicitó el consentimiento informado de acuerdo con los principios establecidos en la Declaración de Helsinski para la investigación con seres humanos. En este documento se expusieron detalladamente los beneficios individuales y sociales que se obtienen con la investigación, la ausencia de perjuicios para el paciente y las posibles reacciones adversas. Se brindó información escrita sobre el cambio de terapia de IgG EV a SC y las características y procedimientos del estudio. El estudio fue evaluado para su aprobación por el Consejo Científico y el Comité de Ética del IHI.
RESULTADOS
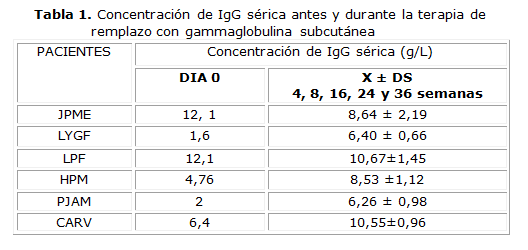
Se constató que el tratamiento con IgG SC fue efectivo y seguro. Los niveles de IgG sérica alcanzaron valores normales de acuerdo al rango de edad,en los dos enfermos que no estaban recibiendo tratamiento con IgGEV y presentaban valores muy disminuidos. En el resto de los pacientes que llevaban tratamiento con IgG EV en la semana anterior al estudio, con una frecuencia de cada dos semanas, los niveles se incrementaron, se hicieron superiores a 7 g/L o semantuvieron dentro del rango normal para su edad (tabla 1).
En todos los enfermos,se observó una disminución del número de episodios infecciosos con la administración SC, la tasa de infección disminuyó de 1,7 infecciones/sujeto/año, durante laadministración de IgGEV o la no administración por reacciones adversas, a 0,5 durante el período de infusión de IgGSC (tabla 2) y las infecciones fueron leves con buena respuesta al tratamiento.
Las reacciones adversas fueron de leves a moderadas, fundamentalmente locales, en las primeras infusiones y de duración corta (tabla 3).
El análisis de las entrevistas mostró que el 100 % de los entrevistados, enfermos y padres, expresan mayor aceptación al tratamiento ambulatorio domiciliario, evolución favorable de salud y una disminución en la frecuencia de enfermedades. Actualmente, todos los enfermos mantienen la administración de IgG SC domiciliaria con una buena respuesta.
DISCUSIÓN
Este trabajo refleja los resultados iniciales del tratamiento con IgG SC en Cuba para enfermos con diagnóstico de IDP con deficiencia de IgG, que requieren de un tratamiento sustitutivo durante toda la vida, por lo que los beneficios se relacionan no solamente con los efectos conocidos de mantener niveles estables de IgG en sangre y la reducción de enfermedades autoinmunes, sino también con la eliminación del acceso venoso, el uso de jeringuillas comunes y el tratamiento domiciliario.
Los enfermos y padres aprendieron fácilmente la administración del medicamento, que realizanen el hogar y todos mostraron preferencia por esta alternativa terapeútica, lo que corresponde con estudios de calidad de vida que demuestran que esto es crucial para la satisfacción de los enfermos 16,18.
La infusión local del medicamento produce reacciones en el sitio de inyecciónlas que se reportan durante este tipo de terapia, particularmente en el inicio, lo que corresponde con lo observado en estos pacientes 9,15,29-31. Los enfermos estudiados recibieron esta infusión por primera vez y las reacciones locales fueron de moderadas a leves lo que permite evaluar el tratamiento de IgG SC con seguridad favorable.
Resulta de interés, que en este estudio al igual que en otros previos, donde se utiliza una dosis equivalente a la IgG EVen el remplazo de tratamiento por vía SC, se corrobora que no es necesario incrementar la dosis para mantener los niveles de IgG en la prevención de las infecciones graves32. Se conoce que los niveles de IgG sérica que se alcanzan con el tratamiento de IgSC en las dosis recomendadas son protectores en pacientes con hipogammaglobulinemia contra infecciones sistémicas 2; se ha demostrado que el uso de dosis más elevadas minimizan la frecuencia y gravedad de las infecciones, reducen las enfermedades autoinmunes sistémicas 33, los días de hospitalización y el uso de antibióticos 34, por lo que el futuro de este tipo de terapia podría ser más personalizada y en búsqueda de las dosis que para cadaenfermo permita unamejor calidad de vida. Estos resultados demuestran que las infecciones disminuyeron en un período de 36 semanas y ningún paciente estuvo hospitalizado ni presentó complicaciones asociadas.
Por todo lo anterior,se concluye de manera preliminar que el remplazo de tratamiento de la IgG EV (Intagglobín) con la IgG SC (Gammanorm) es eficaz para el enfermo con IDP con deficiencia de IgG, ya que se observa una disminución del número de episodios infecciosos, que su aplicación es segura porque las reacciones adversas fueron de leves a moderadas, fundamentalmente locales, en las primeras infusiones y de duración corta, lo que corresponde con lo observado en estudios de otros países35 y que los enfermos y padres refieren mayor aceptación al tratamiento ambulatorio domiciliario y mejor calidad de vida.
REFERENCIAS BIBLIOGRÁFICAS
1. Stiehm ER, Ochs HD, Winkelstein JA. Immunologic disorders: General considerations. Filadelfia: WB Saunders; 2004. p. 289-35.
2. Notarangelo LD, Fisher A,Geha MD. Primary immunodeficiencies: 2009 update. J Allergy ClinImmunol. 2009; 124:1161-78.
3. Notarangelo LD. Primaryimmunodeficiencies. J Clin Immunol. 2010;125(suppl 2):S182-94.
4. Chapel H. Classification of primary immunodeficiency diseases by the International Union of Immunological Societies (IUIS). Expert Committee on Primary Immunodeficiency 2011. Clin Exp Immunol 2012;168(1):58-9.doi: 10.1111/j.1365-2249.2012.04561.x.
5. Kobrynski L. Subcutaneous immunoglobulin therapy: a new option for patients with primary immunodeficiency diseases. Biologics. 2012;6:277-87. doi: 10.2147/BTT.S25188
6. Berger M, Cupps TR, Fauci AS. Immunoglobulin replacement therapy by slow subcutaneous infusions. Ann Intern Med.1980;93:55-6.
7. Berger M. Subcutaneous Administration of IgG. Immunol Allergy Clin N Am. 2008;28:779-802.
8. Orange JS, Grossman WJ, Navickis RJ, Wilkes MM. Impact of trough IgG on pneumonia incidence in primary immunodeficiency: A meta-analysis of clinical studies. ClinImmunol. 2010;137(1):21-30.
9. Bezrodnik L, Gómez A, Regairaz L, Díaz D, Seminario G, Moreira I, et al. Subcutaneous IgG Replacement Therapy by Push in 32 Patients with Primary Immunodeficiency Diseases in Argentine. Clin Exp Pharmacol.2014(4):148. doi: 10.4172/2161-1459.1000148
10. BholeMailin V,Burton J, Chapel H. Self-infusion Programmes for Immunoglobulin Replacement at Home: Feasibility, Safety and Efficacy. Immunol Allergy Clin N Am. 2008;28:821-32.
11. Maroto Hernando M, Soler Palacin P, NaldaM, Oliveras Arenas M, Español Boren T, Figueras Nadal C. Gammaglobulina subctutánea en inmunodeficiencia común variable. Primera experiencia en España. An Pediatr (Barc).2009;70(2):111-9. doi: 10.1016/j.anpedi.2008.11.011.
12. Ochs HD, Gupta S, Kiessling P, Nicolay U, Berger M. Safety and efficacy ofself- administered subcutaneous immunoglobulin in patients with primary immunodeficiency diseases. J Clin Immunol. 2006;26:265-73.
13. Chapel HM, Spickett GP, Ericson D, et al. The comparison of the efficacy and safety of intravenous versus subcutaneous immunoglobulin replacement therapy. J Clin Immunol. 2000;20:94-100.
14. Borte M, Bernatowska E, Ochs HD, Roifman CM. Efficacy and safety of home-based subcutaneous immunoglobulin replacement therapy in pediatric patients with primary immunodeficiencies. Clin Exper Immunol. 2011;1-8.
15. Gardulf A, Hansen S, Johansson K. Rapid subcutaneous IgG replacement therapy in children and adults-20 years of clinical experience. VII Meeting of the Spanish group for Primary Immunodeficiencies. Inmunología 2005;24(4):392-5.
16. Gardulf A, Nicolay U, Asensio O, Bernatowska E, Böck A, Carvalho BC, et al. Rapid Subcutaneous IgG Replacement Therapy is Effective and Safe in Children and Adults with Primary Immunodeficiencies-A Prospective, Multi-National Study. J ClinImmunol. 2006.26: 177-85.
17. Shapiro R. Subcutaneous immunoglobulin therapy by rapid push is preferred to infusion by pump: a retrospective analysis. J Clin Immunol. 2010;30:301-7.
18. Conley MF, Notarangelo LD, Etzioni A. Diagnostic criteria for primary immunodeficiencies. Representing PAGID (Pan American Group for Immunodeficiency) and ESID (European Society for Immuno deficiencies). Clin Immunol. 1999;93:190-7.
19. Orange J. Clinical Update in Immunoglobulin Therapy for Primary Immunodeficiency Diseases. Clinical Focus on Primary Immunodeficiencies. 2011;14:1-9.
20. Gaspar J, Gerritsen B, Jones A. Immunoglobulin replacement treatment by rapid subcutaneous infusion. Arch Dis Child. 1998;79:48-51.
21. Björkander J, Chapel H, Spickett G. Comparison of the efficacy and safety of immunoglobulin given subcutaneously versus intravenous immunoglobulin in the prevention of infection in patients with primary antibody deficiency syndromes. MolImmunol. 1998;35:11-2.
22. Berger M. Subcutaneous immunoglobulin replacement in primary immunodeficiencies. Clin Immunol. 2004;112:1-7.
23. Shah SN, Todoric K, Tarrant TK. Improved outcomes on subcutaneous IgG in patients with humoral immunodeficiency and co-morbid bowel disease. Clin Case Rep Rev.2015;1(7):151-52 doi: 10.15761/CCRR.1000149.
24. Bonagura VR.Dose and outcomes in primary immunodeficiency disorders. Clin Exp Immunol. 2014 Dec;178 Suppl 1:7-9. doi: 10.1111/cei.12492.
25. Gardulf A, Nicolay U,Math D, Asensio O, Bernatowska E, Bock A, et al. Children and adults with primary antibody deficiencies gain quality of life by subcutaneous IgG self-infusions at home. J Allergy Clin Immunol. 2004;114:936-42.
26. Nicolay U, Kiessling P, BergerM,GuptaS, Yel L, RoifmanCM, et al. Health related quality of life and treatment satisfaction in north american patients with primary immunodeficiency diseases receiving subcutaneous IgG self-infusions at home. J Clin Immunol. 2006;26:65-72.
27. Varni JW, Seid M, Rode CA. The PedsQL: measurement model for the pediatric quality of life inventory. Med Care. 1999 Feb;37(2):126-39.
28. Vilagut G, Ferrer M, Rajmil L, Rebollo P, Permanyer-Miralda G, Quintana JM, et al. El cuestionario de salud SF-36 español: una década de experiencia y nuevos desarrollos. GacSanit.2005;19(2):135-50.
29. Koterba AP, Stein MR. Initiation of immunoglobulin therapy by subcutaneous administration in immunodeficiency patients naive to replacement therapy. Allergy Asthma Clin Immunol. 2014;10:63-7.
30. Hagan JB, Fasano MB, Spector S, Wasserman RL, Melamed I, Rojavin MA, et al. Efficacy and safety of a new 20% immunoglobulin preparation for subcutaneous administration, IgPro20, in patients with primary immunodeficiency. J ClinImmunol. 2010;30(5):734-45. doi:10.1007/s10875-010-9423-4.
31. Fadeyi M, Pharm D, Tran T. Calculating the Dose of Subcutaneous Immunoglobulin for Primary Immunodeficiency Disease in Patients Switched From Intravenous to Subcutaneous Immunoglobulin Without the Use of a Dose-Adjustment Coefficient.PT 2013;38(12):768-70.
32. Jolles S, Bernatowska E, de Gracia J, Borte M, Cristea V, Peter HH, et al. Efficacy and safety of Hizentra((R)) in patients with primary immunodeficiency after a dose-equivalent switch from intravenous or subcutaneous replacement therapy. ClinImmunol. 2011;141(1):90-102. doi:10.1016/j.clim.2011.06.002.
33. Jiang F, Torgerson TR, Ayars AG. Health-related quality of life in patients with primary immunodeficiency disease. Allergy Asthma Clin Immunol. 2015 Sep 29;11:27. doi: 10.1186/s13223-015-0092-y.
34. Haddad E, Berger M, Wang EC, Jones CA, Bexon M, Baggish JS. Higher doses of subcutaneous IgG reduce resource utilization in patients with primary immunodeficiency. J Clin Immunol.2012;32(2):281-9. doi:10.1007/s10875-011-9631-6.
35. Bezrodnik L, Gómez Raccio A, Belardinelli G, Regairaz L, Díaz Ballve D, Seminario G, et al. Comparative Study of Subcutaneous Versus Intravenous IgG Replacement Therapy in Pediatric Patients with Primary Immunodeficiency Diseases: A Multicenter Study in Argentina. J Clin Immunol. 2013;33(7):1216-22. doi: 10.007/s10875-013-9916-z.
Recibido: diciembre 21, 2015.
Aceptado: mayo 03, 2016.
DrC. Consuelo Macías Abraham . Instituto de Hematología e Inmunología. Apartado 8070, La Habana, CP 10800, CUBA. Tel (537) 643 8695, 8268. Email: rchematologia@infomed.sld.cu