INTRODUCCIÓN
Los diferentes tipos de cáncer originados en el sistema linfático y órganos hematopoyéticos se ubican entre las diez localizaciones más frecuentes en incidencia a nivel mundial.1 En Cuba ocuparon el séptimo lugar en mortalidad, durante los años 2016 y 2017.2
En particular, los linfomas no Hodgkin (LNH) son un grupo heterogéneo y frecuente de neoplasias malignas que se originan de células linfoides con aspecto maduro. Ocurren con mayor incidencia después de los 60 años, con probabilidad de desarrollarlo 1 de cada 43 personas. 3-6)
Los linfomas pueden afectar el sistema nervioso central (SNC) con un pronóstico muy desfavorable y mortalidad del 75 % en el primer año. Estos linfomas del SNC pueden ser primarios y secundarios. El primario suele ser poco frecuente, solo 3 % de todos los tumores cerebrales, con alta letalidad. 3-7
Los linfomas de Hodgkin rara vez infiltran el SNC, mientras que los LNH lo hacen en el 2,3 - 19 % de los casos, con riesgo de recidiva en el mismo lugar entre el 4,3 % y el 20 %; ello complejiza su tratamiento y hace necesario el diagnóstico temprano de esta infiltración. Se ha comprobado que alrededor del 50 % de los casos poseen una recaída aislada del SNC y el resto en el curso de una enfermedad sistémica. 3-7
Los riesgos de infiltración del SNC no están bien establecidos, pero incluyen los tipos agresivos, estadios avanzados de la enfermedad, presencia de síntomas B, elevación en sangre de la lactato deshidrogenasa (LDH) y los tipos de linfomas extranodales. (7-10
Según la clasificación de la Organización Mundial de la Salud (OMS) del 2008, vigente actualmente para los LNH, se requiere el estudio inmunofenotípico para precisar el diagnóstico.3 Cuando se sospecha infiltración del SNC, se realiza citología convencional e inmunofenotipaje por citometría de flujo (CF) al líquido cefalorraquídeo.3,11-12
La citología del LCR posee una sensibilidad de entre el 2 - 32 %, mientras que la CF alcanza el 80 %; por esto es un método imprescindible para completar el diagnóstico, sobre todo para identificar clones formados por pocas células. (11,13
La infiltración leucocitaria del SNC no siempre se compone de células neoplásicas, puede estar constituida por células normales o reactivas que son expresión de comorbilidades. De la presencia o no del infiltrado y de su tipo dependerá el pronóstico y la conducta a seguir. (14-15
A pesar de las ventajas de la CF no siempre se obtiene un inmunofenotipo confirmatorio de células patológicas y en su lugar se detectan células atípicas o sospechosas de malignidad. En estos casos que no son definitorios, resulta de suma importancia su identificación al menos a este nivel, por la valiosa información que aporta en la pesquisa de los pacientes con infiltración del SNC. (16
En este estudio se hizo una primera aproximación a la identificación de biomarcadores predictores de supervivencia por inmunofenotipaje del LCR, para tomar decisiones mejor fundamentadas en la conducta, elegir fármacos más efectivos con acceso al SNC o decidir realizar terapia intratecal e incluso, planificar profilaxis ante el riesgo de recaídas del SNC.
MÉTODOS
Diseño, muestra y recolección de datos
Se realizó un estudio analítico y prospectivo en pacientes mayores de 18 años con diagnóstico confirmado de LNH por inmunohistoquímica y con síntomas neurológicos, procedentes del servicio de oncología del Instituto Nacional de Oncología y Radiobiología (INOR), durante los años 2017 y 2018. Se utilizaron los siguientes criterios de inclusión: pacientes sin antecedentes de linfoma primario ni secundario del SNC, con sintomatología neurológica de comienzo reciente (menos de 15 días). Se descartaron las muestras de LCR hemático.
La muestra quedó conformada por 15 pacientes, 46,6 % LNH difuso de células grandes B (LNHDCGB), 26,6 % LNH de células T, 13,4 % LNH folicular de células B. El LNH de células B pequeñas y la leucemia linfocítica crónica representaron el 6,7 %, cada uno.
A cada paciente se le extrajeron 2 mL de LCR mediante punción lumbar. Las muestras fueron trasladadas inmediatamente al laboratorio de inmunología del INOR, donde se analizaron y procesaron dentro de la primera hora. El resto del líquido extraído se estudió por citoquímica, microbiología y anatomía patológica, como parte de las normas establecidas de diagnóstico de este tipo de recaída. En todos los casos la citología del LCR fue negativa.
El seguimiento se llevó a cabo en el servicio de oncología médica del INOR, donde los datos no relacionados con las variables del sistema inmune, fueron registrados al efecto.
Citometría de flujo
Se empleó un citómetro Beckman-Coulter Gallios de 10 colores. Se prepararon dos combinaciones de fluorocromos (Beckman-Coulter, Francia) en tubos separados y se siguieron las instrucciones del fabricante:
Tubo 1: fenotipo de subpoblaciones linfocitarias: anti-CD45 KRO (Clon J33), anti-CD19 PC7 (Clon 89B.B4), anti-CD3 FITC (Clon UCHT1), anti-CD4 PB (Clon 13B8.2), anti-CD8 AA700 (Clon B9.11), anti-CD56 PE (Clon N901) (NKH-1) y anti CD34 APC (Clon 581).
Tubo 2: fenotipo de células T activadas y linfocitos B: anti-CD45 KRO (Clon J33), anti-CD19 PC7 (Clon 89B.B4), anti-CD20 FITC (Clon B9E9) y anti-HLA-DR PE (Clon Immu-357).
Se realizó el control de calidad del citómetro con fluoroesferas Flow-Check (Beckman-Coulter, Francia) para comprobar alineación de los láseres y comprobar el sistema hídrico. Se controló la intensidad de fluorescencia con fluoroesferas Flow-Set de la misma firma. La interpretación y reporte de los datos adquiridos se analizó con el software Kaluza Analysis V1.5a.
Los inmunofenotipos definidos fueron:
Normal: características típicas de dispersión de la luz de los linfocitos, intensidad de fluorescencia media (IFM) y el patrón de expresión de antígenos dentro de los parámetros esperados y en concordancia con los protocolos de control de calidad del equipo.
Atípicas:
Reactivas: patrones de dispersión de luz frontal y lateral que correspondieron con linfocitos más grandes y complejos que sus contrapartes normales y expresión de antígenos con patrones de fluorescencia típicos de células activadas.
Sospechosas: patrones de dispersión de luz frontal y lateral alterados, ya fueran mayores o menores de los esperados para la región de linfocitos, cambios atípicos en la IFM o aparecieron antígenos ectópicos o asincrónicos.
Procesamiento estadístico
Para definir rangos de valores se evaluó la distribución normal de las variables mediante la prueba de Kolmogorov-Smirnov. Para las variables que no siguieron una distribución normal, se emplearon la mediana y los percentiles 2.5-97.5 como medida de tendencia central y rango, respectivamente. Se empleó la prueba U de Mann-Whitney para comparar las medianas. El análisis de supervivencia se realizó por el método de Kaplan-Meier y la comparación con la prueba de log-rank (Mantel-Cox). Todas las pruebas fueron de dos colas y se realizaron para un nivel de significación p (0.05. El procesamiento se realizó con el programa GraphPad Prism 5. (California, EEUU).
Aspectos éticos
El estudio se aprobó por el comité de ética del INOR. Se obtuvo el consentimiento informado de los pacientes. Se tuvieron en cuenta los criterios emanados de la Declaración de Helsinki. Se garantizó la confidencialidad de los datos obtenidos y su uso con fines exclusivos de investigación, el estudio no implicó riesgos éticos para los pacientes ya que no fue experimental.
RESULTADOS
Predominaron los pacientes mayores de 60 años (53,4 %) y el sexo femenino (60,0 %), hubo una mortalidad del 26,7 %.
Se caracterizaron 17 poblaciones inmunofenotípicas en las 15 muestras, debido a que en dos casos coexistían dos poblaciones linfocitarias con características inmunofenotípicas distintas (tabla 1). De los inmunofenotipos determinados, el 58,9 % fue normal, el 23,4 % reactivo y el 17,7 % sospechoso; los dos últimos provenientes de líquidos con pleocitosis.
Tabla 1 Distribución de las poblaciones linfocitarias predominantes según el patrón inmunofenotípico por citometría de flujo en el LCR
| Diagnóstico | Normales | Reactivas | Sospechosas | Total | ||||
|---|---|---|---|---|---|---|---|---|
| % | n | % | n | % | N | % | ||
| LNHDCGB | 4 | 23,5 | 2 | 11,7 | 1 | 6,0 | 7 | 41,2 |
| LNH-T* | 2 | 11,7 | 2 | 11,7 | 2 | 11,7 | 6 | 35,1 |
| LNH-F | 2 | 11,7 | - | - | - | - | 2 | 11,7 |
| LNH-BP | 1 | 6,0 | - | - | - | - | 1 | 6,0 |
| LLC | 1 | 6,0 | - | - | - | - | 1 | 6,0 |
| Total | 10 | 58,9 | 4 | 23,4 | 3 | 17,7 | 17 | 100 |
*2 pacientes con LNH-T mostraron doble población linfocitaria por inmunofenotipo en la citometría de flujo (normal/reactiva y reactiva/sospechosa).
LNHDCGB: linfoma no-Hodgkin difuso de células grandes B, LNH-T: linfoma no-Hodgkin de células T, LNH-F: linfoma no-Hodgkin folicular, LNH-BP: linfoma no-Hodgkin de células B pequeñas, LLC: leucemia linfocítica crónica.
No se encontró presencia de células con inmunofenotipo CD45bajo y CD34+ en ninguno de los LCR estudiados. Se observó heterogeneidad en los valores porcentuales de las poblaciones CD3+ y CD19+. El índice linfocito-monocito (ILM) fue mayor en los pacientes con presencia de células atípicas (Fig. 1).

Fig. 1 Distribución de las principales poblaciones leucocitarias en el LCR de los pacientes LNH y síntomas neurológicos. (n=15)
En las subpoblaciones CD4+ y CD8+, se apreció gran variabilidad de concentraciones en los LCR con células sospechosas y menor variabilidad cuando procedían de LCR normales (Fig. 2). Hubo dos pacientes con células sospechosas de estirpe T, uno mostró un patrón inmunofenotípico doble positivo en el 100 % de sus linfocitos y el otro un patrón doble negativo en la totalidad de sus linfocitos sospechosos.
 A: distribución de las subpoblaciones linfocitarias de TCD3+ en CD4+ y CD8+, procedentes de LCR tanto de células normales (N) como atípicas (A). B: distribución de los porcentajes de linfocitos T HLA-DR+, según los LCR con células normales (N), reactivas (R) y sospechosas de malignidad (A).
A: distribución de las subpoblaciones linfocitarias de TCD3+ en CD4+ y CD8+, procedentes de LCR tanto de células normales (N) como atípicas (A). B: distribución de los porcentajes de linfocitos T HLA-DR+, según los LCR con células normales (N), reactivas (R) y sospechosas de malignidad (A).Fig. 2 Distribución de las principales subpoblaciones linfocitarias en el LCR de los pacientes con LNH y síntomas neurológicos. (n=15)
Los resultados relacionados con parámetros de CF que permitieron evaluar los niveles de expresión de los diferentes antígenos y que caracterizan los distintos inmunofenotipos se aprecian en la Fig. 3.
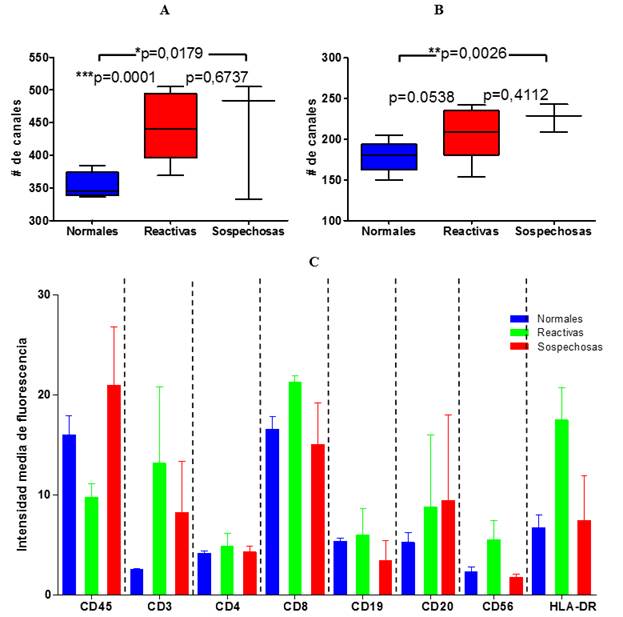
Fig. 3 Representación gráfica de parámetros de citometría de flujo en las poblaciones linfocitarias del LCR de los pacientes con LNH y síntomas neurológicos (n=15).
La IFM de los antígenos CD3, CD8 y CD56 fue significativamente mayor en los fenotipos de células reactivas respecto a las normales (*p=0.027, *p=0.034 y p=*0.035), respectivamente (Fig. 3C). Al comparar la IFM entre normales y sospechosas existieron diferencias en todos los marcadores, pero solo fueron significativas al comparar el CD3 (*p=0.035). El mayor nivel de significación estadística se encontró al comparar la expresión de HLA-DR entre normales y reactivas (**p=0.0037), a favor de estas últimas. De forma general la mayor heterogeneidad de expresión antigénica la arrojaron las células sospechosas de malignidad y las normales tuvieron un patrón homogéneo.
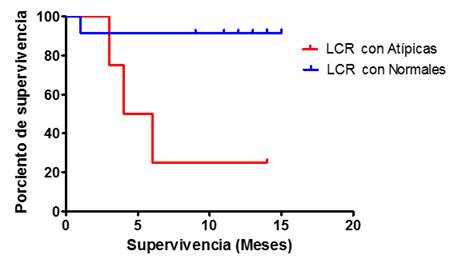
Se obtuvo una mediana de supervivencia de 5 meses para los casos atípicos y no se pudo definir para los que tuvieron el LCR normal, porque 10 siguieron vivos durante el periodo de seguimiento. Se encontró ventaja de supervivencia global en los pacientes con LCR paucicelular, con patrón inmunofenotípico normal y con un índice linfocito-monocito (ILM) de 3.0±1.1, con nivel de significación *p=0.016 y un HR. 0.04 (IC95 %: 0.004-0.482), al comparar las curvas (Fig. 4).
DISCUSIÓN
La introducción de la CF en el estudio del LCR se incrementó considerablemente la sensibilidad del diagnóstico y disminuyeron los falsos negativos, se comprobó que la incidencia era mayor a la reportada. Hoy existe mayor certeza al respaldar la utilidad de un método de diagnóstico al disponer de sistemas que valoran la calidad de la evidencia acumulada para respaldar la fuerza de recomendación del uso de determinado procedimiento.4,8,9,17,18
Por ejemplo, en Europa se emplea la escala Clasificación de la Evaluación, Desarrollo y Valoración de las Recomendaciones (GRADE, siglas en inglés), para evaluar la pertinencia de la CF en el diagnóstico de infiltración del SNC por linfomas secundarios y clasifica al método con una fuerza de recomendación grado 1 (fuerte) y nivel de evidencia A (Alto), que son los óptimos para esta escala. (18
Las técnicas inmunofenotípicas, sobre todo la CF, han pasado al diagnóstico inicial seguimiento, y estudios multiparamétricos con análisis n-dimensionales en muestras paucicelulares como el LCR. La sensibilidad y especificidad de la CF es mayor del 80 % y en el caso de linfomas B superior al 95 %. La principal utilidad de la CF en el diagnóstico radica en su poder de discriminar entre poblaciones normales, reactivas y atípicas o aberrantes e incluso diferenciar dos poblaciones patológicas coexistentes en una muestra. Recientemente los inmunofenotipos de otros leucocitos han cobrado valor en el diagnóstico de los LNH. Esto permite el tratamiento adecuado y oportuno con el impacto positivo en el pronóstico. 7,19-23
En la investigación se encontraron dos muestras con doble población coexistente que la CF pudo discriminar correctamente. El 100 % de los fenotipos que se clasificaron como normales se realizó de la forma recomendada, mientras que las sospechosas se clasificaron por la presencia de alteraciones de tamaño y complejidad interna con marcadores aberrantes. Sin embargo, al no realizar estudio fenotípico de clonalidad en linaje B se prefirió dejar el término de sospechosas. 16,24-26
En estudios publicados se muestran resultados normales por CF al diagnóstico inicial en el 70 - 80 %, en pacientes con LNH y síntomas neurológicos.16,24-26 En varios solo se evidenciaron células malignas en lecturas seriadas evolutivas de LCR, lo cual sugiere que en ocasiones los síntomas neurológicos aparecen cuando la infiltración es oculta, aún a la CF.
Se encontraron resultados muy similares a los que reporta Schinstine y otros., 8 de 13 pacientes (61,5 %) poseen células patológicas en el LCR. (16 Lo mismo se observó con el estudio de Sang Yong y otros., 41 normales de 55 pacientes (74,9 %) en el primer estudio por CF, que al estudiar la concordancia con la citología dio positiva en el 70,2 %.24
La concordancia de resultados positivos en la CF con la citología del LCR es baja, dándole ventajas a la CF. En el presente estudio no existió concordancia, ya que 3 casos fueron sospechosos de malignidad (20 %) por CF; mientras que la citología no reportó anormalidades. Estos resultados no difieren de los hallados en estudios previos, como el de Alvarez y otros., que reporta solo un caso concordante contra 4 (28,6 %) de positividad en la CF de un total de 14 pacientes con síntomas neurológicos.17
Curiosamente se observa que la citología convencional no posee la sensibilidad requerida para abordar la infiltración del SNC. Así Benevolo y otros, reportaron solo el 4 % de 174 pacientes, con citología positiva y Wilson y otros., 5 % en la citología de 326 casos. 26,27.
La variabilidad interindividual de porcentajes de células T (CD3+) encontrada en este estudio coincide con estudios que reportan un rango del valor porcentual entre 25 % y 100 %. En los líquidos normales el rango de linfocitos B es muy reducido, fundamentalmente por su escasez habitual. En un estudio comunican una mediana de 7,2 % de células CD19+ con rango entre 1 % y 72 %. En el caso de la NK ocurre lo mismo.28
Las diferencias significativas encontradas en los infiltrados linfocitarios, donde la mediana de los líquidos atípicos fue superior a los normales, pudo deberse a que los procesos linfoproliferativos o reactivos ocurren en presencia de alta celularidad de esta población. Lo contario sucede con los monocitos. Estos resultados son similares a otras investigaciones publicadas, donde los linfocitos del LCR infiltrados tuvieron un rango de 6-91 %.28 Sin embargo, el estudio realizado en LCR procedentes de infecciones, mostró rangos más reducidos de linfocitos de 11,2 - 21,8 % y para monocitos, medianas de 6,8 y rango de 4,7 - 9,7 %.29 Se toma esta referencia debido a la presencia de células reactivas en los líquidos estudiados, ya que, como su nombre lo indica poseen un fenotipo reactivo a procesos que cursan con inflamación del SNC.
Se encontró un ILM más alto en los LCR atípicos que en los normales, con diferencias altamente significativas. Este índice y el de neutrófilo-linfocitos, (INL) están asociados con la progresión, las respuestas terapéuticas y la supervivencia de los pacientes con cáncer en general y también con linfomas. En este trabajo no se empleó el INL pues no se evidenciaron neutrófilos en los LCR. 29-34
Los estudios precedentes reportan que los ILM bajos no son beneficiosos, cuando hay más monocitos que linfocitos existe un mayor microambiente inflamatorio con una subpoblación de monocitos, células derivadas mieloides supresoras, que favorecen el escape tumoral.30-34) Cuando el LCR sufre una infiltración por LNH, contiene mayoritariamente las células patológicas y el infiltrado reactivo acompañante no siempre aparece o lo hace tardíamente y resulta no ser cuantioso, a menos que haya una infección concomitante o autoinmunidad.35,36
En este estudio los linfocitos clasificados como sospechosos dominaban casi la totalidad de las células contenidas en la muestra del LCR calculados porcentualmente. Por esto el índice se mostró muy elevado debido al incremento de dichos linfocitos y no a la disminución de monocitos. No obstante, los valores del ILM en los líquidos clasificados como normales se encontraron alrededor de 4, similar a lo reportado en la literatura.29-34
La distribución de subpoblaciones de linfocitos TCD4 y TCD8 en el LCR no mostró muchas diferencias con respecto a estudios anteriores. Sin embargo, existieron casos sospechosos de malignidad, uno doble positivo para CD4 y CD8, que se ha observado en linfomas T como en los angioinmunoblásticos y linfomas linfoblásticos T que cursan con CD3 negativo, como el inmunofenotipo encontrado en este estudio que también está asociado a una mayor frecuencia de invasión del LCR. El otro caso fue doble negativo, que aparecen con poca frecuencia dentro de los subtipos de LNH-T. 35-37
La discriminación entre linfocitos reactivos y patológicos es un poco difícil, especialmente en muestras que contienen bajo contenido celular y bajo grado de atipia celular, como puede ocurrir en los linfomas que son neoplasias de células con fenotipo maduro. Por tal motivo, en ocasiones se prefiere emplear los términos de células atípicas o sospechosas y no ser categóricos con patológicas.16,36) Uno de los procedimientos que mejor permite su diferenciación es el inmunofenotipaje, al incluir marcadores de activación celular tardíos como el HLA-DR, análisis de la expresión del CD45 y aumento del tamaño y complejidad celular. Además, para identificar las reactivas se observan incrementos en la expresión de antígenos que denotan citotoxicidad como el CD56 y el CD8, linfocitos que aparecen fundamentalmente en el transcurso de infecciones virales y en procesos neoplásicos.16,36,38-40
Los parámetros de CF son muy sensibles, específicos y precisos al poder clasificar adecuadamente los linfocitos en típicos y atípicos y a estos últimos en reactivos o patológicos.16,18,39,41) Sin embargo, en el estudio que se presenta no se emplearon marcadores de clonalidad u otros que permiten definir patrones patológicos en células T, lo que es una limitación del estudio. No obstante, las características de dispersión de la luz permitieron clasificar a los grupos reactivos y sospechosos con precisión y diferenciarlos de las poblaciones normales. Las células sospechosas fueron significativamente más grandes y complejas que las típicas, lo cual coincide con lo reportado en s estudios precedentes, donde con un solo tubo de citometría, se estudió el patrón inmunofenotípico de linfomas en líquidos paucicelulares.36) El tamaño de los linfocitos ha sido bien caracterizado por la señal de dispersión frontal de la luz (FCS, siglas en inglés) y se reporta gran concordancia con la clasificación por enfermedad.13,16,17,21,36,37,39)
La intensidad de fluorescencia depende de varios factores que se fijaron y controlaron, de forma que el único elemento variable fue el grado o densidad de expresión del antígeno en la célula. Así, existió una correspondencia entre la IFM y el nivel de expresión del antígeno, lo cual es muy útil para los estudios n-dimensionales por CF en el caso de los linfomas, ya que no solo informa si el antígeno está presente o ausente, sino describe el patrón de expresión: disminuido, normal, sobrexpresado; heterogéneo u homogéneo.42,43
Todos los marcadores mostraron gran variabilidad interindividual en la población sospechosa excepto el CD4, probablemente debido al fenotipo aberrante de estos linfocitos. Estos datos coinciden con lo reportado en relación al inmunofenotipo de linfomas. La mayor variabilidad intraindividual se obtuvo en marcadores como el CD3, el CD19 y CD20 que tienen un patrón de expresión heterogéneo en algunos tipos de linfomas, como el LNHDCGB; como ocurrió en este estudio. En el caso del HLA-DR ocurre lo mismo de forma normal, al ser un antígeno terciario para la población de linfocitos T.3,18,42-44
En un estudio que analizó la supervivencia global de casos positivos de infiltración del LCR por LNHDCGB, se reportó que estos poseen peor pronóstico que los de LCR normal por CF, aunque sin diferencia significativa, probablemente por una muestra escasa. 24) Similarmente ocurrió en el estudio que se presenta, pero con diferencias significativas. Otro estudio reportó una mediana de supervivencia global de 8.5 meses en pacientes con infiltración del SNC. (45 Sin embargo, dentro de los predictores de supervivencia global no pudieron incluir el diagnóstico positivo de infiltración del SNC por no ser estadísticamente significativo HR=1,86 p=0.24. Esto pudo deberse al empleo solo de la citología como método de diagnóstico y no haber utilizado la CF, que tiene mayor sensibilidad.
En el caso del ILM específicamente, se encontró muy alto en los casos que tuvieron un peor pronóstico, contrario a lo esperado para este índice. Esto pudo deberse, a que el ILM alto fue a expensas solo de los linfocitos sospechosos de malignidad, los cuales solo producen efectos deletéreos dentro del SNC.
Según el metanálisis de Liangyou Gu y otros., basado en 56 publicaciones con una n resultante de 20 248 pacientes, más de la mitad con neoplasias de tipo linfomas; existe asociación entre el ILM y la supervivencia global (SG) a favor de valores altos como beneficiosos con HR= 0,44 (95 % CI: 0,34-0,56; p<0.001).46 Curiosamente el ILM encontrado en el presente estudio es muy similar a este, pero con una interpretación inversa y con significación estadística. Por tal motivo debe seguirse investigando sistemáticamente el ILM en los casos de infiltración del SNC.
La CF resultó ser un método útil en la clasificación de los inmunofenotipos del LCR y discriminó entre células normales, reactivas y sospechosas de malignidad, aun cuando la citología no ofreció resultados positivos de células neoplásicas. La presencia en el LCR de células atípicas, pleocitosis y un ILM alto puede ser valorada como candidato a marcadores pronósticos en los LNH, con síntomas del SNC, que se asocian con menor tiempo de supervivencia global. Se debe aumentar la muestra y continuar el estudio para demostrar la asociación entre estos marcadores y la supervivencia de los pacientes.