INTRODUCCIÓN
El linfoma extranodal de células NK/T(ENKTL por sus siglas en inglés), también conocido como linfoma angiocéntrico de células T, es un linfoma no Hodgkin (LNH) extranodal que afecta típicamente al tracto aerodigestivo superior y causa la gran mayoría de los casos del síndrome conocido anteriormente como "granuloma letal de la línea media".1
A la luz de su presentación típica en la nasofaringe, el ENKTL se ha clasificado como "tipo nasal" (ENKTL-NT), un término que ha sido adoptado por la Clasificación de la Organización Mundial de la Salud (OMS).1
Sin embargo, el ENKTL-NT con frecuencia se extiende a los senos para nasales, las órbitas y los ganglios linfáticos, y en algunos casos también puede desarrollarse fuera de la nasofaringe. En un subgrupo de pacientes, el ENKTL-NT se desarrolla en sitios extraganglionares, como el tracto gastrointestinal, la piel, los testículos o los pulmones y muestra características morfológicas e inmunofenotípicas idénticas a los del tracto aerodigestivo superior, incluida la asociación constante con virus de Epstein Barr (VEB).En todos los casos, el VEB clonal se encuentra en la mayoría de las células tumorales. La asociación es tan fuerte que la falta de detección del VEB debería generar dudas sobre el diagnóstico.1
El pronóstico del ENKTL-NT es extremadamente pobre, especialmente cuando están involucrados otros sitios extralinfáticos.2
Se ha diseñado un régimen de quimioterapia basado en dexametasona, metotrexato, ifosfamida, L-asparaginasa y etopósido (SMILE, siglas en inglés) para abordar específicamente esta enfermedad.3
El régimen comprende 3 fármacos no dependientes de la glucoproteína P, dexametasona, metotrexato e ifosfamida, la L-Asparaginasa se incorpora, en función de su actividad en linfomas de células NK/T recidivantes/refractarios,4el etopósido está incluido, debido a su eficacia en el síndrome hemofagocítico asociado con neoplasias de células T.5
El protocolo SMILE se ha probado en un estudio multicéntrico de fase 2 realizado por el “Grupo de Estudio de Tumores NK”, en el que se trataron 38 pacientes con linfoma NK/T en recaída, refractario o en estadio IV. Los resultados mostraron una tasa de remisión completa (RC) del 45 % y una tasa de remisión parcial (RP) del 34 %, con una tasa de respuesta global del 79 %.6
Hasta el presente no existen antecedentes de la aplicación de este protocolo en pacientes cubanos, por lo que esta presentación constituye el primer reporte de su utilización en Cuba.
PRESENTACIÓN DEL CASO
Paciente femenina de 47 años, blanca, sin antecedentes patológicos personales, ni familiares. En julio del año 2016 acudió al Instituto Nacional de Oncología y Radiobiología (INOR) por presentar aumento de volumen de la hemicara derecha y obstrucción nasal derecha. En el examen físico se observó una masa en fosa nasal derecha, a la cual se le realizó biopsia donde se informó: linfoma no Hodgkin de células T/NK. Inmunohistoquímica: LCA(+) focal; CD 20(-); CD 3(+) focal; CD 5(-); CD 10(-); CD 30(-); CD 43(+); CD 79(-); Bcl-2(+) focal; CD 8(-); CD 56 (-); ALT-1(-).
Se le realizó una tomografía axial computarizada (TAC) simple y contrastada en cortes de 3 y 5mm en la que se observó una imagen hiperdensa de aspecto tumoral hipercaptante que ocupaba la fosa nasal derecha; invadía el seno maxilar ipsilateral, celdillas etmoidales, órbita y seno frontal de ese lado, así como la fosa pterigo palatina; destruía el tabique nasal, los huesos propios de la nariz, la pared medial y posterior del seno maxilar, piso y pared medial de la órbita; en contacto con el globo ocular y tejido celular subcutáneo de región maxilar. No se apreciaron alteraciones en el cuello, tórax, abdomen y pelvis. Se le realizó biopsia de médula ósea, en la que no se encontró infiltración tumoral. Los análisis de hematología y hemoquímica no mostraron alteraciones. La paciente tenía un estado general de 0, según ECOG (del inglés, Eastern Cooperative Oncology Group).
Se estadificó como etapa IAE según los estadio de Ann Arbor y se le realizó tratamiento con radioterapia de intensidad modulada con dosis total de 40 Gy y quimioterapia concurrente con cisplatino en dosis de 30mg/m2/semanal. Posteriormente se le realizaron3ciclos de quimioterapia adyuvante, esquema VIPD (etopósido, ifosfamida, cisplatino, dexametasona) sin toxicidades asociadas. Al finalizar el tratamiento en marzo del año 2017, se evaluó con una respuesta completa de la enfermedad.
En julio del 2017 comenzó con aumento de volumen de partes blandas de hemitórax izquierdo, en la región comprendida entre el octavo y noveno espacio intercostal, de aproximadamente 5 cm de diámetro. Se le realizó TAC de cráneo, cuello, tórax, abdomen y pelvis que mostró imagen hiperdensa de contornos mal definidos a nivel de la pared anterior izquierda del tórax, de 49 x 27 mm, ubicada en el tejido celular subcutáneo, que contactaba con los músculos intercostales a los cuales infiltraba, sin erosionar el hueso ni penetrar a la cavidad abdominal.
Se le realizó biopsia por TRU-CUT que se concluyó como un linfoma T/NK extraganglionar tipo nasal (infiltración de partes blandas). Se le realizaron las técnicas de inmunohistoquímica y se concluyó: CD 20, CD 5, CD 10, CD 138, BcL-6, CD 79a, ciclina D1 (-), CD 3 (+), CD 56(+) difuso, Ki-67 (40%). (Fig. 1)
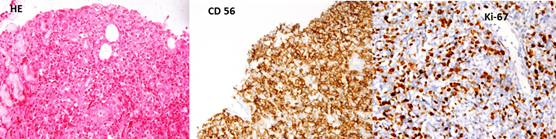
Fig. 1 Biopsia por TRU-CUT de partes blandas. Se observa: evidencia la infiltración en la tinción con hematoxilina eosina (A), la positividad de la infiltración difusa con el marcador CD56 (B) y el alto índice de proliferación del Ki 67(C).
Se discutió el caso en la consulta multidisciplinaria de linfoma y se decidió iniciar quimioterapia con esquema SMILE (Tabla 1).
Tabla 1 Protocolo de quimioterapia SMILE
| Fármaco | Dosis | Días | Vía | Dilución conNaCl 0.9% | Tiempo |
|---|---|---|---|---|---|
| Ifosfamida | 1.5 g/m2 | 2-4 | Intravenosa | 500 mL | 4 horas |
| Etopósido | 100 mg/ m2 | 2-4 | Intravenosa | 500 mL | 1 hora |
| Dexametasona | 40 mg/d | 2-4 | Intravenosa | 100 mL | 30 min |
| L-Asparginasa | 6000 U/m2 | 8,10,12,14,16,18,20 | Intravenosa | 100 mL | 60 min |
| Metrotexate | 2 g/m2 | 1 | Intravenosa | 500 mL | 6 horas |
| FECG | 300 µg | 6 | Subcutánea | - | Dosis única, hasta CAN>5000/µL |
FECG: factor estimulador de colonias granulocíticas; CAN: conteo absoluto de neutrófilos
La paciente recibió 4 ciclos de quimioterapia con una frecuencia de 28 días y presentó como toxicidades náuseas y vómitos grado 1 y trombocitopenia grado 3 según los Criterios Comunes de Terminología para Eventos Adversos v4.0. Posteriormente recibió radioterapia de intensidad modulada con dosis total de 40Gy en las partes blandas afectadas. Se evaluó nuevamente y se comprobó una respuesta completa al final del tratamiento por estudio tomográfico contrastado.
DISCUSIÓN
La descripción del ENKTL, data de más de 100 años.7 En 1982 se identificó que la célula que daba origen a esta rara entidad reaccionaba con antisuero contra células T y no así contra el de células B. Posteriormente, a inicios de la década del 90, el perfeccionamiento de las técnicas de inmunofenotipización permitió el desarrollo de anticuerpos contra el antígeno CD56 expresado en las células.8
Dos grupos investigadores describieron un subtipo diferente de linfoma, caracterizado por localización extraganglionar y curso agresivo, que luego de una mejor caracterización de su inmunofenotipo, definió a los ENKTL como un único y particular tipo de linfoma no Hodgkin de células T maduras, que invariablemente está asociado con el virus del VEB.9
Las células asesinas naturales (NK) constituyen el tercer linaje linfoide, además de los linajes de células T y células B. En su desarrollo, las células NK y las células T comparten una ontogenia relacionada, que surgen de un progenitor linfoide común.(10)
Las células NK se desarrollan predominantemente en sitios no nodales, incluidos el hígado y la médula ósea.El inmunofenotipo de los ENKTLevidencia las estirpes de diferenciación celular CD2(+), CD56(+), CD3 membrana(-) y el CD3( citoplasmático(+). Este suele ser también el fenotipo de las células NK normales. El CD56, a pesar de su utilidad como marcador de células NK, no es específico de los linfomas T/NK extraganglionares. La expresión de moléculas citotóxicas como granzima B, TIA1 y perforina es positiva. Otros antígenos asociados a células T y NK tales como CD4, CD5, CD8, TCR(, (F1 y CD16 son habitualmente negativos y otros como CD57, CD43, CD45RO, HLA-DR, CD25, FAS y el ligando FAS se expresan comúnmente.11
La inmunohistoquímica realizada a la biopsia para la confirmación de la recaída del presente caso fue positiva para CD56 y negativo para CD5, lo que se corresponde con lo antes mencionado.
Ocasionalmente hay casos positivos para CD7 o CD30, este último sobre todo en aquellos ricos en células grandes. La fracción de proliferación evidenciada por Ki-67 es usualmente alta, mayor del 70%, aun en aquellas lesiones con predominio de células pequeñas.12
El ENKTL-NT tiene una distribución étnica y geográfica distintiva con una mayor incidencia en el este de Asia y América Latina, donde puede representar más del 10% de los LNH. En los Estados Unidos, Canadá y Europa es raro; las mejores estimaciones que indican que representa significativamente menos del 1% de todos los LNH.13)
Un estudio de la Base Nacional de Datos de Cáncer presentado en la reunión anual de la Sociedad Estadounidense de Oncología Clínica (ASCO, siglas en inglés) del 2016 identificó 1 398 (0.2%) casos de ENKTL-NT del total de 563833 pacientes con LNH entre 1998-2012.(14)
En Asia aproximadamente el 70% de los pacientes presentan enfermedad limitada (estadio Ann Arbor I/II) en la nasofaringe, la presentación clínica más frecuente de ENKTL-NT en Estados Unidos y Europa es la obstrucción nasal o hemorragia de una masa en la cavidad nasal, nasofaringe, senos paranasales, amígdalas, hipofaringe y laringe;15) lo cual coincide con algunos síntomas al diagnóstico de esta paciente. Otros sitios afectados reportados en esas áreas geográficas incluyen el área paranasal, piel, tejido blando, tracto gastrointestinal y testículo.16-18
En la mayoría de las cohortes asiáticas la edad al momento del diagnóstico es de 53 años, con predominio del sexo masculino y una razón masculino: femenino de 3:1. Los pacientes son típicamente inmunocompetentes.19
El ENKTL usualmente afecta la nasofaringe o la porción superior del tracto aerodigestivo (principalmente la cavidad nasal) donde causa lesiones ulcerativas que provocan una destrucción progresiva.19
Los síntomas predominantes están asociados a la diseminación local, entre ellos los más frecuentes son:la obstrucción, el sangramiento y la secreción nasal; la inflamación facial, la proptosis y la parálisis de los músculos extraoculares. El tumor frecuentemente se disemina hacia las estructuras anatómicas aledañas como: senos paranasales, órbita, paladar, cavidad oral y orofaringe. Es frecuente encontrar la erosión ósea.19
El 80 % de los casos se diagnostican en estadios I-II, de hecho algunos casos permanecen solo invasivos localmente aun en pacientes terminales. La médula ósea está infiltrada en menos del 10 % de los casos.19 En los estudios de imágenes realizados al diagnóstico se encontró una gran invasión local de los senos paranasales, la órbita, la fosa nasal y los huesos propios de la nariz, pero sin extensión a distancia por lo que se estadificó como etapa I.
El enfoque de tratamiento de ENKTL-NT ha evolucionado a lo largo de los años. Los primeros estudios demostraron que los regímenes de quimioterapia basados en antraciclina, como CHOP (ciclofosfamida, doxorrubicina, vincristina, prednisona) no eran tan efectivos. Esto se ha atribuido a los altos niveles de expresión de la P-glicoproteína en células de linfoma NK que causa resistencia a múltiples fármacos, lo que hace que los fármacos (como la ciclofosfamida y la adriamicina sean ineficaces. 20-23
En consecuencia, ahora se han abandonado los regímenes de CHOP o tipo CHOP en el tratamiento de pacientes con linfoma de células NK/T y se han remplazado por una serie de regímenes más efectivos que no contienen antraciclina. Debido a la resistencia del ENKTL-NT a la quimioterapia, la radioterapia a dosis de 45 a 60 Gy se adoptó inicialmente como la modalidad de tratamiento de primera línea. Sin embargo, incluso en la etapa I del ENKTL-NT, las tasas de progresión fuera del campo de irradiación en algunos de los estudios son inaceptablemente altas.20-23
Después de la publicación inicial de la eficacia de la L-asparaginasa como agente único en el ENKTL-NT recidivante / refractario en 2003,24) Jaccard et al informaron una tasa de respuesta objetiva (TRO) del 87 % y una tasa de RC del 47 % en 15 pacientes occidentales.25) La L-asparaginasa se incorporó a una variedad de regímenes, aumentando las TRO aproximadamente al 80 %, a menudo con tasas de RC en el rango del 50-60 %. 6,25
Lam Kwong et al analizaron una muestra de 86 pacientes que recibieron el esquema SMILE. La mediana de ciclos administrados fue de 3 (0-6). Las toxicidades reportadas fueron: neutropenia grado 3/4 en el 67 % de los casos, infecciones graves en 27 pacientes (31 %), trombocitopenia grado 3/4 en el 42 % y ocurrieron 5 fallecimientos (6 %) asociados a la quimioterapia. Para toda la cohorte, el análisis intermedio mostró una tasa de RC del 56% y una tasa de respuesta parcial (RP) del 22 %, lo que arroja una TRO del 78 %. Al finalizar el tratamiento, la tasa de RC mejoró al 66 %, con una tasa de RP del 15 % y una TRO del 81 %. Las tasas de respuesta intermedia y al final del tratamiento fueron comparables para los pacientes recién diagnosticados o recidivantes/ refractarios, así como para las diferentes localizaciones.26) La paciente que se presenta se evalúo con una respuesta completa al final de tratamiento con toxicidades no graves asociadas a la quimioterapia.
La supervivencia general estimada a los 5 años para el ENKTL-NT es entre el 40 y el 50 %. La supervivencia depende en gran medida del estadio al momento del diagnóstico. El seguimiento a largo plazo sugiere un riesgo continuo de recaída hasta 10 años después del diagnóstico.(27)














