Introducción
Durante la gestación se establece un estado de hipercoagulabilidad biológica que permite el control del sangrado excesivo durante la etapa de alumbramiento de la placenta, es un mecanismo intrínseco de todas las mujeres y está condicionado por diferentes factores, entre los cuales, los hemostáticos tienen un protagonismo decisivo. Entre ellos se encuentran la elevación de diferentes factores de la coagulación, la activación plaquetaria y la disminución de la fibrinólisis.1 Si se asocia el diagnóstico de una trombofilia hereditaria o adquirida a este estado biológico el riesgo protrombótico aumenta de forma considerable lo que puede conducir a complicaciones fetales y maternas tan graves como el fallecimiento de los neonatos, fenómenos tromboembólicos en las gestantes y alteraciones relacionadas con la activación del endotelio vascular e interferencia en la circulación placentaria. 2
Estas complicaciones observadas en el curso de la gestación asociadas a las trombofilias se evidencian desde el primer trimestre en forma de abortos a repetición y daño sobre la placenta y el feto en sus primeros estadios. En el segundo y tercer trimestres, se manifiestan el desprendimiento prematuro de la placenta normoinserta, la restricción del crecimiento fetal intrauterino, el óbito fetal, la preclampsia y, aunque no frecuentes, pueden verse las microangiopatías trombóticas que provocan un mal pronóstico perinatal. El tratamiento tromboprofiláctico con heparinas de bajo peso molecular (HBPM) en combinación o no con otros fármacos ha cambiado la evolución del embarazo de estas pacientes.2-4
El resultado de lograr una gestación libre de complicaciones trombóticas conlleva al nacimiento de un neonato a término, cuyo nacimiento ocurre entre las 37 y 41 semanas de edad gestacional. Cuando el recién nacido nace a término con características morfofuncionales y peso adecuados para esta etapa, puede adaptarse a la vida extrauterina y, por tanto, tiene menor morbilidad y mortalidad que el recién nacido pretérmino. Por el contrario, el neonato pretérmino, por su falta de madurez, presenta ausencia de reservas energéticas e inmadurez funcional que le hacen más vulnerable a las infecciones y a trastornos metabólicos; con incremento de las manifestaciones clínicas derivadas de estos trastornos u otros observables en esta etapa neonatal. 5
Desde hace algunos años, se han incorporado esquemas de tratamiento tromboprofiláctico con el objetivo de lograr gestaciones seguras para las madres con trombofilia y garantizar el nacimiento de neonatos a término. Aún no es aceptado de forma universal el uso de estos tratamientos, por lo que sigue siendo un tema controversial pues algunos grupos de trabajo apoyan esta decisión, pero otros no han encontrado diferencias en los logros perinatales al implementar terapias antitrombóticas a lo largo de las gestaciones en mujeres con trombofilias y antecedentes de pérdidas fetales.4,6-9
Hace una década, en la consulta de Hemostasia del Instituto de Hematología e Inmunología (IHI), se comenzó la evaluación, seguimiento y tratamiento de mujeres con pérdidas recurrentes de embarazos, con antecedentes de eventos oclusivos en el período perinatal o previo y antecedentes familiares de trombofilia. En este trabajo se presenta la caracterización de los recién nacidos de madres con diagnóstico definitivo de trombofilia tratados con tromboprofilaxis combinada.
Métodos
Se realizó un estudio descriptivo, de corte transversal de los neonatos de madres con trombofilia, remitidas a la consulta de Hemostasia. Estas gestaciones fueron evaluadas de forma sistemática por un equipo multidisciplinario de especialistas de hematología, obstetricia, genética, de medicina general integral y del laboratorio de Hemostaisa, en el período de enero de 2014 a agosto de 2017.
Se incluyeron a todas las embarazadas con diagnóstico de trombofilia que llevaron tromboprofilaxis durante la gestación y que dieron su aprobación de participar en la investigación mediante la firma del consentimiento informado. Se excluyeron aquellas gestantes que interrumpieron su asistencia a las consultas de seguimiento en la institución.
De las 71 gestantes atendidas en consulta, la muestra se conformó por 62 neonatos.
Las variables se analizaron a través del programa estadístico SPSS versión 15 para Windows, se compararon las medias y correlacionaron las variables. Se utilizó la t-Student, con un nivel de confianza de 95 % y una significación estadística de ρ<0.005.
Resultados
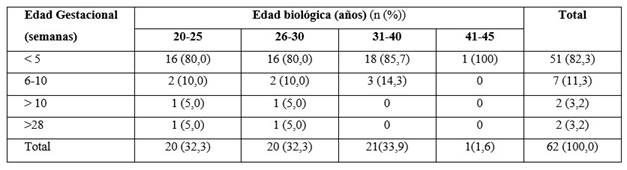
En la tabla 1 se muestran las edades de las gestantes, la edad promedio fue 29,88 años; con una edad mínima de 20 años y máxima 44; la mayoría (64,5 %) de las pacientes fueron menores de 30 años. El 82,3 % de las gestantes iniciaron tratamiento precoz antes de las cinco semanas de gestación y 11,3 % entre 5 y 10 semanas.
El síndrome antifosfolípidos (SAAF) (53,2 %) y de plaquetas pegajosas (SPP) (29 %) fueron los diagnósticos de trombofilias más frecuentes encontrados en las gestantes tratadas (Fig. 1).
 Leyenda: FVL: mutación del factor V Leiden, SPP: síndrome de plaquetas pegajosas, Def Prot S: deficiencia de proteína S de la coagulación, SAAF: síndrome antifosfolípidos, Prt G20210: Mutación G20210 de la protrombina
Leyenda: FVL: mutación del factor V Leiden, SPP: síndrome de plaquetas pegajosas, Def Prot S: deficiencia de proteína S de la coagulación, SAAF: síndrome antifosfolípidos, Prt G20210: Mutación G20210 de la protrombinaFig. 1 Tipo de trombofilias diagnosticadas en las gestantes con tratamiento tromboprofiláctico
Seis gestantes presentaron complicaciones asociadas a la hipercoagulabilidad, lo que correspondió al 9,7 % del total; fueron 10 eventos: 3 (4,8 %) partos pretérminos a las 36 semanas, con igual número de recién nacidos que presentaron un crecimiento intrauterino retardado (CIUR); el 6,4 % manifestaron enfermedad hipertensiva gestacional. No ocurrieron episodios trombóticos durante los embarazos ni en el puerperio.
La totalidad de los fetos presentó pesos adecuados para su edad gestacional hasta las 28 semanas, según biometría fetal. Posterior a esa edad gestacional, 59 (95,1 %) se mantuvieron con pesos normales y 3 (4,8 %) presentaron pesos fetales disminuidos diagnosticados como CIUR.
El 98,4 % de los neonatos tuvo un apgar normal, un recién nacido correspondiente al 1,6 % estuvo moderadamente deprimido. No hubo pacientes gravemente deprimidos. Se obtuvo la totalidad de recién nacidos vivos con examen físico normal. El peso medio de los neonatos fue 3 136,85 g, con un mínimo de 2 025 g y máximo de 4 100 g.
En ninguno de los casos se presentaron complicaciones secundarias a la tromboprofilaxis, como trombocitopenia, manifestaciones hemorrágicas o malformaciones congénitas.
No se encontró correlación entre el peso al nacer, la edad materna y la edad gestacional; ni se demostraron diferencias significativas en cuanto el tipo de trombofilia y el peso del neonato. Se evidenció que la condición de hipercoagulabilidad no determinó cambios en el peso al nacer de los recién nacidos que se obtuvieron bajo regímenes de tromboprofilaxis. (Tabla 2).
Tabla 2 Comparación de medias de peso al nacer, sintomatología de la gestante y tipo de trombofilia
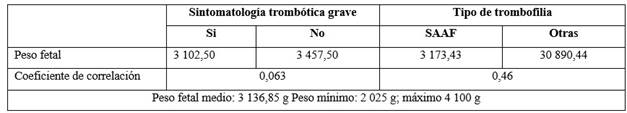
SAAF: Síndrome antifosfolípidos 95% Intervalo de confianza, nivel de significación ρ<0.005
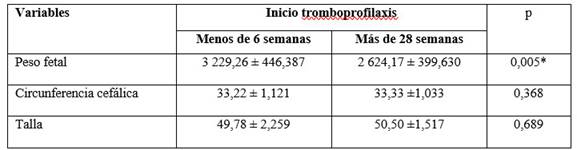
Al comparar las medidas al nacer, en relación con el inicio del tratamiento tromboprofiláctico (Tabla 3), hubo diferencia significativa (p<0.005) entre los pesos de los recién nacidos de madres que comenzaron de forma temprana respecto a aquellas que lo iniciaron muy tarde. La media del primer grupo fue 3 229,26 g, comparada con 2 624,17 g de las que comenzaron la terapéutica antitrombótica tardíamente. La circunferencia cefálica y la talla no mostraron cambios significativos en esos dos grupos comparados.
Discusión
El nacimiento de un nuevo ser constituye, sin duda alguna, un hecho trascendental en todas las familias. Es de vital importancia que el equipo médico logre entregar a las familias un recién nacido sano y vigoroso y que la madre continúe en condiciones óptimas para una recuperación rápida, adecuada y funcional con el objetivo de que pueda sentirse bien y logre alimentar de forma correcta a su hijo. 5
El recién nacido se clasificará como sano o enfermo según el examen físico e interrogatorio detallados que se establezca en los primeros momentos de inspección. Virginia Apgar en el año 1952 creó el conocido puntaje clínico Apgar que permite valorar la adaptación a la vida extrauterina. Considera aspectos como el tono muscular, frecuencia cardíaca, esfuerzo respiratorio, irritabilidad refleja y color de la piel. A cada uno se le asigna un puntaje 0, 1 o 2 que luego se sumarán para determinar el puntaje total. Se realiza al minuto y al quinto minuto de vida. Un neonato vigoroso puede alcanzar una puntuación desde 7 hasta 10 puntos, se encontrará moderadamente deprimido si la puntuación obtenida es de 4 a 6 puntos y gravemente deprimidos, si solo alcanza de 0 a 3 puntos.5
Entre los valores de normalidad del recién nacido se consideran la edad gestacional de 37 a 41 semanas, peso al nacer entre 2 500 y 3 800 g, circunferencia cefálica 35 ± 2 y talla entre 48 a 52 cm. Es conocido que el neonato presenta mayor riesgo de morbilidad y mortalidad si su peso al nacer es bajo y su edad gestacional no es a término. Si el parto se produce antes de las 37 semanas de edad gestacional se considera parto prematuro y está relacionado con inmadurez, a su vez, la falta de madurez está asociada con ausencia de reservas energéticas e inmadurez funcional que hacen al niño pretérmino más vulnerable a morbilidades e incrementa los aspectos negativos relacionados con el período neonatal y, las manifestaciones clínicas de las distintas enfermedades se comportan de forma diferente al recién nacido a término.5
De la misma forma, el retardo del crecimiento fetal puede dar lugar a un neonato pequeño para su edad gestacional. Cuando el trastorno que motiva la afectación del crecimiento fetal se instaura desde el inicio del embarazo en etapas tempranas del desarrollo, se puede producir una reducción proporcional del peso, la talla y la circunferencia cefálica y su resultado es un recién nacido pequeño y armónico para su edad gestacional, el cual tiene un pronóstico reservado. Los principales factores que lo motivan pueden ser: las enfermedades maternas crónicas, las malformaciones congénitas, las infecciones prenatales y las alteraciones cromosómicas. Si los factores que alteran el crecimiento fetal se inician tardíamente en el embarazo, suelen asociarse a trastornos o deficiencias de la función útero placentario o deficiencia nutricional materna durante el tercer trimestre de la gestación, que producen una detención de la ganancia del peso fetal, lo cual da como resultado un neonato pequeño para su edad gestacional con mayor compromiso del peso que de la talla y la circunferencia cefálica y que presenta como característica típica, el escaso panículo adiposo con una cabeza relativamente grande en relación con el tronco y sus extremidades, con un mayor riesgo de asfixia perinatal, policitemia, trastornos metabólicos y hemorragia pulmonar.5,10-12
La determinación de la edad gestacional es fundamental para conocer el grado de madurez neonatal, y al relacionarla con el peso se puede precisar el riesgo neonatal, determinar precozmente diagnósticos específicos en cada grupo de niños y se pueden planificar métodos preventivos de atención médica. 5
El tratamiento tromboprofiláctico ha demostrado ser exitoso para lograr gestaciones a término en pacientes con estados trombofílicos. Diversos son los esquemas de tratamiento, que van desde la observación, bajas dosis de aspirina, dosis profiláctica o terapéutica de alguna HBPM, combinadas o en esquemas de tratamiento independiente que comienzan desde la etapa preconcepcional o durante las primeras semanas de la gestación y se mantienen hasta el puerperio, con variación en el tiempo protocolizado.13-16)
En este estudio hubo pacientes con inicio de la tromboprofilaxis temprana, otras intermedias y un pequeño grupo de forma tardía. La falta de uniformidad del comienzo del tratamiento dependió de la etapa en que las gestantes fueron remitidas a la consulta de Hemostasia, no siempre se enviaron antes de la concepción. Este dato coincide con otros estudios en los cuales al ser centros receptores de casos no siempre llegan con el mismo tiempo de gestación para comenzar las profilaxis.14-17) Aunque predominaron las gestantes iniciaron tratamiento precoz, antes de las cinco semanas de gestación, lo cual es favorable en cuanto a efectividad del tratamiento pues mientras más precoz el mismo, menos establecido está el daño en la placenta.
Las edades maternas más frecuentes estuvieron por debajo de los 30 años, que es coherente con el trabajo desarrollado por el programa de atención materno infantil que estableció una consulta centralizada para tratar pacientes con coagulopatías en estado de gestación. Mientras más jóvenes llegan las pacientes a la consulta presentan menos morbilidades asociadas con la edad. De hecho, en este estudio la correlación del peso fetal con la edad materna y la edad gestacional no tuvieron diferencia significativa cuando se compararon los diferentes grupos.
Lo ideal es hacer la consulta antes de planificar el próximo embarazo dado que el pronóstico cambia radicalmente con el tratamiento. Hay estudios que no se pueden realizar cuando la paciente está embarazada, se debe tener en cuenta, que lo ideal es comenzar el tratamiento desde el momento de la ovulación.3) Múltiples estudios concuerdan en que aquellas pacientes que precisen profilaxis antenatal, la terapia antitrombótica debe iniciarse tan precoz como sea posible en el embarazo y demostraron el fracaso en las gestaciones cuando lo iniciaron tarde en la gestación.18-21) En este estudio las pacientes que iniciaron el tratamiento más tardíamente se debió a una llegada a la consulta de Hemostasia con avanzada edad gestacional.
De forma general, el protocolo de tromboprofilaxis que se establece en el IHI no estima el tipo de trombofilia, excepto el SPP que comienza solo con aspirina y después de las 20 semanas de edad gestacional o si aparecen complicaciones maternas previas a la mitad de la gestación se adiciona el uso de HBPM. La mayoría de los casos presentaba SAAF o SPP, estas entidades se observan con frecuencia, fundamentalmente el primero, en mujeres con mala historia obstétrica, donde se incluyen las pérdidas fetales recurrentes. Para nada es desestimable la presencia de pacientes con otras alteraciones de la coagulación, como es el caso del factor V Leiden y el déficit de proteína S, que además de ocasionar recurrencia de las pérdidas fetales, las pacientes pueden presentar eventos trombóticos.
Durante la gestación el riesgo de tromboembolismo arterial está aumentado entre 3-4 veces y el venoso entre 4-5 veces. El riesgo de enfermedad trombótica venosa en el posparto es hasta 20 veces mayor. Se estima que se dan 2 episodios de enfermedad tromboembólica venosa (ETEV) por cada 1 000 embarazos, de manera que actualmente se considera el embolismo pulmonar como la causa más frecuente de muerte materna en el mundo desarrollado.22)
En esta investigación no hubo muertes fetales, ni se detectaron eventos trombóticos maternas. Sin embargo, aunque mínimas se presentaron casos con preclampsia, CIUR y parto pretérmino. Estas complicaciones han sido comunicadas por otros grupos de trabajo, en mujeres con tendencia a la hipercoagulabilidad sin tratamiento tromboprofiláctico donde se obtuvieron recién nacidos pequeños para su edad gestacional con pesos inferiores a la media de aquellos de madres sanas y los de las madres que tuvieron solo un defecto trombofílico tuvieron pesos mayores que los que tenían combinaciones de defectos inmunológicos y de la coagulación en sus madres.22
A pesar de lo controversial de la imposición o no de la tromboprofilaxis en mujeres con tendencia a la hipercoagulabilidad estamos de acuerdo en la utilización de esta herramienta terapéutica que permite revertir, según otros estudios, los daños sobre la placenta que son inducidos por los anticuerpos antifosfolípidosy y la procoagulación establecida en mujeres con trombofilia.15,23
Intentar esquemas generalizados para aplicar en estas gestantes, es de obligación de los médicos, con el fin de lograr opciones viables para que nazcan neonatos sanos con peso, madurez y edad gestacional adecuados.
Se concluye que las características físicas de los neonatos nacidos de madres con trombofilias en regímenes de tromboprofilaxis iniciados tempranamente no fueron diferentes a madres sanas.
La divulgación de principios básicos de este tema es imprescindible en el ambiente médico de hematólogos, obstetras, radiólogos y neonatólogos, es preciso unirse para alcanzar la satisfacción de entregar al mundo un recién nacido sano que puede lograrse con una atención integradora de estas pacientes. Un sistema de salud como el cubano, con un programa nacional materno infantil organizado debe, en el futuro, lograr mejoras y continuar las logradas.