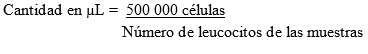Introducción
La citometría de flujo (CMF) constituye una técnica de avanzada, automatizada, objetiva y altamente sensible, la cual es muy útil para el estudio del inmunofenotipo de las células normales y anormales.1 Es el método de elección para la identificación y la caracterización inmunofenotípica de las células leucémicas. Se caracteriza por el empleo de anticuerpos monoclonales (AcMo) conjugados a fluorocromos, que son detectados y visualizados mediante un sistema informático apropiado y de forma rápida.2
Esta técnica presenta múltiples ventajas frente al uso del microscopio de fluorescencia y de las técnicas inmunocitoquímicas, entre las que se encuentran: analizar un elevado número de partículas en suspensión, en un corto período (5000 partículas/seg); ofrecer información simultánea de varios parámetros, como el tamaño y la complejidad celular, de una manera objetiva y precisa, en un gran número de células.3
Permite, además, identificar paralelamente antígenos (Ags) de superficie y citoplasmáticos; así como cuantificar la densidad antigénica por medio de la intensidad media de fluorescencia del canal por el cual se mide ese antígeno. Posee una sensibilidad superior a 1 x 10-4, es decir, es capaz de detectar una célula tumoral entre 10 000 células normales.4
En los últimos años, la CMF multiparamétrica demuestra ser de gran utilidad en la identificación y caracterización del síndrome linfoproliferativo crónico (SLPC) con el estudio de sangre periférica, médula ósea y ganglio linfático. Además, se pueden estudiar otros líquidos biológicos, como el líquido cefalorraquídeo (LCR). La CMF analiza el inmunofenotipo en células individuales que deben estar suspendidas en un fluido, por lo que se emplea fundamentalmente en tejidos líquidos como la médula ósea o la sangre periférica, aunque también se emplea en tejidos sólidos que precisan ser disgregados antes del análisis.5
Dentro de las limitaciones de la CMF, en el contexto de los SLPC, se pueden generar resultados falsos negativos o falsos positivos que se atribuyen fundamentalmente a la existencia de poblaciones heterogéneas de linfocitos presentes en situaciones especiales, como la presencia de linfoma folicular con células linfoides normales entre folículos neoplásicos, la presencia de numerosos linfocitos no neoplásicos residuales entre células neoplásicas o linfomas difusos como el linfoma de céulas B rico en células T.6)
La CMF es más sensible que la histología en la detección de niveles bajos de células clonales, pero pueden obviarse casos en los que existan pequeños infiltrados paratrabeculares focales.7) Igualmente, cuenta con un limitado uso en estudios de clonalidad de células T. En pacientes leucopénicos, la pérdida selectiva de subpoblaciones específicas puede afectar la exactitud de la determinación. Es importante comprender el patrón normal de expresión de estos antígenos y su relación con la expresión de otros antígenos relevantes, con el fin de realizar un análisis adecuado. Requiere además, la preparación especializada de un operador y altos costos de instrumentación.8
En la actualidad, el diagnóstico y la clasificación de los SLPC siguen basados, en gran medida, en criterios morfológicos, citoquímicos, histológicos e inmunohistoquímicos, metodologías que presentan un importante componente subjetivo, inclusive se observan discrepancias entre expertos en una muchos de los casos. Desde hace varias décadas, con la aparición de los anticuerpos policlonales, en principio, y AcMo, a posteriori, se han ensayado diversas técnicas de inmunofenotipificación de los SLPC. En este momento, la CMF constituye una herramienta de gran utilidad, por su rapidez, precisión y alto grado de sensibilidad, y se considera desde el punto de vista de su utilización diagnóstica como un criterio objetivo, que se integra con otros parámetros clínicos, biológicos y morfológicos para arribar a un diagnóstico final.9
El estudio inmunofenotípico en los SLPC nos aporta datos muy valiosos: diferenciar un SLPC de otros procesos neoplásicos no hematológicos; determinar la estirpe B, T o NK de la proliferación linfoide; distinguir entre SLPC "maduros" o inmaduros, como las leucemias agudas B o T; reconocer subgrupos distintos dentro de los SLPC y en el caso de los SLPC-B, el origen clonal de estos, mediante el estudio de cadenas ligeras de inmunoglobulinas, lo cual es la regla principal para el estudio de la clonalidad B y supera a la biología molecular; caracterizar entidades clínico-patológicas definidas; así como determinar factores pronósticos.10
Este artículo tiene como objetivo analizar los aspectos generales de la aplicación de la técnica de citometría de flujo al estudio y clasificación inmunofenotípica de los síndromes linfoproliferativos crónicos.
Métodos
Se realizó una revisión extensa y actualizada de la literatura acerca del tema, de los últimos 10 años. Se utilizaron los motores de búsqueda SciELO y Pubmed. Se emplearon los descriptores MeSH (por sus siglas en inglés, medical subject headings) y DeCS (descriptor de diencias de la salud). Se emplearon las palabras clave: citometría de flujo, inmunofenotipo y síndromes linfoproliferativos crónicos.
Análisis y síntesis de la información
Tipos de muestras y obtención
Los especímenes que se utilizan principalmente, son: sangre periférica, sangre de cordón umbilical, aspirados de médula ósea. También se emplean otros derivados de la sangre periférica, como: los productos de leucaféresis, productos de transfusión, como los concentrados de hematíes y plaquetas, y plasma. Además, se estudian especímenes procedentes de tejidos linfoides como ganglio linfático, bazo y timo; y de tejidos no linfoides como piel, hígado, mucosa gástrica e intestino, que se pueden obtener por procedimientos quirúrgicos, biopsia o punción‐aspiración con aguja fina (PAAF). Igualmente, se puede realizar el estudio en distintos fluidos corporales como LCR, líquido pleural y líquido ascítico.11 En los SLPC las muestras biológicas más estudiadas son sangre periférica y médula ósea.
Como regla general, todos los especímenes procedentes de cualquier fluido corporal, aspirado de médula ósea, punción o biopsia de un tejido sólido, deben obtenerse en tubos que contengan anticoagulante. El etilendiaminotetraacetato (EDTA) es el anticoagulante recomendable para la mayoría de los estudios de inmunofenotipaje celular.11
La cantidad de muestra necesaria dependerá del número de marcadores antigénicos a analizar; 1 mL de sangre total es suficiente para determinar hasta diez antígenos. Se recomienda realizar el conteo total de leucocitos obtenidos en la muestra a estudiar, para determinar la cantidad de µl necesarios para cada determinación, a través de la siguiente fórmula:1
Conservación
La calidad de los resultados es inversamente proporcional al tiempo transcurrido desde la obtención del espécimen y al grado de manipulación, por lo que se recomienda siempre procesarlas recién obtenidas. No es conveniente hacerlo después de transcurridas 24-48 h.
Pueden mantenerse a temperatura ambiente 18-25 ºC, pero si no pueden procesarse en el tiempo adecuado y se requiere tiempos de almacenamiento o transporte más prolongados, se debe mantener la muestra en nevera a 4 ºC.11
En estas condiciones, en especímenes de sangre periférica y médula ósea destinados al estudio inmunofenotípico de leucocitos, es recomendable, además, añadir estabilizantes que permiten la obtención de resultados muy aceptables hasta cinco días después de su obtención.12
Almacenamiento y eliminación
El excedente de las muestras utilizadas para el análisis, en caso de existir, se conservan durante un periodo de 7 días. Se deben mantener las mejores condiciones para la estabilidad de las propiedades de las muestras, para repetir parte o todo el ensayo, si se considera necesario, o para estudios adicionales. Transcurrido ese periodo de tiempo, como norma general, las muestras se destruyen.13
Anticuerpos monoclonales conjugados a fluorocromos
Los AcMo permiten detectar y “etiquetar” poblaciones específicas de células. Estas moléculas son capaces de unirse específicamente a una estructura específica (Ag), que se expresa en el tipo celular que se requiere identificar. Adicionalmente, este anticuerpo debe contener una unión covalente a un fluorocromo, que emitirá luz fluorescente cuando sea excitado por el láser; de este modo, la célula se “tiñe” y facilitará la identificación de las células que se unió al anticuerpo.14
Titulación de anticuerpos
La titulación de anticuerpos se realiza para obtener la concentración mínima necesaria a utilizar en técnicas de inmunofenotipaje celular. Esta óptima dilución del anticuerpo es capaz de discriminar la señal de fluorescencia que emiten las células que expresan el Ag (células positivas), de aquellas que no lo expresan (células negativas), lo que permite determinar la razón entre la intensidad de fluorescencia de la tinción y las uniones inespecíficas.15
En términos generales, a la hora de seleccionar un determinado fluorocromo (o grupo de fluorocromos) óptimo(s) deben tomarse en consideración varias características de este, como son:
Un perfil de excitación y emisión que sea compatible con la configuración óptica del equipo,
su intensidad de fluorescencia relativa,
el grado de solapamiento de su espectro de emisión con otros fluorocromos,
que pueda ser conjugado de forma fácil, estable y reproducible con un AcMo,
que sea biológicamente inactivo al no interactuar de forma inespecífica con la célula.16
En el diseño inicial de la combinación se recomienda emparejar fluorocromos y anticuerpos, se sigue una relación inversa entre la densidad de expresión del Ag y la intensidad de fluorescencia proporcionada. Es decir, se emplean aquellos fluorocromos más sensibles para detectar Ag celulares que muestren una baja expresión y fluorocromos más tenues para moléculas altamente expresadas.17
Para el estudio de los SLPC, el panel de AcMo incluye anticuerpo dirigidos contra antígenos de diferenciación linfoides B, T y NK expresados en la membrana y el citoplasma celular. Estos se conjugan directamente a los fluorocromosisotiocianato de fluoresceína (FITC), ficoeritrina (PE), aloficocianina (APC) y ficoeritrina cianina 5 (PC5), entre otros.16
Procesamiento de la muestra
Una vez añadidos los ACMo a las muestras, estas se incuban durante 20-30 min, protegidas de la luz y a temperatura ambiente. Para la detección de los antígenos intracitoplasmáticos se emplean previamente reactivos permeabilizadores/estabilizadores que se incuban por 30 min, protegidas de la luz, a temperatura ambiente. El lisado de los hematíes se puede realizar con solución lisante o cloruro de amonio, durante 10 min a temperatura ambiente.18) Como principales ventajas, la lisis de los eritrocitos se asocia a una menor manipulación de la muestra, una mayor recuperación celular y a tiempos más cortos de procesamiento.19) Posteriormente, las células deben ser lavadas en dos ocasiones con suero fisiológico y centrifugadas a 4 °C durante 10 min a 1500 rpm.1) Algunos agentes permeabilizantes son saponina, detergentes no iónicos, NP40, Tween 20 y triton x-100. Por otra parte, cuando se busca identificar moléculas de superficie habitualmente, deben realizarse pasos de lisis y lavado, posterior a la marcación de las muestras biológicas.18
Finalmente, las células marcadas se fijan con una solución fijadora para conservar su viabilidad y se guardan a 4 ºC hasta el momento de la adquisición por el equipo.
Se recomienda, previamente a su paso por el citómetro, filtrar mediante filtros de 40 µm las muestras que presenten tendencia a agregarse. Para evitar la agregación, las células pueden resuspenderse también en medios libres de cationes divalentes (Ca2+, Mg2+) que contengan EDTA.20
Calibración del equipo
Para la calibración del equipo se utilizan perlas marcadas con una mezcla de fluorocromos que son excitados por los rayos láser de diferentes colores y que emiten fluorescencia detectable por los sensores del equipo. Es necesaria para obtener una adecuada distribución de las células según su tamaño y complejidad interna, establecer una adecuada resolución y un nivel basal de detección de fluorescencia para discriminar las poblaciones negativas de las positivas con mayor exactitud.20
Información que se genera en un citómetro de flujo
Cuando la luz difractada incide en el mismo eje de la luz incidente, se evalúa el tamaño celular, a través del “Forward Scatter” (FSC). Por otro lado, cuando la luz difractada y reflejada se detecta a 90º de la dirección del láser, se evalúa la complejidad interna celular o granulosidad, a través del “Side Scatter” (SSC)18 (Figura 1).
En los citómetros actuales, la información que se genera, se almacena inmediatamente después de convertirse en señal digital, sin ninguna modificación adicional. Para la visualización de los resultados de forma gráfica estos pueden transformarse empleando escalas lineares, logarítmicas o mixtas ("logical").21
 Fuente: Sales I, prieto R.Curso Teórico-Práctico Básico de Citometría de Flujo. Disponible en http://www.vhir.org/portal1/Global/pdf/ucts/Fundamentos%20citometr%C3%ADa_Irene%20Sales.pdf
Fuente: Sales I, prieto R.Curso Teórico-Práctico Básico de Citometría de Flujo. Disponible en http://www.vhir.org/portal1/Global/pdf/ucts/Fundamentos%20citometr%C3%ADa_Irene%20Sales.pdf
Fig. 1 Distribución normal de linfocitos, monocitos y granulocitos, según tamaño celular y complejidad interna. El círculo rojo señala la localización de los linfocitos, que son células pequeñas y poco granulares por lo que se representan cerca del origen.
La compensación de la fluorescencia permite corregir la superposición que generan los espectros de emisión de los fluorocromos. Se realiza sobre las subpoblaciones linfocitarias procedentes de individuos clínicamente normales, con el fin de obtener una señal positiva y una negativa con intensidades de fluorescencia adecuadamente lejanas que eviten el solapamiento espectral.20,22
La compensación de la autofluorescencia se lleva a cabo en los tubos que contienen los AcMo conjugados con los diferentes fluorocromos, según los detectores respectivos. A través de la ventana de selección (Gate, traducido del inglés) CD45/SSC se discrimina la población de linfocitos, sobre la cual se realiza el análisis.20
De manera general, se considera que la CMF permite asignar el linaje y clasificar los SLPC-T, B y NK.
En el siguiente apartado solo abordaremos la caracterización inmunofenotípica de algunas de las entidades dentro de los SLPC.
Características inmunofenotípicas de los SLPC-B
Leucemia linfoide crónica B (LLC-B) y linfoma linfocítico de células B pequeñas
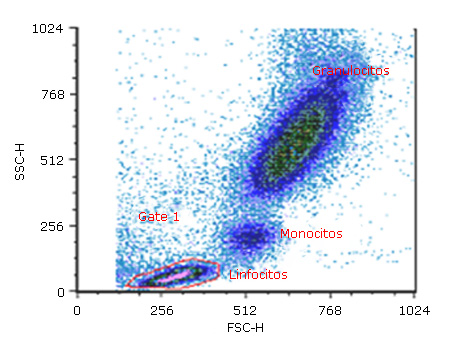
La LLC-B expresa el antígeno pan-B CD19, y fenotípicamente es CD5, CD23 y CD200 positiva; además, presenta reactividad débil para CD20, CD22, CD79b, CD81 e inmunoglobulina de superficie (sIg), así como ausencia de FCM7. Expresan un solo tipo de cadena ligera de las inmunoglobulinas (Ig) (κ o λ) (Figura 2). Cabe señalar que la expresión de CD38 e intracitoplasmática de ZAP-70 (CyZAP-70) se ha asociado con el estado no mutado de los genes de las cadenas pesadas de las Ig (genes IGH), lo que implica un pronóstico adverso; al igual que en el caso de CD49d (presente en LLC no mutada).23,24,25,26
 Fuente: Toby Eyre. Flow Cytometry. Principles and practice.. Oxford University. 2018. Disponible en: https://lymphoma-action.org.uk/sites/default/files/media/documents/2018-06/3.TOBY_.EYRE_.pdf
Fuente: Toby Eyre. Flow Cytometry. Principles and practice.. Oxford University. 2018. Disponible en: https://lymphoma-action.org.uk/sites/default/files/media/documents/2018-06/3.TOBY_.EYRE_.pdf Fig. 2 Inmunofenotipo por CMF característico de la LLC-B. A: expresión del Ag CD19, B: coexpresión de los Ags CD5/CD19, C: expresión del Ag CD23, D: expresión del Ag CD19, E: expresión de la cadenaligera de inmunoglobulina λ, con ausencia en la expresión de cadena ligera (indica monoclonalidad).
Leucemia prolinfocítica B
Los prolinfocitos expresan intensamente antígenos como CD19, CD20/FMC7, CD22, CD79b o sIg, con niveles elevados de sIgM y/o sIgD, y más bajos de CD5, CD23 y CD25.24
Tricoleucemia o leucemia de células peludas
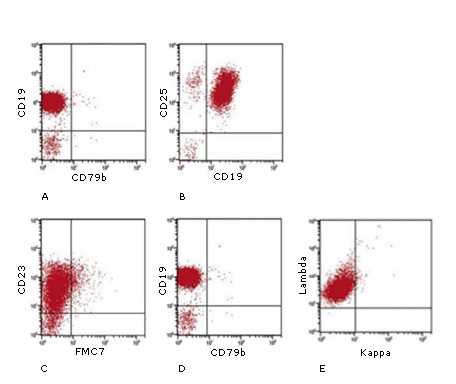
Fenotípicamente expresa con elevada intensidad antígenos pan-B como CD19, CD20, CD22 y sIg, además de CD25, CD103 (Figura 3), CD305, CD11c, FMC7, CD79b, CD123, T-beta, anexina A1 y CD72. Curiosamente, puede expresar IgM y/o IgD junto a sIgG y/o sIgA.27
 Fuente: Fernández E. Análisis Inmunofenotípico de los SLPC. Complejo Hospitalario Universitario de Santiago de Compostela. 2011 Marzo 24. Disponible en: https://docplayer.es/3359997-Analisis-inmunofenotipico-de-los-slpc.html
Fuente: Fernández E. Análisis Inmunofenotípico de los SLPC. Complejo Hospitalario Universitario de Santiago de Compostela. 2011 Marzo 24. Disponible en: https://docplayer.es/3359997-Analisis-inmunofenotipico-de-los-slpc.htmlFig. 3 Análisis por CMF de la expresión de los antígenos CD25 y CD103, característicos de la leucemia de células peludas de fenotipo B. El rectángulo rojo indica la densidad de expresión antigénica.
Características inmunofenotípicas de los SLPC-T
Leucemia linfoide crónica T
Se caracteriza por presentar fenotipo de célula T madura, el fenotipo auxiliador CD4+ predomina sobre CD8+. No expresa marcadores de células NK como CD16, CD56, y CD57. Tiene un curso clínico agresivo, es refractaria a la terapia y por lo general, los pacientes no exceden los cinco años de vida, después de haber realizado el diagnóstico. Además, puede ser difícil distinguir la LLC-T de otros trastornos linfoproliferativos raros especialmente, la fase leucémica del linfoma de células T periféricas y algunos casos de síndrome de Sezary.24,25,26,27,28
Leucemia prolinfocítica T
Los prolinfocitos T se caracterizan por presentar un fenotipo T (CD2+, CD3+, CD5+) maduro (ausencia de expresión de CD34, Tdty CD1a junto a expresión generalmente fuerte de CD45) con sobreexpresión de CD7, y un fenotipo CD4+/CD8-; aunque también puede presentar fenotipos CD4+/CD8+ y CD4-/CD8+, en aproximadamente el 25 % y el 15 % de los casos, respectivamente.29,30
Leucemia/linfoma T del adulto
La leucemia/linfoma T del adulto relacionado con la infección del virus linfotrópico T humano-1 (HTLV-1), se caracteriza por la expresión de marcadores pan-T como CD2, CD5, con frecuencia las células T neoplásicas muestran expresión débil o incluso negatividad para CD7 y en menor medida, para CD3 y TCRαβ. El antígeno CD8, así como los marcadores asociados a la célula citotóxica CD57, CD56, CD11b y CD11c son habitualmente negativos en las células T clonales de estos pacientes.30
Leucemia/linfoma de linfocitos T grandes granulares
Estas entidades conforman un grupo heterogéneo desde el punto de vista fenotípico. En la mayoría de los pacientes las células T clonales muestran un fenotipo CD3+/TCRαβ+/CD8+ aunque también, se han descrito casos CD3+/TCRγδ+/CD4- o CD3+/TCRαβ+/CD4+ asociados o no a la expresión débil de CD8. Además, puede expresar antígenos como CD5 y CD57. De forma excepcional, se detectan expansiones clonales de células T con aspecto de linfocito grande granular CD3+/TCRαβ+/CD8-/CD4‐, tal como se muestra en la figura 4.
Características inmunofenotípicas de los SLPC-NK
La leucemia de linfocitos grandes granulares de fenotipo NK se caracteriza por la expresión variable de CD16, CD56, CD11c, CD94, expresión intensa de CD45RA y positividad variable para CD45RO31 (Figura 4).
Las células NK de los SLPC-NK presentan un fenotipo de célula madura, similar al de su contraparte normal: CD16+, CD3-, CD7-.32,33
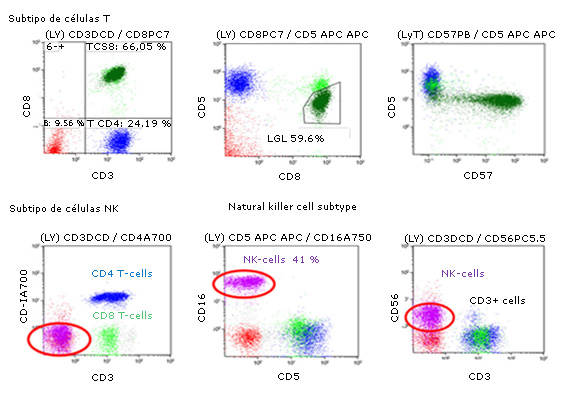 Fuente: Moignet and Lamy. Latest Advances in the Diagnosis and Treatment of Large Granular Lymphocytic Leukemia. Am Soc Clin Oncol Educ Book. 2018 May 23;38:616-25.
Fuente: Moignet and Lamy. Latest Advances in the Diagnosis and Treatment of Large Granular Lymphocytic Leukemia. Am Soc Clin Oncol Educ Book. 2018 May 23;38:616-25.Fig. 4 Inmunofenotipo por CMF de la leucemia de linfocitos T grandes granulares y leucemia de linfocitos grandes granulares NK.
Leucemia agresiva de células NK
El fenotipo de las células tumorales se caracteriza por la expresión de marcadores de células NK maduras (CD56+, CD16+, CD7+, CD3-, CD8-o+), y es habitual la expresión de CD95 en ausencia de CD57.33
CMF en la determinación de la clonalidad linfoide en los SLPC
Clonalidad B
La CMF multiparamétrica se ha convertido en uno más de los métodos diagnósticos del SLPC-B. Uno de los principales objetivos del estudio inmunofenotípico por CMF consiste en descartar si esa población de células B es clonal o no.34
Anteriormente, el estudio de clonalidad B por CMF se fundamentaba casi exclusivamente en detectar un exceso de células B con expresión restringida en membrana o citoplasma, de una de las cadenas ligeras de Ig kappa (Igκ+) olambda (Igλ+). Actualmente, esta técnica cobra protagonismo con las modificaciones en la estrategia de detección de clonalidad B35,36 (Figura 5).
La identificación de fenotipos aberrantes presentes en casi la totalidad de los SLPC-B es un signo inequívoco de clonalidad, sin requerir en este caso confirmación molecular.37) Dentro de los fenotipos aberrantes el más frecuente es la expresión anómala de CD5 combinado con la restricción de las cadenas ligeras de Igs. Este hallazgo posibilita el posible diagnóstico diferencial entre la LLC y el linfoma de células del manto (LCM). Existe una pequeña población de células B CD5+ en individuos sanos, que muestran una expresión policlonal de cadenas ligeras de Ig. Otro patrón de expresión anómalo es el Ag CD10 combinado con el marcador de maduración celular CD20. Ambos marcadores pueden ser expresados en células B en dependencia de su estadio de maduración, pero no pueden expresarse juntos en una gran cantidad de células B. Esta expresión sugiere la presencia del linfoma folicular o el linfoma difuso de células grandes, cuando se combina con restricción de las cadenas ligeras.
La débil expresión de cadenas ligeras CD20, CD22, CD79b y CD5, sugiere LLC, y cuando es anormalmente elevada de CD200 indica un LCM o una leucemia de células peludas.37,38) Además, con el empleo de estas técnicas se alcanza una mayor sensibilidad y especificidad cuando se comparan con los procedimientos convencionales, y los resultados se obtienen en un corto período de tiempo.33) La CMF brinda información útil para la caracterización diagnóstica de las células clonales, lo que hace que el análisis inmunofenotípico constituya un pilar básico en la caracterización diagnóstica de estas entidades, unido a otras características clínicas, morfológicas, histopatológicas, genéticas y moleculares. En algunos casos, permite detectar la presencia de dos o más clones diferentes de células B (no relacionados) en un mismo paciente, hasta en un 5 % de todos los SLPC-B leucemizados.37,39
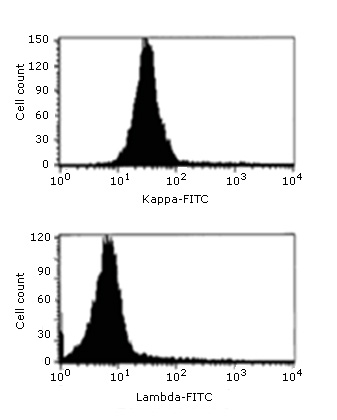 Fuente: Walser-Kunt D. TooMany B Cells: Chronic Lymphocytic Leukemia and the Role of Flow. Biology department. Carleton College, Northfield. Disponible en: https://sciencecases.lib.buffalo.edu/files/flow_cytometry.pdf
Fuente: Walser-Kunt D. TooMany B Cells: Chronic Lymphocytic Leukemia and the Role of Flow. Biology department. Carleton College, Northfield. Disponible en: https://sciencecases.lib.buffalo.edu/files/flow_cytometry.pdfFig. 5 Histogramas de fluorescencia que muestran la monoclonalidad de la cadena ligera K (Igκ) y la ausencia en la expresión de la cadena ligera λ mediante el análisis por CMF.
Clonalidad T
Ante la presencia de un desequilibrio porcentual entre las subpoblaciones de células T y la presencia de fenotipos T poco habituales o aberrantes, se sospecha la existencia de una población clonal T. Entre las aberraciones fenotípicas más frecuentes se encuentra: la ausencia o pérdida de la expresión de una o más moléculas pan-T; la sobre-expresión de algún antígeno característico de las células T; los asincronismos madurativos (perfil fenotípico de co-expresión de dos o más marcadores ausentes en linfocitos T normales, como la expresión asincrónica de CD3 y TCR en la superficie celular); la co-expresión de CD4 y CD8 o la ausencia de expresión de ambos marcadores en una proporción elevada de linfocitos.35) Las células T maduras, tanto normales como las neoplásicas, expresan en su mayoría las cadenas alfa (α) y beta (β) o gamma (γ) y delta (δ) del TCR (TCR αβ y TCR γδ, respectivamente). Para la confirmación de clonalidad T, existen dos aproximaciones metodológicas distintas para la caracterización del repertorio de estas cadenas del TCR, centradas en técnicas de biología molecular.40,41
No obstante, los reordenamientos del TCR, particularmente el repertorio TCR β, pueden evaluarse a través de la CMF. El consorcio Euroflow propone un panel de 24 anticuerpos, los cuales determinan el 70 % de los dominios.42 Según Lima y colaboradores, este análisis citométrico es una buena herramienta de tamización para la clonalidad de lesiones linfoides de linaje T, en especial en el caso de la leucemia de células grandes granulares.43
Para la interpretación de los resultados en pacientes con sospecha de SLPC-T se requiere un conocimiento detallado del repertorio T normal ya que en sujetos sanos se pueden encontrar expansiones de una o más familias, especialmente en los linfocitos T efectores de individuos de edad avanzada,44) o en sujetos que padecen algunas enfermedades de naturaleza infecciosa, tumoral o autoinmune en las que se pueden observar expansiones oligoclonales de células T.44,45
Clonalidad NK
Desde el punto de vista fenotípico, se ha sugerido que algunos patrones de expresión de receptores de tipo Ig de las células NK (KIR) (en especial CD158a y CD158b) podrían ser marcadores útiles para la detección de clonalidad NK. También, encontrar una expresión fuerte y homogénea de CD94 indica una alta probabilidad de que la población NK sea clonal.46)
En la actualidad, la CMF permite el análisis, interpretación y clasificación inmunofenotípica de los SLPC y especialmente, en el contexto de los SLPC-B, constituye una regla básica para la confirmación de clonalidad B. Además, es uno de los pilares en los que se apoya el diagnóstico y el seguimiento de los pacientes con estas entidades, lo que la convierte en una de las técnicas más atractivas y prometedoras para el estudio de las hemopatías malignas, en general.