Introducción
El cáncer es un problema de salud mundial con una elevada incidencia y mortalidad. En Cuba es la segunda causa de muerte, según el anuario estadístico de salud 2018.1,2) La evaluación del funcionamiento del sistema inmunitario (SI) es crucial en pacientes con cáncer, por su rol dual en la carcinogénesis y en la eliminación del tumor. Esto permite clasificarlos inmunológicamente, establecer pronósticos y predicciones de respuestas a los tratamientos onco-específicos, así como definir estrategias inmunoterapéuticas efectivas. En la actualidad el estado general del sistema inmunitario (EGSI), se considera un biomarcador predictor emergente, que evidencia factores condicionales del éxito de la inmunoterapia entre otros aspectos.3,4,5,6
La determinación de los inmunofenotipos linfocitarios en sangre periférica, es uno de los componentes de evaluación del EGSI y ofrece informaciones valiosas de la distribución, concentración y funcionabilidad de las células inmunitarias. Se sugieren cuatro aportes esenciales:
Permite cierta predicción de la infiltración de linfocitos a nivel del microambiente del tumor.
Se pueden correlacionar con las concentraciones de las células tumorales circulantes (CTC).
Posibilita estimar los valores de las poblaciones linfocitarias después de los tratamientos onco-específico.
Forma parte de los predictores de respuestas inmunoterapéuticas, en la era de la inmuno-oncología.7,8,9
Es bueno resaltar que el EGSI en el cáncer evidencia los cambios celulares sistémicos ejercidos, por la presencia de estructuras linfoides terciarias en los tumores malignos. Los descubrimientos de la organización estructural del cáncer, con el concepto del microambiente tumoral10 y de la inducción de órganos linfoides terciarios,11,10,12evidencian los efectos locales y sistémicos del tumor primario específicamente. Estos efectos sistémicos sobre la inmunidad intervienen en la progresión del cáncer, a través del proceso de formación de las metástasis.9
En este sentido, uno de los métodos más importantes para determinar las concentraciones de dichas células inmunitarias es el inmunofenotipo por citometría de flujo. Esta metodología cuantifica las poblaciones linfocitarias de forma relativa y absoluta, aunque en ocasiones se emplea una doble plataforma para determinar los valores absolutos, lo cual reduce el error por imprecisiones en un solo equipo.13,14
Dentro de las células efectoras inmunitarias más estudiadas con significado biológico en el cáncer se encuentran: las células asesinas naturales (NK, por sus siglas en inglés) como parte de la inmunidad innata y los linfocitos T CD4+, T CD8+ y B dentro de la adaptativa. Se ha comprobado que el aumento en los tumores de NK y T CD8+ se asocian con mejor pronóstico, mientras que la presencia de linfocitos T CD4+ y/o B del tipo regulador (Treg y Breg, respectivamente) se asocian generalmente con un pronóstico desfavorable. Por otra parte, con la profundización en el estudio de los inmunofenotipos linfocitarios, se descubrieron nuevas subpoblaciones con funciones importantes en la biología del cáncer como son: las células asesinas naturales T (NKT, por sus siglas en inglés), linfocitos T dobles negativos (TDN) y dobles positivos (TDP (inmunofenotipos: CD4-CD8- y CD4+CD8+, respectivamente).13,14,15,16,17,18
Por todo lo anterior, se decidió realizar el presente trabajo con el objetivo de evaluar la distribución de las concentraciones linfocitarias circulantes en sangre periférica de pacientes con cáncer.
Métodos
Se realizó un estudio analítico y transversal en pacientes con cáncer atendidos en el servicio de Inmunología del Instituto de Oncología y Radiobiología de La Habana, entre 2017 y 2019.
Se estudiaron 154 pacientes con cáncer, de quienes se extrajeron 2 mL de sangre venosa en tubos Vacutainer con ácido etilen diamino tetraacético (EDTA) en la primera consulta, antes de cualquier intervención inmunoterapéutica. Todas las muestras fueron procesadas dentro de las primeras 4 h de colectadas. Se tuvo en cuenta la edad, el género, los tumores sólidos y hematológicos, así como algunas localizaciones del cáncer: mama, próstata, linfomas, cabeza y cuello, entre otras variables.
Para la tinción celular se realizó un procedimiento de lisis de hematíes sin lavado. Se dispensaron 50 µL de sangre para la tinción con anticuerpos monoclonales conjugados con fluorocromos: anti-CD45 Krome Orange (Clon J33), anti-CD19 ficoeritrina-cianina 7 (Clon J3-119), anti-CD3 isotiocianato de fluoresceína (Clon UCHT1), anti-CD4 Pacific Blue (Clon 13B8.2), anti-CD8 aloficocianina-Alexa Fluor 700 (Clon B9.11), anti-CD56 ficoeritrina (Clon N901 NKH-1) (todos los monoclonales fueron Beckman-Coulter, Francia). Se empleó un citómetro Beckman Coulter Gallios de 10 colores. Los análisis se realizaron con el software Kalluza AnalysisTM v1.5ª.
Se definieron ocho inmunofenotipos linfocitarios: CD3+ (linfocitos T), CD3+CD4+ (linfocitos cooperadores), CD3+CD8+ (linfocitos citotóxicos), CD19+ (linfocitos B), CD3-CD56+ (NK), CD3+CD56+ (NKT), CD3+CD4+CD8+ (TDP) y CD3+CD4-CD8- (TDN). Además, se evaluaron los linfocitos totales y el índice CD4/CD8. El conteo absoluto de linfocitos se determinó por doble plataforma, con un contador hematológico automático Sysmex 1000, mediante la siguiente fórmula:
Para el procesamiento estadístico se aplicó el test de normalidad de Shapiro-Wilk y la mayoría de los datos no siguieron una distribución normal. Se establecieron los rangos de las poblaciones linfocitarias a través de la mediana y los percentiles 2,5-97,5. Se aplicaron las pruebas no paramétricas: rangos con signos de Wilcoxon, U de Mann-Whitney y el coeficiente de correlación de Spearman. Se prefijó un nivel de significación p< 0,05. Se utilizó el programa Graph Pad Prism versión 7.00, San Diego California, EE.UU.
Se obtuvo el consentimiento informado de los pacientes. Se tuvieron en cuenta los criterios derivados de la Declaración de Helsinki. Se garantizó la confidencialidad de los datos obtenidos y su uso con fines exclusivos de investigación.
Resultados
Se estudiaron 123 pacientes con tumores sólidos y 31 con diagnóstico de linfomas. Las medianas se encontraron disminuidas, tanto de los porcentajes como de conteos absolutos para linfocitos totales, linfocitos T, T cooperadores y linfocitos Ben los pacientes con tumores sólidos. En este mismo sentido, en los linfomas también se encontraron disminuidas significativamente las medianas de los linfocitos T cooperadores y linfocitos B, así como el índice CD4/CD8. Al comparar las medianas de poblaciones linfoides entre tumores sólidos y linfomas, los linfocitos B mostraron valores significativamente más bajos en los linfomas respecto a los tumores sólidos. Esta misma tendencia mostraron los porcentajes de linfocitos T cooperadores y el índice CD4/CD8 (tabla 1).
Tabla 1 Distribución de las poblaciones linfocitarias en sangre periférica entre controles y pacientes con cáncer
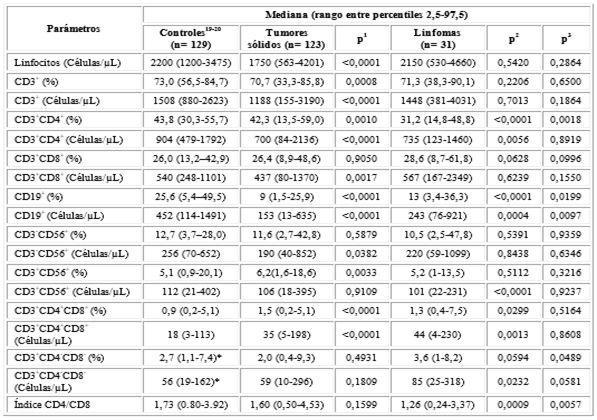
p: nivel de significación (p< 0,05), en negritas valores significativos, p1: Prueba de los rangos con signos de Wilcoxon entre controles y tumores sólidos, p2: entre controles y linfomas y p3: U de Mann-Whitney entre tumores sólidos y linfomas. Controles19,20: Referencias bibliográficas de valores normales, *Datos no publicados.
La mayoría de las poblaciones no mostraron diferencias significativas entre sexos. Sin embargo, los conteos absolutos de linfocitos totales, de linfocitos T y T citotóxicos sí mostraron diferencias significativas, a favor del sexo masculino.
La distribución de las concentraciones porcentuales de las poblaciones linfocitarias, según algunas de las localizaciones de los tumores, exhibieron medianas con diferencias significativas en muchos casos (Fig. 1). Respecto al porcentaje de los linfocitos CD3+ en sangre de pacientes con cáncer de próstata se encontró una mediana significativamente menor, que en el resto de las localizaciones estudiadas. Los mismos resultados se hallaron para las células NK. Los linfocitos T CD3+CD4+ en pacientes con cáncer de mama, estuvieron significativamente elevados respecto a los pacientes con cáncer de próstata y linfomas. Los pacientes con linfomas de Hodgkin tuvieron medianas de linfocitos T citotóxicos significativamente superiores a pacientes con cáncer de próstata y de mama. Los porcentajes de linfocitos B en sangre periférica no mostraron diferencias significativas entre localizaciones, pero fue el de mayor dispersión en todos sus resultados (Fig. 1).
 Significación: p< 0,05. Prueba U de Mann-Whitney. *significativo, **muy significativo, ***altamente significativo, ****extremadamente significativo; las diferencias no significativas entre localizaciones no aparecen señaladas en los gráficos.
Significación: p< 0,05. Prueba U de Mann-Whitney. *significativo, **muy significativo, ***altamente significativo, ****extremadamente significativo; las diferencias no significativas entre localizaciones no aparecen señaladas en los gráficos.Fig. 1 Comparación de las concentraciones de poblaciones linfocitarias en sangre periférica de pacientes con cáncer, según algunas de sus localizaciones (n= 144). Cada símbolo representa un paciente.
Las medianas del conteo absoluto de los linfocitos y sus subpoblaciones en sangre periférica de los pacientes con cáncer de próstata, mostraron valores significativamente menores que en el resto de las localizaciones. Solo la mediana de las células NK fue superior al resto de las localizaciones, pero sin significación estadística (Fig. 2).
 Significación: p< 0,05. Prueba U de Mann-Whitney. *significativo, **muy significativo, ***altamente significativo, ****extremadamente significativo; las diferencias no significativas entre localizaciones, no aparecen señaladas en los gráficos.
Significación: p< 0,05. Prueba U de Mann-Whitney. *significativo, **muy significativo, ***altamente significativo, ****extremadamente significativo; las diferencias no significativas entre localizaciones, no aparecen señaladas en los gráficos.Fig. 2 Comparación de las cuantificaciones de poblaciones linfocitarias en sangre periférica de pacientes con cáncer, según algunas de sus localizaciones (n= 144). Cada símbolo representa un paciente.
El estudio de poblaciones linfocitarias con menor concentración en sangre periférica (TDP y TDN) mostró la mayor dispersión de sus resultados, tanto en valores porcentuales como absolutos, lo que evidenció mayor variabilidad interindividual en comparación con las otras poblaciones mayoritarias en sangre. Las neoplasias de cabeza y cuello tuvieron medianas significativamente mayores de TDN, tanto porcentual como absolutos, que sus contrapartes de tejidos sólidos (mama y próstata).
La evaluación de las correlaciones entre la edad y las poblaciones linfocitarias de los pacientes con tumores sólidos, mostraron asociaciones inversas y estadísticamente significativas. Estas correlaciones evidenciaron una disminución de las concentraciones en sangre de estas poblaciones con el aumento de la edad de los pacientes (Fig. 3).
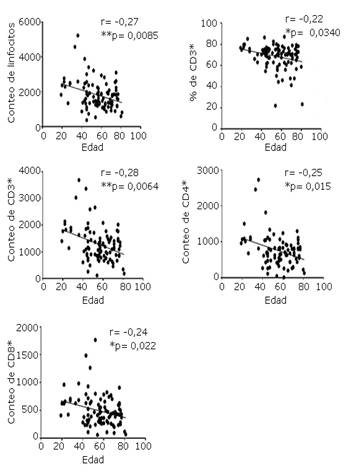 r: coeficiente de correlación de Spearman. p: nivel de significación, *significativo, **muy significativo
r: coeficiente de correlación de Spearman. p: nivel de significación, *significativo, **muy significativoFig. 3 Correlaciones entre la edad y concentraciones de poblaciones linfocitarias en sangre periférica de pacientes con tumores sólidos (n= 113). Cada punto representa un paciente.
Las correlaciones entre la edad y las poblaciones linfocitarias de los pacientes con linfomas, mostraron asociaciones inversas y estadísticamente significativas, las de conteos absolutos de: linfocitos totales, linfocitos T, linfocitos B, T cooperadores, T citotóxicos y en el caso de los T dobles negativos tanto porcentual como conteo absoluto. Estas correlaciones evidenciaron una disminución de las concentraciones en sangre de estas con el aumento de la edad de los pacientes, con asociaciones fuertes (Fig. 4).
 r: coeficiente de correlación de Spearman. p: nivel de significación, *significativo, **muy significativo, ***altamente significativo
r: coeficiente de correlación de Spearman. p: nivel de significación, *significativo, **muy significativo, ***altamente significativoFig. 4 Correlaciones entre la edad y concentraciones de poblaciones linfocitarias en sangre periférica de pacientes con linfomas (n= 31). Cada punto representa un paciente.
Discusión
Las ventajas de la citometría de flujo en el estudio inmunofenotipaje linfocitario en sangre periférica de pacientes con cáncer consisten en su objetividad, automatización, rapidez y exhaustividad en su análisis.13 De esta forma estos pacientes pueden ser evaluados para su clasificación inmunológica, conformar su pronóstico, predecir respuestas a las terapéuticas empleadas y monitorear las respuestas a las inmunoterapias en los casos en que se requieran.6
La disminución de linfocitos y de sus subpoblaciones ha sido documentada en los pacientes con cáncer, aunque no siempre se llega a una franca linfopenia.21,23,24) En la etapa pre-tratamiento dicha disminución de linfocitos se debe fundamentalmente, a mecanismos inmunosupresores derivados del cáncer y linfolisis producida por citocinas originadas en el tumor, como ocurre en los linfomas. Posteriormente, en las etapas postratamiento, se añaden los efectos inmunosupresores de las quimio y radioterapias. La linfopeniase acentúa con la aparición de metástasis que son indicativas de progresión y mortalidad, por lo tanto, se considera un biomarcador de compromiso inmunitario y de supervivencia global.9,22Además, en la actualidad es imprescindible la determinación de linfocitos para los cálculos de los índices neutrófilo-linfocito y monocito-linfocito, los cuales también se consideran biomarcadores pronósticos.23,24
La disminución de linfocitos T, a expensa de los cooperadores CD4+, de linfocitos B y el índice CD4/CD8, también se informan en estudios anteriores. En localizaciones como mama, ovario, pulmón y colon, la disminución de linfocitos CD4+ se correlaciona con un pronóstico favorable, sobre todo si se evidencia un índice CD4/CD8 bajo. Esto se debe a que un porcentaje de estos linfocitos CD4+ son células Treg, que se asocian con inmunosupresión. Si el aumento de los CD8 es el responsable de la disminución del índice CD4/CD8, resulta más beneficioso para el paciente. Por el contrario, en los cánceres de cabeza y cuello, los índices con CD4+bajos se asocian a un mal pronóstico.25,26,27
La existencia de una correlación positiva entre las concentraciones de linfocitos circulantes en sangre y los infiltrantes de tejido (TIL), sugiere que se pueden hacer estimaciones de estos últimos, a partir de los valores de sus homólogos en sangre.25,26,27 Trabajos recientes demuestran que la disminución de linfocitos NK y TCD8+en sangre se correlacionan con valores altos de CTC y con bajos niveles de TIL en el tejido tumoral. Esto constituye una evidencia de las funciones antitumorales de estas células citotóxicas.7,8) En el presente estudio se encontraron valores significativamente bajos de linfocitos B, T, CD4+ y CD8+ en el cáncer de próstata, en comparación con otras localizaciones. Los reportes previos lo asocian con un mal pronóstico y resistencia a la de la radioterapia, así como mayor propensión a una linfodepleción más profunda postratamiento.28
La disminución de linfocitos B respecto a los controles que se encontraron en el presente trabajo coinciden con algunos estudios previos en tumores de mama, pulmón, hígado, próstata y ovario. Lo mismo sucede con las células B normales o reactivas que acompañan a los linfomas. Sin embargo, según la subpoblación de linfocitos B que predomine, ya sean convencionales o B reguladoras (Breg) cambia el pronóstico, ya que estas últimas se asocian con progresión, como ocurre en los cánceres de próstata castración resistente y de ovario.9,29,30 Esto puede ser un blanco atractivo para las inmunoterapias depletoras de linfocitos B. Los estudios con Rituximab en tumores sólidos ofrecen beneficios limitados, debido a que las Breg son resistentes a los tratamientos anti-CD20.30
Los linfocitos TDP maduros circulan en bajas concentraciones en sangre periférica y no exceden el 5 % en personas sanas. Está demostrado que poseen funciones definidas en el cáncer, pero contradictorias (tolerantes vs citotóxicas), que son reflejo de su plasticidad celular dependiente del contexto. Los resultados que se obtuvieron en el presente trabajo no difieren de los reportados en trabajos similares ya publicados. La mayoría de estos estudios coinciden en que los TDP están incrementados con respecto a sujetos sanos, en cánceres de mama, colon, melanomas, linfomas, vejiga, próstata y en riñón. En el caso de algunos linfomas forman parte de los infiltrados reactivos que lo acompañan. Por otro lado, en los tejidos estos linfocitos muestran altas concentraciones en cánceres urológicos sin relación con los niveles en sangre, lo cual sugiere que no recirculan. Se plantea que mayoritariamente son linfocitos CD8+exhausto, que re-expresan CD4 en virtud de la plasticidad celular para recuperar la función citotóxica a antígenos presentados en el contexto de MHC clase-II.31,32,33,34
Los linfocitos TDN se encontraron disminuidos en los tumores sólidos y elevados en los linfomas respecto al grupo control, lo cual coincide con reportes previos publicados. Existen pocos estudios sobre estas células en cáncer, pero sí evidencias acumuladas acerca de sus funciones reguladoras ejercidas sobre sus contrapartes T simples positivas, que están involucradas en la supervivencia de los trasplantes, la autoinmunidad y algunas infecciones virales. En el presente estudio, de las localizaciones analizadas, cabeza y cuello presentó valores porcentuales y absolutos de TDN más altos significativamente respecto a próstata y mama. Esto pudo estar en relación con las características patogénicas de ese cáncer, que en muchos casos involucra una infección por el Virus Papiloma Humano. Los mecanismos supresores en estos linfocitos son del tipo citotóxicos, mediados por Fas/Fas ligado y secreción de granzimas y perforinas.35,36
Los linfocitos TDN son del tipo γδ en un 80 %, 10 % αβ y 1 % entre NKT y linfocitos invariantes T asociados a mucosas. Su incremento en linfomas y leucemias se asocia con destrucción de células tumorales. Estos hallazgos unidos a las evidencias de falta de reconocimiento de lo propio las han hecho candidatas a terapias celulares adoptivas con resultados prometedores tanto en leucemias como en melanomas, cáncer de páncreas y cáncer de pulmón. Sin embargo, en el cáncer existen mecanismos aún no esclarecidos que provocan la disminución de TDN en el cáncer de forma general.9,37,38,39
Las células NKT son linfocitos que pueden reconocer lípidos en contexto CD1d y están involucrados en la defensa contra infecciones y tumores. Existen tres variantes: las invariantes iNKT (NKT-I), las variables (NKT-II) y las células NK tipo T (NKT-III). En individuos saludables sus medianas oscilan entre 4 % y 5 % en sangre.20) Aunque estas células representan una baja proporción del total de linfocitos, hoy se conoce que poseen acciones antitumorales directas y a través de secreción de citocinas pueden revertir el estado exhausto de CD8+ y NK, sobre todo en etapas avanzadas del cáncer. Se informa disminución en sangre de pacientes con cáncer de mama, próstata, cabeza y cuello, lo cual no coinciden con los datos del presente estudio. Las evidencias apuntan a que existe una relación inversa entre la supervivencia y los valores en sangre de estas células.40,41
En la distribución de poblaciones linfocitarias por sexo, no se encontraron diferencias estadísticamente significativas en la mayoría de las poblaciones analizadas. En este sentido, en la literatura revisada se demuestra que el sexo cromosómico y las hormonas dan ventaja al femenino. Sin embargo, en estudios en individuos saludables en Cuba el sexo no influyó en la mayoría de las poblaciones linfocitarias, aunque si en los valores de linfocitos totales a favor de las mujeres, como ocurrió en el presente estudio.19,20) En relación con los pacientes con cáncer también se informan datos de concentraciones linfocitarias a favor del sexo femenino, pero sin evidencias de repercusión en la supervivencia.42
El avance de la edad produce una disminución de la concentración y función de los linfocitos. En el caso de los linfocitos T ocurre por involución del timo principalmente. Los datos que se evidencian en los modelos de este estudio no difieren de los encontrados en las publicaciones previas. Por otro lado, aumentan las células NK como expresión de la inmunidad entrenada por sucesivos retos antigénicos con el decursar de la vida. El balance entre subpoblaciones también se modifica, como la disminución de linfocitos vírgenes, el aumento de los de memoria y de los fenotipos exhaustos y senescentes. Se acumulan también linfocitos que habitualmente son escasos como los NKT-III y las TDP. Se reduce la diversidad clonal y se incrementan poblaciones oligoclonales. Estos efectos se resumen dentro del proceso de inmunosenescencia, que en el cáncer se encuentra acelerado y se asocia con un peor pronóstico. Estos hallazgos apoyan los postulados de la inmunovigilancia del cáncer, al incrementarse considerablemente su incidencia con la edad.43,44,45
La asociación del aumento de la incidencia y mortalidad del cáncer con la edad se correlaciona con el estado del SI. Los estudios de modelos lineales multivariados de Wang y colaboradores. demuestran que la edad es una de las variables que más influye en la inmunosenescencia y concluyen que los linfocitos T, NK y NKT son gradualmente más afectados en el cáncer. En este sentido, los estudios de Palmera y colaboradores abordan modelos de correlación de la edad con el estado inmune y otras variables, que describen los efectos en la incidencia del cáncer. Proponen que la disminución de las células inmunitarias funcionales con la edad, delimitan un umbral con un perfil cinético exponencial en descenso, con el incremento de la edad.43,44,45
De manera general, este estudio permite afirmar que los pacientes con cáncer tienen concentraciones significativamente menores de células linfocitarias circulantes de sangre periférica respecto a los sujetos sanos. Las células más afectadas suelen ser las subpoblaciones T y linfocitos B. Los tumores sólidos, principalmente los de próstata, muestran valores más bajos. El sexo no es una variable que presente diferencias. Sin embargo, con el incremento de la edad si existe una tendencia a la disminución de las poblaciones linfocitarias T, B y NK la que evidencia la relación del EGSI con la inmunosenescencia del paciente oncológico.















