Introducción
El término de neutropenia febril (NF) se utiliza cuando se constata un recuento absoluto de neutrófilos (RAN) menor de 500 x mm3 o menor de 1000 x mm3 si se prevé su descenso en las 48 horas siguientes en el contexto de una temperatura corporal mayor de 38,3 ºC en una ocasión o mayor de 38 ºC mantenida por 1 hora o en dos ocasiones separadas por más de 6 horas.1,2
La NF incide frecuentemente en pacientes con hemopatías malignas y representa una urgencia médica; actualmente su manejo terapéutico constituye un verdadero reto debido a la aparición de infecciones por microorganismos multirresistentes y a la coexistencia de factores dependientes del paciente y del tratamiento, lo cual contribuye a situaciones de riesgo para el desarrollo de complicaciones graves.
Entre el 50 al 75 % de los pacientes neutropénicos experimentan fiebre relacionada con infecciones y a pesar de los avances producidos en las últimas décadas, tanto en su profilaxis, como en su tratamiento, se alcanzan índices de mortalidad estimados en 11 %.1
Múltiples son los factores que predisponen a la presencia de infecciones en estos pacientes dentro de los que se destacan: duración e intensidad de la neutropenia, utilización reciente de quimioterapia intensiva, estado de la enfermedad de base en el momento de la evaluación, defectos de la inmunidad celular y humoral, presencia de catéteres venosos, sonda urinaria o ventilación mecánica, alteración de la integridad de las barreras mucocutáneas y las enfermedades debilitantes concomitantes.3
Las infecciones que se presentan tienen diversas etiologías: bacterianas, virales, fúngicas y parasitarias, pero son las infecciones bacterianas las que representan la mayoría de los eventos por NF.4,5
Los patrones de infección bacteriana en pacientes con NF han cambiado a lo largo de los años, a mediados de la década del 80, 70 % de las infecciones eran producidas por gérmenes gram negativos; desde la mitad de la década hasta finales de 1990, eran los gram positivos los causantes de la mayoría de las infecciones, probablemente por el empleo de catéteres venosos centrales (CVC); quimioterapia más intensiva, que originaba mayores eventos de mucositis, y el empleo de quinolonas como profilaxis antibiótica; pero desde finales de los años 90 nuevamente se presentó un incremento de las infecciones por bacterias gram negativas.5,6
En la actualidad de usa el acrónimo ESKAPE (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa y Enterobacter spp.), para resumir los agentes patógenos que circulan frecuentemente.6
Las diferencias encontradas en el espectro microbiano en diferentes países, muestran que el conocimiento de estos patógenos en cada área particular constituye un aspecto de gran relevancia para un mejor abordaje terapéutico de los pacientes, así como para establecer las políticas de recursos de enfrentamiento a estos. Añadido a esto, la creciente tendencia a la resistencia antimicrobiana por parte de los patógenos, requiere un estudio exhaustivo por parte de cada centro de los patrones de susceptibilidad y resistencia a los antibióticos, como parte de su política estándar en el manejo de estos eventos.4
Este trabajo abordará fundamentalmente el enfoque diagnóstico y terapéutico en pacientes de alto riesgo de complicaciones por infecciones bacterianas.
Métodos
Se realizó una revisión exhaustiva en las principales bases de datos de la Biblioteca Virtual de Salud; se utilizó como referencia artículos actualizados publicados principalmente en los últimos cinco años, en los idiomas inglés y español. Los descriptores utilizados fueron: neutropenia febril, hemopatías malignas, tratamiento, sepsis. Se confeccionó el análisis y resumen de la bibliografía usando los aspectos más significativos referidos al tema.
Análisis y síntesis de la información
Diagnóstico
Tomando en consideración lo mencionado, es importante considerar que el abordaje de los episodios febriles en pacientes neutropénicos, crea una situación que, aunque es frecuente no deja de ser complicada, sobre todo si el enfoque diagnóstico y terapéutico no es el adecuado.
De manera general, todos los pacientes con NF, deben ser evaluados de forma inmediata por el personal médico calificado a partir de un interrogatorio, examen físico exhaustivo y la indicación de pruebas diagnósticas encaminadas a localizar un posible foco de infección, determinar su gravedad y documentarla microbiológicamente.
Es necesario obtener información detallada, a través del interrogatorio y el examen físico acerca de la evidencia de factores de riesgo preexistentes de desarrollar NF: uso de profilaxis antimicrobiana; historia de infecciones previas y posible existencia de resistencia antimicrobiana en estos episodios; comorbilidades en el paciente, presencia de síntomas y signos específicos de disfunción orgánica, signos de infección del CVC y el uso de esteroides.3
Es importante tener en cuenta que en un gran número de pacientes la fiebre es el primer y único signo constatado como evidencia de infección; y que su ausencia no descarta la posibilidad de la presencia de ella, pues existen signos de sospecha de infección como son: dolor localizado, aparición de lesiones cutáneas, hipotensión arterial, presencia de signos de hipoperfusión tisular (acidosis metabólica, oligoanuria, desorientación), hiperventilación o alcalosis respiratoria.
No todos los episodios febriles corresponden a etiología infecciosa pues pueden deberse a: transfusión de hemocomponentes durante o en las 6 horas inmediatas a su administración; uso de fármacos pirogénicos; presencia de un síndrome de lisis tumoral; un hematoma de cualquier localización, pero en especial del sistema nervioso central (SNC); un tromboembolismo pulmonar; un infarto esplénico, una trombosis venosa/flevitis, insuficiencia suprarrenal y cardiaca congestiva o de la progresión de la enfermedad de base.7
Al concluir un exhaustivo interrogatorio se debe realizar un detallado examen físico que requiere, además de la evaluación general y por sistemas, un mayor detenimiento sobre los sitios más frecuentemente afectados en estos casos, así como de aquellas estructuras a las cuales en el interrogatorio se recogió información de interés; entre estos: la piel, el sitio de inserción del catéter, la cavidad oral, los senos perinasales, los pulmones, el abdomen, los genitales externos, la región anal y perianal (debe evitarse el examen digital por riesgo de traumatizar la mucosa anal y provocar complicaciones a este nivel).4,7
Con los elementos anteriormente expuestos, se debe realizar determinaciones de laboratorio que incluyen la realización de un hemograma completo, panel metabólico (creatinina sérica, pruebas de función hepática, electrolitos), pruebas de diagnóstico microbiológico: hemocultivos (2 extracciones) de CVC y de vena periférica (diferenciales); urianálisis y cultivo de orina; tinción de Gram y cultivo de muestras procedentes del foco de infección (esputo, líquido cefalorraquídeo, líquido pleural, exudado pericatéter, biopsia lesiones cutáneas); coprocultivo; determinación de toxina de Clostridium difficile en heces, detección de antígeno de Legionella y Streptococo pneumoniae en orina; pruebas de diagnóstico por imagen (de acuerdo a manifestaciones clínicas) y otras pruebas de acuerdo a las manifestaciones clínicas del paciente como son la tomografía torácica de alta resolución, de senos perinasales, cerebral o abdominal y un examen de fondo de ojo.6,7
Una vez realizada la evaluación integral en el paciente con NF, es de gran importancia establecer la estratificación de riesgo, para conocer el grado de aparición de futuras complicaciones en estos pacientes.
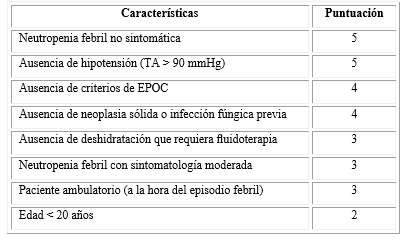
El índice de la Asociación Multinacional para los Cuidados de Soporte en el Cáncer (MASCC, siglas en inglés Multinational Association for Supportive Care in Cancer), es la herramienta más utilizada para efectuar la estratificación de riesgo (Tabla).
El índice es calculado a partir de la suma de 8 características individuales de los pacientes, en las que con un score ≥ 21 se estratifica al paciente en alto riesgo de desarrollar complicaciones.8
Recientemente se publicó una nueva herramienta: el índice clínico de neutropenia febril, (CISNE del inglés Clinical Index of Stable Febrile Neutropenia). Adicionalmente organizaciones, como la Sociedad Americana de Oncología Clínica (American Society of Clinical Oncology) y la Sociedad Europea de Oncología Médica (European Society of Medical Oncology), han publicado sus propios instrumentos de evaluación de riesgos.1,5,8
En general, todos definen al paciente con alto riesgo de desarrollo de complicaciones si se espera una duración de la neutropenia mayor de 7 días, aunque otros elementos de alto riesgo incluyen la presencia de inestabilidad hemodinámica, mucositis, síntomas gastrointestinales, cambios en el estado neurológico, infección del CVC, hipoxemia, nuevos infiltrados pulmonares, enfermedad pulmonar subyacente, uso de alemtuzumab en los dos meses previos al episodio, enfermedad en progresión o no controlada, evidencias de insuficiencia hepática o renal.9
Tratamiento
Múltiples guías de práctica clínica basadas en la evidencia, recomiendan que el tratamiento de los pacientes con NF debe comenzar en la primera hora de haberse documentado la fiebre, debido a que las infecciones pueden progresar rápidamente con un alto riesgo de desarrollo de sepsis, inestabilidad hemodinámica y disfunción multiorgánica.6,7,8,10,11 A esta hora se le denomina: “hora dorada” por lo cual la administración de la antibióticoterapia empírica debe realizarse lo antes posible junto a las medidas generales de soporte.10
De manera general, los esquemas antimicrobianos deben cubrir un amplio espectro de sensibilidad antibacteriana ante gérmenes gram negativos y gram positivos; pero cada institución hospitalaria debe ajustar la política de tratamiento a sus datos microbiológicos, donde incluyan factores relacionados con los agentes patógenos más frecuentes y los patrones de susceptibilidad y resistencia de estos.11
La mayor parte de las guías de actuación recomiendan el inicio de tratamiento antimicrobiano empírico de amplio espectro con monoterapia o terapia combinada. El uso de estos fármacos puede realizarse desde dos enfoques: un enfoque de escalamiento y un enfoque de desescalamiento.4,6,7
Se recomienda iniciar la monoterapia con antibióticos betalactámicos con espectro antipseudomónico, como cefepime, imipenem-cilastatina, meropenem, o piperacillina-tazobactam. Actualmente no se incluye a la ceftazidima entre los betalactámicos de elección porque su actividad frente a microorganismos gram positivos es baja y en cualquier caso totalmente inferior a la de los antibióticos recomendados; además, se ha asociado con incremento en las tasas de resistencia de bacterias gram negativas y mayores requerimientos de uso de glicopéptidos.5,6,8
En los casos de instituciones con alta prevalencia de bacterias multirresistentes se recomienda añadir un aminoglucósido al tratamiento empírico inicial.11
Los glicopéptidos más utilizados son la vancomicina, el linezolid y la daptomicina. El tratamiento inicial con este grupo farmacológico no se recomienda como parte de la primera línea de tratamiento, a menos que existan indicaciones específicas relacionadas con la existencia de inestabilidad hemodinámica, presencia de signos de sepsis, cultivos positivos para gérmenes gram positivos como el Estafilococo aureus u otros gérmenes como la Pseudomona aeruginosa y las especies de cándida; la sospecha de infección del CVC, la infección de piel o partes blandas, la presencia de neumonía, endocarditis, o mucositis grave.10,11
En aquellos pacientes con alergia a penicilinas y cefalosporinas se recomienda el uso de carbapenémicos o aztreonamen monoterapia o asociado a vancomicina. En caso de sospecha de sepsis desde el inicio, deben agregarse aminoglucósidos y glucopéptidos, al betalactámico seleccionado.10
Duración del tratamiento
El régimen inicial debe mantenerse hasta la resolución de los signos y síntomas iniciales, así como hasta la recuperación del RAN. Si se inició cobertura inicial empírica para microorganismos que luego no se documentaron o no existió evidencia microbiológica de su presencia, se deberá descontinuar su uso luego de 48 h de haberse iniciado el tratamiento, es lo que se conoce como desescalamiento.12
En episodios de fiebre cuya causa no se puede precisar, se debe continuar el tratamiento por un mínimo de 2 días luego de la efervescencia (que ocurre generalmente a los 5 días) si existe recuperación del RAN. La modificación del tratamiento inicial antes del quinto día de iniciado, sin evidencias de progresión o infección subtratada es innecesaria.5,7,11,13
En el caso de que la fiebre persista entre el tercer o quinto día de tratamiento antimicrobiano, este deberá ajustarse tanto a los resultados del antibióticograma, como a los datos clínicos evolutivos a partir del primer episodio febril. Si los cultivos son positivos, se recomienda ajustar el tratamiento a la sensibilidad del microorganismo aislado y retirar el CVC si existen signos de infección en área de inserción.11
En caso de que los cultivos sean negativos se debe añadir un aminoglucósido, un glucopéptido o ambos, si no los llevaba en la pauta inicial y aparece clínica de infección focal, progresiva o con criterios de sepsis grave.14
En caso de sospecha de infección por gérmenes anaerobios, se debe añadir metronidazol. Si no se documenta la existencia de infección bacteriana es necesario repetir las pruebas analíticas y radiológicas comentadas y considerar otras causas de fiebre no infecciosa, de infección no bacteriana (especies de candida, Aspergillus u otro hongo, Toxoplasma gondii, citomegalovirus, virus del herpes simple, adenovirus, enterovirus) o de infección por micobacterias o por Clostridium difficile.14,15
Cuando la fiebre es persistente entre el quinto y séptimo día de tratamiento u ocurre un segundo episodio febril se debe considerar la adición de tratamiento antifúngico empírico y cambio del CVC. En esta situación es necesario reevaluar al paciente repitiendo la sistemática diagnóstica inicial y descartar la existencia de lesiones pulmonares compatibles con infección por especies de aspergillus o lesiones hepato-esplénicas sugestivas de candidiasis.15,16
La indicación de tratamiento antifúngico empírico se considera principalmente si el paciente presenta una de las siguientes alteraciones: dolor a la palpación de los senos paranasales, lesiones ulceradas en la mucosa nasal, infiltrados pulmonares que aparecen durante el tratamiento antibiótico, lesiones cutáneas, dolor retroesternal sugestivo de esofagitis y si la fiebre persiste o reaparece durante la fase de recuperación de la neutropenia.16
Resistencia antimicrobiana
La aparición de resistencias al tratamiento antimicrobiano es uno de los mayores retos a los que se enfrenta el personal médico en estos pacientes, sobre todo debido a la inmunosupresión subyacente y a las posibilidades terapéuticas disponibles. El microorganismo más frecuentemente aislado en casos de resistencias es el estafilococo aureus meticillín resistente (SAMR), el cual es tratado con vancomicina, linezolid o daptomicina. Otros microorganismos resistentes son aquellos productores de betalactamasas de amplio espectro como bacilos gram negativos que responden adecuadamente a carbapenémicos; sin embargo, algunos de estos producen carbapenemasas y requieren de colistina o tigeciclina para su eliminación.4,5,6
Sepsis en pacientes neutropénicos
La sepsis y el shock séptico (SS) son causas mayores de mortalidad durante la NF en los pacientes con hemopatías malignas. Sin embargo, los criterios para su detección no están estandarizados pues la mayor parte de los estudios no utilizan definiciones uniformes para detectarla y tratarla. Otras razones que dificultan encontrar uniformidad de criterios es la inclusión de pacientes no neutropénicos así como el enfoque de la sepsis en distintos subgrupos.6,8,11
La incidencia de la sepsis en estos pacientes varía desde 7 al 45 % de los casos con NF, según el estudio y el año de publicación; sin embargo, se considera que estas situaciones son causas más frecuentes de ingreso en unidades de cuidados intensivos así como de mortalidad.5,6,8
Por todas estas razones, actualmente existe gran interés en optimizar las herramientas de pesquisa, diagnóstico precoz y tratamiento, de manera que los resultados en materia de supervivencia sean cada vez mejores, teniendo en cuenta que el patrón de respuesta clínica e inmunológica en estos pacientes ante la infección se encuentra considerablemente modificado, por lo que constituye un elemento importante a tener en cuenta y que lo convierte en una situación de excepcional interés al enfocar su manejo.
La más reciente definición para sepsis (Sepsis-3, 2016) describe el término como “una disfunción orgánica potencialmente mortal causada por una respuesta desregulada del huésped a la infección”. Esta nueva definición implica una respuesta no homeostática del huésped a la infección e incluye el concepto de disfunción orgánica, lo cual implica gravedad, necesidad de diagnóstico y manejo precoz y convierte en superfluo el término “sepsis grave”.17
Las herramientas que se recomiendan en este consenso para su diagnóstico contienen la escala de qSOFA (del inglés, quick Sepsis-Related Organ Failure Assessment) que incluye: evaluación de la frecuencia respiratoria, alteraciones del sensorio y los valores de la tensión arterial sistólica; y la escala SOFA (del inglés, Sepsis-Related Organ Failure Assessment) que incluye: evaluación de la relación entre la presión arterial de oxígeno y la fracción inspirada, recuento de plaquetas, cifras de bilirrubina, presión arterial media (PAM) o su manejo, escala de coma de Glasgow, valores de creatinina expresados en mg/dL y el gasto urinario.17,18
Sin embargo, en pacientes oncohematológicos con NF, estas escalas diagnósticas pueden tener varias restricciones, si se tiene en cuenta que el estado mental puede cambiar independientemente de la presencia y gravedad de la sepsis por características propias de la enfermedad de base y de su tratamiento de soporte y específico, lo cual dificulta en gran medida la evaluación; que los síntomas asociados a la infiltración tumoral pueden causar déficits neurológicos; a su vez el recuento plaquetario no debe utilizarse debido a la trombocitopenia inducida por quimioterapia y que la alteración de las cifras de bilirrubina y creatinina debido a la quimioterapia pueden afectar el cálculo de la escala.8
La ventaja de estos nuevos conceptos con respecto a los anteriores, radica sobre todo en la alta especificidad de los primeros versus la gran sensibilidad de los segundos. Sin embargo, ante los episodios de NF, independientemente del resultado de estas escalas, se debe tener en cuenta que la neutropenia per se, es un factor de riesgo independiente de la infección y la bacteriemia, por lo que debe considerase a todo paciente febril como potencialmente séptico; teniendo en cuenta por supuesto, la evaluación clínica y de laboratorio como indicadores.8,11,17
Los criterios para definir la ocurrencia de SS incluyen: hipotensión, requerimiento sostenido de vasopresores para mantener una PAM ≥ 65 mmHg y un nivel de lactato sérico mayor de 2 mmol/L.16,17
El desarrollo de SS en la NF es altamente predictivo e independiente de la presencia de: neumonía, taquipnea, niveles elevados de procalcitonina (≥ 1.5 ng/mL) y de lactato (> 3 mmol/L), decrecimiento en los niveles de bicarbonato (< 17 mmol/L), antitrombina (< 70 %), y del factor VIIa (< 0.8 ng/mL). Un índice MASCC ≥ 21 puntos también está asociado a incremento del SS en NF.11,16
Con respecto al tratamiento de la sepsis y el SS en la NF, se consideran 5 objetivos fundamentales que deben cumplimentarse en la primera hora de inicio del episodio febril son:
medición de niveles de lactato,
realización de cultivos sanguíneos,
administración de antimicrobianos de amplio espectro
administración de fluidoterapia
valoración de vasopresores para mantener la TA en pacientes con sospecha de hipotensión debida a SS.11
Se recomienda que a los pacientes con signos y síntomas de infección se les realice diariamente monitoreo para sepsis y SS y, que en situaciones de alta sospecha pero sin evidencias clínicas concluyentes sean admitidos precozmente en la unidad de cuidados intensivos, donde diariamente se realizarán evaluaciones entre oncohematólogos e intensivistas para conformar los planes de tratamiento de manera personalizada y multidisciplinaria.19,20
Con respecto al resto de los componentes del manejo, no existen evidencias de que los pacientes con NF y sepsis o SS deban tratarse de manera diferente a pacientes no neutropénicos en estas circunstancias.8,11,17
El abordaje integral de la NF incluye además de una evaluación clínica y humoral exquisita, la aplicación de herramientas pronósticas para la estratificación de riesgo de cada paciente. El tratamiento de los pacientes con NF debe comenzar en la primera hora de haberse documentado la fiebre, debido a que las infecciones pueden progresar rápidamente con un alto riesgo de desarrollo de sepsis, inestabilidad hemodinámica y disfunción multiorgánica.