Introducción
Las reacciones adversas a medicamentos (RAM) se definen como una respuesta nociva y no intencionada, que se produce con la administración de la dosis de un medicamento, para prevenir, diagnosticar, tratar una enfermedad o modificar cualquier función fisiológica. La existencia de una asociación causal entre la administración del fármaco y la ocurrencia del efecto indeseado es requisito necesario para tal clasificación, en la cual se excluye la sobredosis de medicamentos.1
Un acontecimiento o evento adverso (EA) es todo suceso médico desafortunado y perjudicial, que puede presentarse durante el uso de un medicamento, pero no tiene necesariamente una relación causal con el tratamiento, característica que lo diferencia de la RAM.1
El subregistro de RAM es un problema común y más acentuado con los medicamentos que se prescriben en oncología. La percepción del riesgo y beneficio del tratamiento por los médicos suele ser condicionada por la severidad clínica y el pronóstico de la enfermedad a tratar. Teniendo en cuenta que los pacientes con cáncer son considerados en su mayoría de alto riesgo y los tratamientos provocan EA, el umbral para el reporte espontáneo de las RAM es bajo.
La enfermedad maligna más frecuente en la infancia es la leucemia linfoide aguda (LLA) que constituye el 80 % de las leucemias.2 Según las características clínicas y biológicas de la enfermedad y la respuesta al tratamiento inicial, los pacientes se clasifican en tres grupos pronósticos: riesgo bajo o estándar, riesgo intermedio y riesgo alto.3) La asignación del tratamiento con base al riesgo es una estrategia terapéutica importante que permite prescribir a los pacientes con un riesgo bajo o estándar un esquema terapéutico menos intensivo.4
El tratamiento comprende tres fases: la inducción a la remisión, la consolidación o intensificación y el mantenimiento. En la fase de inducción se inicia la poliquimioterapia cuyo objetivo principal es lograr la remisión completa inicial de la enfermedad. Este periodo tiene una duración de cuatro a cinco semanas y se combinan fármacos tales como vincristina, corticosteroides (prednisona, prednisolona o dexametasona), asparaginasa y una antraciclina (doxorrubicina o daunorrubicina).4,5) La terapia dirigida al sistema nervioso central se administra en las tres fases.
En Cuba desde del año 2002, dirigido por el Instituto de Hematología e Inmunología (IHI), se aplica a los niños mayores de un añoel protocolo de tratamiento del grupo cooperativo ALLIC (Acute Lymphoblastic Leukemia Intercontinental)-BFM (Berlín-Frankfurt-Munster). En 2012 se adoptaron los cambios realizados por el grupo ALLIC-BFM al protocolo de tratamiento en el año 2009.6
El objetivo del presente trabajo es describir los eventos adversos y las reacciones adversas que se presentan durante el tratamiento de inducción, en niños con leucemia linfoide aguda atendidos en el Instituto de Hematología e Inmunología de Cuba, en el periodo comprendido entre 2012 y 2017.
Métodos
Estudio observacional, descriptivo, transversal, de series de casos en fármacovigilancia, que utilizó la fármacovigilancia activa. Se incluyó el universo de pacientes entre uno y 18 años de edad con LLA, confirmada mediante los estudios morfológicos y de citometría de flujo, que fueron expuestos a la fase de inducción del protocolo de tratamiento ALLIC-BFM-2009 en el IHI de Cuba entre el 1ero de enero de 2012 y el 31 de diciembre de 2017. Variables: sexo, grupo pronóstico, semana de tratamiento, presencia y tipo de EA, sistema de órganos afectado, imputabilidad y severidad de las RAM.
Se considera como acontecimientos o eventos adversos a todo suceso médico desafortunado y perjudicial, que puede presentarse durante el uso de un medicamento, pero no tiene necesariamente una relación causal con ese tratamiento. Esto sucede en el caso de la presente investigación donde se presentan manifestaciones hematológicas que pueden ser propias de la enfermedad y del objetivo del tratamiento.
La agrupación de los EA según los sistemas de órganos se realizó acorde a la terminología declarada en el diccionario de términos de reacciones adversas de la Organización Mundial de la Salud.7) Para el análisis de imputabilidad se utilizó el algoritmo de Karch y Lagsana,8 el cual fue realizado por un grupo de cinco especialistas con experiencia en farmacovigilancia y hematología. Los EA que al aplicar el algoritmo se clasificaron como RAM graves o mortales fueron objeto de una segunda revisión de la historia clínica con el propósito de recabar la información necesaria para realizar la descripción de las mismas.
Se utilizaron como fuentes de información, el registro nacional del protocolo ALLIC-BFM 2009, del cual se obtuvo el número de historia clínica de los niños tratados en el periodo de estudio y la historia clínica, de la que se obtuvieron datos referentes a: edad, sexo, grupo pronóstico, signos, síntomas, alteraciones de parámetros de laboratorio, que registraron los médicos de asistencia y el personal de enfermería en las evoluciones clínicas durante el período de administración de medicamentos descritos en el protocolo ALLIC-BFM 2009 para la fase de inducción, fecha de inicio de cada EA para su posterior agrupación por semana de tratamiento.
De acuerdo con el protocolo utilizado, los pacientes se agrupan según los factores pronósticos en riesgo estándar, intermedio y alto. Para el presente estudio se agruparon en riesgo estándar e intermedio-alto, ya que estos últimos en el periodo de inducción reciben igual esquema de tratamiento. Se consideró la presencia de anemia como EA cuando el valor de hemoglobina fue inferior a 80 g/L, aunque no existiera repercusión clínica. La información se resumió en porcentajes y media aritmética.
Aspectos éticos
La investigación fue aprobada por el Comité de Ética de la Investigación y el Consejo científico del IHI. No se realizó entrevista directa a los pacientes, solo se obtuvo el número de historia clínica el cual no es declarado en reportes o publicaciones derivadas de la investigación.
Limitaciones del estudio
La fuente de información utilizada pudo provocar el subregistro de algún tipo de EA debido a que el paciente o el familiar olvidó, referir el mismo, al médico o al personal de enfermería durante las entrevistas y exámenes físicos que los profesionales realizan como parte de la atención; situación que no ocurrió con los EA cuya detección dependió de los parámetros de laboratorio.
El esquema de tratamiento durante la etapa de inducción comprende la administración de una combinación de fármacos tales como vincristina, corticosteroides (prednisona, prednisolona o dexametasona), asparaginasa y una antraciclina (doxorrubicina o daunorrubicina). La terapia dirigida al sistema nervioso central se administra en las tres fases. Este esquema de poliquimioterapia limitó la adjudicación de RAM a fármacos de manera independiente, sino que se evaluó como reacciones a los fármacos contemplados en el esquema.
Resultados
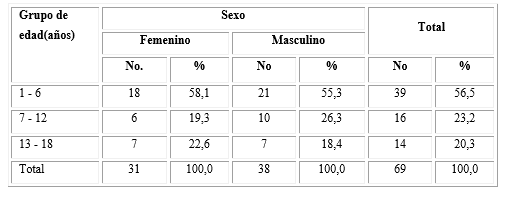
Se incluyeron 69 niños con el diagnóstico de la leucemia linfoide aguda, de ellos el 55,1 % (38 pacientes) perteneció al sexo masculino. El mayor porcentaje se encontró en el grupo comprendido entre 1-6 años (56,5 %; n= 39); en ambos sexos, este grupo de edad representó más de 55 % de los casos (Tabla 1).
El 100 % de los pacientes presentó al menos un EA. Se registraron un total de 471 EA. El promedio de eventos por pacientes fue 6,8. Cifra similar en ambos sexos: 6,7 eventos por paciente masculino (217 EA) y 7 eventos por paciente femenino (254 EA).
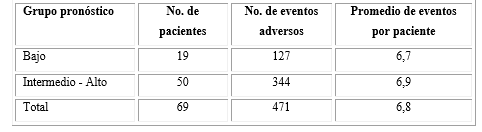
El promedio de eventos adversos en los diferentes grupos pronósticos fue similar (6,7 en el grupo bajo o estándar y 6,9 en el intermedio y alto (Tabla 2).
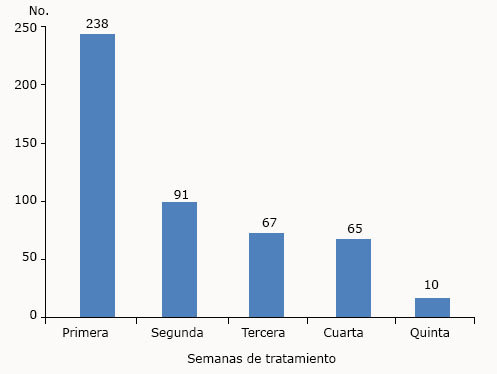
El 51 % de los eventos (238 EA) ocurrieron en la primera semana. Se constató una disminución en el transcurso del periodo de tratamiento. En la quinta semana se reportó 2,1 % del total de EA (10 eventos) (Fig. 1).
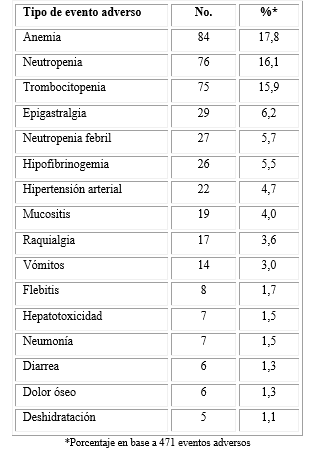
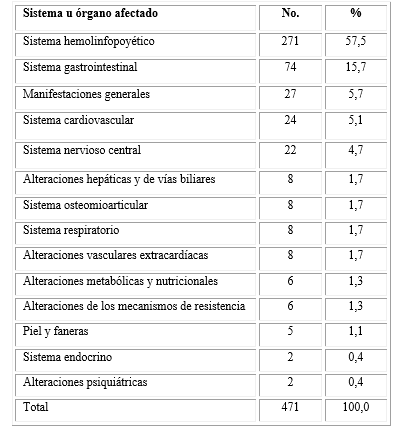
Se identificaron 41 tipos diferentes de EA, aproximadamente el 50 % se correspondió con alteraciones hematológicas. Los eventos con un porcentaje de ocurrencia superior al 1% se presentan en la tabla 3.
En el sistema hemolinfopoyético se agruparon más del 50 % de los eventos (n=271; 57,5 %), seguido de las alteraciones gastrointestinales (n= 74; 15,7 %), el general (n= 27; 5,7 %) y el sistema cardiovascular (n= 24; 5,1 %). En el resto de los sistemas y órganos se concentraron el 15,9 % de los eventos (Tabla 4).
El análisis de imputabilidad de los 471 EA arrojó 457 RAM, de ellas se clasificaron 456 en posibles (93,2 % del total de EA analizados) y una condicional (0,2 % del total de EA analizados). Un total de 31 EA se clasificaron como no relacionados (6,6 %).
La RAM condicional fue un episodio de convulsión que se presentó en la segunda semana de tratamiento luego de la administración de la daunorubicina. Este tipo de RAM no está descrito para este medicamento. Se descartó la infiltración leucémica y hemorragia del sistema nervioso central y se mantuvo en estricta observación durante el tratamiento con anticonvulsivantes.
No existieron eventos clasificados como RAM definitivas, ni probables ya que, al aplicar el algoritmo, a pesar de existir una secuencia temporal y ser RAM conocidas, había una causa alternativa que lo justificaba y no se suspendió ningún medicamento del esquema de tratamiento, por lo que no se pudo comprobar el criterio de reexposición.
Los 31 EA no relacionados se agrupan en seis tipos diferentes: raquialgia, flebitis, meningoencefalitis bacteriana, trombosis venosa profunda, dermatitis y colecistitis. La mayoría de ellos estuvo en relación con procederes invasivos como punción lumbar (raquialgia, meningoencefalitis bacteriana), las venipunturas (flebitis), y abordaje venoso profundo (trombosis venosa profunda). Estos son eventos que se describen como complicaciones de los procederes y se les informa de forma previa a los familiares mediante el consentimiento informado. Tres pacientes presentaron dermatitis en relación con el uso de pañales desechables y una paciente un cuadro de colecistitis por múltiples litiasis, que existían previos al diagnóstico de la leucemia linfoide aguda.
En la clasificación de las RAM según severidad existió predominio de las moderadas (331 RAM, 72,4 %) seguida de las graves (125 RAM, 27,4 %) y una mortal (0,2 %).
En el caso de las 125 RAM clasificadas como graves, el motivo que condicionó la gravedad en 123 casos fue la condición de poner en peligro la vida del paciente y en dos casos se conjugaron los criterios de peligro a la vida del paciente y la prolongación de la estadía hospitalaria, específicamente estas RAM fueron fascitis necrotizante y artritis séptica. Los dos casos correspondieron a pacientes femeninas sin la presencia de puerta de entrada y se concluyó la vía de contaminación por diseminación hematógena, con aislamiento de Pseudomona aeruginosa en los cultivos microbiológicos. Las dos niñas recibieron antibioticoterapia de amplio espectro y múltiples intervenciones quirúrgicas, causa por lo cual se extendió el periodo de hospitalización.
La RAM mortal ocurrió en un niño de dos años de edad, perteneciente al grupo pronóstico intermedio, que presentó un episodio de neutropenia febril de alto riesgo sin focalización y sin respuesta a los antibióticos en la tercera semana de tratamiento. Este cuadro evolucionó a un shock séptico y el paciente falleció con un fallo múltiple de órganos antes de alcanzar la remisión hematológica.
Discusión
La incidencia de leucemia linfoide aguda en niños de dos a tres años de edad es aproximadamente diez veces mayor que en adolescentes de 16 a 21 años.5,9) Villabalba y otros. reportaron en una serie de casos de pacientes pediátricos con LLA, como edad promedio 3,9 años y 66 % en el intervalo entre 2 y 6 años,10 lo que concuerda con la presente investigación.
En el año 2014, Stary y otros, publicaron el resultado de la aplicación del protocolo internacional ALLIC-BFM-2002, en el que de 5 060 pacientes, el 51,9 % pertenece al rango de edad de 1-6 años, con predominio del sexo masculino (57,1 %).11) En Cuba en el mismo año los resultados de este protocolo obtienen datos similares en cuanto a los grupos etarios y el sexo.12
Respecto al esquema de tratamiento, la diferencia entre los grupos pronósticos está dada por la administración de dos dosis adicionales de daunorubicina en los grupos intermedio y alto, en comparación con los de riesgo bajo o estándar.13,14) Canan y otros, en el año 2017, con el protocolo ALLIC-BFM 2009 en niños, no reportan diferencias en el promedio de EA entre los grupos pronósticos,15) dato que coincide con la presente investigación.
La ocurrencia de la mayor cantidad de EA en la primera semana de tratamiento guarda relación con las manifestaciones clínicas iniciales de la enfermedad, la administración de altas dosis de esteroide y una punción intratecal con metotrexato que se realiza en ese periodo.
Varios autores señalan entre los síntomas más frecuentes al diagnóstico de LLA los relacionados con la infiltración medular como la anemia, la trombocitopenia y la neutropenia.5,16,17) Al final del tratamiento, en la quinta semana, la médula ósea comienza a recuperar la hematopoyesis normal y los eventos hematológicos comienzan a disminuir.
La anemia es un hallazgo frecuente en los pacientes oncológicos de manera general que produce un impacto negativo en la calidad de vida. Puede ser causado por el proceso oncológico propio, el uso de quimioterapia o ambos.17) La encuesta europea sobre anemia asociada a cáncer reporta que el 50,5 % de los pacientes con cáncer que reciben quimioterapia desarrollan anemia.18) Por su parte, la neutropenia y la trombocitopenia constituyen también problemas comunes en los pacientes con cáncer que limitan la dosis y la frecuencia de la quimioterapia.19)
El grupo ALLIC-BFM en estudio sobre toxicidad hematológica, durante la inducción de la LLA, en niños encuentra la presencia de neutropenia en el 60 % de los casos, trombocitopenia en el 51 % y anemia con repercusión clínica en el 34 %.20 Estos resultados son similares a lo encontrado en la presente investigación, aunque con diferencias en el porcentaje que representa la anemia, lo que puede estar relacionado en la forma de contabilizar este evento.
La hipofibrinogenemia es un EA hematológico poco frecuente pero bien conocido en el contexto de las leucemias agudas. Generalmente, se asocia a la presencia de una coagulación intravascular diseminada en el debut de la enfermedad, aunque pueden existir otras causas, como el daño hepático, el empleo de L-asparaginasa y esteroides.21
La epigastralgia, síntoma de la dispepsia, no se reporta como frecuente con el uso de citostáticos, aunque si con la asociación de altas dosis de esteroides por tiempo prolongado.22) Cihan y otros, reportan en pacientes con LLA que reciben tratamiento en la fase de inducción, la existencia de posible asociación entre la ocurrencia de EA por esteroides y las alteraciones del gen del receptor GC (NR3C1),23) dato que resulta de interés para la individualización de los tratamientos con el objetivo de disminuir los EA.
Aproximadamente un tercio de los niños con leucemia bajo tratamiento médico desarrollan fiebre durante el período neutropénico. La fiebre en el contexto de neutropenia secundaria a mielosupresión por citostáticos es una complicación que puede amenazar la vida y requiere de atención inmediata. Unido a ello, en este grupo de pacientes existe un riesgo elevado para desarrollar enfermedades bacterianas invasoras en las cuales la fiebre puede ser el único indicador de la enfermedad bacteriana grave.24)
Una investigación en China en el año 2015 sobre las infecciones durante el periodo de inducción en niños con LLA, registra en 256 niños un total de 65 episodios de fiebre y 30 de ellos (46,2 %) se corresponden a neutropenia febril.25) Inaba y otros consideran que la neutropenia febril es un evento frecuente del tratamiento mielosupresor en pacientes con LLA, con un riesgo mayor durante el periodo de inducción y la reinducción.26
Durante el tratamiento con quimioterapia todos los órganos se pueden afectar debido amplio espectro de toxicidad de los fármacos utilizados. El daño depende de la tasa de células en división o replicación de cada sistema, por tanto, más efectiva y a la vez más tóxica en aquellas que tienen el mayor índice proliferativo (médula ósea y tracto gastrointestinal).16
León y cols. plantean que el sistema hemolinfopoyético es de los más afectados en pacientes que reciben quimioterapia, al punto de agravar el cuadro clínico del paciente y en ocasiones precipitar la muerte.27) Esto conlleva en ocasiones a suspender el tratamiento y buscar alternativas sustitutivas como la transfusión de concentrados de eritrocitos, plaquetas y leucocitos.
Las alteraciones digestivas, aunque reversibles, pueden deteriorar el estado nutricional del paciente. Los fármacos utilizados en la etapa de inducción (vincristina y daunorubicina) presentan una capacitad emetizante en el 40 % de los pacientes.28) Sin embargo, no fue el evento más frecuente en este estudio, en opinión de los autores, debido al seguimiento estricto de los protocolos de prevención de la emesis.
Una alta proporción de pacientes con cáncer durante la administración de la quimioterapia desarrollan alteraciones de la mucosa gastrointestinal, tales como infecciones (bacterianas, virales y micóticas) y mucositis oral. En ese periodo se produce un daño microvascular, desregulación de la expresión de citocinas inflamatorias, reacción de la matriz extracelular e interacciones con la flora microbiana de la cavidad bucal. La mucositis tiene una prevalencia entre 40 a 76 % en los pacientes que se encuentran en quimioterapia.29
Juárez y cols. reportan que la mayor frecuencia y gravedad de las alteraciones bucodentales se presentan durante la fase de inducción del tratamiento de la LLA, con implicaciones en la alimentación y la salud integral de los niños.30 Dentro de los fármacos, incluidos en esta fase de tratamiento, que provocan el mayor daño en la cavidad oral se encuentran las antraciclinas.31,32
Las reacciones adversas a medicamentos clasificadas como posibles en el presente estudio con una secuencia temporal razonable con la administración de los medicamentos, se encuentran descritas para los fármacos utilizados32 y existían causas alternativas que pueden explicar la ocurrencia de las manifestaciones, como la enfermedad de base de los pacientes.
Respecto a la gravedad, las RAM moderadas y graves ocurridas se describen en el perfil de seguridad de los medicamentos utilizados.32,33) Kim y otros, reportan en pacientes con neutropenia febril una frecuencia de infección por Pseudomona aeruginosa del 30 % de foco respiratorio y 20 % en piel y mucosas.34) Unido a ello, se conoce que la internación prolongada afecta negativamente la calidad de vida de los pacientes con enfermedades oncológicas, además de aumentar el riesgo de morbilidad y los costos de la enfermedad.35
El grupo ALLIC-BFM reporta un 2,8 % de mortalidad en la fase de inducción a consecuencia de infecciones, sangramientos y refractariedad al tratamiento.11) En Colombia un estudio de caracterización de la leucemia en niños, reportacomo causa de muerte en sus casos las complicaciones infecciosas.10) Maaz y otros, reportan en Paquistán 25,9 % (21/81) de mortalidad durante la etapa de inducción en LLA.36 En 20 fallecidos la causa de muerte se relaciona con procesos infecciosos.
La totalidad de los casos presentó eventos adversos, predominaron las alteraciones hematológicas y los eventos reportados para fármacos incluidos en la quimioterapia. Se identificaron reacciones adversas clasificadas como posibles, con predominio de las moderadas y graves. La temática de farmacovigilancia en oncología, fundamentalmente en niños, mantiene abierto el camino para incrementar las investigaciones tanto a nivel de hospitales como en un contexto nacional o en redes internacionales.