Introducción
Desde el punto de vista clínico, la leucemia promielocítica (LPM) representa una urgencia médica con alta mortalidad por hemorragia, coagulación intravascular diseminada (CID) y fibrinólisis. No obstante, con el tratamiento oportuno y específico, puede lograrse la remisión de la enfermedad con una sobrevida prolongada y posible curación de la misma.1,2
Hasta finales de la década de los ochenta, era considerada como la forma más temible y mortal de las LMA, pero con la introducción de nuevos métodos de diagnóstico y tratamiento se convirtió en el subgrupo de mayor tasa de remisiones completas y curaciones. Entre los elementos fundamentales se citan la identificación de una aberración cromosómica específica en más de 95 % de los pacientes, dada por la t(15,17) y el gen de fusión PML-RARα, así como también la introducción de un inductor de la maduración celular, el ácido trans-retinoico (ATRA), en el tratamiento de quienes la padecen.3,4
En los últimos 25 - 30 años se ha propuesto el tratamiento de la LPM con ATRA. El ATRA permite lograr la remisión tanto al inicio de la enfermedad como lograr una nueva remisión en aquellos pacientes, que de manera previa, habían logrado remisión completa con quimioterapia y tenían recaída.5
En el año 1997, investigadores chinos destacaron la eficacia del trióxido de arsénico (TOA) para lograr una nueva remisión en enfermos que presentaban una recaída, ellos alcanzaron una nueva remisión en 14 de 15 pacientes adultos con LPM con la utilización del TOA en infusión endovenosa a razón de 10 mg/día.6
Del mismo modo, múltiples estudios demostraron la eficacia en el rescate de dichos pacientes, al comprobar la eficacia del TOA en el tratamiento de la LPM en recaída o resistente al ATRA.7,8
Por otra parte, varios grupos utilizaron el TOA como droga de primera línea en el tratamiento de pacientes con LPM al inicio de la enfermedad, ya sea como medicamento único, asociado al ATRA, a una antraciclina, a ambos, o junto con anticuerpos monoclonales. Con estos esquemas de tratamiento reportaron tasas de remisión hematológica entre 80 y 100 % logradas entre los 28 y 42 días de iniciado el tratamiento.9
La acción del TOA sobre el promielocito leucémico no es citotóxica, sino que por diferentes mecanismos afecta numerosas vías de señales de transducción intracelular y de esta forma altera la función de las células e inducen a su apoptosis. También degrada la proteína de fusión producto del gen PML/RARα, la cual ocasiona el bloqueo de los genes responsables de la diferenciación mieloide. Por otra parte, el TOA a concentraciones menores induce la diferenciación celular.9,10
Estudios aleatorios en Italia y Reino Unido, demostraron que en pacientes con LPM de bajo riesgo, la combinación de TOA y ATRA es superior al tratamiento estándar con ATRA y antraciclinas.11,12
En el año 2000, el Instituto de Hematología e Inmunología (IHI) comenzó a utilizar el TOA de producción cubana, en pacientes que tenían recaída y con ello se logró una nueva remisión hematológica de la enfermedad en 8 de los 10 enfermos tratados,13En el año 2007 se confeccionó el protocolo LPM - TOA para el tratamiento de la enfermedad en el que se utilizaba el TOA como droga de primera línea en el tratamiento desde el inicio de la enfermedad. De esta forma Cuba se puso al nivel de los países más desarrollados y a la cabeza de los países latinoamericanos, al ser uno de los países pioneros a nivel mundial en el uso del TOA como droga de primera línea en el tratamiento de pacientes con LPM y con excelentes resultados.14
Es conocida la hepatotoxicidad de las antraciclinas y de los componentes arsenicales, que puede presentarse de forma inmediata, mediata y tardía, y ser de carácter irreversible, con consecuencias a mediano y largo plazo que pueden comprometer la vida del paciente. En el protocolo LPM -TOA, estos dos grupos de medicamentos son utilizados en el manejo de los pacientes y a mediano plazo, desde el punto de vista clínico los enfermos no han presentado sintomatología hepática de importancia.
Teniendo en cuenta el efecto hepatotóxico de las antraciclinas y de los compuestos arsenicales se decidió evaluar la toxicidad hepática tardía en pacientes adultos con LPM tratados según el protocolo LPM-TOA.
Métodos
Se realizó un estudio longitudinal prospectivo en el Instituto de Hematología e Inmunología (IHI), en el período comprendido entre julio de 2017 y julio de 2019, en el que se realizaron estudios enzimáticos a pacientes con LPM tratados con el protocolo LPM-TOA, con dos años o más de haber recibido el tratamiento.
El universo estuvo constituido por 53 pacientes mayores de 18 años de edad, de ambos sexos con diagnóstico clínico, morfológico y molecular de LPM tratados con el protocolo LPM-TOA, con dos años o más de haber concluido el tratamiento, seguimiento en consulta externa y que manifestaron estar de acuerdo en participar en la investigación a través de consentimiento informado. Se excluyeron aquellos pacientes fallecidos.
La muestra estuvo constituida por 20 pacientes seleccionados por muestreo no probabilístico, según criterio del investigador.
Las fuentes de información secundarias fueron la historia clínica general y la microhistoria. La información se resumió en una planilla de recolección de datos, que constituyó la fuente primaria. Luego dicha información se vertió en una base de datos utilizando el Microsoft Office Excel 2010 y se procesó por medios y métodos computarizados. El investigador fue el responsable del llenado de la documentación con el máximo de calidad y fidelidad de la información. Toda la información fue revisada y clasificada para ser sometida después a las distintas etapas de análisis estadísticos.
Se utilizaron los métodos propios de la estadística descriptiva utilizando como estadígrafos la determinación de frecuencias absolutas y relativas como porcentajes, la media y desviación estándar. El tratamiento estadístico se realizó utilizando el paquete estadístico SPSS versión 20.0 para Windows.
Atendiendo al valor que tiene para predecir evolución a la cronicidad en las enfermedades del hígado se calculó el índice de Ritis, que consiste en la razón entre los niveles de TGO/TGP.15
Se parte de que la TGP es una enzima que se encuentra toda en el citoplasma y la TGO solo el 60%, mientras que el 40% se encuentra dentro de los organelos citoplasmáticos. Una elevación superior de la TGP sobre la TGO con índice menor que 1 indica enfermedad hepática aguda con tratamiento, y al contrario una elevación superior de la TGO respecto a la TGP con índice superior a 2, indica mayor probabilidad de evolución a la cronicidad al ser expresión de un daño más profundo en el hepatocito. El índice entre 1 y 2 tiene menor valor. Además, se prefijaron los valores de R entre 0 y 1 y en la medida que estén más cercanos a 1 la predicción fue mayor, en los casos más cercanos al 0 se expresa que el valor de las enzimas al inicio no permite predecir su valor evolutivo. Como elemento final el valor p superior a 0,05.
Fueron considerados los principios expuestos en la declaración de Helsinki del año 2013, basado en estos, el investigador tuvo en cuenta el respeto a las personas encuestadas. Se les solicito su colaboración a través del consentimiento informado, considerando su autonomía y se cuidó la confidencialidad de la información aportada, además del compromiso de honestidad y respeto a la veracidad de los resultados de la investigación.
Resultados
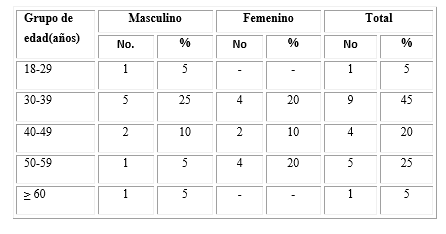
Se incluyeron 20 pacientes con edades comprendidas entre 19 y 62 años, agrupados en cinco grupos de edad (Tabla 1). El grupo más representado fue entre 30 y 39 años con nueve enfermos. El sexo tuvo una distribución homogénea, 50 % el masculino y 50 % el femenino.
La variedad morfológica más frecuente fue la hipergranular, 18 pacientes, 90 % del total de los casos.
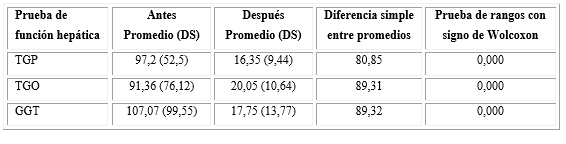
La función hepática inicial y evolutiva se muestra en la tabla 2.
Tabla 2 Estadísticos descriptivos de la función hepática inicial y evolutiva (n=20)

TGP: transaminasa glutámico pirúvica; TGO: transaminasa glutámico oxalacética, GGT: Gammaglutamiltransferasa
La tabla 3 muestra la función hepática de los pacientes antes y después de recibir el protocolo LPM-TOA. Los valores iniciales y evolutivos de las enzimas repetidas en el tiempo difieren. Este resultado que confirma la experiencia clínica de que el arsénico no deja secuelas de lesión hepática a largo plazo.
El promedio del índice de Ritis fue solo 1,006 con una desviación estándar de 0,745; lo que es coherente con menor probabilidad de evolución a la cronicidad del daño que se expresó al inicio del tratamiento (tabla 4).
Discusión
El tratamiento de la leucemia promielocítica con TOA está considerado como una muy buena alternativa terapéutica tanto para los pacientes con diagnóstico reciente como en el rescate de aquellos que presentan algún tipo de recaída de la enfermedad.16,17
En nuestra investigación la edad promedio para el sexo masculino fue de 36,39 ±14,02 años y para el sexo femenino 39 ±9,43. Predominó la enfermedad en los pacientes entre los 30-39 años; hallazgos que apoyan la mayor incidencia de la enfermedad en esta etapa de la vida, por otra parte, se aprecia un descenso luego de los 60 años. No obstante, la edad constituye un factor pronóstico relevante ya que los mayores de 60 años tienen peor evolución debido a comorbilidades frecuentes en esta etapa de la vida. De forma similar ocurrió con el sexo, de manera que no existió diferencia significativa y se correspondió con lo descrito por otros investigadores, quienes encontraron una distribución homogénea en hombres y mujeres.18,19
En cuanto a la variedad morfológica, la mayoría de los pacientes presentaron la variedad hipergranular. Varios autores han mostrado que el 96 % de los pacientes portadores de LPM presentaron una morfología hipergranular,20,21resultados similares a los de este estudio. Sin embargo, las dos formas, la hipergranular o clásica y la variante o microgranular, tienen el mismo significado diagnóstico.22
Miller y otros refirieron que la variante hipergranular está asociada con la t(15,17), que se caracteriza por presentarse con leucopenia y que representa más de 50 % del resto de las variantes,23resultados que concuerdan con los de esta serie.
El advenimiento del TOA en el manejo de la LPM ha aumentado la posibilidad de lograr la curación de los pacientes, tanto en la enfermedad de reciente diagnóstico como en el rescate de aquellos que presentan algún tipo de recaída; sin embargo, la gran toxicidad del arsénico es bien conocida. Según la literatura, las reacciones adversas hepáticas se observan con la elevación de transaminasas, fosfatasa alcalina, y bilirrubina entre 15 y 20 % de los pacientes, resultados similares a los de esta serie.24,25
En el estudio, en cuanto a la función hepática de los pacientes antes y después de recibir el protocolo LPM-TOA, se pudo observar que los valores iniciales y evolutivos de las enzimas hepáticas repetidas en el tiempo difieren, resultado que confirma la experiencia clínica de que el arsénico no deja secuelas de lesión hepática a largo plazo.
Campos-Cortés y otros reportaron un caso clínico de un hombre de 23 años de edad, con LPM y translocación t(15;17), que presentó recidiva molecular de la enfermedad que fue tratado con TOA, donde las reacciones adversas más frecuentes fueron la hiperleucocitosis (50,5%), alteraciones cardiovasculares (prolongación del intervalo QT, taquicardia ventricular y torsión de puntas) y elevación de las transaminasas, fosfatasa alcalina y bilirrubina (15 a 20 %).26No obstante, concluyeron que los pacientes con recidiva clínica de LPM tienen una elevada tasa de remisión-curación cuando reciben TOA como tratamiento, resultados similares a los de esta investigación.
Otros investigadores también exploraron la toxicidad hepática del TOA donde registraron que la hepatotoxicidad se presentó en 64,7 % de los enfermos y que solo fue expresada por el aumento de las enzimas hepáticas, las que se normalizaron antes de culminar el tratamiento y en ninguno de los pacientes fue preciso suspender el TOA,27resultados que concuerdan con los de esta investigación.
Del mismo modo Suárez Beyríes y otros, en estudio de tipo observacional, descriptivo y transversal con 17 adultos con LPM, con el fin de evaluar la eficacia del tratamiento de inducción con TOA, obtuvieron la remisión hematológica completa en 82,4 % de sus pacientes a los 42,2 días como promedio, y que las reacciones adversas que predominaron fueron la hepatotoxicidad y los dolores óseos, el aumento de las enzimas hepáticas se presentó en 44,7 %de los casos,28resultados similares a los de este estudio.
Niu y otros, mostraron que la hepatotoxicidad se presentó en 63,7% (7/11) de los pacientes tratados con TOA en primera línea, mientras que en los del grupo de pacientes refractarios al tratamiento con ATRA, se observó hepatotoxicidad en 15 de los 47 pacientes (32 %).29
Mathews y otros, en estudio realizado para demostrar que con el TOA utilizado en el tratamiento de la LPM de reciente diagnóstico,se obtenían remisiones prolongadas de la enfermedad con mínima toxicidad, encontraron que la hepatotoxicidad fue la reacción adversa más frecuente (33,3 %) y que 6,9 % de estos pacientes tuvieron que suspender el tratamiento por 18,2 días (rango 7-28 días)30como promedio, además se asoció la hepatotoxicidad a una mutación homocigótica del gen MTHFR A1298C vinculado al metabolismo del medicamento a nivel hepático, presente en el 60,3% de los casos.
En relación con el valor del índice de Ritis para predecir una evolución a la cronicidad en las enfermedades del hígado, los valores obtenidos permitieron concluir que los pacientes tienen menores probabilidades de evolución a la cronicidad que se expresó al inicio del tratamiento.
En la muestra estudiada no se detectaron signos de compromiso hepático, a pesar de que los pacientes recibieron según el protocolo LPM - TOA drogas hepatotóxicas durante el tratamiento. Esto pone de manifiesto que el cuidado en la evaluación hepática y monitoreo de la función hepática de forma sistemática durante la terapia garantiza la curación del enfermo sin secuelas hepáticas.
La edad, el sexo y la variedad morfológica que presentaron los pacientes se corresponde con lo reportado en la literatura nacional e internacional. En el grupo estudiado no hubo evidencias clínica ni enzimática de toxicidad hepática tardía por el arsénico administrado según el protocolo LPM - TOA, y el aumento de las enzimas hepáticas durante la fase de inducción no influyeron en la función hepática actual.