Introducción
El principio de exclusión competitiva, también conocida como ley o regla de Gause, es la consecuencia de que la selección natural opera sobre poblaciones que no se cruzan y que ocupan el mismo nicho ecológico.1 Según Darwin, la competencia será generalmente más severa entre las formas más similares entre sí en todos los aspectos. Así, dos especies en competencia biológica por los mismos recursos, no pueden coexistir de forma estable si todos los demás factores ecológicos permanecen constantes.2 Este concepto en ecología puede trasladarse al ámbito clínico, donde tras la infección por virus que afectan a un mismo huésped por vías de transmisión similares, uno de los competidores siempre dominará sobre el otro, llevándolo a la inhibición o modificación de su comportamiento en un determinado micronicho anatómico. Por lo tanto, los competidores totales no pueden coexistir o varias especies no pueden ocupar indefinidamente el mismo nicho ecológico.
De hecho, esta regla puede presentar excepciones, ya que se han descrito múltiples casos de coinfección viral y bacteriana en enfermedades respiratorias en huéspedes humanos.3 Sin embargo, estos eventos presentan ciertas condiciones y son en su mayoría raras respecto al común de infecciones. Así, cuando un germen se encuentra de manera concomitante con otro produciendo una infección en una determinada zona anatómica, por lo general su naturaleza biológica es distinta. Por ejemplo infecciones: hongo-bacteria, bacteria-virus, parásito-bacteria.4 Esto permite que no exista competencia por los mismos sustratos biológicos. A diferencia de lo que ocurre cuando dos microorganismos son de la misma o similar naturaleza y requerimientos nutricionales. En el caso de los virus, al depender exclusivamente de la célula huésped a la que infectan, el factor crítico de una coinfección será el tipo de célula para la que dos o más virus concomitantes poseen receptores.
La pandemia del COVID-19 presenta un escenario de alto riesgo para la transmisión de enfermedades respiratorias bacterianas y virales concomitantes. Se han notificado casos de coinfección durante el curso de la pandemia,5 con incremento en la morbimortalidad entre los afectados, y se tuvo temor de que tanto la influenza como la COVID-19 confluyeran en lo que se podría denominar una sindemia.6 Sin embargo, durante la última temporada de influenza en el hemisferio sur, se pudo apreciar la drástica reducción de los casos de gripe.7 Por su parte, en el hemisferio norte también se reportó dicho descenso de casos, producto de la pandemia por COVID-19.8 Por ello, el presente estudio propone comprender mejor el comportamiento de las infecciones respiratorias concomitantes en escenarios de brotes comunitarios y de forma individual en entornos hospitalarios e individuos con comorbilidades.
Métodos
La búsqueda y análisis de la información se realizó en un rango de tiempo personalizado (últimos cinco años), utilizando los descriptores Medical Subject Headings (MeSH) enlazados a términos libres: coinfection/virology, respiratory tract infections/virology, competitive exclusion, viral interference, defective viruses, SARS-CoV-2, pandemics.A partir de la información obtenida, se realizó la revisión bibliográfica de un total de 1359 artículos publicados en las bases de datos MEDLINE / PubMed, SciELO y LILACS, sin restricciones de idioma. También se consideraron los artículos de preimpresión publicados en medRxiv y los informes de los Centros para el Control y Prevención de Enfermedades de los EE.UU. Mediante el gestor de referencias “Mendeley Desktop 1.19.4”, se eliminaron los duplicados y aquellos que no se ajustaban al objetivo del estudio, seleccionando para la presente revisión 48 artículos.
Análisis y síntesis de la información
El viroma del aparato respiratorio: de la coexistencia a la exclusión competitiva
El viroma respiratorio humano, se define como los virus presentes en el tracto respiratorio que pueden infectar células humanas. La composición del viroma humano incluye virus que infectan estas células, elementos derivados de virus antiguos insertados en nuestros cromosomas y bacteriófagos que infectan una amplia gama de bacterias que nos habitan.9 En la última década, el desarrollo de ensayos moleculares sensibles e independientes del cultivo (reacción en cadena de la polimerasa y secuenciación de alto rendimiento), revelaron que además de los virus comunes que causan infecciones agudas y sintomáticas, el viroma incluye virus que no causan síntomas clínicos aparentes y tienen un efecto patogénico desconocido. Lo cierto es que cada vez se cuentan con mejores herramientas moleculares que permiten definir mejor el viroma y estudiar los efectos de las infecciones virales en la dinámica de las enfermedades pulmonares.10
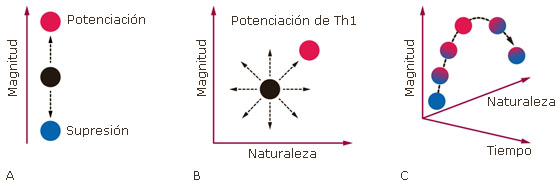
Los virus coexisten de forma natural en el tracto respiratorio. Este conocimiento ha permitido determinar la composición del viroma respiratorio humano. Estudios del viroma en sujetos sanos han descrito familias como Papillomaviridae, Polyomaviridae, Adenoviridae, Circoviridae y Parvoridae, además de Anelloviridae y Herpesviridae, como predominantes en piel y capas mucosas, y con prevalencias que dependen del origen de las muestras.11 En otras palabras, hay virus que infectan células del aparato respiratorio y que pueden coexistir de forma natural. Así, al ser los virus parásitos intracelulares obligados, no colonizan al huésped y requieren el uso constante de la maquinaria celular para su replicación. Pero eso sí, sin alterar o estimular significativamente una respuesta inflamatoria que motive su erradicación. Es posible que el viroma respiratorio incluya diversos virus comensales y patógenos, que pueden inducir o no una amplia gama de respuestas inmunes del huésped, mediante el desarrollo de inmunomodulación, es decir, la capacidad de aumentar o disminuir la respuesta inmune (Fig. 1).12
La presencia de un virus puede cambiar el estado cualitativo y cuantitativo de la inmunidad en múltiples dimensiones, alterando así la susceptibilidad a posteriores enfermedades inflamatorias o infecciones. En este sentido, durante la inmunopotenciación, un virus aumenta la magnitud de una respuesta posterior o disminuye el umbral necesario para provocar una determinada respuesta inmunitaria. Por el contrario, la inmunosupresión ocurre cuando el sistema inmunológico está comprometido y la magnitud de las respuestas posteriores disminuye (Fig. 1A. Así mismo, la presencia de un virus cambia el estado de inmunidad hacia una respuesta de células T helper (Th) más potente (Fig. 1B). Otro resultado común es el aumento sostenido de los niveles de interferón tipo I. Por último la inmunomodulación viral puede cambiar con el tiempo, volviendo ocasionalmente a los niveles basales, pero a menudo no hasta el punto original (Fig. 1C).12
 Nota: Figura adaptada y modificada a partir del artículo: The Virome in Host Health and Disease. Immunity. 2015;42(5):805-13.12
Nota: Figura adaptada y modificada a partir del artículo: The Virome in Host Health and Disease. Immunity. 2015;42(5):805-13.12
Fig. 1 Niveles de inmunomodulación viral: A) los virus pueden modificar la magnitud de la respuesta inmune del huésped, aumentándola (inmunopotenciación) o disminuyéndola (inmunosupresión); B) polarizándola hacia respuestas de células Th más potentes; C) o cambiando a lo largo del tiempo.
A parte de la inmunomodulación, el desequilibrio en la composición del microbioma que puede estar asociado con la patogenia, puede ocasionar disbiosis.13 A este desequilibrio en la composición específica de virus podemos definirlo como disbiosis viral, el cual podría ser un marcador de inflamación de las mucosas. En este sentido, se conoce que pacientes con enfermedad intestinal inflamatoria, muestran incremento en los distintos taxones de fagos intestinales, sobre todo los de ADN bicatenario pertenecientes al orden Caudovirales.14 Mientras que la disbiosis en el viroma pulmonar que incluye fagos y algunos virus animales, se ha observado en pacientes con fibrosis quística.15 Así, la alteración de las distintas proporciones de virus revela que, aunque pueden coexistir en un micronicho anatómico determinado, su número puede estar limitado por otro. Prueba de ello son los Anellovirus que infectan y persisten en casi todos los mamíferos, y representan una gran parte del viroma humano. Se replican continuamente sin dañar al huésped y por lo tanto, son un buen ejemplo de virus comensales que podrían influir en el desarrollo de otros virus, como el Torque teno virus (TTV) que interviene en el desarrollo y/o exacerbación de enfermedades respiratorias en la infancia.16
Los Anellovirus infectan de forma temprana y persistente al huésped humano, y la alteración de su proporción podría generarse por “disbiosis vírica” debido a infecciones por otros virus, como ocurre en la infección pulmonar grave por rinovirus humanos (RV) que, si se produce en los dos primeros años de vida, tiene una fuerte correlación con el desarrollo del asma.17 Mientras que en la etapa adulta, la infección por RV podría representar, más que un elemento deletéreo para el huésped humano, una barrera o mecanismo de defensa frente a patógenos respiratorios como el virus de la influenza. De hecho, un estudio reciente indica que un virus respiratorio puede bloquear la infección de otro estimulando las defensas antivirales en las mucosas respiratorias, lo cual apoyaría la idea de que la interferencia viral por RV interrumpió la pandemia de influenza en 2009 en Europa.18 Por lo tanto, la interferencia viral puede afectar potencialmente el curso de una epidemia, y esta posibilidad, según algunos estudios, puede considerarse al diseñar intervenciones para las epidemias de influenza estacional y la pandemia de COVID-19 en curso.18
Las partículas interferentes defectuosas como primera evidencia de interferencia intracelular en la cinética de crecimiento de los virus
La exclusión competitiva de virus de diferente naturaleza que comparten las mismas vías de transmisión, puede tomar mayor relevancia en el ámbito clínico, en condiciones naturales y en episodios de pandemia. Sin embargo, es preciso considerar que la exclusión competitiva no es un evento nuevo, sino que se desarrolla de manera natural durante el ciclo replicativo de los virus mediante la formación de partículas interferentes defectuosas (DIP).19
Las partículas interferentes defectuosas se generan por mutaciones espontáneas en una porción crítica del genoma viral, por lo que los virus pierden parte de su material genético (virus "incompletos"), que puede ser un gen esencial, como resultado de la replicación defectuosa, recombinación no homóloga y deleciones.20 Estas partículas interfieren en la función del virus estándar a través de la inhibición competitiva. Es decir, los virus defectuosos y no defectuosos compiten y se replican simultáneamente, lo que implica, que el aumento de las DIP disminuye la cantidad del virus con actividad patógena, manteniendo la respuesta inmune innata del huésped. De este modo, las DIP son la principal evidencia de que la exclusión competitiva entre partículas virales existe, y cuando dos o más virus intentan o logran infectar una misma célula, la eficacia de tal actividad estará sujeta a la disponibilidad de los elementos celulares para la replicación viral por parte de la célula, y a las características propias de los virus infectantes.20
Probable mecanismo de exclusión competitiva viral
A diferencia de los procariotas y levaduras, los virus no colonizan las superficies. Es decir, pueden estar presentes de manera transitoria o esporádica sobre superficies celulares en un determinado micronicho anatómico, pero no encontrarse en esta de manera permanente o persistente. Esto debido a su naturaleza de parásito intracelular obligado. Por ello, ante el ingreso de dos o más virus en una determinada región anatómica, como por ejemplo el aparato respiratorio, el primer requisito para el éxito de la infección, es encontrar una célula susceptible y permisiva. Si esta característica es compartida por más de un virus que en ese momento han ingresado en el huésped, dependerá de la efectividad de adsorción e integración de la partícula viral, la cual puede estar determinada en algunos casos, por el número de receptores, la necesidad de correceptores e incluso si el virus está envuelto o desnudo (Fig. 2).
Durante la primera etapa del ciclo replicativo viral, el ingreso es un punto importante a considerar en el que la exclusión competitiva depende de la afinidad y número de receptores. En este sentido, algunos virus tienen ciertas ventajas sobre otros, debido a la disponibilidad de sus receptores en la célula huésped. Por ejemplo, se ha descrito que los RV fueron responsables de la interrupción en el incremento de casos durante la pandemia de influenza en 2009 y una de las razones podría encontrarse en las características de sus receptores (Fig. 2A. Mientras que el virus influenza (IV) depende del ácido siálico presente en las células para su ingreso, los más de 160 tipos conocidos de RV, utilizan tres glicoproteínas de membrana celular diferentes expresadas en el epitelio respiratorio, la molécula de adhesión intercelular 1 (ICAM-1; utilizada por la mayoría de RV-A y todos los tipos de RV-B), el receptor de lipoproteínas de baja densidad (LDLR; utilizado por 12 tipos RV-A) y la proteína de transmembrana relacionado con la familia de cadherina 3 (CDHR3; utilizado por RV-C).21 De todas estas, ICAM-1 es la más empleada, y a diferencia del ácido siálico, puede modular su expresión tras la infección por los RV. De este modo, la sobre expresión de ICAM-1 y su caída pueden mejorar y bloquear respectivamente la producción de estos virus, incluso las vías respiratorias pueden dirigir y estimular la replicación significativa de ciertos RV como el RV16 en células monocíticas a través de un mecanismo dependiente de ICAM-1.22 De tal modo, que el tipo de receptor en este caso jugaría un rol importante en la exclusión competitiva ya que daría oportunidad al ingreso de un mayor número de partículas virales.
La envoltura de los Orthomyxovirus representa otro importante obstáculo que debe superar durante su ingreso, ya que atraviesan por dos pasos para liberar su material genético en la célula, la unión a un receptor y la fusión de las membranas viral y celular, un evento que no sufren los RV debido a su naturaleza de virus desnudo (Fig. 2B). El proceso de fusión, utiliza proteínas virales especializadas llamadas fusógenos, que promueven la fusión de membranas entre el virus y la célula. Los fusógenos virales experimentan cambios estructurales drásticos durante la fusión, liberando la energía necesaria para superar las fuerzas de repulsión que impiden la fusión espontánea de las dos membranas.23 En este caso, la hemaglutinina (HA) del IV media la interacción inicial del virus con el ácido siálico en la superficie celular. Después de esta unión, el virus es internalizado por endocitosis. La acidificación del endosoma por la fusión con lisosomas activa la HA para iniciar los cambios conformacionales. Sin embargo, este proceso requiere la cooperación entre varios fusógenos virales para la fusión de membranas y para la HA que se ve afectada positivamente por la densidad de proteínas, por lo que se estima que se requieren de cuatro a seis moléculas de HA para la fusión.24 Estos pasos adicionales requeridos por los virus con envoltura representan en sí mismos una barrera a superar y lo colocan en cierta desventaja si hay competencia frente a virus desnudos durante una infección concomitante.
 Nota: Figura diseñada por el autor en Biorender
Nota: Figura diseñada por el autor en BiorenderFig. 2 Probables mecanismos de exclusión competitiva viral: a) disponibilidad de receptores y correceptores, b) características de la partícula viral (virus desnudo, envuelto), c) host shutoff o cierre del hospedador, d) competencia por la maquinaria de replicación esencial, e) inmunidad antiviral por producción de IFN
Luego del ingreso de dos tipos distintos de partículas virales en una misma célula huésped, un segundo eslabón en la competencia viral estará determinada por la disponibilidad de la ARNpol, debido a que la primera actividad biosintética de todo virus es la transcripción de su genoma.25 En el caso de los virus de naturaleza ADN, la mayoría dependen exclusivamente de la célula huésped para su transcripción y por ello requieren competir con la propia maquinaria biosintética de la célula. Mientras que los virus ARN utilizan ARNpol dependiente de ARN, y dependiendo de la disposición de sus hebras ya sea en sentido positivo (puede traducir directamente proteínas) o sentido negativo (requiere pasos adicionales y empaquetar su propia ARNpol) es que uno tendrá ventaja sobre otro en caso de producir infecciones concomitantes.
Un evento conocido como host shutoff o cierre del hospedador, también representa un punto de exclusión frente a infecciones concomitantes. En este sentido, algunos virus respiratorios humanos pueden modificar la expresión de genes relacionados a la transcripción en el huésped durante la infección, con el objetivo de redirigir los recursos celulares hacia la expresión del gen viral e inhibir las respuestas inmunes intrínsecas de la célula huésped. Este evento puede incluir el cierre de la transcripción y traducción (Fig. 2c). Sin embargo, algunos virus pueden realizar host shutoff mediante la codificación de ribonucleasas (ARNasas) que degradan los ARN mensajeros (ARNm) del huésped.26 El virus respiratorio reconocido por presentar ARNasa de cierre del huésped viral, incluye la polimerasa ácida-X (PA-X) del virus de la influenza A (IAV) que modula la respuesta del huésped a la infección (fig. 2c)27 y BGLF5 en el virus de Epstein-Barr (EBV),28 que aunque ocasione principalmente mononucleosis infecciosa, su replicación en el aparato respiratorio podría involucrarse en mecanismos de exclusión competitiva.
Otro aspecto a considerar durante la infección de dos virus sobre una misma célula, es el tamaño de su genoma. Un genoma más corto puede presentar ventajas en su replicación respecto a genomas de virus más extensos. Este hecho ya ha sido descrito en las DIP, las cuales poseen una ventaja de replicación sobre los virus estándar, debido a la corta longitud de su genoma y a la mayor afinidad por la polimerasa viral (Fig. 2d).20 De este modo, los virus con genoma más largos y pasos adicionales en la replicación pueden tener desventajas durante infecciones concomitantes. Este evento podría explicar la probabilidad de inhibición competitiva por parte de los RV frente a los coronavirus que presentan genomas extensos, un hecho que en la práctica ya ha sido corroborado durante la actual pandemia.29 Así, la complejidad de la partícula viral puede ser un atributo que funciona a favor o en contra de la exclusión competitiva.20 Los virus con genomas más cortos se sintetizan más rápido, y por lo tanto, se acumulan más en la célula huésped (Fig. 2d). Lo que aún no se sabe hasta el momento, es si ciertos virus pueden mostrar una transcripción más rápida y una mayor afinidad por la polimerasa en escenarios competitivos, sin embargo, la posibilidad de que esto ocurra está latente, debido a que esto ya ha sido descrito en las DIP.20
Diferentes virus pueden tener fases de eclipse de variada duración. El período de eclipse se considera desde el momento en que un virus ingresa a la célula hasta que comienza a ensamblar su progenie y su consecuente liberación. La duración de este período varía entre las diferentes cepas de virus y afecta la cinética de la infección. Por ejemplo, en el caso del SARS-CoV podría tan solo durar entre siete y ocho horas,2 una ventaja evidente frente a los virus de la influenza que dependiendo de la cepa viral varían entre seis a 12 horas.2
Además, los virus pueden tener diferentes tiempos de incubación. Por ejemplo, el período medio de incubación considerado entre el inicio de la infección y la aparición de los síntomas, para el SARS-CoV-2 se estima en 5,7 (IC del 95 %, 5,1 a 6,4) días,30 mientras que el período de incubación para el IAV, virus de la influenza B (IBV), sarampión (MeV), parainfluenza (PIV), virus sincicial respiratorio (VSR) y RV es de 1,4 (IC del 95 %, 1,3 a 1,5); 0,6 (IC del 95 %, 0,5 a 0,6); 12,5 (IC del 95 %, 11,8 a 13,3); 2,6 (IC del 95 %, 2,1 a 3,1),;4,4 (IC del 95 %, 3,9 a 4,9) y 1,9 (IC del 95 %, 1,4 a 2,4) días, respectivamente.31 De este modo, los virus con períodos de incubación más cortos tendrían ventajas sobre el resto.
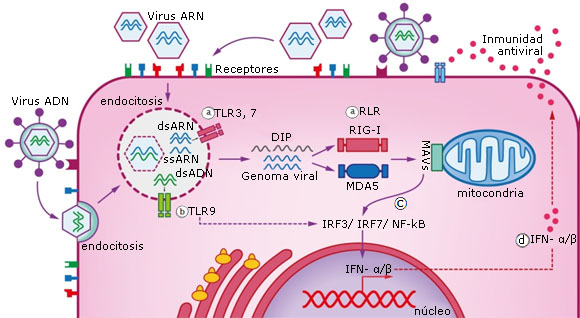
La respuesta inmune innata, también puede ejercer cierta restricción sobre alguno de los virus en competencia. Incluso un virus puede estimular la respuesta inmune que puede repercutir en el bloqueo del ingreso de otro (Fig. 2E y Fig. 3). Esto último se ha descrito en la infección producida por los RV tanto frente al virus influenza como frente al SARS-CoV-2, demostrando que los RV pueden desencadenar una respuesta de interferón (IFN) que bloquea la replicación de ambos virus.18,29 De este modo, la interferencia viral por la producción de IFN, sucederá en las células infectadas a través de los receptores TLR7 que reconocen ARN de cadena simple, TLR3 y receptores RLR (RIG-I, MDA5) que reconocen ARN de doble cadena (Fig. 3a) y TLR9 si se trata de un virus ADN (Fig. 3b).32,33
La señalización a través de la proteína adaptadora MAVS conduce a la activación y translocación de IRF3 y NFκB al núcleo (Fig. 3c). Estas moléculas estimulan la producción y secreción de IFN α/β qué actúan de manera autocrina o paracrina para producir ISG que inhiben la replicación viral (Fig. 3d).19,20 Debido a que la respuesta inmune innata solo posee cierto grado de especificidad denominada inmunidad entrenada que si precede a alguna infección podría bloquearla, los virus que poseen el mismo tipo de genoma o están relacionados podrían estimular de manera cruzada las respuestas inflamatorias innatas, de este modo bloquear la replicación del virus acompañante.
En base a la inmunidad entrenada, se especula que la vacuna BCG puede tener efectos inmunes beneficiosos no específicos de defensa frente a una amplia gama de otras infecciones y que la vacunación con BCG puede tener un papel en la protección de los trabajadores de la salud y otras personas vulnerables contra la enfermedad grave por COVID-19.34 Del mismo modo la vacunación frente al virus influenza podría inducir el mismo efecto.35 Por lo tanto, aunque el tiempo requerido para su inducción aún no se conoce, la infección previa por otro agente puede estimular la inmunidad innata contra otro virus. De existir la necesidad de hacer frente a este evento, algunos virus como el SARS-CoV-2, puede inducir respuestas manifiestas pero retardadas de IFN tipo I, mediante el uso de múltiples proteínas no estructurales (ORF3, ORF6) y proteína M que inhiben la activación del promotor de IFN-β Interfiriendo en muchos pasos de la respuesta innata.36 Lo cual le representa una ventaja si se encuentra en infección concomitante con otro virus que no tenga esta propiedad.
 Fuente: Figura adaptada y modificada a partir del artículo: Defective viral genomes are key drivers of the virus-host interaction. Nat Microbiol. 2019;4(7):1075-87.20
Fuente: Figura adaptada y modificada a partir del artículo: Defective viral genomes are key drivers of the virus-host interaction. Nat Microbiol. 2019;4(7):1075-87.20
Fig. 3 Interferencia viral por la producción de IFN. El ARN o ADN viral y los DIP son reconocidos por los sensores tipo Toll (TLR) y (RLR), induciendo así la producción de IFNα/β y otras citoquinas proinflamatorias en las células infectadas, que actúan de forma autocrina o paracrina inhibiendo así la replicación del otro virus competidor.
Por último, la estabilidad de la partícula viral es otro tema que debería considerarse, ya que los virus desnudos pueden tener mayor ventaja en términos de resistencia a los factores ambientales que los virus envueltos. Así, la luz solar y la temperatura favorecen la inactivación de ciertos patógenos virales, mientras que otros están mejor adaptados, como el enterovirus humano. Este virus es resistente a los ambientes cálidos, lo que también podría generar resistencia a la desinfección con cloro,37 gracias a su característica de virus desnudo. Por otro lado, virus como el de la influenza reducen su replicación viral frente a altas temperaturas.38 Mientras que en otros casos, las variables meteorológicas pueden estar asociadas a la actividad de virus respiratorios como el VSR, el cual, según estudio desarrollado en Bogotá, Colombia en población pediátrica, muestra mayor actividad en épocas de lluvia. De modo que, la precipitación y la temperatura son los dos principales parámetros meteorológicos que muestran una asociación independiente con la actividad del VSR en niños hospitalizados.39
Dinámica epidemiológica del enterovirus D68, sarampión e influenza durante la pandemia de COVID-19 como evidencia de la exclusión competitiva
La pandemia de la COVID-19 presenta un escenario de alto riesgo para la transmisión de enfermedades respiratorias bacterianas y virales concomitantes. Se han notificado casos de coinfección durante el curso de la pandemia, con incremento en la morbimortalidad entre los afectados, y se teme que tanto la gripe como la COVID-19 den lugar a un aumento del número de casos en lo que se denomina una sindemia. Así mismo, los Centros para el Control y Prevención de Enfermedades (CDC por sus siglas en inglés) de los Estados Unidos de América, alertaron que para el año 2020 se presentaría un brote de la potencialmente mortal mielitis flácida aguda relacionada a la infección respiratoria por el enterovirus D68 (EV-D68).40 Contraria a estas predicciones, la propagación del SARS-CoV-2 en el hemisferio sur durante el invierno coincidió con la disminución de los casos de gripe a niveles históricos, lo que revela un curioso comportamiento de este tipo de enfermedad respiratoria de origen viral. Mientras que los casos de mielitis flácida aguda disminuyeron contrariamente a lo predicho durante el 2020.41 Ante ello, la dinámica epidemiológica de EV-D68 e influenza durante la pandemia de COVID-19 se vio alterada, pero la cuestión es si se afectó por ¿exclusión competitiva o por la efectividad del uso masivo de mascarillas?
Durante la temporada de influenza 2019 - 2020 en los EE. UU., aproximadamente 38 millones de personas se enfermaron de gripe con un estimado de 22 mil decesos,42 lo que fue una de las peores temporadas que ha sufrido esta parte del mundo, especialmente mala para los niños, ya que según los CDC hubo 198 muertes pediátricas asociadas con la gripe hasta septiembre de 2020, siendo la peor temporada de influenza para los niños en una década (Fig. 4).43
 Fuente: FluView Interactive - Centers for Disease Control and Prevention.43
Fuente: FluView Interactive - Centers for Disease Control and Prevention.43
Fig. 4 Número de muertes pediátricas asociadas al tipo de influenza en los EE.UU. Temporada 2019 - 2020 (datos hasta la semana epidemiológica 25).
El elevado número de muertes pediátricas durante la última temporada de influenza en los EE.UU., se asoció probablemente a un acontecimiento poco frecuente en el que predominaban los tipos A y B, denominada como temporada de influenza “doble cañón” (Fig. 4). La parte más preocupante de este evento es que un individuo puede enfermarse dos veces en la misma temporada. Los niños en particular son más susceptibles al tipo B, porque las personas mayores pueden tener algo de inmunidad, esto debido a que este tipo no muta tanto, como otras cepas. Lo que significa, que es probable que la contrajeran cuando ésta circulaba durante la temporada anterior.44 Se ha promovido de forma extensiva la vacunación contra influenza producto de la terrible experiencia en la temporada pasada y por el riesgo de una sindemia de tipo SARS-CoV-2 - Influenza. Sin embargo, durante el invierno en el hemisferio sur se suscitó un hecho intrigante, los casos de Influenza prácticamente desaparecieron.
A pesar de que existen casos de coinfección viral durante la pandemia de COVID-19, no se ha producido una sindemia en el hemisferio sur. Este hecho puede atribuirse a la implementación masiva y comunitaria de medidas de prevención frente al coronavirus (lavado de manos, uso de mascarillas y distanciamiento social), las cuales también estarían funcionando contra la transmisión de la gripe. Pero, ¿por qué estas medidas no fueron tan efectivas frente al SARS-CoV-2 como supuestamente sí lo fueron para otros virus? En teoría, estas medidas ampliamente implementadas en casi todos los países del mundo debieron frenar e impedir los contagios. Sin embargo se han reportado múltiples brotes de la enfermedad incluso en poblaciones ya vacunadas.45 Además, este no es el único virus que ha disminuido su frecuencia durante la actual pandemia. El MeV que había recuperado terreno en los países de América antes de 2020,46 a la fecha, ha desaparecido prácticamente de muchos países latinoamericanos (con la excepción de Brasil), algo que también se ha visto en los EE. UU. donde en 2019, se notificaron 1282 casos individuales de MeV en 31 estados y que hasta el 19 de agosto del 2020 solo reportaron 12 casos confirmados en 7 jurisdicciones (todos ellos a inicios de año).47
Variables intervinientes en la exclusión competitiva: el distanciamiento social y el uso comunitario de mascarillas
Mediante estudios observacionales se ha podido detectar la disminución de los casos de infecciones virales respiratorias durante el desarrollo de la actual pandemia, y aunque en este manuscrito se han presentado los probables mecanismos de exclusión competitiva, es importante considerar algunas variables intervinientes que pueden afectar de manera complementaria la dinámica de transmisión viral observada durante el 2020 - 2021. De este modo, la eficacia de las medidas de distanciamiento y el uso de mascarillas adoptadas a nivel comunitario son también variables importantes a considerar frente a la exclusión competitiva, ya que pueden jugar a favor o en contra durante las infecciones concomitantes, sobretodo porque actúan antes de que se suscite específicamente esta exclusión, es decir, estas variables afectan indirectamente la competencia entre dos o más virus, ya que actúan antes de que se produzca la exposición de los virus a las células susceptibles y permisivas.
Aunque hay pocas pruebas sobre la eficacia de su aplicación y uso en entornos naturales, durante la actual pandemia se tuvo la oportunidad de poner en práctica los probables beneficios de las mascarillas, la higiene de las manos y el distanciamiento social. Según algunos estudios, éstas pueden contribuir no sólo a la prevención del COVID-19, sino también a la reducción de otras enfermedades infecciosas respiratorias, concretamente los casos de gripe, enterovirus y neumonía, aunque se necesitan estudios analíticos para dilucidar una verdadera relación causal.48 Sin embargo, estos primeros resultados sugieren que estas variables son importantes, pero pueden no ser suficientes para explicar la complejidad de la dinámica de transmisión. Así, las medidas que aparentemente fueron eficaces para contener la propagación de muchos virus respiratorios no han frenado la pandemia; para ello, el máximo efecto vendrá de la vacunación.
Además, la interacción entre distintos virus puede modelar la dinámica de transmisión. En este sentido, se conoce que otros virus como el RV, desencadena una respuesta de IFN que bloquea la replicación del SARS-CoV-2, un evento estudiado en réplicas de la mucosa de las vías respiratorias humanas, en las que cuando se liberaron ambos virus al mismo tiempo, solo el RV logró la infección. Incluso con 24 horas de ventaja, el SARS-CoV-2 no tuvo ninguna oportunidad de ganar la competencia.29 Por esta razón, es difícil concluir que el uso masivo de mascarillas y el distanciamiento hayan permitido que el SARS-CoV-2 prevalezca sobre otros virus respiratorios. Se necesitan más pruebas sobre la eficacia de estas medidas y su impacto según el tipo de patógeno viral respiratorio.
La idea de la exclusión competitiva es indiscutible cuando se trata de animales y bacterias que intentan ocupar el mismo nicho ecológico, pero su aplicación a la coinfección viral no es tan simple de interpretar. Probablemente hay múltiples factores implicados en este evento, que se han descrito en esta revisión a partir de la evidencia científica disponible en la actualidad. La exclusión competitiva aplica para virus que tienen como diana la misma región anatómica e incluso el mismo tipo celular que es susceptible y permisivo para un grupo determinado de virus. La coinfección de agentes virales es un evento infrecuente, que posee importancia individual más que colectiva. En este sentido, la posibilidad de que dos o más virus confluyan en un escenario de brote o epidemia es aparentemente muy remota debido al fenómeno de la exclusión competitiva, ya que impide que dos virus que comparten rutas de transmisión similares y el mismo órgano diana puedan infectar no solo al mismo tiempo, sino también propagarse con éxito. De esta manera, las sindemias producidas por virus que comparten características podrían ser un evento lejano a concretarse, y tal como se vio la última pandemia, el aumento de casos a nivel poblacional de un agente infeccioso viral en ciertas circunstancias podría inhibir a otro incluso en temporadas de elevada frecuencia de casos.














