Introducción
La mutación JAK2V617F presente en las neoplasias mieloproliferativas (NMP) clásicas BCR-ABL1 negativas consiste en el cambio de una guanina por una timina en el nucleótido 1 849 del exón 14 del gen JAK2 en el cromosoma 9. Esto genera el cambio de una valina (V) por fenilalanina (F) en la posición 617 del dominio autoinhibitorio JH2 del JAK2. Como consecuencia, se produce una activación constitutiva de la proteína JAK2 en ausencia de la unión del ligando al receptor hematopoyético, que provoca una intensificación permanente de la vía de JAK/STAT y en menor extensión de las vías Ras-MAPK y PI3K/AKT, que contribuyen a una excesiva diferenciación y proliferación de células mieloides, eritroides y megacariocíticos.1,2,3
Esta mutación es la alteración molecular más prevalente descrita en la NPM clásicas BCR-ABL1 negativas, un grupo fenotípicamente diverso de hemopatías malignas de origen clonal caracterizadas por una sobreproducción simple o multilineal de los elementos eritroides, mieloides y megacariocíticos.4,5 En la trombocitemia esencial (TE) y la mielofibrosis primaria (MFP) alrededor del 50-60 % de los casos presentan la alteración molecular V617F del JAK2.3,5,6
La mutación JAK2V617F puede estar presente en un estado heterocigoto o puede progresar a la homocigosidad. La pérdida de heterocigosidad (LOH, por sus siglas en inglés) se produce con mayor frecuencia por un evento de recombinación mitótica homóloga del brazo corto del cromosoma 9 entre el alelo mutante y el no mutado del JAK2 que resulta en disomíauniparental (9pUPD). En consecuencia, la cantidad de JAK2 mutado versus no mutado puede variar significativamente, lo que introduce el concepto de carga alélica.
El término de homocigosidad se emplea para indicar a aquellos pacientes en quienes el nivel del alelo mutante es mayor que el 50 % del JAK2 total (mutante más no mutado). La LOH del JAK2V617 se ha observado en aproximadamente el 30 % de los pacientes con policitemia vera (PV) y MFP, en comparación con solo el 2-4 % de los pacientes con TE.3,7,8,9
La detección de esta mutación y la cuantificación de su carga alélica es útil en el establecimiento del pronóstico, el fenotipo de la enfermedad, las complicaciones y la evolución de las NMP. De hecho, la carga alélica del JAK2V617F parece correlacionarse con mayor riesgo de trombosis y evolución a una mielofibrosis secundaria en la PV y, posiblemente, en la TE. Por otra parte, la baja carga alélica se asocia con una reducción de la supervivencia en la MFP.10,11
Este trabajo se propuso evaluar la influencia de la carga alélica de la mutación JAK2V617F en el diagnóstico de los pacientes cubanos con TE y MFP y su relación con variables clínico-hematológicas en estas enfermedades.
Métodos
Se realizó un estudio retrospectivo, descriptivo y longitudinal en pacientes que tenían estudios previos de la mutación JAK2V617F por reacción en cadena de la polimerasa alelo específico cualitativo en el Instituto de Hematología e Inmunología (IHI) en el periodo de julio de 2010 a diciembre de 2020.
Los criterios de elegibilidad incluyeron a todos los pacientes con sospecha de TE y MFP con muestras de ADN genómico válidas para ser procesadas y que cumplieran con los criterios diagnósticos para las NMP clásicas BCR-ABL1 negativas emitidas por la OMS en 2016. No se admitieron los pacientes que presentaban otra patología o condición que pudiera influir en los resultados de las investigaciones de laboratorio y aquellos en los que no se pudo obtener información en las historias clínicas acerca de las variables útiles al estudio.
La muestra estuvo constituida por 53 pacientes con sospecha de TE, MFP y NMP no clasificadas procedentes del IHI y del servicio de Hematología del Hospital “Gustavo Aldereguía Lima” ubicado en la provincia de Cienfuegos.
Se empleó el libro de registro del laboratorio de biología molecular para seleccionar a los pacientes con diagnóstico presuntivo de TE y MFP con estudio molecular de la mutación JAK2V617F.
Todos los diagnósticos fueron revaluados utilizando las historias clínicas en la que se obtuvieron los siguientes datos: edad, sexo, hemoglobina, conteo global de leucocitos y plaquetas, así como la presencia de esplenomegalia, hepatomegalia, antecedentes de trombosis arterial o venosa y de sangrado. Esta información fue corroborada por los hematólogos de asistencia.
Se seleccionaron aquellos pacientes cuyas muestras de ADN obtenidas de sangre periférica anticoagulada con EDTA y conservadas en el laboratorio de Biología Molecular del IHI presentaban una concentración de ADN genómico mayor o igual a 10 ng/µL y un cociente de A260/A280 superior a 1,7 (comprobado a través del equipo espectrofotómetro de microplacas EPOCH).
Las muestras más antiguas fueron aisladas mediante cloroformo-alcohol isoamílico (24:1) y precipitación con etanol absoluto mientras que en las más recientes se empleó el QIAamp DNA Blood Mini Kit (cat. no. 51104) de QIAGEN, Alemania.
Las muestras de ADN genómico fueron normalizadas en una concentración de 10 ng/µL diluidas en solución tampón TE, provisto por el fabricante del kit ipsogen JAK2 RGQ PCR (cat. no. 673613) de QIAGEN, Alemania.
Se les cuantificó la carga alélica de la mutación por PCR en tiempo real en el equipo Rotor-Gene Q MDx 5plex HRM.
Este ensayo se centra en el principio de hidrólisis de oligonucleótidos de la qPCR. Se realizó el procesamiento analítico según las especificaciones del fabricante. Los valores de CT se plotearon en el software del equipo en los que se obtuvo una curva de calibración de los alelos mutados (MT, por sus siglas en inglés) y no mutados (WT, por sus siglas en inglés).
La curva estándar se utilizó para calcular el log10del número de copias de los alelos nativos y mutados en las muestras desconocidas. Los resultados se expresaron como porciento de JAK2V617F según la siguiente fórmula:
Para facilitar el cálculo de los resultados se creó una hoja de cálculo en el programa Excel y se introdujo los valores de CT, así como al intercepto y pendiente de cada curva estándar de WT y MT para que devolviera el resultado en porciento.
De acuerdo con la literatura revisada el porciento de la carga alélica del JAK2V617F por qPCR-AE se agrupó como: heterocigoto (≥ 0,042- 50 %), homocigoto (≥ 51 %) y no detectado (≤ 0,042 %). Los heterocigotos se subdividieron a su vez en bajo (0,042-25 %) y medio (≥26-50 %). Se respetó el límite de detección establecido por el fabricante del kit.
La información se recopiló en una planilla de recolección de datos, que constituyó la fuente primaria. Se creó una base de datos utilizando el Microsoft Office Excel 2010. Toda la información fue revisada y clasificada para ser sometida después a las distintas etapas de análisis estadísticos.
Análisis estadístico
El procesamiento de los datos se realizó con el empleo del paquete estadístico SPSS versión 15.0 para Windows y con el paquete estadístico Past 4.03.
Como medida de resumen para las variables cuantitativas se utilizaron la mediana, la media y la desviación estándar y para las cualitativas las frecuencias absolutas y relativas.
Para determinar asociación entre las variables clínicas y la mutación se utilizó la prueba Chi Cuadrado de independencia.
Se empleó el análisis de regresión lineal simple y la correlación lineal por rangos de Spearman para establecer la asociación entre la carga alélica y las variables cuantitativas continuas.
La comparación de las variables de laboratorio se realizó mediante la prueba de Mann-Whitney y prueba de Kruskal-Wallis para dos y tres grupos respectivamente. En estas pruebas se tuvo en cuenta un nivel de significación de 0,05. En caso de encontrarse diferencias significativas en las comparaciones de tres grupos, para saber cuáles diferían entre sí, se realizaron las comparaciones a posteriori mediante la prueba de Mann-Whitney acompañada de la corrección de Bonferroni, con un nivel de significación de 0,017.
Procedimientos éticos
Para realizar esta investigación se contó con la autorización de la dirección del IHI, con la aprobación del Consejo Científico y del Comité de Ética de las Investigaciones, de la institución. Se respetó lo establecido en los principios básicos de la Declaración de Helsinki que contiene las recomendaciones a seguir en la investigación en seres humanos.
Las muestras de ADN empleadas para el estudio fueron obtenidas con anterioridad para estudios de la mutación JAK2V617F. Se garantizó en todo momento, la integridad del paciente y la confidencialidad de la información.
Resultados
Se incluyeron 53 pacientes con sospecha de NMP con una relación mujer/hombre: 2,8 y un rango de edad de 31 a 78 años.
Se evaluaron 36 pacientes con sospecha de TE, 12 de MFP y 5 de NMP no clasificada.
Del total de los pacientes estudiados, se detectó la presencia de la mutación JAK2V617F en 66,7 % de los diagnosticados con TE (24) y MFP (8) y en el 80 % de los enfermos con NMP no clasificada. (Tabla 1).
Tabla 1 Comparación de la carga alélica del JAK2V617F y características demográficas en pacientes con trombocitemia esencial, mielofibrosis primaria y neoplasias mieloproliferativas (NMP) no clasificadas
| Características | ||||
|---|---|---|---|---|
| JAK2V617F, |
24 (66,7) | 8 (66,7) | 4 (80,0) | 0,22 |
| Edad en años, media (rango) | 55,5 (31-76) | 61,5 (40-75) | 63 (38- 78) | 0,22 |
| Sexo, M/F | 7/29 | 4/8 | 3/2 | 0,12 |
| Carga alélica del JAK2V617F media (rango) | 28,3 (0,09-71,71) | 61,7 (28,8-96,28) | 53,46 (30,12-96,82) | 0,004* |
| Bajo 0, 042-25 %, |
10 (41,7) | 0 | 0 | |
| Medio, 26-50 %, |
9 (37,5) | 3 (37,5) | 3 (75) | |
| Alto, 51-100 %, |
5 (20,8) | 5 (62,5) | 1 (25) |
Se observaron diferencias entre la MFP y la TE con respecto a la distribución de las cargas alélicas según los grupos definidos en este estudio. El 62,5 % de los pacientes con MFP fueron homocigotos a la mutación, mientras que en la TE solo el 20,8 % presentó pérdida de la heterocigosidad. De igual modo, la diferencia en el promedio de cargas alélicas entre ambas enfermedades de los pacientes en los que se detectó la mutación fue significativa (p=0,028) (Tabla 1) (Fig. 1).
Dentro de los pacientes heterocigotos al JAK2V617F con TE se encontraron tres pacientes femeninas con carga mutacional inferior al 1 %, que no se detectaron en los estudios por PCR-AE cualitativos.
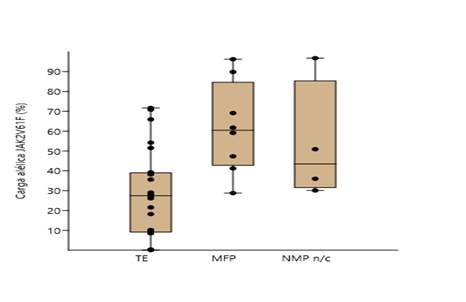
Fig. 1 Comparación de medias entre neoplasia mieloproliferativa (NMP) no clasificadas, mielofibrosis primaria (MFP) y trombocitemia esencial (TE). Se observan diferencias entre los valores medios de las cargas alélicas del JAK2V617, en los que la trombocitemia esencial presenta menores cargas alélicas.
Carga alélica del JAK2V617F en la trombocitemia esencial
En este grupo, de los 24 pacientes positivos a la mutación, 19 enfermos, el 79,1 % fueron heterocigotos al JAK2V617F.
Se apreció un incremento de la edad con relación al aumento de la carga alélica, pero esto no representó una diferencia significativa.
Hubo predominio del sexo femenino en todos los grupos estudiados, que fue absoluto en aquellas pacientes con carga alélica inferior al 25 %. No se encontraron diferencias significativas en la comparación de las variables clínicas y hematológicas (Tabla 2).
Tabla 2 Comparación de variables demográficas y clínico-hematológicas en la trombocitemia esencial según grupos de cargas alélicas
| Características | Carga alélica JAK2V617F | |||
|---|---|---|---|---|
| <25 % | 26-50 % | ≥ 50 % | ||
|
|
10 (41,6) | 9 (37,5) | 5 (20,8) | |
| % de carga alélica del JAK2V617F | 8,6 (0,09-21,56) | 30,9 (26,16-39,23) | 62,8 (51,54-71,71) | |
| Edad en años, media (rango) | 50 (32-68) | 57,6 (44-76) | 60,2 (44-72) | 0,26 |
| Sexo M/F | -/10 | 4/5 | 2/3 | 0,056 |
| Hemoglobina (g/L) media (rango) | 132,2 (103-149) | 137,3 (96-157) | 132,2 (96-149) | 0,63 |
| Conteo de plaquetas (x 109/L) media (rango) | 811,5 (446-1071) | 922 (570-1538) | 770 (350-1202) | 0,76 |
| Conteo de leucocitos(x 109/L) media (rango) | 8,6 (5,4-12,5) | 12, 04 (5,3-29,7) | 10,7 (4,8-16,9) | 0,38 |
| Hepatomegalia, |
1 (10) | 1 (11.1) | 0 | 0,74 |
| Esplenomegalia, |
2 (20) | 2 (22.2) | 1 (20) | 0,9 |
| Trombosis, |
1 (10) | 0 | 0 | 0,48 |
| Sangrado, |
1 (10) | 0 | 0 | 0,48 |
En este estudio se evaluó la correlación entre la carga alélica y la edad, la hemoglobina, el conteo de plaquetas y de leucocitos. No se pudo evidenciar una asociación entre estos parámetros y la tendencia de la carga mutacional para este grupo estudiado (Fig. 2).
Carga alélica del JAK2V617F en la mielofibrosis primaria
En la muestra estudiada de pacientes con MFP no se registraron pacientes con baja carga alélica (inferior a 25 %). Hubo predominio de pacientes homocigotos a la mutación (62,8 %).
Se observó una tendencia a agrupar a los pacientes de mayor edad y menor conteo de plaquetas en el grupo de menor carga mutacional, aunque esta disposición no puede ser considerada estadísticamente significativa (Tabla 3).
Tabla 3 Comparación de variables demográficas y clínico-hematológicas en la mielofibrosis primaria según grupos de cargas alélicas en la mielofibrosis primaria
| Características | Carga alélica JAK2V617F | p | |
| 26-50 % | ≥ 50 % | ||
|
|
3 (37,5) | 5 (62,8) | |
| % de carga alélica, media (rango) | 28,8 (28,8-47,3) | 75,2 (59,1-96,28) | |
| Edad en años, media (rango) | 73,6 (73-75) | 60 (48-74) | 0,13 |
| Sexo M/F | ½ | ¼ | 0,18 |
| Hemoglobina (g/L) media (rango) | 82,3 (64-98) | 102,4 (43-151) | 0,37 |
| Conteo de plaquetas (x 109/L) media (rango) | 33,6 (10-80) | 485 (62-817) | 0,07 |
| Conteo de leucocitos (x 109/L), media (rango) | 13,3 (5,2-24,3) | 18,5 (4,2-28,5) | 0,75 |
| Hepatomegalia, |
1 (33,3) | 2 (40) | 0,85 |
| Esplenomegalia, |
3 (100) | 5 (100) | n/s |
| Trombosis, |
0 | 0 | n/s |
| Sangrado, |
0 | 1 (20) | 0,4 |
Leyenda: n/s: no significativo.
Se pudo establecer una asociación positiva entre la proporción de la carga alélica y el conteo de plaquetas en este grupo mediante la correlación lineal por rangos de Spearman con un valor de probabilidad inferior a 0,05 (p: 0,013). El resto de las variables cuantitativas evaluadas no mostraron similar comportamiento (Fig.2).
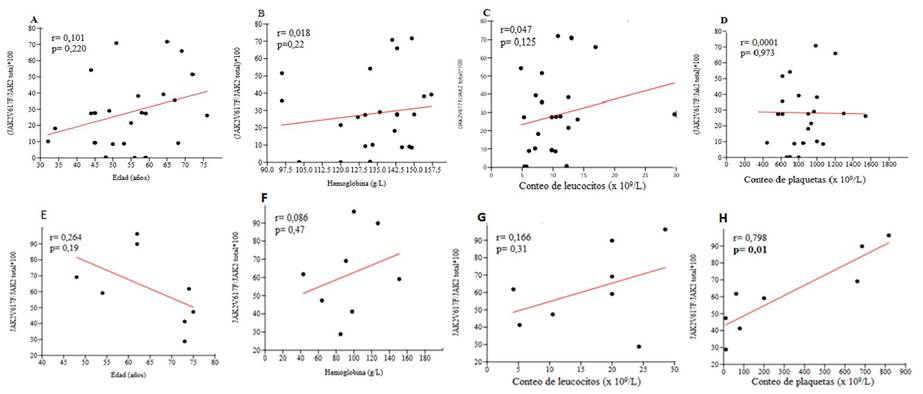
Fig. 2 Correlación entre la carga alélica del JAK2V617F y la edad, hemoglobina, leucocitos y plaquetas en la trombocitemia esencia (A, B, C, y D) y la mielofibtosis primaria (E, F, G y H). Se encontró asociación positiva entre la carga alélica y el conteo de plaquetas mediante la correlación lineal por rangos de Spearman en la mielofibrosis primaria. No se evidenció correlación con el resto de las variables.
Discusión
La mutación somática adquirida JAK2V617F es la alteración molecular más común asociada a las NMP. Las investigaciones actuales estiman su presencia entre 50 al 60 %3,5,6 aunque Rumi y Cazzola6 consideraron hasta un 65 % de los pacientes con TE y MFP. En este estudio la mutación se encontró en 24 pacientes con TE (24/36) y en 8 enfermos con MFP (8/12), que representa el 66,7 % para cada una de ellas, superior a estudios previos.
Sin embargo, estudios similares han mostrado una prevalencia de la mutación alta. Park y otros12 en una investigación realizada en Corea con 151 pacientes encontraron que 85,2 % de los pacientes con TE y el 83,3 % de los que presentaron MFP portaban esta mutación.
Singdong y otros,13) en otro trabajo que incluyó 100 pacientes demostró la presencia del JAK2V617F en el 75,4 % de los pacientes con TE (41/55), pero solo en el 25 % (1/4) de los casos con MFP se encontró la alteración molecular. Otro estudio realizado en Portugal con 133 individuos con NMP mostró una elevada prevalencia de la mutación en la TE (70,9 %) y apenas 35,7 % en la MFP.14 Estas diferencias pudieran explicarse por el limitado número de pacientes incluidos en este ensayo en comparación con estudios poblacionales que incluyeron gran cantidad de sujetos.
Con relación a la influencia de la carga alélica del JAK2V617F, se observó diferencia significativa en el porcentaje del alelo mutado entre la TE y la MFP. También se observó un predominio de LOH entre los pacientes con MFP con respecto al grupo de la TE. De igual modo, tampoco se encontraron pacientes con MFP y cargas alélicas inferiores al 25 %, grupo predominante en pacientes con diagnóstico de TE. Estos hallazgos son consistentes con otros estudios previos que mostraron una alta carga alélica en la MFP en contraste con la TE y también coinciden con investigaciones que sugirieron que la carga alélica puede contribuir a diferenciar entre los subtipos de NMP.11,12,15,16
La presencia de la mutación JAK2V617F fue detectada mediante qPCR, en tres pacientes con cargas alélicas inferiores al 1 %, que no habían sido identificadas por PCR-AE cualitativa. Se conoce que la técnica de qPCR posee mayor sensibilidad que la PCR cualitativa y por tanto permite la detección de casos con bajo porcentaje alélico.17 Esto justifica la introducción de la qPCR en el país como parte del diagnóstico molecular de las NMP clásicas BCR-ABL1 negativas, lo cual permitiría estar al nivel de las recomendaciones internacionales para el estudio de la mutación JAK2V617F.18
La influencia de la carga alélica en la TE y la MFP ha sido ampliamente abordada por diversos autores. Vannucchi y otros, realizaron una recopilación de los efectos fenotípicos atribuidos a la presencia del JAK2V617F en la TE y la MFP, teniendo en cuenta los resultados de otros investigadores.19
Los pacientes con TE positivos a esta mutación, en comparación con los no mutados, se caracterizan por presentar altos niveles de hemoglobina y leucocitos, bajo conteo de plaquetas y un incremento del riesgo de trombosis venosa y una médula ósea hipercelular con mielopoyesis estimulada.
En la MFP, la mutación se ha correlacionado con un alto conteo de leucocitos y hemoglobina; y variabilidad en el conteo de plaquetas y de manifestaciones clínicas como prurito. Diferentes estudios han mostrado discrepancia en relación a la relevancia del JAK2V617F en el pronóstico de la MFP.19
Guglielmelli y otros, confirmaron que los pacientes con más baja carga alélica con MFP tienen un tiempo de progresión más corto hacia la anemia y la leucopenia. Además, tenían una supervivencia global significativamente reducida en comparación con los de mayores cargas alélica.20
Solamente en la MFP se pudo establecer una asociación positiva entre el conteo de plaquetas y la carga alélica. Las diferencias entre este estudio y lo reportado internacionalmente puede ser atribuido al número de participantes en este grupo en comparación con los trabajos sobre el tema que involucran una gran cohorte de pacientes.
No obstante, Ha y otros,16 en un estudio que incluyó 103 pacientes (68,8 % con TE y 52,9 % con MFP) solo encontraron diferencias significativas en la edad y la presencia de organomegalia con relación a la carga alélica en la TE. No informaron ninguna relación en la MFP.
Yow y otros,15) en otra investigación en los que participaron 128 sujetos con NMP tampoco establecieron asociación entre la carga de la mutación y los parámetros hematológicos. Por otra parte, Gángó y otros21 notificaron diferencias significativas en el conteo de leucocitos, plaquetas y la enzima LDH, pero no en los casos de MFP. Ese estudio involucró 652 individuos (55,8 % con TE y 58,6 % en la MFP). En todos estos estudios hubo coincidencia, al igual que en este trabajo, en las diferencias entre las medias de las cargas alélicas de la MFP y la TE en los pacientes positivos a la mutación.
Aunque los criterios diagnósticos de la OMS no establecen un valor de corte especifico de la carga alélica para la clasificación de las NMP, la determinación de la misma puede resultar una herramienta diagnóstica valiosa en la discriminación de los subtipos de NMP.22 Además, pudiera ser muy útil en la evaluación de la respuesta al tratamiento.
Conclusiones
Nuestro estudio estuvo limitado por la pequeña muestra de pacientes, principalmente en la MFP. Esto impidió realizar una interpretación estadística adecuada de los resultados. No obstante, estuvo en correspondencia con otras investigaciones que sostienen el concepto de que la presentación fenotípica de las NMP está influenciada por la carga mutacional del JAK2V617F.














