Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.17 n.2 Ciudad de la Habana Mayo-ago. 1998
Trabajo de Revisión
Centro de Investigaciones y Referencia de Aterosclerosis de La HabanaLa lesión aterosclerótica: estado del arte a las puertas del siglo XXI
Dr. José E. Fernández-Britto RodríguezResumen
Se revisa la literatura médica y principalmente las investigaciones terminadas en el Centro de Investigaciones y Referencia de Aterosclerosis de La Habana. Se mencionan los hechos históricos más relevantes de las primeras lesiones ateroscleróticas estudiadas en momias egipcias. Se hace referencia a las clasificaciones más usadas de este tipo de lesiones desde 1957 (Organización Mundial de la Salud): estría adiposa, placa fibrosa, placa complicada y placa calcificada. Se analiza el concepto de unificación de las placas complicadas y calcificadas como lesiones de igual valor de gravedad y la introducción del concepto de placa grave. Se hace referencia a los métodos de estudiar las lesiones y a la clasificación de Stary, en 6 variedades de lesiones ateroscleróticas. Se describen en forma cronológica los fenómenos que influyen en el desarrollo de la lesión, con especial énfasis en el papel de los lípidos, el endotelio, las células musculares lisas (contráctiles y sintéticas), los macrófagos, los diferentes factores de crecimiento, los radicales libres y la respuesta del tejido conectivo de la pared arterial, que englobando en sus acciones de defensa los mecanismos de inflamación e inmunidad crea y desarrolla la placa aterosclerótica. Se mencionan los mecanismos por los cuales la placa se rompe produciendo la trombosis (aterotrombosis) que lleva a los infartos de los territorios afectados.Descriptores DeCS: ATEROSCLEROSIS/fisiopatología; ATEROSCLEROSIS/clasificación.
En 1856 el sabio alemán Rudolf Virchow definió que las alteraciones de las paredes de las arterias, conocidas hoy como arteriosclerosis, se producían como resultado de las interacciones de 3 elementos básicos: (a) los fenómenos hemodinámicos derivados por el flujo sanguíneo; (b) la sangre y sus componentes, responsables de los fenómenos hemorreológicos y (c) los integrantes de la pared arterial. Estos criterios se han visto reforzados a lo largo de todos estos años por los resultados de las muchas investigaciones científicas realizadas hasta la fecha en esta materia (Fernández-Britto JE. Atherosclerotic lesion: a morphometric study applying a biometric system. [Thesis of Doctor in Medical Sciences, Promotion B] Humboldt University of Berlin, 1987).
Se describen 3 variedades de enfermedades derivadas de la arteriosclerosis, cada una con sus propias características: (a) la aterosclerosis, (b) la calcificación de la capa media arterial o enfermedad de Monckeberg y (c) la arteriolosclerosis. Este trabajo analizará algunas de las características consideradas entre las más importantes de una de ellas, la aterosclerosis (Fernández-Britto JE. Atherosclerotic lesion: a morphometric study applying a biometric system. [Thesis of Doctor in Medical Sciences, Promotion B] Humboldt University of Berlin, 1987).
La aterosclerosis y sus principales consecuencias orgánicas -la enfermedad cardíaca coronaria o cardiopatía isquémica, la enfermedad cerebrovascular, la enfermedad vascular arterial periférica obstructiva y los aneurismas ateroscleróticos- están consideradas desde el punto de vista epidemiológico, como la primera causa de muerte en todos aquellos países donde las infecciones no ocupan este lugar preponderante y constituyen además, en estos mismos países, la primera causa de morbilidad en los ingresados hospitalarios (Fernández-Britto JE. Atherosclerotic lesion: a morphometric study applying a biometric system. [Thesis of Doctor in Medical Sciences, Promotion B] Humboldt University of Berlin, 1987).1
La aterosclerosis puede interpretarse como la respuesta defensiva obligada del tejido conectivo de la pared arterial ante una agresión permanente y de carácter exponencial. El orden biológico de la pared se ve alterado por los agentes agresores y como consecuencia obligada de la biología de los seres vivientes, en la zona agredida se produce la correspondiente respuesta tisular defensiva caracterizada por los fenómenos de las respuestas inflamatoria y de la inmunidad. La aterosclerosis debe ser considerada como una enfermedad del metabolismo general que se trasmite por la sangre y cuyo órgano diana es la pared arterial.
La aterosclerosis es un evento crónico, silencioso, larvado, generalmente ignorado y desconocido por el paciente y sus familiares. Su «debut» es con frecuencia una gran crisis de agudización y en ocasiones su primer síntoma es la muerte súbita, un infarto de miocardio, una enfermedad cerebrovascular, un aneurisma aterosclerótico fisurado o roto o una crisis vascular arterial periférica obstructiva. Esta enfermedad suele atacar al hombre en su etapa más productiva para la humanidad, su familia y para él mismo.2-4
El aumento de la expectativa de vida en cualquier país viene acompañado de un incremento notable de la mortalidad y morbilidad por aterosclerosis, siendo esta la causa fundamental de investigación dentro del grupo de las enfermedades crónicas no trasmisibles.5 La importancia del estudio de esta enfermedad en edades tempranas, donde es evidente que comienza la aterosclerosis, es también objeto de investigación de diferentes países y organismos internacionales.6,7
Antecedentes históricos y patomorfología
A principios de este siglo, desde 1901 a 1910, un grupo de investigadores ingleses se dedicó a estudiar los cuerpos de momias egipcias de más de 2 000 años. Estos investigadores analizaron aortas, coronarias, ilíacas y otras arterias y llegaron a la conclusión de que la aterosclerosis no había sufrido variación alguna de como se presentaba en las primeras épocas conocidas de la historia del hombre; tampoco existen diferencias patomorfológicas entre los hallazgos actuales y lo que se observó en aquellos momentos. Por lo descrito por ellos y lo observado en la actualidad se puede afirmar que la aterosclerosis es una enfermedad de las arterias con grave repercusión en los órganos por ellas irrigados; en su evolución histórica ha tenido siempre las mismas expresiones patomorfológicas y manifestaciones clinicopatológicas.Antes de 1957, el estudio y descripción de la lesión aterosclerótica era muy impreciso y difícil de unificar, pues cada grupo de investigadores lo refería a su manera, por lo que existía un verdadero caos de nomenclatura e interpretación de los fenómenos que la acompañan.
En 1957 la Organización Mundial de la Salud (OMS)8 reunió a un grupo de expertos en aterosclerosis con el objetivo de organizar, orientar y sobre todo clasificar y uniformar internacionalmente los conocimientos referentes a la lesión aterosclerótica. Este grupo, presidido por Holman, definió 4 tipos de lesiones ateroscleróticas de acuerdo con sus características patomorfológicas: (a) estría o banda adiposa; (b) placa fibrosa; (c) placa complicada y (d) placa calcificada.
En 1960 el mismo grupo de expertos9 se reunió para examinar el desarrollo de los acontecimientos de acuerdo con la clasificación inicial y señalaron que las placas complicadas y calcificadas tenían una influencia clínica muy similar y decidieron dejar la clasificación en 3: estría adiposa, placa fibrosa y placa complicada. A esta última en La Habana, 1980,10 se sugirió denominarla placa grave, englobando en este concepto a las complicadas y calcificadas. Estos 3 tipos de lesiones son aceptados por la generalidad de los investigadores, aunque también se han descrito otras 3 variedades: (a) la placa adiposa, (b) la lesión gelatinosa y (c) las estructuras rítmicas. De la placa adiposa se hablará más adelante.
La lesión gelatinosa se observa en las arterias de los niños, sobre todo en los miembros inferiores y en la aorta. Se caracteriza por la concentración de un fluido rico en proteoglicanos y glicosaminoglicanos, en forma de un pequeño habón; estas lesiones son muy pequeñas y suelen desaparecer y es raro encontrarlas en las autopsias de los adultos. Su importancia radica en que se localizan precisamente en aquellas regiones donde durante la vida adulta se localizan las lesiones ateroscleróticas, considerándose como predecesoras de éstas.
Las estructuras rítmicas, descritas y defendidas por A. Vikhert,11 se ven con relativa frecuencia preferiblemente en las arterias ilíacas y femorales y se caracterizan porque la íntima arterial se observa como replegada sobre sí misma en una extensión que oscila entre unos pocos milímetros y varios centímetros. La mayor parte de los investigadores las interpretan como alteraciones en el proceso de fijación de las placas fibrosas. Lo cierto es que se observan con relativa frecuencia también en las personas jóvenes y en las arterias de los miembros inferiores.
Muchos han sido los científicos que han pretendido establecer diferentes clasificaciones de la lesión aterosclerótica, entre ellos merece especial mención HC Stary,12,13 quien en 1990 definió algunos conceptos generales básicos para el estudio de estas lesiones.
Stary revolucionó el concepto de la íntima arterial normal, al demostrar la existencia de 2 capas en la íntima: la de proteoglicanos, inmediatamente posterior al endotelio y posterior a ésta la musculoelástica; demostró la presencia de células musculares lisas en estadio contráctil (CMLc) y en estadio sintético (CMLs) en la íntima normal de los niños, así como la presencia de macrófagos en ellas, también considerados como elementos normales de esta capa arterial. Asimismo describió la proliferación intimal normal diferenciándola de la lesión aterosclerótica inicial y definió 6 variedades microscópicas de lesión aterosclerótica. Las 2 primeras se corresponden con las estrías adiposas, la tercera con la placa adiposa, que se explicará a continuación, la cuarta con la placa fibrosa y la quinta y sexta con las complicadas o graves. No obstante para los estudios de la morfometría macroscópica de la lesión aterosclerótica la OMS y su grupo de expertos internacionales siguen utilizando la clasificación propuesta en 1957 y modificada en 1960 por esta misma organización. De acuerdo con estos criterios se definirán los conceptos que se describen a continuación.
La lesión aterosclerótica inicial o lesión grado I, denominada estría adiposa o banda de grasa (Fernández-Britto JE. Atherosclerotic lesion: a morphometric study applying a biometric system. [Thesis of Doctor in Medical Sciences, Promotion B]. Humboldt University of Berlin, 1987),2,6,14 se caracteriza macroscópicamente por presentar estrías amarillentas, muy bien puestas en evidencias por técnicas histológicas especiales para teñir las grasas, como por ejemplo la descrita por Holman utilizando Sudán IV.9 Estas lesiones iniciales suelen localizarse en algunas regiones específicas de las arterias, allí donde se producen bifurcaciones, trifurcaciones, curvaturas, o sea, donde el flujo sanguíneo sufre modificaciones. Vistas al microscopio están formadas por células llenas de vacuolas de grasas, unas son macrófagos y otras de músculo liso (CML); en general se les conoce con el nombre de células espumosas, lipófagos o aterocitos, los que adquieren, con las técnicas histológicas habituales de hematoxilina y eosina un aspecto de células llenas de vacuolas o espacios vacíos, pues la grasa se disuelve con los reactivos utilizados en esta técnica, de aquí el nombre de células espumosas. Esta lesión generalmente no protruye hacia la luz arterial y si lo hace es muy discretamente; su consistencia es muy blanda y no altera de manera importante la elasticidad, la flexibilidad, ni la distensibilidad de la pared, por lo tanto no modifica el flujo sanguíneo. Se observa desde los primeros años de la vida y en los niños se localiza principalmente en la aorta. Su mayor importancia radica en su capacidad de evolucionar hacia otra lesión más agresiva que se describe a continuación.
Se conoce como placa aterosclerótica (Fernández-Britto JE. Atherosclerotic lesion: a morphometric study applying a biometric system. [Thesis of Doctor in Medical Sciences, Promotion B]. Humboldt University of Berlin, 1987),2,13 aquella lesión que protruye hacia la luz arterial disminuyendo el calibre vascular. Estas placas o lesiones elevadas, como también se les conoce, se dividen según sus características histopatológicas en placas adiposas, placas fibrosas, placas complicadas, placas calcificadas y placas graves; algunos de estos nombres engloban varias de estas lesiones.
La placa adiposa15 es la continuidad cuantitativa de la acumulación de grasas en la lesión inicial o estría adiposa, donde se ha incrementado la cantidad de macrófagos y CML repletas de grasa (células espumosas), suficiente como para comenzar el proceso de abultamiento con protrusión de esta lesión hacia la luz arterial. El exceso de macrófagos y su excesiva ingestión de grasas los llevan a romperse y liberar esta grasa, en ocasiones predigerida, en la matriz extracelular de la íntima arterial, lo que inicia la formación de un núcleo central de depósito de grasa extracelular; todo esto contribuye a la formación del abultamiento de la lesión y su consecuente protrusión hacia la luz arterial. Durante muchos años se ha discutido si la placa adiposa debe considerarse una lesión especial o interpretarse como una variedad de la estría adiposa. Independientemente de cualquier opinión los que hemos visto muchas arterias por dentro conocemos perfectamente bien la existencia de ambas lesiones y sus características patomorfológicas.
La placa fibrosa, lesión aterosclerótica grado II, constituye la lesión más discutida e interesante de la aterosclerosis; la mayor parte de los investigadores en la materia la aceptan como la lógica evolución progresiva de la estría y de la placa adiposa. Es una lesión elevada, dura, prominente, que protruye hacia la luz arterial, de color blanco perlado y con bordes generalmente hiperhémicos y teñidos de rojo con la técnica del Sudán IV. Contribuye a la obstrucción y consecuente estenosis de la luz arterial y es responsable de muchos cambios hemodinámicos y hemorreológicos del flujo y los componentes de la sangre, precisamente donde se localiza. Estos cambios influyen en la evolución progresiva de esta placa hacia otras más graves y predisponen a los fenómenos de aterotrombosis, tan peligrosos para el paciente. Esta placa divide la íntima arterial en 3 zonas importantes desde el punto de vista hemodinámico y hemorreológico: la anterior a la lesión, la de la lesión y la posterior a la lesión. Precisamente el crecimiento de esta lesión y su transformación hacia otra variedad más agresiva radica en el efecto, o sea, los cambios patomorfológicos y fisiopatológicos que introduce en la biología de la pared arterial y su obligada consecuencia, la lesión aterosclerótica de mayor gravedad.
Se caracteriza microscópicamente por la presencia de abundantes células de músculo liso (CML) transformadas de su variedad fenotípica contráctil (CMLc) a su variedad sintética (CMLs) y abundante material de la matriz del tejido conectivo, segregado por ella, colágeno en diferentes estadios de maduración, fibras colágenas, elastina y sus correspondientes fibras elásticas, proteoglicanos, glicosaminoglicanos, glicolípidos, fibronectina, laminina, vitronectina, versican, etcétera.
En la placa fibrosa suele observarse el núcleo central de lípidos extracelulares, con cristales de colesterol y abundantes células espumosas, rodeado de la cápsula fibrosa más o menos colagenizada y hialinizada que le da el nombre a esta lesión. Se ha interpretado esta disposición como la reacción de agresión de los lípidos en la íntima arterial y la respuesta del tejido conectivo tratando de limitar la progresión del reciente depósito de lípidos.
Esta respuesta tisular está producida por las CML que se encuentran normalmente en la capa musculoelástica de la íntima y en la media y resultan estimuladas y activadas por diferentes factores de crecimiento provenientes de las células endoteliales (FCDE), de las plaquetas (FCDP), de los monocitos-macrófagos (FCDM-M), de los linfocitos (FCDL), mastocitos (FCDMt) y otros, desconocidos por nosotros o aún no descubiertos. Estas CML en estadio contráctil (CMLc), resultan estimuladas, activadas y se transforman en sintéticas (CMLs), proliferan y migran hacia el espacio subendotelial de la íntima donde se localizan y comienzan un proceso intenso de secreción de los componentes normales del tejido conectivo, tal y como se han mencionado.
La placa grave o lesión aterosclerótica grado III. Así se ha denominado desde 1980, por el grupo de investigadores del Centro de Investigaciones y Referencia de Aterosclerosis de La Habana (CIRAH),3,10 a las placas complicadas y calcificadas descritas desde 1957 por el grupo de expertos de la OMS. Esta placa grave (complicada o calcificada) es la continuidad biológica evolutiva de la progresión patológica de la placa fibrosa. Es una placa fibrosa que ha sufrido alguna de las alteraciones siguientes: fisura del endotelio, ruptura del endotelio con inicio de la formación de un trombo, presencia de grupos de plaquetas agregadas y adheridas al endotelio iniciando la formación de un trombo, trombosis ya establecida en la pared arterial, hemorragia intraplaca o presencia de depósitos de calcio en la íntima y media arterial. Se definió como placa calcificada aquella en la que el depósito de calcio era muy intenso y dominaba el cuadro histopatológico.
Más adelante este mismo grupo de expertos9 definió que la calcificación era una de las complicaciones que transformaban una placa fibrosa en complicada y que solamente su cuantificación respecto a la cantidad de calcio depositado o de territorio ocupado por éste era lo que definiría si una placa debería ser considerada complicada o calcificada; como puede apreciarse esta división resulta poco precisa y artificial. Ante esta disyuntiva y los criterios de algunos que continuaron utilizando la clasificación de 4 y otros la de 3, denominando indistintamente placa o lesión complicada se prefirió, por el grupo de investigadores del CIRAH darle el nombre de placa grave a estas lesiones.
Fisiopatología de la lesión aterosclerótica
Las fuerzas hemodinámicas como el shear stress (SS) ejercen sus influencias sobre las células endoteliales de forma diferente de acuerdo con las características e intensidad del SS.16,17 En aquellas zonas donde el SS es bajo se ha demostrado que se produce un cierto estancamiento de la sangre por el enlentecimiento de la circulación a ese nivel (una cierta fuerza de succión actúa sobre las células endoteliales [CE] precisamente a ese nivel). Está perfectamente demostrado que la geometría arterial tiene bien definidas las zonas donde se inician y desarrollan las lesiones ateroscleróticas en cada arteria.18 Estas son precisamente donde el SS es bajo, en las bifurcaciones, trifurcaciones, dobleces, emergencias arteriales, etcétera. Estos cambios hemodinámicos estimulan a las CE a segregar interleuquina 8 y una proteína especial conocida como proteína quimiotáctica de macrófago-1, además otras sustancias resultan también secretadas y todas ellas ejercen influencia sobre los leucocitos circulantes en la sangre, principalmente los monocitos y los polimorfonucleares neutrófilos (fig. 1).19-21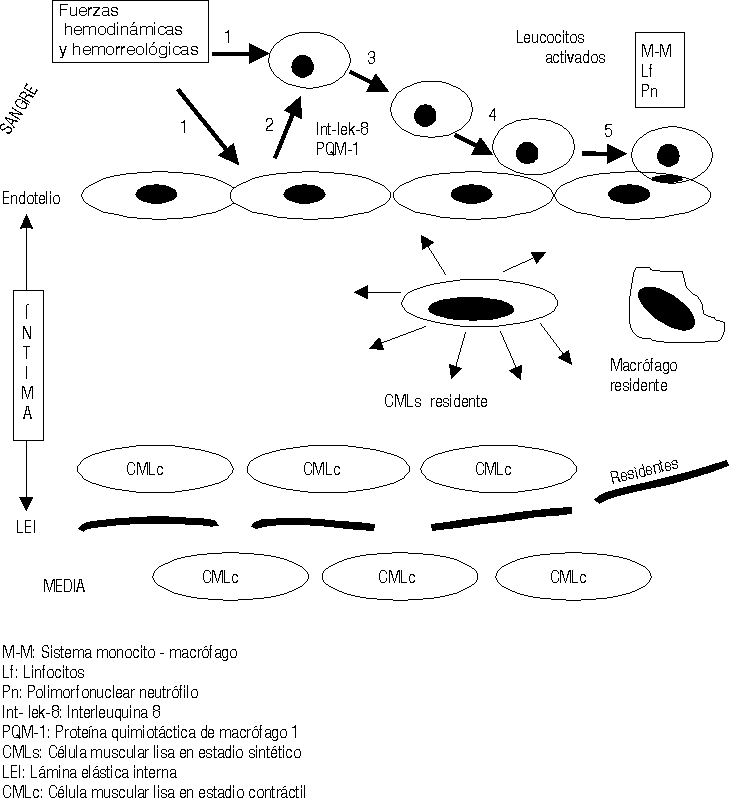
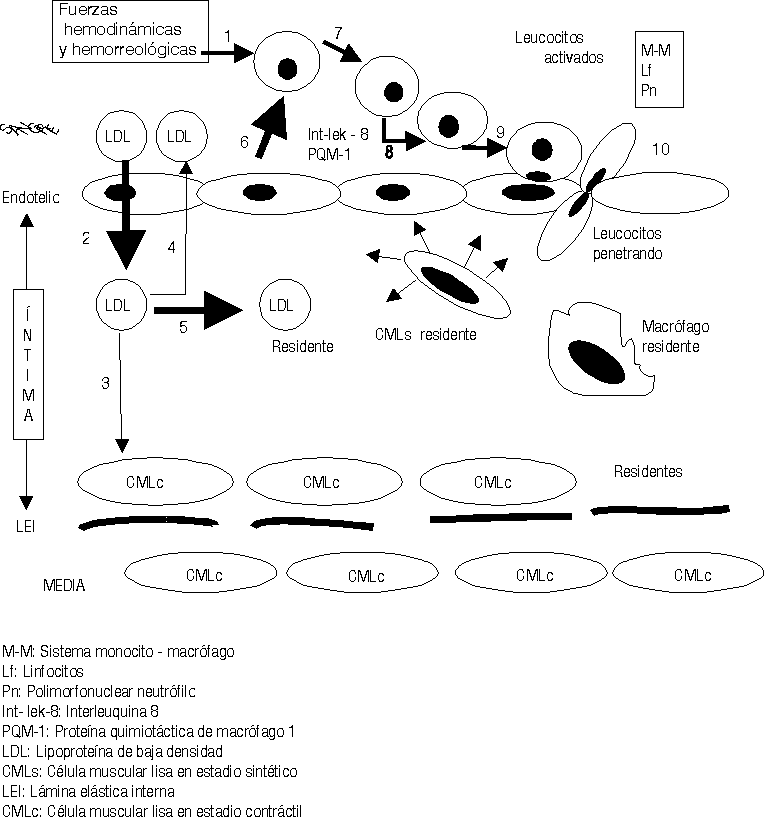
Una vez en la íntima (fig. 3) las LDL siguen 3 caminos diferentes: a) en pequeñas cantidades penetran en las CMLc de la capa musculoelástica de la íntima, para contribuir a la formación de las membranas celulares de éstas; b) otra cantidad de ellas retornan al torrente circulatorio por la misma vía que penetraron y c) otras se quedan residentes en la íntima arterial.
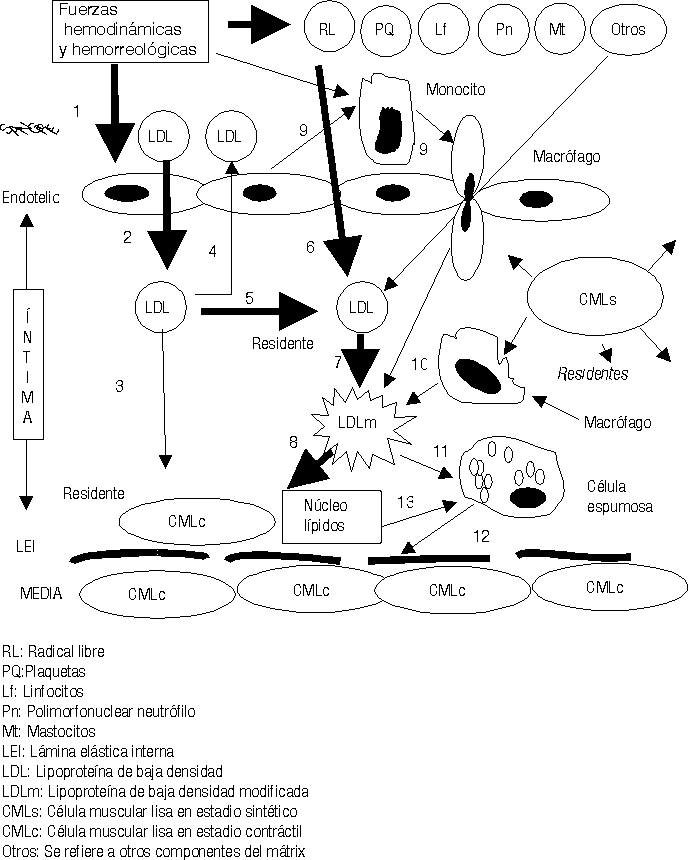
El exceso de LDL residentes en el subendotelio estimula otra serie de mecanismos fisiopatológicos.25-29 Se ha demostrado que en el mátrix extracelular existen muchos elementos bioquímicos y entre ellos se encuentran algunos proteoglicanos que atraen y fijan las LDL, las que detienen su movilidad y resultan fácilmente expuestas para ser modificadas.30 La carga fuertemente negativa de este proteoglicano se une a la fuertemente positiva de la capa externa de las LDL. Diferentes procesos bioquímicos se producen en la íntima para modificar las LDL (fig.4); estas modificaciones consisten en un cambio sustancial de su estructura exterior, en ocasiones esto responde a la oxidación producto de las acciones de los radicales libres o especies reactivas del oxígeno, o glicosilación, o como se ha demostrado in vitro, modificación por metilación o por acciones del ácido malondialdehído; lo cierto es que las LDL modificadas no pueden ser incorporadas a las CMLc de la íntima por no tener éstas receptores de membrana para estas nuevas estructuras. Sin embargo los macrófagos son las células que selectivamente ingieren las LDLm pues ellos sí poseen los receptores de membrana específicos para estas nuevas estructuras. Pero sucede que los macrófagos son de las pocas células, o quizás las únicas que no poseen la capacidad de metabolizar en su interior las LDL, lo que hace que estas células almacenen los lípidos ingeridos que no pueden metabolizar. La acumulación de estos lípidos dentro de los macrófagos es lo que da el aspecto de células llenas de vacuolas y por eso se les ha llamado células espumosas (fig. 4).
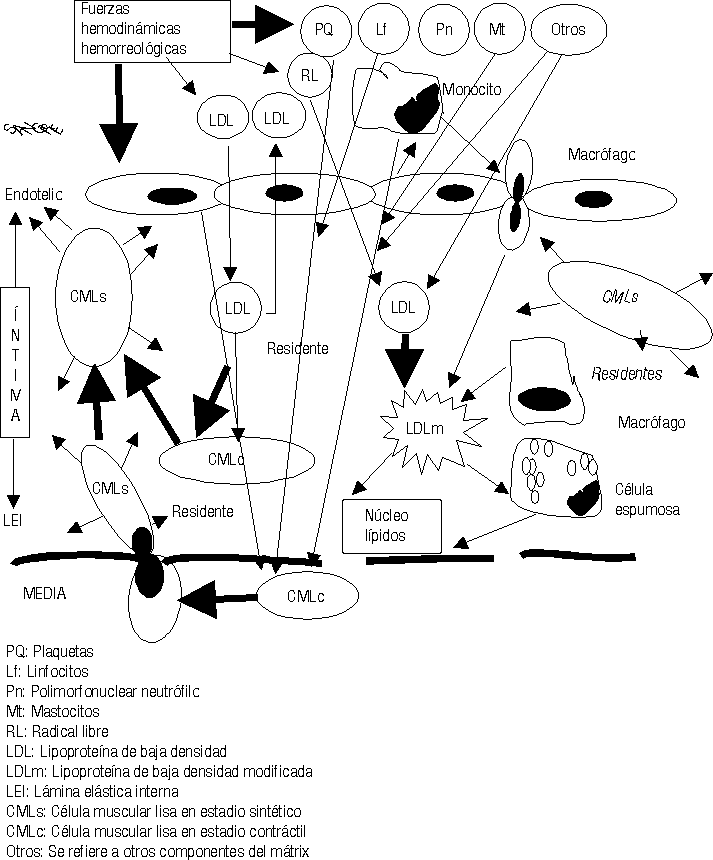
Mientras este proceso avanza el intercambio fisiopatológico entre las células de la sangre, plaquetas, hematíes, leucocitos, las CE, los componentes del mátrix extracelular, las fuerzas hemodinámicas y otras acciones, van cada vez haciendo todo este proceso más y más complejo (figs. 2-5).23-29
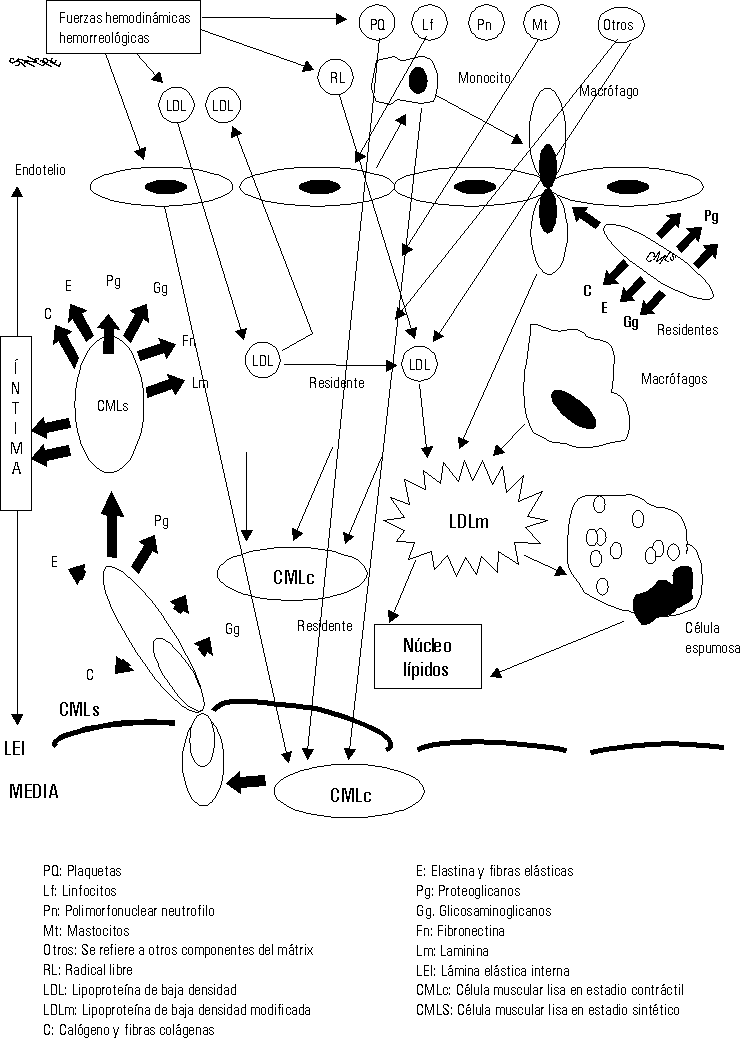
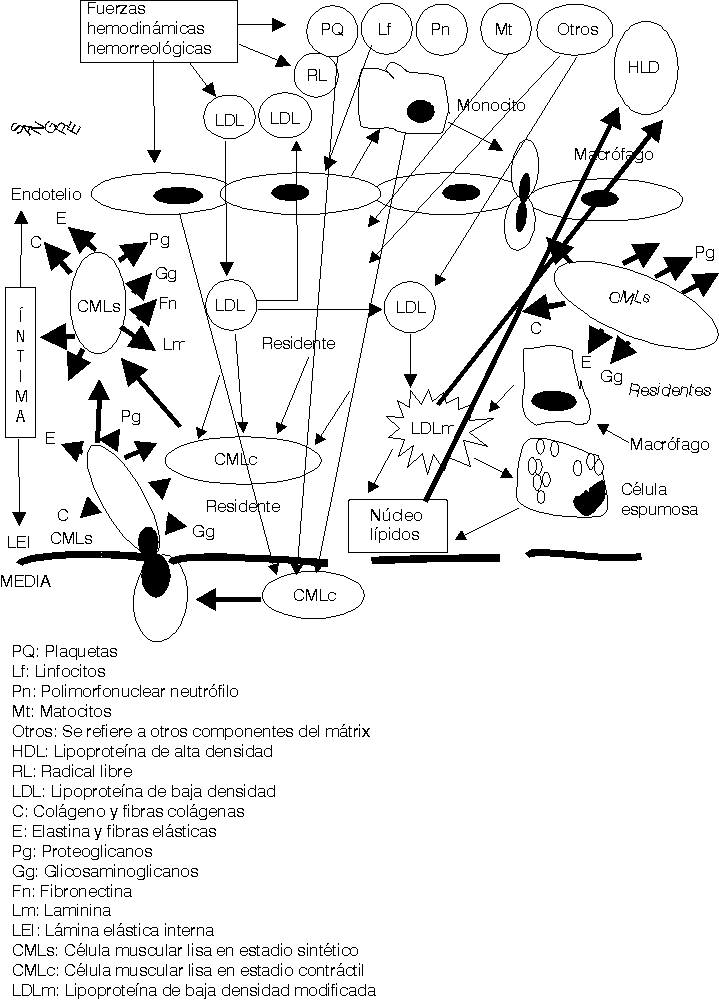
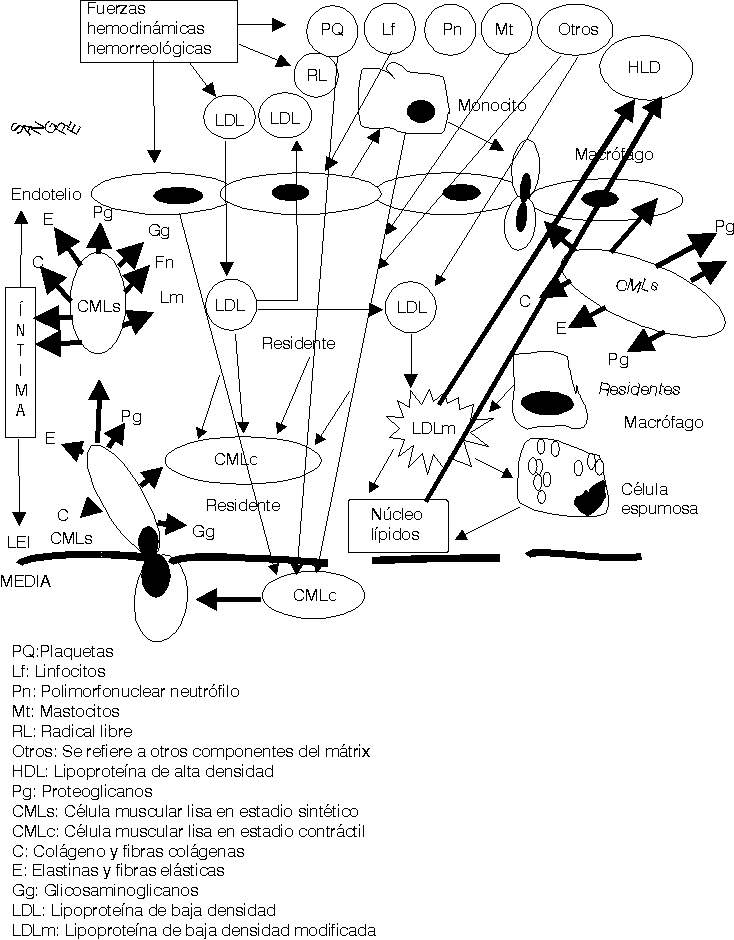
Los conceptos más modernos indican que la placa aterosclerótica puede seguir 3 caminos diferentes en su evolución: a) la progresión de la lesión; b) la regresión de la lesión y c) la estabilización de la lesión.19-21,25,26,31-34
Mucho se discute y mucho se ha publicado sobre la regresión de la aterosclerosis (estudios experimentales con diferentes tipos de animales, sobre todo con diferentes especies de monos e inclusive muchos estudios observacionales en humanos, utilizando varios métodos, dietas, estudios angiográficos, ultrasonido de diferentes categorías, tomografía axial computadorizada, resonancia magnética, etcétera), sin embargo, la verdadera regresión patomorfológica no se ha podido demostrar de manera concluyente para ser aceptada por todos los investigadores en esta temática.
En los últimos años se ha modificado el concepto de lo que se puede hacer para evitar los grandes desastres clínicos consecuentes a la evolución fatal de la placa aterosclerótica y hoy existe acuerdo entre los expertos de que lo que sí se puede lograr es estabilizar la placa aterosclerótica, para evitar su ruptura e inmediata formación del trombo causante del posterior infarto tisular, cualquiera que sea el órgano de que se trate.
La mayoría de los investigadores acepta que la disminución general de los lípidos en el paciente repercute muy favorablemente en la disminución de los lípidos dentro de la lesión aterosclerótica y por lo tanto la consecuencia obligada es la estabilización de la placa y el mejor pronóstico del paciente.
Summary
Medical literature, particularly the research works carried out by the Center for Investigations and Reference of Atherosclerosis of Havana are reviewed. The most relevant historical events related to the first atherosclerotic lesions studied in Egyptian mummies are stated. Reference is made to the most usual classifications for this type of lesions since 1957 (World Health Organization): fatty streak, fibrous plaque, complicated plaque and calcified plaque. The concept of calcified and complicated plaques unified into equally severe plaque concept are analyzed. Reference is also made to the methods for studying the lesions and to the Starys classification into six kinds of atherosclerotic lesions. The factors affecting the development of lesions making special emphasis on the role of lipids, the endothelium, smooth muscle cells (contractile and synthetic), macrophages, various growth factores, free radicals and the response of the connective tissue of the arterial wall are chronologically described. The connective tissue of the arterial wall which includes the inflammatory and immunity mechanisms in its defense actions, causes and develops the atherosclerotic plaque. The mechanisms by which the plaque rupture occurs leading to the thrombosis (atherothrombosis) and infarcts in the affected areas are explained.Subject headings: ATHEROSCLEROSIS/physiopathology; ATHEROSCLEROSIS/classification.
Referencias Bibliográficas
- World Health Organization, Statistical Review, 1994.
- Fernández-Britto JE, Wong R, Contreras D, Nordet P. Atherosclerotic risk factors, their impact in youth: a ten-year multi-national, pathomorphometrical study (1986-96) using atherometric system. International WHO/ISFC research project Pathobiological Determinants of Atherosclerosis in Youth (PBDAY). Proceeding of 9th International Dresden Symposium on Lipoproteins and Atherosclerosis 1997;36.
- Fernández-Britto JE. La lesión aterosclerótica: descripción anatomopatológica de sus componentes. Rev Cubana Med 1981;20:220-30.
- Fernández-Britto JE, Carlevaro PV, Bacallao J, Dujarric R. Mortalidad por aterosclerosis: estudio estadístico de 300 necropsias del Hospital «Dr. C. J. Finlay». Rev Cubana Med 1981;9:105-17.
- Gotto AM Jr. Directions of atherosclerosis research in the 1980s and 1990s. Circulation 1984;70 (Suppl 3).
- Pathobiological Determinants of Atherosclerosis in Youth. Unites States of American Research Projects. General Coordinator Prof. R.W. Wissler, 1985.
- W.H.O.: Pathobiological Determinants of Atherosclerosis in Youth, PBDAY International Projects of Research 1988-95.
- Holman RL, McGill HC, Strong JP, Geer JC. Technics for studying the atherosclerotic lesions. Lab Invest 1960;7:42-9.
- Holman RL, et al. An index for the evaluation of arteriosclerotic lesions in the abdominal aorta. A report by the Committee on lesions of the American Society for the study of Atherosclerosis. Circulation 1960;28:1137-42.
- Fernández-Britto JE, Bielokrinitzki V, Morgalo R, Candas A, Dujarrric R, Candas M. Diseño experimental de la investigación. Estudio de la aterosclerosis coronaria, aórtica y cerebral. Rev Cubana Hig Epidemiol 1981;19:137-49.
- Vikhert AM. Atherosclerosis of the aorta in five towns. Bull World Health Organ 1976;53(5-6):501-12.
- Stary HC, Chandler AB, Dinsmore RE, Fuster V, Glagov S, Insull W Jr, et al. A definition of advanced types of atherosclerotic lesions and a histological classification of atherosclerosis. Circulation 1995;92:1355-74.
- Stary HC, Chandler A, Glagov S, Guyton JR, Insull WJr, Rosenfeld ME, et al. A definition of initial, fatty streak, and intermediate lesions of atherosclerosis. Circulation 1994;89:2462-78.
- OMS. Grupo de estudio para la clasificación de la lesión aterosclerótica. Serie de reportes técnicos 1958;143.
- Wissler RW. Chairmans introduction to workshop on regression atherosclerosis. Atherosclerosis VI. Proceeding of the Sixth International Symposium. Berlin: Springer-Verlag, 1982:183-6.
- Fernández-Britto JE, Affeld K. Biofluidmechanics of atherosclerotic lesions. Int J Artif Organs 1995;18(8):436.
- Fernández-Britto JE, Affeld K, Cardinal S. Influence of Bloodflow in molecular transport at and in the arterial wall. Proceeding of 66th Congress of the European Society of Atherosclerosis, Florence Italy, July 13-17, 1996;99.
- Valente AJ, Rosek MM, Sprague EA, Schwartz CJ. Mechanisms in intimal monocytemacrophage recruitment. Circulation 1992;86:20-5.
- Fuster V, Badimon L, Badimon JJ, Chesebro JH. The pathogenesis of coronary artery disease and the acute coronary syndromes, (first of two parts). New Engl J Med 1992;242-50.
- . The pathogenesis of coronary artery disease and the acute coronary syndromes, (second of two parts). New Engl J Med 1992;310-8.
- Ross R. The pathogenesis of atherosclerosis: an update. New Engl Med 1986;488-500.
- Wissler RW. New insights into the pathogenesis of atherosclerosis as revealed by PBDAY. Atherosclerosis 1994;108:(Suppl)3-20.
- Falk E. Why do plaques rupture? Circulation 1992;86(Suppl 3):30-42.
- Chesebro JH, Webster MWI, Zoldhelyi P, Roche PC, Badimon L, Badimon JJ. Antithrombotic therapy and progression of coronary artery disease. Circulation 1992;86:(Suppl 3):100-11.
- Fuster V, Badimon JJ. Regression or stabilization of atherosclerosis means regression or stabilization of what we dont see in the arteriogram. Eur Heart J 1995;16:(Suppl. E)6-12.
- Badimon JJ, Fuster V, Badimon L. Role of high density lipoproteins in the regression of atherosclerosis. Circulation 1992;86:(Suppl 3);86-94.
- Mailhac A, Badimon JJ. Fallon JT, Fernández-Ortiz A, Meyer B, Chesebro JH, et al. Effect of an eccentric severe stenosis on fibrinogen deposition on severely damaged vessel wall in arterial thrombosis. Circulation 1994;90:988-96.
- Meyer BJ, Badimon JJ, Mailhac A, Fernández-Ortiz A, Chesebro JH, Fuster V, et al. Inhibition of growth of thrombus on fresh mural thrombus. Circulation 1992;90:2432-8.
- Fernández-Ortiz A, Badimon JJ, Falk E, Fuster V, Beat M, Mailhac A, et al. Characterization of the realtive thrombogenicity of atherosclerotic plaque components: implications for consequences of plaque rupture, JACC 1994;23;1562-9.
- Kayser K, Bartels S, Yoshida Y, Fernández-Britto JE, Gabius HJ. Atherosclerosis associated changes in the carbohydrate- -binding capacities of smooth muscle cells of various human arteries. Zentralbl Pathol 1993;139:4-9.
- Fernández-Britto JE. Bacallao J, Castillo JA, Campos R, Wong R, Guski H. Atherosclerosis in diabetes and hypertension: a comparative morphometric study of their progression using an atherometric system. Zentralbl Pathol 1991;137(6):487-91.
- Fernández-Britto JE, Carlevaro PV. Atherometric system: a suitable methodology to characterize the atherosclerotic lesions in any artery or group of patients. Zentralbl Pathol 1991;137(4):337-40.
- Fernández-Britto JE, Carlevaro PV, Bacallao J, Koch AS, Guski H, Campos R. Atherosclerosis in the cerebral arteries, its study applying an atherometric system. Cor Vasa 1991;33(3):188-96.
- Fernández-Britto JE, Carlevaro PV. Atherometric system: morphometric standardized methodology to study atherosclerosis and its consequences. Gegenbaurs Morphol Jahrb 1989;135:1-12.
Dr. José E. Fernández-Britto Rodríguez. Centro de Investigaciones y Referencia de Aterosclerosis de La Habana. Apartado 6493, La Habana 10600, Cuba. Fax 537-662075. Correo electrónico: jfbritto@infomed.sld.cu














