Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.20 n.1 Ciudad de la Habana ene.-mar. 2001
Facultad de Biología. Universidad de La Habana
Capacidad protectora de Cymbopogon citratus (DC.) Stapf. ante el daño genético inducido por estrés oxidativo
Lic. Nancy Cápiro, Lic Ángel Sánchez-Lamar, Lic. Gladys Fonseca, Lic. Ligia Baluja y Lic. Ernesto Borges
Resumen
Se estudió el efecto protector de una decocción de las hojas de la planta Cymbopogon citratus (DC.) Stapf. (caña santa o caña de limón) frente al daño genético inducido por los agentes oxidantes H2O2 y etilnitrosourea (ENU). Se utilizó para ello un modelo esperimental in vitro y otro in vivo: cultivo de células de ovario de Hamster chino (CHO) y el insecto Drosophila melanogaster, respectivamente. La capacidad de formar colonias de la línea celular CHO, fue el indicador de toxicidad utilizado para evaluar 5 concentraciones (0,1; 1; 5; 10; 15 %) de la decocción de caña santa, en tanto que el porcentaje de sobrevivencia de adultos se usó para evaluar el efecto tóxico de 4 concentraciones de esta (5; 25; 50; 100 %) sobre las larvas mwh + / + flr3 de Drosophila melanogaster; en ambos casos los resultados evidenciaron efectos tóxicos dependientes de las concentraciones utilizadas. Los estudios citofluorimétricos con diclorofluoresceína-diacetato en células CHO permitieron demostrar la capacidad antioxidante de la decocción de caña santa. Dosis no tóxicas de 0,1; 1 y 5 % produjeron reducciones significativas del estrés oxidativo causado por el H2O2. La genotoxicidad y antigenotoxicidad de diferentes concentraciones de la decocción fueron evaluadas mediante los ensayos de aberraciones cromosómicas en células CHO y el SMART de alas de Drosophila melanogaster. Los resultados de actividad mutagénica obtenidos fueron negativos, en tanto que los correspondientes a la acción protectora de las concentraciones probadas reafirmaron la capacidad antioxidante mostrada por el extracto vegetal.
Descriptores DeCS: ESTRÉS OXIDATIVO; DAÑO DEL ADN; ANTIOXIDANTES/uso terapéutico; PLANTAS MEDICINALES/uso terapéutico; MEDICINA HERBARIA; CRICETULUS/genética; DROSOPHILA MELANOGASTER/genética; MODELOS BIOLÓGICOS.
Paralelo a la evaluación del riesgo genético al que el hombre está expuesto, las investigaciones actuales están dirigidas a la búsqueda de agentes quimiopreventivos naturales,1 inocuos, baratos, y de preferencia, que provengan de fuentes dietéticas accesibles al hombre.
Muchos mutágenos y carcinógenos conocidos actúan a través de mecanismos oxidativos que dañan al ADN; consecuentemente, existen reportes de antioxidantes naturales capaces de minimizar los efectos de los compuestos genotóxicos:2 vitaminas, minerales, fenoles y aceites esenciales, han demostrado efectos inhibitorios sobre la genotoxicidad, tanto en ensayos in vivo como in vitro.
Una de las plantas medicinales más utilizadas en Cuba, por sus múltiples usos terapéuticos3,4 y por su sabor agradable como bebida, es la caña santa o caña de limón (Cymbopogon citratus [DC.] Stapf.). La decocción de sus hojas no ha mostrado efectos tóxicos, genotóxicos ni teratogénicos en diferentes modelos biológicos, en tanto que sí ha evidenciado efecto protector frente al agente alquilante de nitrógenos metilmetanosulfonato (MMS).5 El presente trabajo tuvo como objetivo evaluar la capacidad antioxidante de la decocción de caña santa y su efecto protector del ADN frente al daño inducido por el agente oxidante H2O2 y el agente alquilante de oxígenos, etilnitrosourea (ENU).
Métodos
Preparación de la muestra: 40 g de hojas secas (37 - 40 °C durante 3 d) se dejaron hervir durante 10 min en 500 mL de agua para un volumen final de 275 mL; a partir de esta solución madre (concentración 100 %), se prepararon el resto de las concentraciones ensayadas.
1. Experimentos in vitro
Se utilizó la línea celular CHO obtenida de ovario de Hamster chino, Cricetulus griseus,6 cultivada en Ham's F10 suplementado con 2 % estreptomicina-penicilina, 0,5 % L-glutamina y 10 % suero bovino fetal (SBF). Se utilizaron como control negativo el medio de cultivo y positivo peróxido de hidrógeno (H2O2) 5 x 10-5 mol. La citotoxicidad de la decocción a las concentraciones de 0,1; 1; 5; 10 y 15 %, fue evaluada mediante la capacidad de formar colonias (CFC).7 La actividad antioxidante se estudió mediante análisis citofluorimétrico por coloración con diclorofluo-resceína-diacetato (DCFH-DA),8 el tratamiento y procesamiento de las células se efectuó según lo indicado por De Salvia y otros.8 En los estudios de genotoxicidad y antimutagenicidad se empleó el ensayo de aberraciones cromosómicas (AC) con las dosis que causaron menor citotoxicidad, según lo planteado por Galloway, en 1986.9
2. Experimentos in vivo
Se utilizó la línea homocigótica mwh y flr3 /TM3, Ser de Drosophila melano-gaster.10 Se usó sacarosa 5 % como control negativo y etilnitrosourea (ENU) 0,01 y 0,1 mmol como control positivo. La sobrevivencia de adultos fue el parámetro utilizado para evaluar la toxicidad de la decocción a las concentraciones de 5, 25, 50 y 100 %, obtenidas del cruzamiento parental. Se empleó el cruzamiento estándar del ensayo de mutación y recombinación somática (SMART) de alas (Sigarroa A. Biometría y diseño experimental. Facultad de Biología, Universidad de La Habana, 1985) para estudiar la genotoxicidad y antigenotoxicidad de la decocción a 100 %, en la progenie adulta de larvas transheterocigóticas de 72 h mwh +/+ flr3 cotratadas de forma crónica.
Pruebas estadísticas: Los datos se procesaron mediante las pruebas t de Student, la prueba de ajuste a la distribución binomial y la de probabilidad exacta de Fisher; se comprobó la normalidad (prueba de Kolmogorov-Smirnov) y la homogeneidad de varianza (prueba de Bartlett).11
Resultados
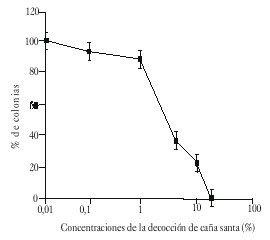
En las figuras 1 y 2 se muestran los efectos de toxicidad causados por las diferentes concentraciones de la decocción de caña santa en los 2 modelos biológicos empleados; como se observa, en ambas curvas se manifestó un efecto dosis dependiente que en el caso de la citotoxicidad en la línea celular CHO, permitió delimitar un rango de menor efecto por debajo de 5 %, en tanto que en Drosophila todas las concentraciones probadas fueron superiores a la DL50.
Fig. 1. Curvas dosis-efecto de la capacidad de formar colonia (CFC), de células CHO, tratadas con la decocción de caña santa, a diferentes concentraciones, durante 18 h. Se muestran los valores medios de 2 experimentos.
Fig 2. Curva dosis-respuesta obtenida con los valores promedio de las frecuencias de los adultos sobrevivientes (%), a las diferentes concentraciones de caña santa.
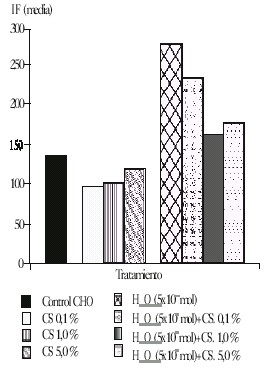
La figura 3 muestra la reducción de la intensidad de fluorescencia (IF) producida en las células cotratadas; es de destacar que en los cultivos tratados solo con la decocción, la IF también disminuyó respecto al nivel espontáneo de oxidación metabólica en las células.
Fig. 3. Acción antioxidante de la decocción de caña santa (Cymbogon citratus), en células CHO tratadas con diferentes concentraciones de la decocción y sus combinaciones con el H2O2 (ambos adicionados al inicio del tratamiento), durante 30 min. Se presentan los valores de la intensidad de fluorescencia emitida por 10 000 células analizadas.
Como se observa en la tabla 1, la decocción de las hojas de caña santa produjo una disminución altamente significativa de la frecuencia de células portadoras de aberraciones cromosómicas, una vez que los cultivos fueron simultáneamente tratados con H2O2 y cada una de las 3 concentraciones del extracto ensayadas (0,1; 1,0 y 5,0 %).
Tabla 1. Reducción de las aberraciones cromosómicas inducidas por el H2O2 en células CHO, por causa de la acción de la decocción de caña santa (CS) aplicada en cotratamiento con el mutágeno, durante 30 min
| Frecuencias por cada 100 células | ||||||
| Tratamiento (30 min) | Células anormales | Gaps | Aberraciones | Total de aberraciones (- gaps) | IM | |
| Cromatídicas | Cromosómicas | |||||
|
0 % | 4 | 2 | 2 | 2 | 4 | 100 |
| H2 O2 (5 x 10-5 mol) | 18 | 8 | 8 | 4 | 12 | 87 |
| CS 0,1 % | 4 | 2 | 2 | 0 | 2 | 98,6 |
| CS 1,0 % | 6 | 4 | 2 | 4 | 6 | 93 |
| CS 5,0 % | 4 | 0 | 0 | 4 | 4 | 89 |
| H2 O2 (5 x 10-5 mol)+ CS 0,1% | 4*** | 4 | 0 | 0 | 0 | 98 |
| H2 O2 (5 x 10-5 mol) + CS 1 % | 4*** | 0 | 2 | 2 | 4 | 94 |
| H2 O2 (5 x 10-5 mol) + CS 5 % | 4*** | 2 | 2 | 0 | 2 | 93 |
*** muy significativo.
La tabla 2 muestra las frecuencias de manchas totales obtenidas para los cotratamientos de la decocción a 100 % con las 2 concentraciones del control positivo, las cuales evidencian una disminución de 52 y 31 % a las concentraciones de 0,1 y 0,01 mmol del mutágeno ENU, respectivamente.
Tabla 2. Efecto de la decocción de caña santa (CS) sobre la genotoxicidad de ENU, medido en el ensayo SMART de alas de Drosophila melanogaster: resultados de los cotratamientos ENU 0,01 mmol + CS 100 % y ENU 0,1 mmol + CS 100 %
|
Manchas simples | Manchas simples grandes | Manchas gemelas | Total de manchas | ||||||||||
|
Tratamiento |
No. de alas | N | f | % | N | f | % | N | f | % | N | f | % |
|
Control sacarosa 5 % | 100 | 23 | 0,23 | 8 | 0,08 | 2 | 0,02 | 33 | 0,33 | ||||
|
CS 100 % | 100 | 25 | 0,25 | 8 | 0,08 | 1 | 0,01 | 34 | 0,34 | ||||
| ENU 0,01 mmol |
100 | 51 | 0,51 | 12 | 0,12 | 0 | 0,00 | 63 | 0,63 | ||||
| Cotratamiento | 100 | 24 | 0,24 | 52 | 6 | 0,06 | 5 | 0 | 0,00 | 0 | 30 | 0,30 | 52 |
| ENU 0,1 mmol | 60 | 64 | 1,06 | 6 | 0,10 | 4 | 0,06 | 74 | 1,23 | ||||
| Cotratamiento | 80 | 60 | 0,75 | 31 | 8 | 0,10 | 0 | 0 | 0,00 | 1 | 68 | 0,85 | 31 |
N: número de manchas, f: manchas/ala, %: porcentaja de reducción de manchas del cotratamiento respecto al control positivo, CS: caña santa, ENU: etilmitrosourea.
Discusión
Dado que en ambos experimentos la aplicación de los tratamientos fue crónica, la diferencia observada entre las curvas de toxicidad obtenidas, se explica por las características de los modelos in vitro e in vivo en relación con la eficiencia de destoxificación.
Los estudios citofluorimétricos evidenciaron la capacidad antioxidante de la planta estudiada ante el estrés oxidativo causado por el H2O2. El hecho de que la IF también disminuyó respecto al nivel espontáneo de oxidación metabólica en los cultivos celulares tratados solo con la decocción, sugiere que la acción antioxidante de la caña santa también tiene lugar en el compartimiento intracelular.
Consecuentemente con la capacidad antioxidante demostrada, la decocción de las hojas de caña santa produjo un efecto protector al DNA, manifiesto en la disminución muy significativa de la frecuencia de aberraciones cromosómicas en los cultivos de células CHO, cotratadas con el extracto y H2O2.
La capacidad inhibitoria de la caña santa sobre la inducción de los eventos genéticos medidos por el ensayo mosaico del ala de Drosophila melanogaster, específicamente de los eventos mutacionales, quedó demostrada con la reducción de los porcentajes de las frecuencias de manchas totales en los cotratamientos aplicados respecto al control positivo utilizado. ENU es un potente alquilante de átomos de oxígeno causante de lesiones mutagénicas, lo que concuerda en este experimento con frecuencias incrementadas de manchas simples en relación con los controles negativos; por lo tanto, los porcentajes de reducción de manchas simples y totales, obtenidos con los cotratamientos respecto a ENU a las 2 concentraciones probadas, sugieren que la protección de la caña santa al ADN podría realizarse haciendo que las posiciones de oxígenos sean menos accesibles a la alquilación por ENU, reacción que por demás, debe involucrar una oxidación-reducción para la formación de los aductos causantes de los eventos mutacionales.
Estos resultados ratifican y amplían las propiedades antigenotóxicas de esta especie vegetal, que han sido reportadas por otros autores y permiten inferir que uno de los posibles mecanismos antigenotóxicos de la caña santa esté en relación con su acción antioxidante.
Summary
The protective effect of a decoction of Cymbopogon citratus (DC) Stapf. against genetic damage induced by oxidizing agents H2O2 and ethylnitrosourea was studied. To this end, was used an experimental model in vitro and another in vivo; Chinese Hamster ovary cell culture and Drosophila melanogarster respectively. The colony-forming capacity of CHO cell line was the toxicity indicator used to evaluate 5 Cymbopogon citratus (DC) Stap. decoction concentrations (0,1; 1; 5; 10; 15 %) whereas the percentage of surviving adult insects was used to asses the toxic effect of 4 concentrations of this extract (5; 25; 50; 100 %) on mwh + 1 + flr3 larvae of Drosophila melanogaster. In both cases, the results revealed concentration dependent toxic effects. The cytofluourimetric studies performed on CHO cells with dischlorofluorescein-diacetate showed the antioxidant capacity of the decoction. Non-toxic doses of 0,1; 1 and 5 % caused significant reductions of H2O2 induced oxidative stress. Genotoxicity and antigenotoxicity of the different decoction concentrations were evaluated by chromosomal aberration detection tests in CHO cell and the SMART of Drosophila melanogastes' wings. The results of the mutagenic activity were negative whereas those of the protective capacity of the tested concentrations confirmed the antioxidant capacity of this vegetal extract.
Subject headings: OXIDATIVE STRESS; DNA DAMAGE; ANTIOXIDANTS/therapeutic use; PLANTS, MEDICINAL/therapeutic use; MEDICINE; HERBAL; CRICETULUS/genetic; DROSOPHILA MELANOGASTER/genetic; MODELS, BIOLOGICAL.
Referencias bibliográficas
- Greenberg ER. A clinical trial of Beta carotene to prevent basal-cell and squamous-cell cancers of the skin. N Engl J Med 1990;323:789-95.
- Hartman PE, Shankel DM. Antimutagens and anticarcinogens. Environ Mol Mutagen 1990;15:145-82.
- Carbajal D. Pharmacological screening of plant decoction commonly used in Cuba folk medicine. J Ethnopharmacol 1991;33:21-41.
- Miranda M. Programa nacional de plantas medicinales. Rev Cubana Farm 1995;30:95.
- Tjio JH, Puck T. Genetic of mammalian cells II. Chromosomal constitution of cells in tissue culture. J Exp Med 1958;108:259-68.
- Armstrong MJ, Bean CL, Galloway MS. A quantitative assesment of the cytotoxicity associated with chromosomal aberration detection in Chinese Hamster ovary cells. Mutat Res 1992;265:45-60.
- Bass. Flow cytometric studies of oxidative product formation by neutrophils: a graded response to membrane stimulation. J Immunol 1983;130(4):1910-7.
- De Salvia R, Fiore M, Aglitti T, Festa F, Ricordy R, Cozzi R. Inhibitory action of melatonin on H2O2 and cyclophosphamide induced DNA damage. Mutagenesis 1999;4(1):107-12.
- Galloway MS, Ivett JL. Chemically induced aneuploidi in mammalian cells in culture. Mutat Res 1986;167:89-105.
- Graf U, Wurgler AJ, Katz AJ, Frei H, Juon H, Hall CB et al. Environm Mutagenesis 1984;6:153-88.
- Beranek DT. Distribution of methyl and ethyl adducts following alkylation with monofunctional agents. Mutat Res 1990;285:209-17.
Recibido: 10 de enero del 2000. Aprobado: 18 de mayo del 2000.
Lic. Nancy Cápiro. Laboratorio Genética Toxicológica, Facultad de Biología, Universidad de La Habana. Calle 25 No. 455 e/ J e I. El Vedado. CP 10400, Ciudad de La Habana, Cuba.