Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.20 n.1 Ciudad de la Habana ene.-mar. 2001
Centro Nacional de Investigaciones Científicas
Actividad antioxidante de la ficocianina frente a radicales peroxílicos y la peroxidación lipídica microsomal
Lic. Cheyla Romay, Lic. Diadelis Remírez y Lic. Ricardo González
Resumen
La ficocianina es una biliproteína que se extrae de las algas verdeazules como la Spirulina (Arthospira) máxima. Esta proteína porta 3 grupos cromogénicos (tetrapirroles lineales) por unidad monométrica, que poseen una estructura muy similar a la de la bilirrubina, que es un reconocido antioxidante endógeno. Por otra parte se conoce que otros derivados de las porfirinas, como la clorofila alfa, presentan propiedades antioxidantes. Teniendo en cuenta estos antecedentes, en este trabajo el propósito fue evaluar si la ficocianina presentaba propiedades antioxidantes frente a radicales peroxílicos en diferentes condiciones experimentales como fueron: 1. disminución de la banda de absorción a 620 nm, asociada con la integridad del cromógeno, al reaccionar con radicales peroxílicos; 2. protección de hematíes humanos de la lisis inducida por radicales peroxílicos; 3. inhibición de la peroxidación lipídica microsomal inducida por Fe+2 -ascórbico. Los resultados indicaron que los grupos cromóforos de la ficocianina reaccionaban rápidamente con los radicales peroxílicos, mecanismo por el cual la biliproteína era capaz de proteger los hematíes de la lisis celular y de inhibir la peroxidación lipídica microsomal.
Descriptores DeCS: ANTIOXIDANTES/uso terapéutico; FICOCIANINA/uso terapéutico; PEROXIDACIÓN DE LÍPIDO; CYANOBACTERIAS; EXTRACTOS VEGETALES; MODELOS BIOLÓGICOS; RATAS.
La ficocianina es una biliproteína que se extrae de las algas verdeazules como la Spirulina (Arthospira) máxima. Esta proteína porta 3 grupos cromógenos (tetrapirroles lineales) por unidad monomérica, que poseen una estructura muy similar a la de la bilirrubina, reconocido antioxidante endógeno. Los grupos cromógenos (bilinas) presentan una banda de absorción en los 620 nm asociada con la integridad de este.
Recientemente se ha reportado que la ficocianina presenta propiedades antioxidantes,1 pues es capaz de secuestrar radicales hidroxilo y alcoxilo, y de inhibir la respuesta quimioluminiscente de leucocitos polimorfonucleares activados por zimosan. Teniendo en cuenta estos antecedentes, el propósito en este trabajo fue evaluar si la ficocianina presentaba propiedades antioxidantes frente a radicales peroxílicos, que están involucrados en los procesos de peroxidación lipídica y citotoxicidad.
Métodos
El 2,2'-azobis(2-amidinopropano) (ABAP) es un compuesto que por termólisis y en presencia de oxígeno genera radicales peroxílicos a una velocidad conocida y constante. Este compuesto fue utilizado para evaluar la interacción entre la ficocianina y los radicales peroxílicos, mediante el monitoreo de la disminución de la absorbancia a 620 nm de la ficocianina y el efecto que esta ejerce sobre la lisis inducida por ABAP en eritrocitos humanos. Además se estudió si la ficocianina inhibe la peroxidación lipídica inducida por Fe+2-ascórbico en microsomas aislados de hígado de rata. En todos los estudios se utilizó ficocianina obtenida en el Centro Nacional de Investigaciones Científicas (CNIC) a partir de Arthospira máxima2 y purificada según el método de Neufeld y Riggs.3
El monitoreo de la banda de absorción del cromógeno se realizó en un espectrofotómetro Hewlett Packard 8453 a 37 °C luego de la adición de ABAP (10 mmol) a diferentes concentraciones del cromógeno (7-30 mmol).
Los ensayos de hemólisis mediada por radicales peroxílicos se evaluaron según el método de Sigiyama y otros.4 A una suspensión a 20 % de eritrocitos en 0,34 mol NaCl/10 mmol fosfato de potasio pH 7,4, se le adicionó el mismo volumen de ABAP 150 mmol y diferentes concentraciones de ficocianina, trolox (análogo hidrosoluble de la vitamima E) o ácido ascórbico (vitamina C), utilizados los 2 últimos como antioxidantes (hidrosolubles) de referencia. La mezcla de reacción se incubó a 37 °C con agitación moderada durante 180 min.
Posteriormente cada muestra se diluyó con volúmenes apropiados de 0,9 % NaCl (A) o agua destilada (para lograr 100 % de hemólisis), se centrifugaron a 1 000 g por 10 min y se midió la absorbancia de los sobrenadantes a 540 nm.
Para el estudio de la inhibición de la peroxidación lipídica se aislaron microsomas de hígado de rata mediante ultracentrifugación diferencial y se incubaron (1,3 mg/mL) a 37 °C en tampón Tris 50 mmol pH 7,4 antes de la inducción de la peroxidación lipídica con 10 mmol de FeSO4 y 0,2 mmol de ácido ascórbico recién preparado. Posteriormente se tomaron 0,3 mL de la mezcla de reacción y se añadieron a 2 mL de TBA-TCA-HCl-BHT frío. Luego de calentar por 15 min a 80 °C y centrifugar por 15 min a 2 000 g se determinó la absorbancia a 535 nm.5
Resultados
La exposición de la ficocianina a la fuente de radicales conduce a una pérdida progresiva de la absorbancia a 620 nm, esto indica que la conjugación de la parte bilínica de la proteína se reduce considerablemente como consecuencia de su interacción con los radicales peroxílicos. A partir de la máxima velocidad de decoloración medida, y considerando un peso molecular de 13 000 para cada grupo bilínico, se obtuvo una velocidad máxima de eliminación de estos grupos de 0,92 mmol/min, que si se compara con la velocidad de producción de radicales peroxílicos en estas condiciones experimentales (0,75 mmol/min), se puede concluir que el blanco principal de ataque de los radicales peroxílicos son los grupos cromógenos y que la reactividad de estos es considerablemente mayor que la de la parte proteica (apoproteína).
Cuando el ABAP se añade a la suspensión de eritrocitos este induce hemólisis dependiente del tiempo y de la concentración utilizada de dicho producto, que es inhibida por las diferentes dosis de ficocianina empleadas en la misma forma que los otros 2 antioxidantes evaluados (tabla). Si se considera la CI50, definida como la concentración de aditivo que produce 50 % de inhibición del daño peroxidativo, se observa que la ficocianina resultó ser entre 6 y 7 veces más eficiente que el trolox y el ácido ascórbico.
Tabla. Porcentaje de hemólisis inducida por radicales peroxilo y su inhibición por antioxidantes
|
Aditivo | % Hemólisis |
% Protección | CI50 (mmol) |
|
Ninguno | 92,2 ± 5,4 | - | - |
|
Ficocianina | |||
|
|
88,0 ± 2,4 | 12,0 | |
| 75,5 ± 8,2 | 24,5 | 0,10 |
| 12,5 ± 1,0 | 87,5 | |
| 2,3 ± 0,5 | 97,7 | |
|
Trolox | |||
| 78,5 ± 3,3 | 21,5 | |
|
40,3 ± 7,5 | 59,7 | 0,57 |
|
21,8 ± 7,0 | 78,2 | |
|
Ácido ascórbico | |||
| 86,6 ± 3,5 | 13,4 | |
| 15,7 ± 1,5 | 84,3 | 0,71 |
| 10,3 ± 0,5 | 89,7 |
Nota: El porcentaje de hemólisis se calculó mediante la relación A/B x 100 %. Los experimentos se repitieron 4 veces a cada concentración de aditivo usada. Los datos se expresaron como media ± DE. La CI50 se obtuvo gráficamente mediante un programa Microcal Origin (versión 4.0, 1995).
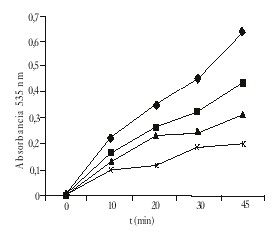
La adición de ficocianina a la fracción microsomal en presencia de Fe+2-ascorbato da por resultado una disminución de la peroxidación lipídica, medida como cantidad de productos reactivos con el TBA formados, que es dependiente del tiempo y de la concentración de ficocianina ensayada (CI50=12 mg/mL) (fig.).
Fig. Cinética de peroxidación lipídica microsomal en ausencia ( ) y presencia de ficocianina: ( ) 8 mg/mL, ( ) ( 12 mg/mL y (x) 20 mg//mL. Cada punto representa la media de 3 determinaciones.
Discusión
Se ha reportado6 que los radicales derivados del ABAP inducen la oxidación de los lípidos y proteínas de la membrana del eritrocito, lo que conduce finalmente a la hemólisis, que es directamente proporcional a la concentración de estos radicales. Además se ha demostrado que los antioxidantes hidrosolubles como el ácido úrico, ascórbico y trolox, secuestran eficientemente los radicales peroxílicos derivados del ABAP en la fase acuosa antes de que estos puedan atacar la membrana del eritrocito, protegiéndolos de esta forma del daño peroxidativo.7
El efecto inhibitorio de la peroxidación lipídica observado pudiera estar relacionado con la capacidad de la ficocianina de secuestrar radicales hidroxilo, pues se ha planteado que el secuestro de radicales iniciadores de la peroxidación lipídica, como los hidroxilo, puede constituir un mecanismo de defensa antioxidativa.8 Sin embargo, la contribución de estos radicales en la peroxidación inducida por Fe+2-ascórbico ha sido seriamente cuestionada, por lo que en este caso debe ser otro el mecanismo por el que la ficocianina protege de la peroxidación lipídica. En este sentido sería interesante esclarecer un posible efecto quelante de esta biliproteína.
En la actualidad existe el criterio de que los radicales libres, en especial los radicales oxígeno centrados como el hidroxilo, alcoxilo y peroxilo, atacan lípidos, carbohidratos, proteínas y al ADN e inducen daño en la membrana, inactivación de enzimas y modificaciones genéticas que conducen finalmente a una serie de eventos patológicos asociados con múltiples enfermedades.9 Por tal motivo, gran parte de las investigaciones actuales se centran en la búsqueda y evaluación de nuevos fármacos potenciales, capaces de interactuar con estas especies y evitar el daño que producen. Teniendo en cuenta los presentes resultados, así como otras investigaciones previas de este grupo de trabajo10 consideramos que este producto natural reúne los requisitos para convertirse en un candidato a fármaco.
Summary
Phycocyanin is a biliprotein from blue green algae as Spirulina (Arthospira) maxima. This protein carries 3 chromogenic groups (linear tetrapyrroles) per monometric unit, with a structure similar to that of bilirubin which is a recognized endogenous antioxidant. On the other hand, it is known that other porphyrin derivatives such as alpha chrlorophyll have antioxidant properties. Taking this into consideration, this paper is aimed at evaluating whether phycocyanin has antioxidant properties to peroxyl radicals or not at different experimental settings, such as 1. reduction of absorption band to 620nm associated to the integrity of chromogen when reacting to peroxyl radicals; 2. protection of human hematids from peroxyl radical-induced lysis; 3, inhibition of Fe+2-ascorbate-induced microsomal lipid peroxidation. The results indicated that choromophore groups of phycocyanin quickly reacted to peroxyl radicals, a mechanism by which this biliprotein was able to protect red cells from cell lysis and inhibit microsomal lipid peroxidation.
Subject headings: ANTIOXIDANTS/therapeutic use; PHYCOCYANIN/therapeutic use; LIPID PEROXIDATION; CYANOBACTERIA; PLANT EXTRACTS; MODELS, BIOLOGICAL; RATS.
Referencias bibliográficas
- Romay CH, Armesto J, Remirez D, González R, Ledón N, García I. Antioxidant and anti-inflammatory properties of C-phycocyanin from blue-green algae. Inflamm Res 1998;47:36-41.
- Benítez F, Travieso L, Dupeiron E. Method for phycocyanin obtainment from microalgae. Cuban Patent (pending) RPI: 111/97.
- Neufeld GJ, Riggs AF. Aggregation properties of C-phycocyanin from Anacystis nidulans. Biochem Biophys Acta 1969; 181:234-43.
- Sugiyama H, Fung KP, Wu TW. Purpurogallin as an antioxidant protector of human erythrocytesgainst lysis by peroxyl radicals. Life Sci 1993;53:39-43.
- Demopolus VJ, Rekka E. Effect of aminoethylpyrroles on carragenan-induced inflammation and on lipid peroxidation in rats: some structural aspects. J Pharm Pharmacol 1994;46:740-4.
- Miki M, Tamai H, Mino M, Yamamoto Y, Niki E. Free-radical chain oxidation of rat red blood cells by molecular oxygen and its inhibition by a-tocopherol. Arch Biochem Biophys 1987;258:373-80.
- Niki E, Komuro E, Takahashi M, Urano S, Ito E, Terao K. Oxidative hemolysis of erythrocytes and its inhibition by free radical scavengers. J Biol Chem 1988;263:19809-14.
- Halliwell B, Gutteridge JMC. Lipid peroxidation: a radical chain reaction. En: Free radicals in biology and medicine. 2 ed. Oxford: Claredon Press,1989:200-36.
- Sies H. Oxidative stress. Oxidants and antioxidants. New York: Academic, P, 1991.
- Romay CH, Ledón N, González R. Further studies on anti-inflammatory activity of phycocyanin in some animal models of inflammation. Inflamm Res 1998;47:334-8.
Recibido: 10 de febrero del 2000. Aprobado: 18 de mayo del 2000.
Lic. Cheyla Romay. Centro Nacional de Investigaciones Científicas. Avenida 25 y 158. Apartado Postal 6990, Cubanacán, Ciudad de La Habana, Cuba.