Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.20 n.1 Ciudad de la Habana ene.-mar. 2001
Centro de Investigaciones Biomédicas de Cuba
Universidad Autónoma de México
Tinidazol: una droga antimicrobiana con actividad genotóxica
Lic. Gisell Rodríguez Ferreiro, Lic. Lourdes Cancino Badías, Dr. Elio Prieto González y Dr. Javier Espinosa Aguirre
Resumen
La reducción del grupo nitro presente en varios medicamentos, pesticidas y materiales de uso diario, produce especies reactivas del oxígeno capaces de interactuar con el ADN. El tinidazol, una droga antimicrobiana de la familia de los 5 nitroimidazoles, fue evaluada por el ensayo cometa. Se estudió la capacidad de la droga para inducir roturas de simple cadena y sitios sensibles al álcali, expresado como el porcentaje de células dañadas y el porcentaje de células en cada nivel de daño. En el ensayo in vitro a concentraciones de 100, 250 y 500 mg/mL se encontró inducción de roturas en los cromosomas de leucocitos de ratón a los 30 min de exposición, esto describió una relación dosis respuesta. La importancia de la reducción del grupo nitro, mediada por la acción de nitrorreductasas microsomales hepáticas, para la actividad mutagénica de los nitroimidazoles, ha sido estudiada. Sin embargo, estos resultados revelaron que el tinidazol no necesitaba ser metabolizado para inducir el daño. A los 30 min de reparación el daño en los leucocitos se mantuvo, a los 60 min solamente el daño producido con la concentración de 500 mg/mL de tinidazol había sido reparado. A concentraciones mayores se disparan diferentes mecanismos de reparación para no comprometer la viabilidad celular. Estos mecanismos pueden ser responsables de estos hallazgos, se reparan las roturas aunque se comprometa la fidelidad de la secuencia del ADN. In vivo se pudo observar que una dosis de 100 mg/kg de peso era capaz de inducir daño en el ADN de los leucocitos de ratón. Este efecto fue observado a las 24 y 48 h después del tratamiento con una dosis 3 veces superior a la dosis terapéutica (2 g/d). El mecanismo propuesto para explicar el efecto clastogénico de los 5 nitroimidazoles está relacionado con la formación de un anión nitro, que se reoxida y genera especies reactivas del oxígeno.
Descriptores DeCS: DAÑO DEL ADN; TINIDAZOL/uso terapéutico; TINIDAZOL/toxicidad; ESPECIES DE OXÍGENO REACTIVO; RATONES CONSANGUÍNEOS BALB C.
El grupo nitro está presente en varios medicamentos, pesticidas y materiales de uso diario. El tinidazol, un antiinfeccioso que pertenece a los nitroimidazoles, se aplica en infecciones causadas por Trichomona vaginalis, Entamoeba hystolitica y Giardia lambia1 y en la profilaxis de infecciones perioperatorias de cirugías digestivas y ginecológicas.2 También se utiliza en el tratamiento de Helicobacter pylori3 y en inflamaciones periodontales.4 Este principio activo interacciona con el ADN de la célula bacteriana, produce inhibición de la síntesis de ácidos nucleicos y muerte celular. La nitrorreducción de estos compuestos es necesaria para su actividad mutagénica;5-7 sin embargo en células de mamíferos el daño al ADN está relacionado con la formación de especies reactivas del oxígeno, que varían de un compuesto a otro dependiendo de la posición que ocupe el grupo nitro dentro de la molécula.6,8,9 El objetivo de este trabajo fue conocer la capacidad del tinidazol de inducir rupturas de simple cadena en leucocitos de ratón, in vitro e in vivo, con la utilización del ensayo cometa. Además, se estudió la capacidad reparativa de estas células in vitro y después de un tratamiento con una dosis 3 veces superior a la dosis terapéutica (2 g/d).
Métodos
In vitro: 80 µL de sangre fueron expuestos durante 30 min a 37 °C, a 3 concentraciones de tinidazol (100, 250 y 500 µg/mL). Para medir la reparación, se incubó a 37 °C, durante 30 y 60 min y se utilizó el peróxido de hidrógeno (350 mmol) como control positivo.
In vivo: 100 mg de tinidazol/kg de peso se inocularon por vía intraperitoneal en ratones Balb/c, cada animal fue su propio control y la ciclofosfamida (100 mg/kg de peso) el control positivo. Las muestras de sangre se tomaron a las 24 y 48 h después de la inoculación.
Ensayo cometa: 10 µL de la suspensión celular se mezclaron con 75 µL de agarosa de bajo punto de fusión (0,5 %) y se extendieron en láminas portaobjetos. Se añadió la tercera capa de ABPF (75 µL) y las láminas fueron puestas en lisis (2,5 mol NaCl, 100 mmol EDTA, 10 mmol Tris, lauril sarcosinato de sodio 1 %, pH 10; Tritón X100 1 %, DMSO 10 %) 1 h a 4 °C. El desenrollamiento se realizó en la solución tampón (300 mmol de NaOH, 1 mmol EDTA, pH 12,6) a 4 °C, durante 20 min. Se corrió la electroforesis a 25 V y 250 mA durante 30 min. Posteriormente se lavaron las láminas con el tampón de neutralización (0,4 mol Tris, pH 7,5) y se tiñeron con bromuro de etidio (20 µg/mL). Se analizaron 200 células por tratamiento en un microscopio de fluorescencia y se expresó el daño al ADN como el porcentaje de células dañadas y el porcentaje de células en cada nivel de daño. Se consideraron 5 categorías arbitrarias (nivel 0, no migración; nivel 1, migración corta; nivel 2, migración media; nivel 3, migración larga y nivel 4, núcleo no definido). La viabilidad celular se midió utilizando la técnica de exclusión con tripan azul. Los grupos fueron comparados entre sí por la prueba t de Student, para 95 y 99 % de significación, utilizando el paquete estadístico MICROSTAT.
Resultados
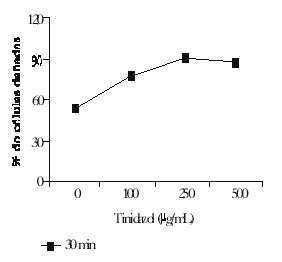
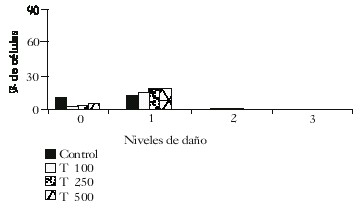
Ensayo cometa in vitro: Se observó un incremento significativo del porcentaje de células dañadas en las 3 concentraciones ensayadas (fig. 1). También se encontró que 100 y 250 µg/mL de tinidazol incrementaron significativamente el porcentaje de células con migración media, con respecto al control (fig. 2), mientras que 500 µg/mL aumentó la cantidad de células con migración corta. Estos incrementos se corresponden con una disminución significativa de células sin migración del ADN para todas las concentraciones ensayadas; esto confirma los resultados obtenidos para el porcentaje de células dañadas.
Fig. 1. Efecto genotóxico del tinidazol en leucocitos a los 30 min de exposición (p = 0,05).
Fig. 2. Porcentaje de células en cada nivel de daño a los 30 min de exposición (p = 0,05)
Durante la reparación por escisión de bases y nucleótidos se generan rupturas, que pueden ser también causa de la migración del ADN en el ensayo cometa.10,11 Después de 30 min no ha sido reparado el daño generado por el tinidazol. A los 60 min, no existen diferencias significativas con respecto al control del porcentaje de células no dañadas y en los diferentes niveles de daño solo para 500 µg/mL.
Ensayo cometa in vivo: Se obtuvieron diferencias significativas entre los animales antes y después del tratamiento para el porcentaje de células dañadas (fig. 3). A diferencia del estudio in vitro, donde se encontraron solamente células con migración corta y media, el tinidazol in vivo indujo la formación de colas largas (nivel 3).
Fig. 3. Porcentaje de células dañadas. Ensayo cometa in vivo (p = 0,05) (p = 0,01).
Discusión
Los resultados in vitro demuestran que este fármaco no necesita de activación metabólica para generar rupturas de simple cadena en leucocitos de ratón. Re y otros, en 1997,8 demostraron que el metronidazol y el dimetridazol, 2 medicamentos con estructura similar al tinidazol, inducen roturas en el ADN de linfocitos humanos, en ausencia de activación metabólica y en condiciones aerobias. La toxicidad obtenida en estas condiciones parece estar relacionada con la reducción de un electrón de la molécula parental y la producción del radical nitro, que en presencia de oxígeno es reoxidado y genera especies reactivas,8 como ya fue demostrado para el 1-metil-2-nitroimidazol.9
Dependiendo de la concentración y la magnitud del daño, funcionan 1 o más mecanismos de reparación.12 Cuando se compromete la vida de la célula, se dispara el mecanismo de reparación SOS y los fragmentos son reparados aunque se pierda la fidelidad de la secuencia original,13 lo que puede explicar los resultados obtenidos en el ensayo de reparación.
La formación de hidroxilamina, que puede ser convertida por vía enzimática o no enzimática a un ión electrofílico, potencia la actividad mutagénica del tinidazol y el metronidazol,6 y puede ser el responsable de generar un daño característico de agentes como el peróxido de hidrógeno y las radiaciones ionizantes.10 En estos resultados se observa que el tinidazol daña el ADN en el nivel cromosómico, a dosis 3 veces mayor que la dosis terapéutica (2 g/d), aunque ya a dosis de 50 mg/kg de peso se induce la formación de micronúcleos en ratones.
Las rupturas de simple cadena son el resultado de diferentes tipos de reacciones que incluyen: reparación por escisión de bases y nucleótidos, roturas producidas por el ataque de un compuesto químico o radiaciones, escisión por causa de la unión de agentes intercalantes, aductos del ADN, acción de las endonucleasas o topoisomerasas y la acción de hidrolasas.11 El ensayo cometa reveló que el tinidazol induce roturas de simple cadena en leucocitos de ratón, in vitro e in vivo, pero cuál de estos mecanismos puede ser el responsable del efecto clastogénico de esta droga, no ha sido estudiado.
Otros estudios deben ser objetivo de investigaciones futuras, en las que se esclarezca la contribución del metabolito hidroxilado, la relevancia de las enzimas antioxidantes, la contribución de las roturas inducidas por los mecanismos de reparación, así como el estudio del efecto geno-tóxico del tinidazol en células humanas.
Summary
The reduction of the mitro group existing in various drugs, pesticides and materials of daily use gives rise to reactive oxygen species capable of interacting with DNA. Tinidazole, an antimicrobial drug of the family of the 5 nitroimidazols was tested using a comet assay. The capacity of this drug to induce single chain breaks and alkali-sensitive sites expressed as the percentages of damaged cells and cells at each level of damage was studied. The in vitro assay at concentrations of 100, 250 and 500 µ/mL showed the induction of breaks in rat leukocyte chromosomes after 30 minutes of exposure. This indicated a dosage-response ratio. The importance of the hepatic microsomal nitroreductase-mediated nitro group reduction for the mutagenic activity of nitroimidazols has been studied. However, these results revealed that tinidazole did not require to be metabolized to induce damage. After 30 minutes of repair, the leukocyte damage persisted, and 60 minutes after only the damage caused by the 500 µ/ml tinidazole concentration had been repaired. At higher concentrations, different repair mechanisms are triggered so as not to put cell viability in jeopardy. These mechanisms may be responsible for these findings; the breaks are repaired even if the fidelity of DNA sequence is endangered. It can be observed in the in vivo/assay that a dose of 100 mg/kg weight can induce damage in mouse leukocyte DNA. This effect was seen 24 and 48 hrs after the treatment with a dose that triplicated the therapeutical dose (2g/day). The suggested mechanism for explaining the clastogenic effect of the five nitrimidazols is related with the formation of a nitro annion which re-oxidizes an generates reactive oxygen species.
Subject headings: DNA DAMAGE; TINIDAZOLE/therapeutic use; TINIDAZOLE/toxicity; REACTIVE OXYGEN SPECIES; INBRED BALB C.
Referencias bibliográficas
1. Saurina G, De Méo L, McCormack WM. Cure of metronidazole and tinidazole resistant Trichomoniasis with use of high dose oral and intravaginal tinidazole. Clin Infect Dis 1998;26(5):1238.
2. Brismar B, Edlund C, Malmborg A, Nord C. Ecological impact of antimicrobial prophylaxis on intestinal microflora in patients undergoing colorectal surgery. Scand J Infect Dis 1990;70:25.
3. Oderda J, Ponzetto A, Boero M, Bellis D, Forni M, Vaira D et al. Family treatment of symptomatic children with Helicobacter pylori infection. Ital J Gastroenterol Hepatol 1997;29(6):509.
4. Bercy P, Adriaenssen C. Effect of tinidazole on gingival inflammation and subgingival plaque. Curr Therap Res 1990;47:306.
5. De Méo M, Vanelle P, Bernadini E, Laget M, Maldonado J, Jentzer O et al. Evaluation of the mutagenic and genotoxic activities of 48 nitroimidazoles and related imidazole derivatives by the Ames test and the SOS Chromotest. Environ Mol Mutat 1992;19:167.
6. Gupta RL, Vats V, Juneja TR. Activation of tinidazole, analogous antiprotozoal drug to a mutagen by mammalian liver S9. Mutat Res 1996;370:195.
7. Espinosa JJ, Torre RA, Lares I, Rubio J, Dorado V, Wong M et al. Bacterial mutagens in the urine of patients under tinidazole treatment. Mutat Res 1996;359:133.
8. Re JL, De Méo MP, Lagel M, Gulraad H, Castegnare M, Vanelle P et al. Evaluation of the genotoxic activity of metronidazole and dimetridazole in human lymphocytes by the comet assay. Mutat Res 1997;375(2):147.
9. Brezden C, Horn L, McClelland R, Rauth A. Oxidative stress and 1-methyl-2-nitroimidazole cytotoxicity. Biochem Pharmacol 1998;56(3):335.
10. Tice R. The single cell gel/comet assay: a microgel electrophoretic technique for detection of DNA damage and repair in individual cells. En: Phillips DH, Venitt S, eds. Environmental mutagenesis. Oxford Bios, 1995:315.
11. Horváthová E, Slamenová D, Hlicíková L, Kumar T, Gábelová M, Collins A. The nature and origin of DNA single strand breaks determined with the comet assay. Mutat Res 1998;409:163.
12. Yu Z, Chen J, Ford BN, Brackley ME, Glickman BW. Human DNA repair systems: An overview. Environ Mol Mutag 1999;33:3.
13. Voet D, Voet JG. DNA replication, repair, and recombination. En: Biochemistry. 2nd ed. 1995:1046.
Recibido. 10 de febrero del 2000. Aprobado: 18 de mayo del 2000.
Lic. Gisell Rodríguez Ferreiro. Centro de Investigaciones Biomédicas "Victoria de Girón". Avenida 146, No. 3102 esquina a 31, reparto Cubanacán, municipio Playa, Ciudad de La Habana, Cuba. CP 11600.