Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.20 n.2 Ciudad de la Habana abr.-jun. 2001
Instituto de Ciencias Básicas y Preclínicas "Victoria de Girón"
Hospital Militar "Carlos J. Finlay"
Axotomía vago-simpático cervical y degeneración nerviosa intrapulmonar en ratas
Dr. Antonio Barber Gutiérrez, Dra. María O. Fox Pascual, Dra. Vivian González Aguilar, Dra. Alina Ruiz Piedra y Dra. Luisa Castillo Guerrero
Resumen
La axotomía de un nervio periférico conduce a la interrupción de la continuidad del axón, con degeneración walleriana en el segmento distal de la neurona. El proceso postraumático del nervio lesiona el axón y su vaina de mielina y el material dañado es invadido por fagocitos hematógenos, que remueven con el tiempo la gran mayoría de las fibras de mielina y otras células endoneurales. Este hecho permitió el seguimiento del trayecto nervioso intrapulmonar, después de la sección del tronco vago-simpático cervical en la rata, por la aparición en el proceso degenerativo de productos de desintegración de lípidos de la mielina, teñidos con Sudán III y IV. El objetivo del trabajo fue poner en evidencia y se demostró el trayecto de las fibras autónomas intrapulmonares y su relación con las divisiones más finas de los bronquios respiratorios, por la función que el sistema autónomo tiene en el asma bronquial.
DeCS: AXOTOMIA; NERVIO VAGO/cirugía; NERVIOS PERIFERICOS/cirugía; DEGENERACION WALLERIANA; PULMON/inervación; FIBRAS NERVIOSAS MIELINIZADAS; SISTEMA NERVIOSO SIMPATICO/cirugía; RATAS DE CEPAS CONSANGUINEAS/cirugía; ANIMALES DE LABORATORIO.
La axotomía de un nervio periférico conduce a la degeneración del cabo distal del nervio, donde ocurre un proceso conocido como degeneración walleriana (WD), que es una respuesta inflamatoria de los nervios periféricos a la injuria. Si bien la mayor parte de estos experimentos estudian los acontecimientos de regeneración que suceden en el cabo proximal, el interés con la sección de los axones de las neuronas preganglionares del vago y los pos ganglionarses del simpático a su paso por el cuello de la rata, fue estudiar el proceso degenerativo de los cabos distales para que sirvieran de marcadores de la trayectoria de la inervación autónoma intrapulmonar.
A la inervación autónoma intrapulmonar se le ha postulado un papel activo en el asma bronquial, fundamentado en el hecho, entre otros, de que la estimulación eléctrica del cabo distal de los nervios vagos produce broncoconstricción, mientras que el simpático dilata los bronquios.1 De ahí que el objetivo del trabajo fue poner en evidencia la relación de contigüidad que guardan las fibras autónomas intrapulmonares con las divisiones más finas de los bronquios respiratorios, donde los neurotransmisores ejercen su función en el control del calibre bronquial.
Los cambios moleculares en el cabo distal incluyen la exposición de receptores de membrana de neurotrofinas, moléculas de adhesión de células nerviosas, citoquinas y otros factores solubles.2
Para seguir el trazado de un nervio en WD se ha utilizado un anticuerpo policlonal purificado contra el carbono terminal del neuropéptido tirosina (NPY), pues la proteína receptora Y1 está presente en la degeneración de las fibras del sistema nervioso central, donde se produce un intenso marcado inmunológico.3 Sin embargo, esta técnica se ha probado en los receptores somáticos de neuronas ganglionares de pequeñas raíces dorsales, en la sección del nervio ciático y en la termocoagulación de corteza parietal, pero no en fibras autónomas. El modo como la sección del nervio cervical repercutió en la inervación intrapulmonar, fue investigado por medio de métodos histoquímicos para lípidos, por la aparición en el proceso degenerativo de productos de desintegración de los lípidos de la mielina (cerebrósido, colesterol, esfingomielina) en bloques de tejido fijado.
Métodos
Los pulmones una vez extraídos, se fijaron en formol neutro 10 %. La tinción para microscopia óptica se realizó en secciones de parafina de 6 micrómetros de espesor, según la técnica de Kay y Whitehead de Sudán III y IV. Para el análisis histológico se usó un fotomicroscopio NU Karl Zeis. La imagen del tejido fue proyectada a una amplificación de 140 veces sobre una pantalla con 25 cruces dibujadas. En 8 campos, el tipo de tejido bajo las cruces fue determinado y expresado en porcentaje.4 La amplificación total del tejido fue de 560 veces.
Se utilizaron 8 ratas Sprague-Dawley de los dos sexos con un promedio de peso de 250 ± 20 g, las que se anestesiaron con pentobarbital sódico en dosis de 30 mg/kg de peso por vía IP. A 6 de las ratas se les practicó la sección unilateral del tronco vago-simpático derecho en el cuello, en una extensión de aproximadamente 6 mm, bajo microscopio estereoscópico, en el nivel del tercer anillo traqueal, cuando el nervio viaja junto a la arteria carótida primitiva. Después de la operación los animales estuvieron en observación bajo su régimen de vida habitual. Todos los animales se sacrificaron por embolismo gaseoso con inyección de aire en una de las venas del rabo.
Las ratas se comenzaron a matar a las 24 h de operadas, de acuerdo con los rangos dados por la literatura de la aparición de la WD (a las 5 h) y la desaparición completa de los restos axómicos (4 semanas), por la actividad de los macrófagos en ratas, monos y humanos.5-8 El programa de muerte fue el siguiente: una el primer día, otra a los 7,11, 15, 19 y 25 d.
Los pulmones fueron fijados en posición inspiratoria normal por insuflación del formol por la tráquea. Siguiendo el método de análisis histológico de Dunnill,4 se escogieron 2 láminas por cada pulmón (4 por animal) de los 2 animales utilizados como controles, lo que hizo un total de 8 láminas, donde se observaron 64 campos microscópicos en busca de gotas de grasa coloreada y se analizaron 1 600 cruces. Del grupo experimental se tomaron igualmente 2 láminas por cada pulmón (24 en total) para 192 campos y 4 800 cruces. Los controles histológicos normales se prepararon sometiendo los pulmones de las 2 ratas a todo el procedimiento histoquímico empleado con las lesionadas.
Los elementos que se tomaron en cuenta para identificar el nervio en el proceso de degeneración, fueron la tinción en rojo de goticas de grasa por los Sudanes, así como la distribución en filas de estas goticas; pues se observaron acúmulos de goticas teñidas que no representaban, aparentemente, fibras nerviosas y que pudieran corresponder a depósitos o macrófagos con lípidos fagocitados.9,10 Para las comparaciones se realizaron análisis de varianza para una probabilidad no mayor que 5 %.
Resultados
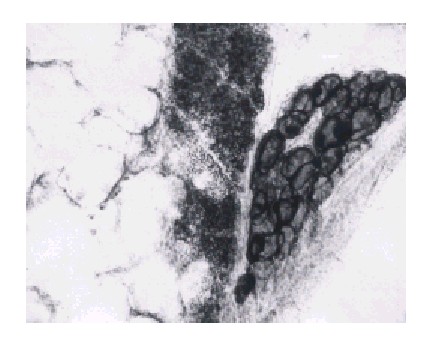
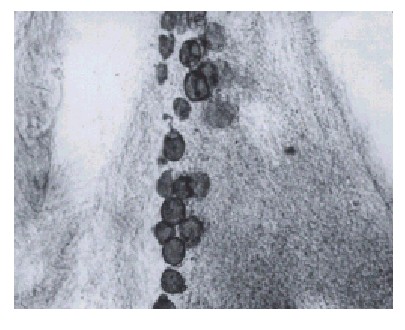
La figura 1 es una fotografía del campo microscópico de un pulmón de rata teñido según se explicó en métodos, después de 1 d de axotomía. A la izquierda se observan espacios aéreos que corresponden a tejido alveolar y en la parte superior derecha una amplia zona vacía que debe corresponder a la luz de una vía aérea, que por la ampliación del campo y el radio de curvatura debe medir alrededor de 100 micrómetros, lo que corresponde a un bronquiolo. En su borde aparece una zona de forma elipsoidal de goticas de grasa que bien puede interpretarse como grasa pulmonar, pero que por su forma un tanto regular y sus dimensiones (unos 130 micrómetros de eje mayor), pudiera tratarse de un ganglio vegetativo intrapulmonar, donde las neuronas parasimpáticas pre y pos hacen sinapsis.
Fig. 1. Lámina x 560. Corresponde a un corte histológico de pulmón de rata con 1 d de axotomizada. Aparece la desintegración de la mielina en forma de gránulos redondos.
En la figura 2 la rata lleva 7 d de axotomizada. Se presenta una zona de forma semejante a la anterior, que parece bordear una vía aérea de similares dimensiones, y de cuya zona se pudiera hacer también iguales consideraciones que en la figura anterior.
Fig. 2. Lámina x 560. Corte de un pulmón de rata de 7 d de operada.
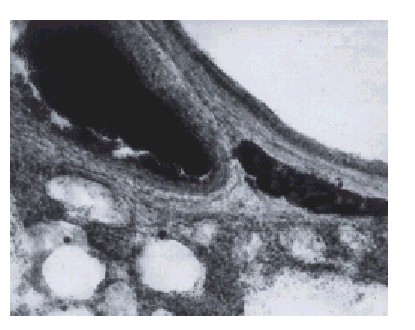
En la figura 3, las goticas de grasa presentan la disposición más típica de un trayecto nervioso; siempre colocado en la vecindad de una vía aérea, en los pulmones de 11 d de realizada la injuria. La zona teñida por los Sudanes llega a definirse como una terminación en la figura 4.
Fig. 3. Lámina x 560. Rata de 11 d de operada. Aparecen las gotas de grasa teñida, con una ordenación lineal, características del trayecto de una fibra.
Fig. 4. Lámina x 560. Parece definirse una terminación.
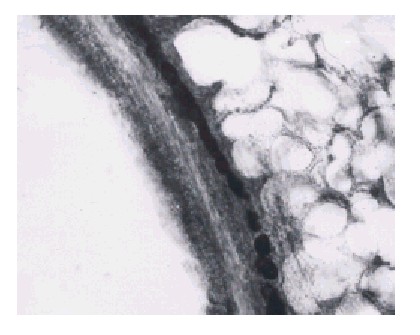
Las figuras 5 y 6 presentan cortes de pulmones con axotomía de 15 y 19 d, respectivamente. El ordenamiento francamente lineal de las gotas de grasa evidencia un trayecto de fibra. No obstante, ya en este momento la actividad de los fagocitos, es probable que, haya determinado que las goticas de grasa sean cada vez más escasas.
Fig. 5. Lámina x 560. Corresponde a 15 d de practicada la axotomía. Se puede observar una disminución marcada de los gránulos.
Fig. 6. Lámina x 560. Rata de 19 d de operada.
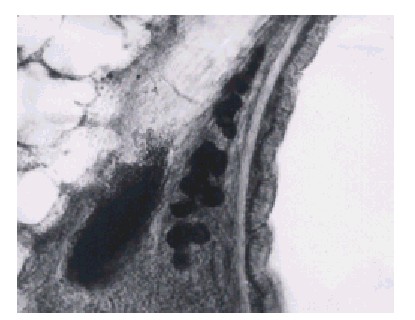
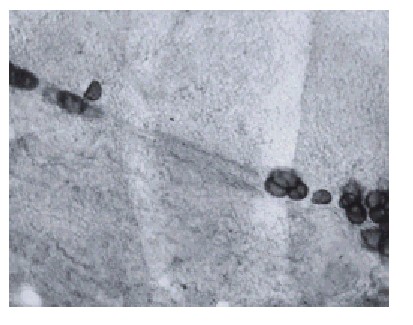
Por último, la figura 7 muestra el trayecto de una fibra nerviosa que termina en una estructura lo más probable ganglionar, que a este tiempo de operación (25 d) muestra un rastro correspondiente a restos de la fibra que se presenta como vainas o trayectos vacíos. Es conocido que la WD es prerrequisito para la generación nerviosa11 y en este último proceso aparecen unos tubos de pequeño diámetro que expresan la superficie de moléculas que guían la regeneración de las fibras y se conocen como bandas de Bungner,2,12 por lo tanto, la figura 7 también puede ser interpretada de esta manera.
Fig. 7. Lámina x 560. Rata de 25 d de operada. Se ve muy disminuida la grasa teñida y trayectos vacíos que posiblemente son restos de la fibras nerviosas o bandas de Bungner.
La tabla 1 expresa que 2,59 % de las cruces examinadas en el pulmón izquierdo presentaron goticas coloreadas reunidas formando piñas, algunas sin forma geométrica definida, lo que fue interpretado como la grasa habitual del pulmón. En el pulmón derecho, semejantes estructuras microscópicas aparecieron en 3,11 % de las zonas examinadas bajo las cruces, sin significación estadística entre ambos pulmones. En los pulmones con axotomía, los promedios de grasa pulmonar o grasa no dependiente de la degeneración nerviosa (o no característica de este proceso), fueron 2,75 % para el pulmón izquierdo y 2,45 % para el pulmón derecho, sin significación estadística entre ambos ni con los controles correspondientes. También la tabla 1 expone el promedio de cruces que tuvieron grasa con alineación característica de nervios, tanto en el pulmón izquierdo intacto como en el derecho axotomizado. El análisis de varianza entre estos resultados resultó significativo a p < 0,05, con predominio de degeneración en el pulmón con axotomía. Debe destacarse el dato que se obtiene del pulmón izquierdo, cuál es la degeneración mielínica en 6,12 % de las áreas examinadas.
Tabla 1. Grasa por degeneración de vainas de mielina en pulmones de ratas
| Grupos | Pulmón | % | P | ||||
| X | S | CV | |||||
| Grasa control | Derecho | 3,11 | 1,20 | 38,58 | NS | ||
| Grasa después de la descentralización | Derecho | 2,45 | 0,90 | 36,74 | |||
| Grasa por degeneración mielínica | Derecho | 16,80 | 2,48 | 14,76 | NS | ||
| Grasa control | Izquierdo | 2,59 | 0,66 | 25,48 | 0,05 | ||
| NS | |||||||
| Grasa después de la descentralización derecha | Izquierdo | 2,75 | 0,71 | 25,81 | |||
| Grasa por degeneración mielínica | Izquierdo | 6,12 | 1,35 | 22,04 | |||
La tabla 2 expone el porcentaje de grasa de la WD según los días de la axotomía. Con estos porcentajes se confeccionó la regresión de la figura 8 que dio valores de r muy cercanos a 1 (0,96 para el pulmón derecho y 0,98 para el izquierdo). Estas relaciones pueden interpretarse en términos de que, mientras la desaparición de la grasa habitual de los pulmones se mantiene sin ninguna dependencia del tiempo (fig. 9), la grasa de mielina desaparece con el tiempo según una función logarítmica.
Tabla 2. Grasa por degeneración de vainas de mielina según los días de operadas
| Días de operadas | ||||||
| 1 | 7 | 11 | 15 | 19 | 25 | |
| Grupos | % | % | % | % | % | % |
| Grasa por degeneración mielínica en pulmón derecho descentralizado (400 =100 %) | 39,0 | 26,0 | 17,5 | 10,5 | 6,0 | 2,0 |
| Grasa por degeneración mielínica en pulmón izquierdo intacto (400 =100 %) | 9,0 | 7,7 | 6,2 | 5,2 | 5,0 | 3,8 |
| Grasa por degeneración mielínica en ambos pulmones | 48,0 | 33,7 | 23,7 | 15,7 | 11,0 | 5,8 |
Fig. 8. Regresión de grasa de mielina degenerada en ambos pulmones sobre días desde la operación (r=0,96).
Fig. 9. Distribución de la grasa intrapulmonar con los días de operación.
Discusión
La histoquímica de los lípidos ha desarrollado técnicas con múltiples colorantes por métodos físicos y químicos. Kay y Whitehead ensayaron gran número de tinturas de Sudán y recomendaron la unión de Sudán III y IV. Daddi fue el primero en usar Sudán III para tinción in vitro de las grasas. Después de haber sido ingerida por los animales, fue demostrada en los tejidos por su color rojo. Michaelis4 propuso el Sudán IV para teñir grasas.
Este autor demostró que la tinción de las grasas con tinturas de Sudán es puramente física y depende de la solubilidad de la tintura inerte en las grasas.
En los resultados aparecen fibras mielinizadas en degeneración en el pulmón axotomizado y en el pulmón intacto. Esto confirma la inervación pulmonar contralateral ya referida por Honjín.13
La grasa de la mielina en degeneración fue un elemento extraño en el parénquima pulmonar, que desapareció con el tiempo; este hallazgo demuestra que se trata de una consecuencia de la sección nerviosa, pues no sucedió de igual manera con la grasa habitual del pulmón.
Una vez demostrada la existencia del trayecto intrapulmonar de las fibras del sistema nervioso autónomo, la ubicación de las fibras marcadas, junto a finos trayectos bronquiales confirma el papel funcional de este sistema en el control del diámetro de las vías aéreas intrapulmonares, en cuyos músculoslisos tienen oportunidad de descargar sus neurotrasmisores respectivos.
Como conclusión se demuestra la inervación intrapulmonar autónoma. También, que las fibras marcadas del sistema nervioso autónomo se hallaron siguiendo el trayecto de finas vías aéreas intrapulmonares y que la contigüidad estructural fibra nerviosa-bronquio permitió comprender la función reguladora del simpático y el parasimpático sobre el calibre bronquial.
Agradecimientos
A la técnica de laboratorio Haydée Rodríguez Yanes que tuvo a su cargo la mayor parte experimental y computacional del trabajo.
Summary
The axotomy of a peripheral nerve leads to the interruption of the continuity of the axon with wallerian degeneration in the distal segment of the neuron. The posttraumatic process of the nerve injures the axon and its sheath of myelin and the damaged material is invaded by haematogenous phagocytes that with the course of time remove most of the myelin fibers and other endoneural cells. This fact allowed to follow the nervous intrapulmonary pathway after the section of the vagosympathetic cervical trunk in the rat, due to the appearance in the degenerative process of products of the desintegration of lipids from myelin, stained with Sudan III and IV. The aim of this paper was to show the pathway of the autonomic intrapulmonary fibers and their relationship with the thinnest divisions of the respiratory bronchi, taking into account the function of the autonomic nervous system in bronchial asthma.
Subject headings: AXOTOMY; VAGUS NERVE/surgery; PERIPHERAL NERVES/surgery; WALLERIAN DEGENERATION; LUNG/innervation; NERVE FIBERS, MYELINATED; SYMPATHETIC NERVOUS SYSTEM/surgery; RATS, INBRED STRAINS/surgery; ANIMALS, LABORATORY.
Referencias bibliográficas
- Bigby TD, Wasserman SI. Asthma. En: Stein JH, ed. Internal Medicine. 4th ed. St. Louis:Mosby-year Book, 1994:2387.
- Stoll G, Muller HW. Nerve injury, axonal degeneration and neural regeneration: basic insights. Brain Pathol 1999;9(2):313-25.
- Pesini P, Kopp J, Wong H, Walsh JH, Grant G, Hokfelt T. An immunohistochemical marker for wallerian degeneration of fibers in the central and peripheral nervous system. Brain Res 1999;828(1-2):41-59.
- Dunnill MS. Quantitative methods in the study of pulmonary pathology. Thorax 1962;17:320.
- Beéri H, Reichet F, Saada A, Rotshenker S. The cytokine network of wallerian degeneration: IL-10 and GM-c S F, Eur J Neurosci 1998;10(8):2707-13.
- Castillo M, Mukherji SK. Early abnormalities related to postinfarction wallerian degeneration: evaluation with MR diffusion-weighted imagin. J Comput Assist Tomogr 1999;23(6):1004-7.
- Tamm ER, Rohen JW, Schmidt K, Robinson JC, Wallow IH, Kaufman PL. Superior cervical ganglionectomy in monkeys: light and electron microscopy of the anterior eye segment. Exp Eye Res 1997;65(1):31-43.
- Taskinen HS, Olsson T, Bucht A, Khademi M, Svelander LFN. Gamma IL-10 and TNF alpha mRNA. J Neuroinmunol 2000;102(1):17-25.
- da Costa CC, Van der Lann LJ, Dijkstra CD, Bruck W. The role of the mouse macrophage scavenger receptor in myelin phagocitosis. Eur J Neurosci 1997;9(12):2650-7.
- Brown HC, Castano A, Fearn S, Towsend M, Edwards G, Streuli C, et al. Adhesion molecules involed in macrophage responses to wallerian degeneration in the murine peripheral nervous system. Eur J Neurosci 1997;9(10):2057-63.
- Terada M, Yasuda H, Kikkawa R. Delayed wallerian degeneration and increased neurofilament phosphorylation in sciatic nerves of rats with streptozocin-induced diabetes. J Neural Sci 1998;155(1):23-30.
- Bradley JL, Abernethy DA, King RH, Muddle JR, Thomas PK. Neural architecture in transected rabbit sciatic nerve after prolonged nonreinnervation. J Anat 1998;192(pt4):529-38.
- Honjin R. On the nerve supply of the lung of the mouse, with special reference to the structure of the peripheral vegetative nervous system. J Cop Neurol 1956;105:1-19.
Recibido: 20 de septiembre del 2000. Aprobado: 30 de septiembre del 2000.
Dr. Antonio Barber Gutiérrez. Instituto de Ciencias Básicas y Preclínicas "Victoria de Girón". Avenida 146 No. 3102, municipio Playa, Ciudad de La Habana, Cuba. CP 11600.