Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.22 n.1 Ciudad de la Habana ene.-mar. 2003
Instituto de Ciencias Básicas y Preclínicas "Victoria de Girón"
Instituto Nacional de Endocrinología y Enfermedades Metabólicas
Centro de Ingeniería Genética y Biotecnología
Lipoproteína (a): estructura, metabolismo, genética y mecanismos patogénicos
Dr. Lázaro E. Alba Zayas, Dra. Giovanna Pereira Roca y Dr. Arístides Aguilar Betancourt
Resumen
Se establecieron las características más sobresalientes de la lipoproteína (a), así como los mecanismos patogénicos de esta partícula lipoproteínica relacionados con la aterotrombogénesis. La lipoproteína (a) [Lp (a)], descubierta por Kare Berg en 1963, posee una composición similar a la de la lipoproteína de baja densidad (LDL). En su estructura también presenta a la apolipoproteína (a) [apo (a)], la cual está unida a la apo B100 mediante un enlace disulfuro. El aspecto más interesante de la biología de la Lp (a) lo constituye, sin dudas, la sorprendente homología estructural que existe entre el plasminógeno y la apo (a); esta apolipoproteína, además, es la responsable de las propiedades metabólicas y bioquímicas de la lipoproteína (a). Por su estructura peculiar y la correlación existente entre los niveles elevados de la Lp (a) y el desarrollo de complicaciones aterotrombóticas, esta lipoproteína se ha convertido en el objeto de numerosas investigaciones.
DeCS: LIPOPROTEINA (a)/ metabolismo; LIPOPROTEINA (a)/ genética; LIPOPROTEINA (a)/ ultraestructura; POLIMORFISMO (GENETICA); APO LIPOPROTEINAS (a); ATEROSCLEROSIS; FACTORES DE RIESGO.
La aterosclerosis constituye la base patomorfológica, patofisiológica y patobioquímica de la enfermedad arterial coronaria y de las enfermedades cerebrovasculares,1 las cuales ocupan la primera y tercera causas de muerte en Cuba.2 La lipoproteína (a) [Lp (a)], descubierta por Kare Berg3 en 1963, es considerada un factor de riesgo aterogénico.4 En su estructura se destaca la apolipoproteína (a) [apo (a)], la cual es responsable de las propiedades metabólicas y bioquímicas de esta partícula lipoproteínica. Por su estructura peculiar y la correlación que existe entre los niveles elevados de Lp (a) y el desarrollo de complicaciones aterotrombóticas, la lipoproteína (a) se ha convertido en el objeto de un intenso programa investigativo. Es propósito de los autores de esta revisión presentar en este trabajo las características más sobresalientes de la Lp (a), así como los mecanismos patogénicos de esta lipoproteína relacionados con la aterotrombogénesis.
Estructura de la lipoproteína (a)
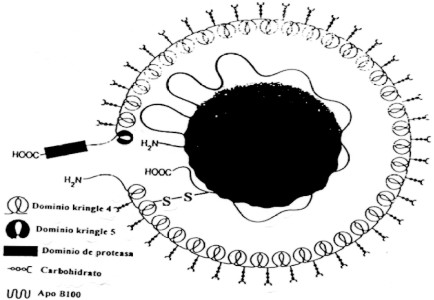
La Lp (a) es una lipoproteína esférica, rica en ésteres de colesterol y fosfolípidos, que se asemeja en su composición a la LDL. También contiene una glicoproteína específica, la apolipoproteína (a), que está unida a la apo B100 por un puente disulfuro.5-8 (fig. 1).
Fig.1. Estructura de la lipoproteína (a).
Tomado de Utermann G. The misteries oflipoprotein (a). Science 1989;246:904-10.
La apo (a) presenta características estructurales distintivas. Su composición de aminoácidos es notablemente diferente a la de la apo B100. El aspartato, la leucina, la isoleucina, la fenilalanina y la lisina están disminuidos, mientras que la prolina, la treonina, la arginina y la glicina están elevados. El alto contenido de prolina, serina y treonina en la apo (a) sugiere la aparición frecuente del giro b. Además, la serina y la treonina proporcionan abundantes sitios de glicosilación.8,9
Mientras que en la apo B100 los carbohidratos representan 5 a 10 % del peso de la proteína, en la apo (a) pueden alcanzar casi 40 %. De este porcentaje, 26 % es de galactosa, 9 % de manosa, 16 % de galactosamina, 12 % de glucosamina y 37 % de ácido siálico.9 La alta proporción de carbohidratos y de prolina en la apo (a) provoca que esta apolipoproteína adopte una estructura menos ordenada que la propuesta para la apo B100.10 En cuanto a la estructura secundaria, la apo (a) contiene 8 % de hélice a, 21 % de hoja b y 71 % de enrollamiento azaroso,9 a diferencia de la apo B100 que posee 40, 30 y 30 % de estas estructuras, respectivamente.10
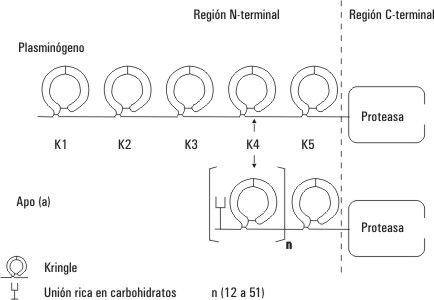
Una de las características más llamativas de la apo (a) es su sorprendente homología estructural con el plasminógeno, 80 % aproximadamente. Este último está formado por un dominio globular con actividad de serina proteasa y un proceso digitiforme en el cual la cadena polipeptídica forma 5 estructuras constituidas por asas internas que son ricas en cisteína, cada una con 3 puentes disulfuro. Estas estructuras son conocidas como kringles, por su semejanza con un pastel danés de igual nombre, que se parece a una rosquilla. En el plasminógeno estos dominios de unión a la lisina son enumerados del 1 al 56,11 (fig. 2). Otras proteínas de la coagulación y la fibrinólisis poseen estructuras similares, por ejemplo, la protrombina, el factor XII, el activador hístico del plasminógeno (t-PA) y la uroquinasa.5,6
Fig. 2. Homología estructural entre el plasminógeno y la lipoproteína (a).
Tomado de Grinstead GF. Lipoprotein (a). Review and update.The fatof life 1990;4(7):2-8.
Por su parte, la apo (a) conserva en su estructura el dominio de serina proteasa, que está seguido por un dominio kringle 5 y múltiples copias de kringle 4 (de 12 a 51) (fig. 2). La localización de los 6 residuos de cisteína en cada uno de estos dominios está conservada, lo cual significa que la estructura de 3 asas internas se mantiene. También se sabe que el penúltimo dominio kringle 4 del extremo amino terminal tiene un residuo adicional de cisteína, el cual forma una unión covalente con una cisteína del extremo carboxilo terminal de la apo B100.5,6,11 La presencia de un enlace disulfuro cerca del sitio de unión con el receptor de la LDL en esta apoproteína podría explicar la baja afinidad de la Lp (a) por este receptor.6,7
En la apo (a) se distinguen 10 tipos de dominios semejantes al kringle 4 del plasminógeno, enumerados desde T1 hasta T10. El primero y los 8 últimos están altamente conservados entre las distintas isoformas, mientras que el segundo de estos módulos representa el kringle 4 principal de la apo (a), T2, el cual está presente en un número variable de copias idénticas. En los kringles 4, desde T5 hasta T9, se han identificado sitios funcionales de unión a la lisina; sin embargo, en los tipos 1 y 2 no se han encontrado. El módulo T10 es el que más se asemeja al kringle 4 del plasminógeno, pues contiene todos los aminoácidos considerados críticos para la unión a los residuos de lisina, ubicados en la fibrina y en los receptores de células mononucleares y endoteliales.11-13 Asimismo, el T7 muestra afinidad por las superficies celulares y es requerido en la formación de la Lp (a). Además, el T8 manifiesta gran afinidad por la matriz extracelular subendotelial.12
Propiedades fisicoquímicas de la Lp (a)
El diámetro aparente y el peso molecular de la lipoproteína (a) han sido determinados por medio de diferentes técnicas, las cuales indican que los valores de estas variables fluctúan entre 210 y 262 Å y 4,66 y 5,6 x 106, respectivamente.5-7 Por su parte, el rango de densidades hidratadas de la Lp (a) oscila entre 1,05 y 1,082 g/mL. Esta variación es atribuible al contenido diferente de apo (a), la cual posee grandes cantidades de carbohidratos.10
La Lp (a), al igual que la VLDL, exhibe una movilidad electroforética pre-b en gel de agarosa. La migración más rápida de la lipoproteína (a) con respecto a la LDL puede deberse a la presencia de la apo (a), cuyo alto contenido de ácido siálico incrementa significativamente la carga de la partícula, aumentando, por lo tanto, su migración anódica.5,6,10
Una de las propiedades físicas distintivas de la Lp (a) es su gran tendencia a la agregación, especialmente a altas concentraciones (mayor que 5 a 10 mg/mL). Se ha sugerido que esta agregación puede ser el resultado de la actividad estereolítica/proteolítica que presenta la lipoproteína después del proceso de purificación.10
La unión a cationes divalentes es otra de las propiedades que posee la Lp (a), de la cual es responsable también el elevado contenido de carbohidratos de la apolipoproteína (a). Este efecto puede deberse a la capacidad del ácido siálico de interactuar con estos iones, especialmente el calcio.8,10
Metabolismo de la lipoproteína (a)
Poco se conoce, en comparación con otras lipoproteínas, acerca del origen metabólico de la Lp (a). La investigación en esta área se ha hecho difícil por el hecho de que los animales de experimentación más comunes no expresan la Lp (a) o no producen una lipoproteína cualitativamente similar.
Síntesis de la Lp (a)
Son varias las evidencias que apuntan hacia el hepatocito como sitio primario de síntesis de esta partícula lipoproteínica. El ARNm de la apo (a) ha sido detectado en grandes cantidades en células Hep G2 y en el hígado humano, órgano en el que también se sintetiza la apo B100.7,11 El cambio de fenotipo de la apo (a), después de un trasplante heterólogo de hígado, constituye otra razón sugestiva del origen hepático de la lipoproteína (a). Asimismo, en los pacientes que padecen de cirrosis alcohólica los niveles plasmáticos de Lp (a) son bajos.14
El ARNm de la apo (a) ha sido identificado también en testículos y cerebro de monos rhesus, lo cual sugiere que la apolipoproteína (a) tiene una función única en estos sitios, sobre todo si se toma en consideración que estos órganos están relativamente aislados de la circulación sistémica por barreras histológicas, además de la ausencia de síntesis de apo B100 en estos tejidos.5
A favor del origen intestinal de la Lp (a) están los resultados obtenidos por Bersot,15 quien encontró que una dieta abundante en grasas provocaba la aparición de apo (a) en lipoproteínas de densidad menor que 1,006 g/mL, al parecer remanentes de quilomicrones. Esto sugiere que esta apolipoproteína puede ser incorporada a partículas lipoproteínicas ricas en triglicéridos. La opinión predominante sostiene que, aun en estas lipoproteínas, la mayor parte, pero no toda la apo (a), está unida covalentemente a la apo B100. Otros investigadores estiman que la asociación de la apo (a) con lipoproteínas ricas en triglicéridos involucra a las uniones no covalentes, que pueden establecerse entre los dominios abundantes en lisina de la apo B100 y las regiones kringles de la apo (a).5
A pesar del hallazgo de la apo (a) en lipoproteínas ricas en triglicéridos, los experimentos de Krempler16 descartan que la Lp (a) sea un producto metabólico de la lipoproteína de muy baja densidad, pues aquella no participa en la cascada catabólica clásica VLDL ® IDL ® LDL. También se ha desechado la posibilidad de que los quilomicrones sean precursores de la Lp (a).
La demostración de que el hígado es el sitio principal de síntesis de la apo (a) no revela, desafortunadamente, dónde se ensambla la Lp (a). La LDL y la apo (a) pueden ser secretadas independientemente y el ensamblaje ocurrir fuera de las células hepáticas.7 Los trabajos de Koschinsky y otros17 apoyan esta hipótesis, la cual podría explicar por qué solo una fracción de la LDL se une a la apo (a).
Un sitio alternativo para el ensamblaje de la Lp (a) sería el hepatocito. El requerimiento de la formación de un enlace disulfuro entre la apo (a) y la apo B100 es un fuerte argumento a favor del ensamblaje intracelular de la lipoproteína (a) y sugiere que la unión podría ser catalizada por tiolasas específicas localizadas en el lumen del retículo endoplasmático liso.7
Se ha propuesto un modelo de ensamblaje de la Lp (a), el cual consta de 2 pasos. Inicialmente, la apo (a) se une a la LDL mediante la interacción de un dominio kringle 4 con un residuo de lisina de la apo B100 y luego se produce la formación del puente disulfuro.18
Catabolismo de la Lp (a)
El catabolismo de la Lp (a) resulta aún más misterioso. Tanto el sitio como el mecanismo de degradación no están definidos. Estudios in vitro indican que la Lp (a) puede unirse al receptor de LDL, aunque con menor afinidad que la lipoproteína de baja densidad. La Kd estimada para la Lp (a) es 9,5 nM, mientras que el valor de esta constante para la LDL es 7,8 nM.19 Sin embargo, otros autores consideran que la lipoproteína (a) es incorporada preferentemente mediante la vía del receptor scavenger.5,6 Una investigación realizada por Haberland y otros20 mostró que la modificación de la Lp (a) por el malonildialdehído incrementaba 60 veces la incorporación y degradación de esta partícula con respecto a la lipoproteína nativa.
Genética de la Lp (a)
Inicialmente se consideraba que la Lp (a) solo estaba presente en una parte de la población. En aquel entonces, Berg supuso que la lipoproteína (a) se heredaba como un rasgo mendeliano dominante, bajo el control de 2 alelos, Lpa y Lp0. En la medida en que los métodos para determinar Lp (a) fueron más sensibles, se encontró que la distribución de los valores de esta lipoproteína era continua y quedó claro que la Lp (a) era un rasgo cuantitativo.5-7
Diversas teorías han sido enunciadas tratando de explicar la herencia de este rasgo. La mayoría de los grupos de investigación concuerdan en que los valores de esta lipoproteína son controlados por un solo gen, aunque se han propuesto modelos poligénicos. El descubrimiento del polimorfismo genético, en cuanto a tamaño, de la apo (a) brindó una nueva percepción de la genética de este rasgo cuantitativo.
El peso molecular de la apo (a) varía entre 300 000 y 800 000. Se ha establecido que esta variación se debe en gran parte a la existencia de una serie de isoformas con pesos moleculares diferentes. El peso de las isoformas de apo (a) depende del número de dominios kringle 4 que contengan y del grado de glicosilación de la proteína.5-7,21
Se conocen al menos 6 isoformas de apo (a), las cuales han sido identificadas mediante western blot. Estas isoformas fueron clasificadas de acuerdo con su movilidad electroforética con respecto a la de la apo B100 y se denominan: B, cuando su migración es similar a la de la apoproteína de la LDL; F (del inglés faster), si tiene una movilidad más rápida y S (S1, S2, S3 y S4) (del inglés slower), cuando la velocidad de migración es progresivamente menor.5-7
Según Utermann, un individuo puede tener 1 ó 2 isoformas de apo (a). Su hipótesis sostiene, además, que las personas que manifiestan una sola isoforma de esta apolipoproteína son homocigóticos y las que poseen 2, heterocigóticos para el polimorfismo de la apo (a). Esta hipótesis también sugiere que este fenómeno se debe a la existencia de 2 alelos que operan en la misma región cromosómica.7,22,23
Aquellos individuos en los que no se identifica isoforma alguna de la apolipoproteína (a) se denominan homocigóticos para el alelo nulo. Muchos homocigóticos para isoformas identificables podrían tener 2, aunque una de ellas no sea detectable por los métodos actuales. Si este fuera el caso, esas personas serían heterocigóticas para el alelo nulo. La elucidación de este problema parece ser simple. Este alelo no es realmente un alelo nulo, o sea, codifica una proteína que es sintetizada en pequeñas cantidades. Por lo tanto, la definición de alelo nulo en el sistema de la Lp (a) es operacional y depende, al menos en cierta medida, de la sensibilidad del western blot.6,7
El gen que codifica la apolipoproteína (a) es considerado uno de los genes más polimórficos de la especie humana. Está localizado en la región cromosómica 6q 26-27, cercano al del plasminógeno.5-8,23 Este gen, en virtud de las estructuras kringles y de la preservación del dominio de serina proteasa, se asemeja a los de las enzimas proteolíticas de los sistemas fibrinolítico y de la coagulación. Es probable, entonces, que el gen de la apo (a) haya evolucionado a partir del gen del plasminógeno o de un gen similar por deleción de los 3 primeros kringles y duplicaciones de la secuencia que codifica el kringle 4.6 El número de estas repeticiones varía entre individuos y se relaciona directamente con el tamaño de la isoforma de apo (a).7,24
Isoformas de apo(a) y concentración de Lp (a)
Las isoformas de apo (a) tienen un efecto significativo sobre la concentración de la lipoproteína (a). En caucásicos y asiáticos, el gen de la apo (a) ha sido reconocido como el factor principal que determina las cifras de Lp (a). En estas poblaciones se ha encontrado una relación inversa entre el peso de la apo (a) y la concentración de la lipoproteína. Las isoformas B, S1 y S2 se asocian con niveles elevados de Lp (a), mientras que con los fenotipos S3, S4 y nulo ocurre lo contrario.21,22,25
El mecanismo por el cual el fenotipo de apo (a) puede regular los niveles de Lp (a) resulta especulativo. Pero una explicación plausible sería que las isoformas de mayor peso molecular son sintetizadas lentamente o secretadas con menor facilidad por el hígado; estas isoformas están sometidas a una mayor degradación.5
En individuos caucásicos y asiáticos también se ha encontrado una correlación negativa entre el número de repeticiones de la secuencia TTTTA en la región reguladora del gen de la apo (a) y los valores de la lipoproteína (a).24
Mecanismos patogénicos de la Lp (a)
Los mecanismos propuestos que tratan de explicar el papel de la lipoproteína (a) en la aterotrombogénesis están relacionados con la formación de las células espumosas y el efecto de esta lipoproteína sobre el sistema fibrinolítico.
Efecto aterogénico de la Lp (a)
El hallazgo inmunohistoquímico de la Lp (a) en lesiones ateromatosas indica que esta lipoproteína puede quedar retenida en la subíntima arterial. Se sabe que la lipoproteína (a) se une fuertemente a la fibronectina, la cual está presente en las lesiones ateroscleróticas iniciales. El complejo resultante de esta unión se interna mediante la vía del receptor de fibronectina, una glicoproteína heterodimérica perteneciente a la familia de las integrinas. La interacción se establece entre la apolipoproteína (a) y la región de unión a la heparina, que reside en el extremo carboxilo terminal de la fibronectina. Una vez en el espacio subendotelial, la lipoproteína interactúa con los componentes de la matriz, es modificada químicamente y sirve como ligando del receptor scavenger de macrófagos.26 Lo anterior sugiere un mecanismo por el cual la Lp (a) contribuye a la formación de las células espumosas, las cuales forman parte de la estría grasa (lesión aterosclerótica inicial).
La lipoproteína (a) también puede formar complejos con los glicosaminoglicanos de la pared arterial. El establecimiento de tales uniones favorece la acumulación de lípidos en la íntima de las arterias y promueve, con ello, la formación de la placa de ateroma.27
Efecto antifibrinolítico de la Lp (a)
La sorprendente homología estructural que se aprecia entre el plasminógeno y la lipoproteína (a) constituye, indudablemente, el aspecto más interesante de la biología de la Lp (a). Esta similitud entre una lipoproteína aterogénica y la enzima clave del sistema fibrinolítico proporciona una evidencia molecular del vínculo existente entre la aterosclerosis y la trombosis.11
Desde el punto de vista estructural, la apolipoproteína (a) pertenece a la superfamilia de proteasas reguladoras del mecanismo fibrinolítico.7,8 Sin embargo, la apo (a) no posee actividad proteolítica cuando se expone a la acción de los activadores del plasminógeno. Esto se debe a una sustitución crítica de serina por arginina en el sitio de activación.5,6,11 Consecuentemente, se ha sugerido que la Lp (a) inhibe la fibrinólisis y favorece, por lo tanto, la trombosis.5-7
La lipoproteína (a) puede unirse a la fibrina, debido a la abundancia relativa de dominios kringle 4 en la apo (a). Se plantea que las isoformas más pequeñas de esta apolipoproteína tienen más afinidad por la fibrina, pues exponen un número mayor de sitios funcionales de unión a la lisina. Asimismo, se ha comprobado que la lipoproteína (a) compite con el plasminógeno y con su principal activador por los sitios de unión de la fibrina.5,6,8,28 De esta manera, la Lp (a) inhibe la conversión del plasminógeno en plasmina.
La superficie de las células mononucleares y endoteliales son ricas en receptores de plasminógeno y proporcionan sitios adicionales en los que se estimula la actividad catalítica del t-PA. Se cree que estos receptores facilitan la transformación del plasminógeno en plasmina, protegen a esta en el medio microvascular y mantienen la fluidez de la sangre. Varios estudios indican que la lipoproteína (a) atenúa la activación del plasminógeno, al competir con este por los receptores situados en la superficie celular.5,29
Por otro lado, la Lp (a) estimula la síntesis del PAI-1 en el endotelio; la modificación oxidativa de la lipoproteína amplifica este fenómeno, y muestra, una vez más, su efecto antifibrinolítico.30
Los datos aportados aquí ponen de manifiesto que la Lp (a) interfiere los mecanismos de la fibrinólisis y promueve una diátesis protrombótica que contribuye a la evolución y expresión clínicas de los trastornos aterotrombóticos.5-7
Otros mecanismos patogénicos de la Lp (a)
El factor de crecimiento transformante b (TGF-b) activado inhibe la migración y proliferación de las células del músculo liso en la íntima, mecanismos importantes en la formación de la placa de ateroma. La relación inversa que existe entre los niveles de Lp (a) y los del TGF-b activado se debe también a la inhibición de la conversión del plasminógeno en plasmina, la cual es necesaria para la activación del TGF-b. Bajas concentraciones de la forma activa de este factor de crecimiento estimulan la invasión y proliferación de las células del músculo liso en la íntima.31
Recientemente se ha demostrado, mediante estudios realizados en líneas celulares de ratones, que la lipoproteína (a) inhibe la síntesis de óxido nítrico. Este compuesto es un potente vasodilatador y, por medio de la activación de la guanilato ciclasa, produce la inhibición de la agregación plaquetaria.32
Summary
The most outstanding characteristics of lipoprotein (a) as well as the pathogenic mechansism of this lipoproteinic particle related to atherothrombogenesis are established. Liopoprotein (a) [Lp (a)] discovered by Kare Berg, in 1963, has a similar composition to that of low density lipoprotein (LDL). In its structure it also presents apolipoprotein (a) [apo (a)], which is bound to apo B100 by a disulfur bond. The most interesting aspect of the biology of Lp (a) is undoubtedly the surprising structural homology existing between plasminogen and apo (a). This apolipoprotein is also the responsible for the metabolic and biochemical properties of lipoprotein (a). Due to its peculiar structure and to the correlation existing between the elevated levels of Lp (a) and the development of atherothrombotic complications, this lipoprotein has become the object of numerous researches.
Subject headings: LIPOPROTEIN (a)/metabolism; LIPOPROTEIN (a)/genetics; LIPOPROTEIN (A)/ultrastructure; POLYMORPHISM (GENETICS); APO LIPOPROTEIN (A); ATHEROSCLEROSIS; RISK FACTORS
Referencias bibliográficas
- Schoen FJ, Cotran RS. Vasos sanguíneos. En: Cotran RS, Kumar V, Collins T, eds. Patología estructural y funcional. 6ta ed. Madrid: McGraw-Hill-Interamericana, 1999:530-2.
- Cuba. Ministerio de Salud Pública. Anuario estadístico 1999. La Habana:Editorial Ciencias Médicas, 1999:21-63.
- Berg K. A new serum type system in man - The Lp system. Acta Path Microbiol Scand 1963;59:369.
- Schachter M. Lipoprotein (a) and cardiovascular risk. Int J Cardiol 2000;74(2-3):169-70.
- Loscalzo J. Lipoprotein (a) and atherothrombosis. Arteriosclerosis 1990;10(5):672-9.
- Mbewu AD, Durrington PN. Lipoprotein (a): structure, properties and possible involvement in thrombogenesis and atherogenesis. Atherosclerosis 1990;85:1-14.
- Utermann G. The mysteries of lipoprotein (a). Science 1989;246:904-10.
- Koschinsky ML, Marcovina SM. Lipoprotein (a): structural implications for pathophysiology. Int J Clin Lab Res 1997;27(1):14-23.
- Morrisett JD, Gaubatz JW, Knapp RD, Guevara JG. Structural porperties of apo (a): a major apoprotein of human lipoprotein (a), En: Scanu AM, ed. Lipoprotein (a). Nueva York: Academic Press, 1990:53-60.
- Morrisett JD, Guyton JR, Gaubatz JW, Gotto AM. Lipoprotein (a): structure, metabolism and epidemiology. Nueva York: Academic, 1991:130-5.
- Eaton DL, Fless GM, Kohr WJ, McLean JW, Ku QT, Miller CG, et al. Partial amino acid sequence of apolipoprotein (a) shows that it is homologous to plasminogen. Proc Natl Acad Sci USA 1987;84:3224.
- Trieu VN, McConathy WJ. Functional characterization of T7 and T8 human apolipoprotein (a). Biochem Biophys Res Commun 1998;251(1):356-9.
- van der Hock YY, Kastelein JJP, Koschinsky ML. Analysis of structure-function relationship in human apolipoprotein (a). Can J Physiol Pharmacol 1996;72:304-10.
- Kostner GM. Apolipoproteins and lipoproteins of human plasma. Significance in health and disease. Adv Lipid Res 1986;20:1.
- Bersot TP, Innerarity TL, Pitas RE, Rall SC. Fat feeding in human induces lipoproteins of density less than 1.006 that are enriched in apoprotein (a) and that cause lipid accumulation in macrophages. J Clin Invest 1987;77:622-30.
- Krempler F, Kostner GM, Bolzano K, Sandhofer F. Lipoprotein Lp (a) is not a metabolic product of other lipoproteins containing apolipoprotein B. Biochim Biophys Acta 1979;575:63.
- Koschinsky ML, Tomlinson JE, Zioncheck TF, Schwartz K, Eaton DL, Lawn RM. Apolipoprotein (a): expression and characterization of a recombinant form of the protein in mammalian cells. Biochemistry 1991;30:5044-51.
- Frank S, Djurovic S, Kostner GM. The assembly of lipoprotein(a). Eur J Clin Invest 1996;26:109-14.
- Floren CH, Albers JJ, Bierman EL. Uptake of Lp (a) by cultured fibroblasts. Biochem Biophys Res Commun 1995;102:636-9.
- Haberland ME, Fless GM, Scanu AM, Fogelmann AM. Modification of Lp (a) by malondialdehyde leads to avid uptake by human monocyte-macrophages. Circulation 1989;80(Suppl 2):163.
- Utermann G, Kraft HG, Menzel HJ, Hopferwieser T, Seitz C. Genetics of the quantitative Lp (a) lipoprotein trait. Relations of Lp (a) glycoprotein phenotypes to Lp (a) lipoprotein concentrations in plasma. Hum Genet 1988;78(Pt 1):4.
- Utermann G, Dubatt C, Menzel HJ. Genetics of the quantitative Lp (a) lipoprotein trait. Inheritance of Lp (a) glycoprotein phenotypes. Hum Genet 1988;78(Pt 2):47.
- Weitkamp RL, Guttormsen SA, Shultz JS. Linkage between the loci for the Lp (a)lipoprotein (LP) and plasminogen (PLG). Hum Genet 1988;79:80-2.
- Pati U, Pati N. Lipoprotein (a), atherosclerosis and apolipoprotein (a) gene polymorphism. Mol Genet Metab 2000;71(1/2):87-92.
- Sandholzer C, Hallman DM, Saha N, Sigurdsson S, Lackner C, Császár A, et al. Effects of the apolipoprotein (a) size polymorphism on the lipoprotein (a) concentrations in 7 ethnic groups. Hum Genet 1991;86:607-14.
- Sonmez H, Suer S, Kokoglu E, Dirican A, Ulutin T, Ucisik N, et al.The importance of Lp (a)-fibronectin interaction in atherogenesis. Haematologia 1997;28(3):149-53.
- Sampol J, Dignat-George F. Thrombosis and endothelium activation and/or alteration. Rev Iberoam Tromb Hemost 1996;9:40.
- Lenzi S, Scanu AM, De Caterina R. Lipoprotein (a) as an athero-thrombotic risk factor: epidemiologic evidence and possible mechanisms. G Ital Cardiol 1996;26(10):1203-25.
- Miles LA, Dahlberg CM, Plow EF. The cell binding domains of plasminogen and their functions in plasma. J Biol Chem 1988;263:11928-34.
- Ren S, Man RY, Angel A, Shen GX. Oxidative modification enhances lipoprotein (a)-induced overproduction of plasminogen activator inhibitor-1 in cultured vascular endothelial cells. Atherosclerosis 1997;128(1):1-10.
- Graingner DJ, Kemp PR, Metcalfe JC, Liu AC, Lawn RM, Williams NR, et al. The serum concentration of active transforming growth factor-b is severely depressed in advanced atherosclerosis. Nat Med 1995;1:74-9.
- Moeslinger T, Fiedl R, Volf I, Brunner M, Koller E, Spieckermann PG. Inhibition of nitric oxide synthesis by oxidized lipoprotein (a) in a murine cell line. FEBS Lett 2000;478(1-2):95-9.
Recibido: 11 de octubre de 2001. Aprobado:26 de diciembre de 2002.
Dr. Lázaro E. Alba Zayas. Instituto de Ciencias Básicas y Preclínicas "Victoria de Girón". Avenidas 31 y 146 No. 3102. Reparto Cubanacán, municipio Playa. Ciudad de La Habana. Código Postal 11600. Teléfono: 284877.