Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.22 n.1 Ciudad de la Habana ene.-mar. 2003
Centro de Investigaciones Biomédicas.
Instituto de Ciencias Básicas y Preclínicas "Victoria de Girón"
Los flavonoides: antioxidantes o prooxidantes
Lic. Gilberto Pérez Trueba
Resumen
Se aportaron evidencias sobre el doble papel que desempeñan los flavonoides como antioxidantes/prooxidantes; así como la contribución de la estructura a tales actividades. Todo lo cual pone de manifiesto que si bien una dieta rica en flavonoides puede ser beneficiosa para la salud, consumos elevados de estos metabolitos pueden tener efectos nocivos debido a sus diversas propiedades farmacológicas. El estudio de los radicales libres (RL) y de los antioxidantes ha cobrado un gran auge particularmente en el último decenio. Un número creciente de artículos que abordan aspectos clínicos y nutricionales ha puesto de manifiesto la importancia que está requiriendo el empleo de antioxidantes en la dieta, teniendo en cuenta que a menudo las combinaciones vitamínicas, comúnmente recomendadas en el mundo entero, no ejercen los efectos esperados o por el contrario, estos resultan dañinos. En este contexto los compuestos polifenólicos, y dentro de estos los flavonoides, ocupan un lugar destacado. Los mecanismos a través de los cuales ejercen su acción antioxidante resultan de una combinación de sus propiedades quelatantes de metales de transición y secuestradoras de RL, así como de la inhibición de oxidasas y acción sobre otras enzimas. Sin embargo, estos compuestos pueden actuar como agentes prooxidantes, rasgo probablemente responsable de los efectos mutagénicos y genotóxicos también encontrados para algunos de estos metabolitos en diversos sistemas experimentales. Algunos de los mecanismos a través de los cuales ejercen sus acciones prooxidantes incluyen la reducción temporal de Cu (II) a Cu (I), la generación de especies reactivas del oxígeno (ERO), así como la afectación de las funciones de los componentes del sistema de defensa antioxidante nuclear: glutatión y glutatión-S transferasa.
.
DeCS: RADICALES LIBRES/uso terapéutico; ANTIOXIDANTES/uso terapéutico; FLAVONAS/toxicidad; FLAVONAS/uso terapéutico; DIETOTERAPIA.
Los flavonoides comprenden un grupo de compuestos polifenólicos ampliamente distribuidos en las frutas y en los vegetales, así como en el té negro, el café, la cocoa, la cerveza y el vino rojo.1-3 Pueden aparecer desde simples moléculas fenólicas hasta compuestos muy polimerizados con pesos moleculares superiores a los 30 000 Da.4
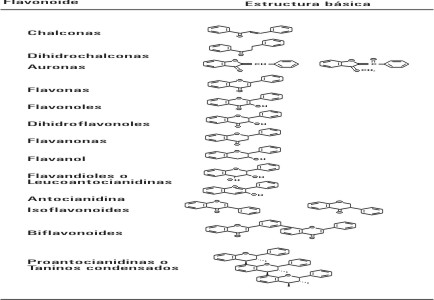
Existen 13 subclases de flavonoides con un total de más de 5 000 compuestos, 10 todos presentando un esqueleto hidrocarbonado del tipo C6-C3-C6 (difenilpropano) derivado del ácido shiquímico y de 3 restos de acetato (figs. 1 y 2).
Fig. 1. Estructura básica de los flavonoides y sistema de numeración.
Fig. 2. Subclases de flavonoides.
Poseen propiedades antioxidantes;2,3,5 antiinflamatorias;6,7 antitrombóticas;6 antimicrobianas;7 antialérgicas;8 antitumorales;7,8 antiasmáticas8 e inhibidoras de enzimas como la transcriptasa reversa, proteína quinasa C, tirosina quinasa C, calmodulina, ornitina decarboxilasa, hexoquinasa, aldosa reductasa, fosfolipasa C y topoisomerasa II.3, 9
Entre todas, las propiedades biológicas de mayor interés han sido sus efectos antioxidantes, los cuales han sido blancos de un sinnúmero de estudios principalmente de corte clínico y nutricional, teniendo en cuenta que a menudo dosis farmacológicas de antioxidantes dietéticos comúnmente recomendados en todo el mundo, como es el caso de las combinaciones vitamínicas (vitamina E más vitamina C y b-caroteno), no producen los efectos esperados o estos resultan dañinos, por lo que para lograr una mejor acción antioxidante se prefiere incluir en la dieta una mezcla de flavonoides y taninos.10
Mecanismos antioxidantes de los flavonoides
Existe un consenso de que la actividad antioxidante de los flavonoides resulta de una combinación de sus propiedades quelatantes de hierro y secuestradoras de radicales libres (RL).2,4,7 Otros autores se refieren además a la inhibición de oxidasas, como la lipoxigenasa (LO), la ciclooxigenasa (CO), la mieloperoxidasa (MPO), la NADPH oxidasa y la xantina oxidasa (XO);3,11 evitando la generación de especies reactivas del oxígeno (ERO) in vivo, así como de hidroperóxidos orgánicos. Por otra parte, se ha podido conocer que también inhiben enzimas involucradas indirectamente en los procesos oxidativos, como la fosfolipasa A2 (FLA2),12 al mismo tiempo que estimulan otras con reconocidas propiedades antioxidantes, la catalasa (CAT) y la superóxido dismutasa (SOD).13 De esta forma los flavonoides interfieren en las reacciones de propagación de RL y en la formación del radical en sí.1
Actividad quelatante de metales de transición y secuestradora de radicales libres de los flavonoides. Relación estructura-actividad
Las ERO reaccionan con las biomoléculas conduciendo al daño celular y tisular.14 Afortunadamente el organismo cuenta con mecanismos efectivos para protegerse de los efectos nocivos de estas especies químicas.15,16 Estos mecanismos se componen de enzimas y de compuestos no enzimáticos como el glutatión (GSH), el ácido ascórbico, el a-tocoferol contenido en la membrana, los flavonoides y los carotenos.
Numerosas investigaciones han evaluado la actividad antioxidante de los flavonoides frente a los RL generados durante la POL, ya sea enzimática o no enzimática. En la tabla 1 se muestra una relación de flavonoides que inhiben la POL, según estudios basados en la medición de la producción de malonildialdehído (MDA) a través del ensayo de sustancias reactivas con el ácido tiobarbitúrico (TBARS). Casi todos los resultados coinciden en que los flavonoides con sustituyentes dihidroxílicos en posiciones 3' y 4' en el anillo B se muestran más activos como antioxidantes y que este efecto es potenciado por la presencia de un doble enlace entre los carbonos 2 y 3, un grupo OH libre en la posición 3 y un grupo carbonilo en la posición 4; como sucede con la quercetina.17-22 Al mismo tiempo se evidencia que las agliconas de los flavonoides se muestran más potentes en sus acciones antilipoperoxidativas que sus correspondientes glicósidos.18
Tabla 1. Actividad inhibitoria sobre la POL ejercida por diferentes flavonoides. Determinación de la producción de malonildialdehído (MDA) a través del ensayo de sustancias reactivas con el ácido tiobarbitúrico (SRATB)
| Inducción de la POL | Compuesto | Efecto sobre la producción de MDA a través del ensayo de SRATB | Referencia |
| Por la hepatotoxina tetracloruro de carbono (in vivo) | · Gossypitrina | concentración inhibitoria media (CI50)=8,011µm | Trueba y colaboradores (1997)47 |
| Por ácido ascórbico y sulfato ferroso (in vitro utilizando la fracción mitocondrial del cerebro de rata) | · quercetina · quercitrina · rutina · taxifolina · miricetina · miricetrina · floretina · floridzina · diosmetina · diosmina · apiína · hesperitina · naringenina · catequina · morina · fisetina · crisina · 3-hidroxi-flavona | CI50 en el intervalo entre 1,47 nM y 900 mM | Ratty y colaboradores (1988)48 |
| Por N-etil maleimida (in vitro utilizando plaquetas humanas) | · catequina · silimarina · ácidos fenólicos | Koch y colaboradores (1985)49 | |
| A través de la peroxidación del linoleato por hierro (Fe2+) (in vitro) | · quercetina · rutina · hesperitina · naringenina | rutina >hesperitina >quercetina >naringenina | Saija y colaboradores (1995)50 |
| Por autooxidación de las membranas celulares de eritrocitos de ratas (in vitro) | · quercetina · rutina · hesperitina · naringenina | quercetina >rutina >hesperitina >naringenina | Saija y colaboradores (1995)50 |
| Por oxidación aumentada de Fe2+ | · baicaleína · baicalina · quercetina · rutina | Yoshino y colaboradores (1998)43 | |
| Por sobrecarga de Fe2+ (in vivo utilizando hepatocitos y mitocondria de ratas) | · silimarina | (Activo en ambos organelos) | Pietrangelo et al (1995)39 |
Por su parte las antocianidinas muestran muy buenas propiedades secuestrantes de RL23,24 pero, dependiendo de las condiciones experimentales, sus bajos potenciales de oxidación (Ep/2) pueden hacer que estas se comporten también como agentes prooxidantes involucrándose en procesos de ciclaje redox. En este sentido su peculiar estructura (ion oxonio), con una alta conjugación que estabiliza los radicales que forma, desempeña un papel muy importante. Por tanto, los flavonoides con un grupo pirogalólico en el anillo B exhiben una mayor actividad antioxidante que los que presentan un núcleo catecólico. Pero al mismo tiempo son más susceptibles a mostrarse como agentes prooxidantes, lo que neutraliza los referidos efectos antioxidantes.1
Los flavonoides secuestran O2-. y OH·.23,25,26 Morazzoni y Malandrino pusieron de manifiesto que la rutina, seguida de la quercetina, se comportó como el secuestrador más fuerte de O2-., generado enzimáticamente a través del sistema xantina/XO y no enzimáticamente a través del sistema NADH-metosulfato de fenacina. Los valores de CI50 de la POL en homogenatos de hígado de ratón estuvieron en el orden de 10-6 M para ambos flavonoides.24 En este mismo contexto una investigación con 15 flavonoides dio a conocer que las constantes de reacción de estos con el O2-. se encuentran en el intervalo de 105-107 M-1s-1.27
La (+)catequina, la (-)epicatequina, la 7,8-dihidroxiflavona y la rutina, secuestran el .OH· generado en un sistema Fenton en un rango de 100 a 300 veces superior a los efectos del manitol, un típico secuestrador de esta ERO. El ensayo se efectuó a través de la determinación de ácido metanesulfónico formado por la reacción entre el dimetilsulfóxido y este radical.28 Por su parte la quercetina y la luteolina suprimieron la reacción de Fenton interfiriendo la onda catalítica voltamétrica, característica del complejo Fe-ATP/H2O2, en un ensayo de espectroscopia de absorción. Un grupo catecol en el anillo B, el grupo carbonilo en posición 4 y una región 5-hidroxi, que puede aumentar la quelación de Fe por parte de estos compuestos, pudieran explicar estos resultados.29
Los flavonoides inhiben también los efectos degradativos provocados por el H2O2.3,23
La quercetina y la catequina eliminaron la citotoxicidad del H2O2 en células V79 de hámsters chinos, a través de un ensayo de formación de colonia en Salmonella TA 104 y en E. coli PQ 37. Los flavonoides impidieron la disminución en el número de colonias provocadas por H2O2 y O2-. en estas células. Los grupos OH de las posiciones 3' y 4' en el anillo B y un doble enlace entre los carbonos 2 y 3, unido al grupo carbonilo de la posición 4 en el anillo C, son cruciales para la actividad protectora.30
Numerosas evidencias apuntan hacia la protección del ADN ejercida por los flavonoides al inhibir los efectos oxidativos que provocan las ERO sobre esta biomolécula. El pretratamiento con flavonoides, a concentraciones estandarizadas (7,6; 23,2; 93 y 279,4 mM), en el daño al ADN generado por H2O2 (100 mM) en linfocitos humanos, analizado a través de un ensayo de electroforesis en gel de células individuales (COMETA), redujo el daño oxidativo al ADN. Los compuestos, a la concentración de 270 mM/L, fueron efectivos en el orden siguiente: luteolina (9 % de inhibición del daño por H2O2), miricetina (10 %), quercetina (22 %), kaempferol (32 %), quercitrina (quercetina-3-L-ramnósido) (45 %), apigenina (59 %), quercetina-3-glucósido (62 %) y la rutina (quercetina-3-b-D-rutinósido) (82 %). Se corrobora de esta manera que los flavonoides libres ejercen un mayor efecto protector que los conjugados.31
Inhibición de oxidasas
La inhibición sobre determinadas oxidasas representa otro de los mecanismos a través de los cuales los flavonoides ejercen sus actividades antioxidantes. Existen evidencias de que la quercetina y la rutina inhiben la NADPH del sistema de la citocromo P-450 en microsomas hepáticos.32 Este efecto pudiera impedir el metabolismo de una gran diversidad de xenobióticos que emplean esta vía para generar RL.
Otros estudios sugieren que la quercetina, la morina y la catequina, a concentraciones de 0,125; 0,25 y 0,5 mM respectivamente, protegen las células endoteliales de la aorta porcina frente al daño inducido por oxirradicales generados por el sistema XO/hipoxantina. La inhibición de la XO ejercida por la morina y por la quercetina fue significativamente mayor (p< 0,01) con respecto a la catequina.33
Las oxidasas CO y LO, involucradas en la cascada del ácido araquidónico, resultan inhibidas por los flavonoides en múltiples ensayos experimentales. La eficacia de la inhibición varía enormemente; así, un único flavonoide puede inhibir una enzima a bajas concentraciones, pero puede necesitar de concentraciones 100 veces superiores para inhibir otra. Por ejemplo, la silibina inhibe fuertemente la 5-LO de granulocitos humanos y de las células de kuffer humanas y de ratas, con valores de CI50 de alrededor de 15 mM determinados por la formación de los leucotrienos.34 Sin embargo, se necesitan concentraciones de hasta 3 y 4 veces más altas que esta para lograr la mitad de la inhibición máxima en la vía de la CO en las células endoteliales y en los granulocitos humanos.3 Otro ensayo efectuado con 11 flavonoides mostró que estos inhibieron tanto la CO como la LO, pero que algunos como el cirsiliol, la gossypetina, la hypoletina y sus glicósidos, fueron más efectivos inhibiendo la LO.35
Algunos estudios también hacen referencia a la inhibición de la enzima MPO por parte de los flavonoides, neutralizando así los efectos nocivos del HOCL.3,36-50
Otros mecanismos de acción antioxidante de los flavonoides
Además de secuestrar RL, quelatar iones metálicos e inhibir oxidasas, los flavonoides pueden aumentar la disponibilidad de antioxidantes endógenos, así como la actividad de enzimas antioxidantes. Al mismo tiempo que son capaces de inhibir enzimas involucradas en la generación de ERO.
Los flavonoides aislados de la Solanum melongena (Brinjal) ejercieron una potente actividad antioxidante, elevando, de manera significativa (p< 0,01), los niveles de GSH y la actividad de la CAT en ratas, luego de la administración intraperitoneal de 1 mg de flavonoides del Brinjal/100 g de peso corporal/d.13
La rutina mostró tener efectos inhibitorios sobre la FLA2 grupo I (FLA2-1) de páncreas porcino, la FLA2 proveniente de la Vipera russelli (FLA2-II) y de la Crotalus atrox, así como sobre la FLA2-II del fluído sinovial. Los grupos OH en posiciones 5, 3' y 4', así como el doble enlace en el anillo del oxano, son rasgos estructurales importantes para poder ejercer una actividad inhibitoria sobre la FLA2.12 Esta enzima está involucrada en la generación de ERO a través de la cascada del ácido araquidónico.
Actividad prooxidante de los flavonoides
Algunos estudios indican la mutagenicidad y genotoxicidad de los flavonoides, tanto en sistemas experimentales bacterianos como de mamíferos (tabla 2). Debido a sus características estructurales estos metabolitos poseen bajos Ep/2 que les permiten reducir el Fe3+ y el Cu2+ para sufrir una autooxidación o incluso involucrarse en un proceso de ciclaje redox, actuando de esta manera como agentes prooxidantes, lo que explica estos efectos mutagénicos y genotóxicos.
Tabla 2. Estudios de mutagenicidad y genotoxicidad en flavonoides.
| Daño | Referencias |
| Inducción de mutaciones recombinantes | Susuki et al (1991)37 |
| Inducción de aberraciones cromosómicas | Carver et al (1983)38 |
| Intercambio de cromátidas hermanas | Popp et al (1991)39 |
| Generación de micronúcleos en linfocitos humanos | Caria et al (1995)40 |
| Formación de peróxido de hidrógeno, radicales hidroxilo y radicales superóxido | Hodnick et al (1986)41 |
| Excisión de cadenas en el ADN | Rahman et al (1989)42 |
| Actividad prooxidante resultando en degradación del ADN | Sahu et al (1993)43 |
| Actividad prooxidante resultando en peroxidación lipídica | Sahu et al (1997)44 |
| Actividad prooxidante e inhibición de la glutatión-S transferasa. | Sahu et al (1996)45 |
Algunos de los mecanismos a través de los cuales los flavonoides ejercen sus acciones prooxidantes incluyen la reducción temporal de Cu (II) a Cu (I),42,48,50 la generación de ERO,43,44 así como la afectación de las funciones de los componentes del sistema de defensa antioxidante nuclear: glutatión y glutatión-S transferasa.45
Aunque con menos efectividad que los que contienen un núcleo pirogalólico, los flavonoides con un grupo catecólico generan H2O2 en solución amortiguadora acetato pH 7,4, al donar un átomo de hidrógeno de su estructura al oxígeno por conducto de un O2-. La capacidad de los compuestos evaluados se comportó en el orden siguiente: miricetina, baicaleína, quercetina, epicatequina, catequina y fisetina.46 Por otra parte, la naringenina, la naringina, la hesperitina y la apigenina, por medio de sus respectivos radicales fenoxilos prooxidantes, oxidaron al NADH en el sistema peroxidasa/H2O2. Los radicales NAD originados generaron H2O2 en el medio.47
La baicalina, la quercetina, la morina y la miricetina, incrementaron la generación de OH· a través de la reacción de Fenton, en un ensayo basado en la determinación de ácido metanesulfónico producido por la reacción entre el dimetilsulfóxido y este radical.28
Los flavonoides quercetina, rutina, galangina, apigenina, fisetina, miricetina y baicaleína, causaron ruptura del ADN de timo de carnero en presencia de Cu y oxígeno molecular. La quercetina, junto con la miricetina y la baicaleína, dieron lugar a la 8-OH-2'-desoxiguanosina, lesión oxidativa del ADN de mayor potencial mutagénico.48,49 Un estudio más detallado, basado en un análisis de los fragmentos obtenidos del gen supresor de tumores p53, puso de manifiesto que el daño oxidativo al ADN inducido por la quercetina en presencia de Cu, transcurre a través del ataque de los residuos de timina y citosina, y que la luteolina y el kaempferol también inducen daños al ADN en presencia de este metal. Teniendo en cuenta que estos daños fueron revertidos por la batocupreína, agente quelatante de Cu, no así por los secuestradores de radicales . OH libres, ha sido sugerido que el daño al ADN es más bien inducido por el complejo oxígeno-Cu-ADN, más que por OH·.48
Al parecer, la sustitución orto 3'-4'-dihidroxi en el anillo B resulta esencial para la formación de quelatos Cu y el OH de la posición 3 aumenta la oxidación de los flavonoides como la quercetina y el kaempferol en presencia de este, cosa que no ocurre con otros como la luteolina y la rutina, que carecen de este grupo. Por último, la conjugación entre los anillos A y B resulta importante también para la acción prooxidante de un flavonoide iniciada por Cu, mientras que la O-metilación de las sustituciones hidroxílicas inactiva dicha acción.50
CONSIDERACIONES FINALES
Los estudios presentados ponen en evidencia que los flavonoides pueden comportarse como antioxidantes y prooxidantes, e influyen en ello factores como: las condiciones del ensayo, la concentración efectiva que se alcance en el sitio donde la ERO es formada; la estabilidad del radical del flavonoide formado al donar un átomo de hidrógeno al radical atacante; la lipofilicidad para ser captados por la membrana y el pH del medio. Por esto, a pesar de que usualmente se asegura que los flavonoides están libres de toxicidad y efectos secundarios, lo que permite sus amplios usos terapéuticos, son necesarias otras investigaciones que profundicen en este sentido tomando en cuenta que las estrategias de mercado, seguidas por los fabricantes de concentrados de flavonoides, consisten en exagerar sus efectos no tóxicos, la mayoría de los cuales no están sustentados por ensayos clínicos regulados, y recomiendan dosis que pueden sobrepasar a las adquiridas a través de una típica dieta vegetariana, conduciendo a la generación de ERO y daño posterior al ADN.
Por otra parte, los aspectos estructurales relacionados con la actividad antioxidante de los flavonoides, considerando los estudios de la actividad secuestradora de RL e inhibición de la POL, incluyen un grupo catecol como rasgo estructural fundamental, junto con el grupo carbonilo en posición 4, en conjugación con el doble enlace entre los carbonos 2 y 3. El grupo OH libre de la posición 3 aparentemente incrementa la capacidad antioxidante porque la forma libre es más lipofílica que la glicosídica y un grupo OH en posición 5 puede aumentar la actividad antioxidante por incremento de la deslocalización electrónica. La conjugación total del anillo piránico con el resto de la molécula, lo cual es típico de las antocianidinas, incrementa la estabilización de los radicales formados, se produce un aumento de la actividad antioxidante, pero al mismo tiempo la presencia de un grupo pirogalólico predispone hacia una actividad prooxidante.
Summary
Evidences are given on the double role played by flavonoids as antioxidants/prooxidants, as well as on the contribution of the structure to such activities. All this demonstrates that if a diet rich in flavonoids may be beneficial for health, elevated consumptions of these metabolites may have dangerous effects due to their diverse pharmacological properties. An increasing number of articles dealing with clinical and nutritional aspects stress the importance of using antioxidants in diet, taking into account that the combination of vitamins recommended in the whole world do not always have the expected effects, or, otherwise, they are harmful. In this context, the polyphenolic compounds and within them the flavonoids occupy an important place. The mechanisms through which they exert their antioxidant action result from a combination of their chelating properties of transtition metals and sequestrators of free radicals, as well as from the inhibition of oxidases and action on other enzymes. However, these compounds may act as prooxidant agents, a trait probably responsible for the mutagenic and genotoxic effects found also for some of these metabolites in diverse experimental systems.
Subject headings: FREE RADICALS/therapeutic use; ANTIOXIDANTS/therapeutic use; FLAVONES/toxicity; FLAVONES/therapeutic use; DIET THERAPY.
Referencias bibliográficas
- Van Acquire SA, Van den Berg DJ, Tromp MN, Griffioen DH, Van Bennekom WP, Van der Vijgh WJ, et al. Structural aspects of antioxidant activity of flavonoids. Free Radic Biol Med 1996;20:331-42.
- Bohm H, Boeing H, Hempel J, Raab B, Krok A. Flavonols, Flavone and anthocyanins as natural antioxidants of foods and their possible role in the prevention of chronic diseases. Ernahrungswiss 1998;2:147-63.
- Groot H de, Rauen U. Tissue injury by reactive oxygen species and the protective effects of flavonoids. Fundam Clin Pharmacol 1998;3:249-55.
- Bravo L. Polyphenols: chemistry, dietary sources, metabolism, and nutritional significance. Nutr Rev 1998;56:317-33.
- Vinson JA. Flavonoids in food as in vitro and in vivo antioxidants. Adv Exp Med Biol 1998;439:151-64.
- Pietta PG. Flavonoids as antioxidant. J Nat Prod 2000;63:1035-42.
- Russo A, Acquaviva R, Campisi A, Sorrenti V, Di Giacomo C. Bioflavonoids as antiradicals, antioxidants and DNA cleavage protectors. Cell Biol Toxicol 2000;16:91-8.
- Hirono I. Bioactive molecular. Naturally ocurring carcinogenes of plant origin. Toxicology phatology and Biochemistry. Biol Pharm Bull 1987;2:120-58.
- Formica JV, Regelson W. Review of the biology of quercetin and related bioflavonoids. Food Chem Toxicol 1995;33:1061-80 .
- Hassing A, Liang WX, Schwabl H, Stampfli K. Flavonoids and tannins: plant-based antioxidants with vitamin character. Med Hypotheses 1999;52:479-81.
- Ferrandiz ML, Alcaraz MJ. Anti-inflammatory activity and inhibition of arachidonic acid metabolism by flavonoids. Agents Actions 1991;32:283-8.
- Lindahl M, Tagesson C. Flavonoids as phospholipase A2 inhibitors: importance of their structure for selective inhibition of group II phospholipase A2. Inflammation 1997;21:347-56.
- Sudheesh S, Sandhya C, Sarah KA, Vijayalakshmi NR. Antioxidant activity of flavonoids from Solanum melongena. Phytother Res 1999;13:393-6.
- Davies KJA. Oxidative stres: the paradox of aerobic life. In: Rice-Evans C, Halliewell B, Lunt GG eds. Free radicals and oxidative stress: Environment. Drugs and Food Additives. London: Portland Press;1995.p. 1-35.
- Halliwell B. How to characterize an antioxidant: an update. In: Rice-Evans C, Halliwell B, Lunt GG, eds. Free radicals and oxidative stress: Environment, Drugs and Food Additives. London: Portland. Press;1995, p. 73-101.
- Vladimirov IA. Free radicals and Antioxidants. Vestn Ross Akad Med Nauk 1998;7:43-51.
- Trueba PG, Márquez HI, Martínez SB. Evaluación de la actividad antioxidante de la Gossypitrina a través de ensayos in vitro e in vivo. Tesis de Diploma. Universidad de La Habana. pags. 10-14, 1997.
- Ratty AK, Das NP. Effects of flavonoids on nonenzymatic lipid peroxidation: structure-activity relationship. Biochem Med Metab Biol 1988;39:69-79.
- Koch HP, Loffler E. Influence of silymarin and some flavonoids on lipid peroxidation in human platelets. Methods Find Exp Clin Pharmacol 1985;7:13-8.
- Saija A, Scalese M, Lanza M, Marzullo D, Bonina F. Flavonoids as antioxidant agents: importance of their interaction with biomembranes. Free Radic Biol Med 1995;19:481-6.
- Yoshino M, Murakami K. Interaction of iron with polyphenolic compounds: application to antioxidant characterization. Anal Biochem 1998;257:40-4.
- Pietrangelo A, Borella F, Casalgrandi G, Montosi G. Antioxidant activity of silybin in vivo during long-term iron overload in rats. Gastroenterolgy 1995;109:1941-9.
- Sichel G, Corsaro C, Scalia M, Di Bilio AJ, Bonomo RP. In vitro scavenger activity of some flavonoids and melanins against O2-.. Free Radic Biol Med 1991;11:1-8.
- Morazzoni P, Malandrino S. Anthrocyanins and their aglycons as scavengers of free radicals and antilipoperoxidant agents. Pharmacol Res Comm 1988;20:254.
- Cotelle N, Bernier JL, Catteau JP, Pommery J, Wallet JC, Gaydou EM. Antioxidant properties of hydroxy-flavones. Free Radic Biol Med 1996;20:35-43.
- Jovanovic SV, Steenken S, Hara Y, Simic MG. Reduction of flavonoid and model phenoxyl radicals. Which ring in flavonoids is responsible for antioxidant activity? J Chem Soc Perkin Trans 1996;2:2497-504.
- Jovanovic SV, Simic MG. Antioxidants in nutrition. Ann NY Acad Sci 2000;899:326-34.
- Hanasaki Y, Ogawa S, Fukui S. The correlation between active oxygen and antioxidative effects of flavonoids. Free Radic Biol Med 1994;16:845-50.
- Cheng IF, Breen K. On the ability of four flavonoids, baicilein, gluteolin, naringenin, and quercetin, to suppress the Fenton reaction of the iron-ATP complex. Biometals 2000;1:77-83.
- Nakayama T. Suppression of hydroperoxide-induced cytotoxicity by polyphenols. Cancer Res 1994;54:1991-3.
- Noroozi M, Angerson WJ, Lean ME. Effects of flavonoids and vitamin C on oxidative DNA damage to human lymphocytes. Am J Clin Nutr 1998;67:1210-8.
- Kostiuk VA, Potapovich AI, Tereshchenko SM, Afanas'ev IB. Antioxidant activity of flavonoids in various systems of lipid peroxidation. Biokhimiia 1988;53:1365-70.
- Zeng LH, Wu J, Fung B, Tong JH, Mickle D, Wu TW. Comparative protection against oxyradicals by three flavonoids on cultured endothelial cells. Biochem Cell Biol 1997;75:717-20.
- Dehmlow C, Erhard J, Groot H de. Inhibition of kupffer cell functions as an explanation for the hepatoprotective properties of Silibinin. Hepatology 1996;23:749-54.
- Prior RL, Cao G. Antioxidant capacity and polyphenolic components of teas: implications for altering in vivo antioxidant status. Proc Soc Exper Biol Med 1999;220:255-61.
- Mira L, Silva M, Manso CF. Scavenging of reactive oxygen species by silibinin dihemisuccinate. Biochem Pharmacol 1994;48:753-9.
- Susuki S, Takada T, Sugawara Y. Quercetin induces recombinational mutations in cultured cells as detected by DNA fingerprinting. Japan J Cancer Res 1991;82:1061-4.
- Carver JH, Carrano AV, MacGregor JT. Genetics effects of the flavonols quercetin, kaempferol, and galangin on chinese hamster ovary cells in vitro. Mutat Res 1983;113:45-60.
- Popp R, Schimmer O. Induction of sister-chromatid exchanges (SCE), polyploidy, and micronuclei by plant flavonoids in human lymphocyte cultures. A comparative study of 19 flavonoids. Mutat Res 1991;246:205-13.
- Rueff J, Laires A, Borba H, Chaveca T, Gomes ML. Genetic toxicology of flavonoids: the role of metabolic conditions in the induction of reverse mutation, SOS functions, and sister-chromatid exchanges. Muatgenesis 1998;1:179-83.
- Hodnick WF, Kung FS, Roettger WJ, Bohmont CW, Pardini RS. Inhibition of mitochondrial respiration and production of toxic oxygen radicals by flavonoids. A structure-activity study. Biochem Pharmacol 1986;35:2345-57.
- Rahman A, Shahabuddin S, Hadi SM, Parish JH. Strand sccision in DNA induced by quercetin and Cu (II): role of Cu (I) and oxygen free radicals. Carcinogenesis 1989;10:1833-9.
- Sahu SC, Gray GC. Interactions of flavonoids, trace metals, and oxygen: nuclear DNA damage and lipid peroxidation in induced by miricetin. Cancer Lett 1993;70:73-9.
- Sahu SC, Gray GC. Lipid peroxidation and DNA damage induced by morin and naringenin in isolated rat liver nuclei. Food Chem Toxicol 1997;35:4436-47.
- Sahu SC, Gray GC. Pro-oxidant activity of flavonoids: effects on glutathione and glutathione-S transferase in isolated rat liver nuclei. Cancer Lett 1996;104:193-6.
- Miura YH, Tomita I, Watanabe T, Hirayama T, Fukui S. Active oxygens generation by flavonoids. Biol Pharm Bull 1998;21:93-6.
- Chan T, Galati G, O' Brien PJ. Oxygen activation during peroxidase catalysed metabolism of flavones or flavanones. Chem Biol Interact 1999;122:15-25.
- Rahman A, Fazal F, Greensill J, Ainley K, Parish JH, Hadi SM. Strand scission in DNA induced by idetary flavonoids: role of Cu(I) and oxygen free radicals and biological consequences of escission. Mol Cell Biochem 1992;111:3-9.
- Yoshino M, Haneda M, Naruse M, Murakami K. Prooxidant activity of flavonoids: copper-dependent strand breaks and the formation of 8-hydroxy-2'-deoxyguanosine in DNA. Mol Genet Metab 1999;68:468-72.
- Brown JE, Khodr H, Hider RC, Rice-Evans CA. Structural dependence of flavonoids interactions with Cu2+ ions: implications for their antioxidant properties. Biochem J 1998;330:1173-8.
Lic. Gilberto Pérez Trueba. Centro de Investigaciones Biomédicas. Instituto de Ciencias Básicas Preclínicas "Victoria de Girón". Avenida 146 No. 3102, municipio Playa 11600. La Habana. Cuba. Teléf.: 537-781686. Correo electrónico: havxnxs@typeb.sita.int