Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.22 n.2 Ciudad de la Habana jun. 2003
TRABAJOS ORIGINALES
Centro Nacional Coordinador de Ensayos Clínicos
Centro de Investigaciones y Evaluaciones Biológicas
Actividad antioxidante del clorhidrato de triacetonamina in vitro
Lic. Ivis C. Mendoza Hernández, Dra. Tatiana Yoldi y Dr. Gregorio Martínez
RESUMEN
Se estudiaron los efectos antioxidantes del clorhidrato de triacetonamina (THC) in vitro a través de una serie de ensayos, en los que se analizó la capacidad secuestrante del OH· y quelante de Fe, con el ensayo de la 2 desoxi-d-ribosa y la capacidad secuestrante del O2· por la autooxidación del pirogalol (2-12 mM THC). Se estudió además la actividad prooxidante del THC (0,1-0,6 mM), sobre el ADN inducida por Cu-fenantrolina y Fe-bleomicina. También se valoró la actividad prooxidante del TH-NO· (10-12 mM) y del THNOO· (10-12 mM), radicales derivados del THC. Finalmente se determinó el efecto del THC sobre la peroxidación lipídica en homogenato de cerebro de rata. Los resultados demostraron que el THC posee capacidad secuestrante del O2·, con un comportamiento dependiente de la concentración y CI50 de 10 mM de THC. Se encontró efecto protector sobre la 2 desoxi-d-ribosa, tanto por acción quelante de Fe, como por secuestro directo de OH· con una Ks de 4.6 ´ 108 M-1s-1. El THC mostró efecto dependiente de la concentración para el daño sobre el ADN, mientras que el THNO· no dañó a esta molécula, a diferencia del THNOO· que si produjo daño a las concentraciones ensayadas. La peroxidación lipídica en homogenato de cerebro de rata no fue inhibida.
DeCS: ALCALOIDES DE LA VINCA/aislamiento de purificación; ANTIOXIDANTES;AGENTES ANTINEOPLASICOS; MELANOMA EXPERIMENTAL.
El clorhidrato de triacetonamina (THC) fue obtenido durante el proceso de aislamiento y purificación de los alcaloides de la Vinca por Cuéllar. Este compuesto surge como un artefacto del método de preparación de los extractos totales de alcaloides, utilizando acetona y amoníaco en el medio de reacción. Los estudios realizados sobre las propiedades farmacológicas del THC, han demostrado: acción midriática, ciclopléjica, antiespasmódica y antisecretora, efectos cardiovasculares que reflejan una marcada hipotensión, actividad antineoplásica, efecto gangliobloqueador, actividad analgésica y antipirética, entre otros.1
La actividad citostática del THC ha sido ensayada en un variado número de tumores experimentales,2-5 encontrándose un significativo efecto inhibidor en el melanoma de Harding Pasey.
En estudios realizados sobre compuestos atrapadores de electrones, se describe la capacidad del TEMPONE, análogo estructural del THC, para reaccionar con las especies reactivas del oxígeno (EROs) y formar radicales estables por horas. El TEMPONE es capaz de reaccionar con el oxígeno singlete (1O2), el radical hidroxilo (OH·), el radical anión superóxido (O2·-), el peroxinitrito (ONOO·) y el radical peroxilo (RO2·) para rendir los radicales TEMPONE-NO· y/o TEMPONE-NOO·.
Por su parte las EROs se han vinculado con diferentes eventos asociados a la patogenia de gran número de patologías, entre estas el cáncer.6-8 Cabe entonces preguntarse si el THC posee la capacidad de reaccionar con EROs y de hacerlo, si pudieran estas propiedades antioxidantes estar involucradas en sus efectos antitumorales.
Para dar respuesta a estas interrogantes los autores de este estudio se propusieron evaluar la capacidad secuestrante in vitro del THC sobre los radicales hidroxilo, anión superóxido y su capacidad como quelante de iones de hierro, comprobar si el THC y sus radicales ejercen efecto prooxidante sobre el ADN y evaluar el efecto del THC sobre la peroxidación lipídica.
Métodos
Con concentraciones de THC de 2-12 mM, se realizaron los ensayos siguientes:
Ensayo de la 2-desoxi-d-ribosa: el OH. formado por reacción entre Fe3+/EDTA/ H2O2, en presencia de ascorbato, ataca al azúcar y origina productos reactivos con el TBA. El OH. al generarse en el medio de reacción es atrapado por el EDTA, y está disponible para atacar a la desoxirribosa. El THC competirá por el OH..
Actividad antioxidante in vitro empleando homogenato de cerebro de rata: evalúa la actividad antioxidante por inhibición de los procesos peroxidativos en homogenato de cerebro de ratas. En el medio se libera Fe, que cataliza los procesos de peroxidación. Se utilizaron 2 variantes: autoxidación espontánea y catalizada por Fe3+/ascorbato.
Con concentraciones de THC de 0,1-0,6 mM se realizaron los ensayos siguientes:
Ensayo del pirogalol: se basa en la autoxidación espontánea del pirogalol en medio básico. Al generarse el radical O2._ en el medio de reacción, se acelerará la autoxidación del pirogalol. La presencia de un secuestrador del radical anión superóxido inhibirá la reacción de autoxidación del pirogalol.9,10
Potencial prooxidante en el modelo de daño al ADN inducido por Cu++-fenantrolina: se fundamenta en la capacidad del complejo Cu++ -fenantrolina para dañar las bases del ADN en presencia de oxígeno.11
Potencial prooxidante en el modelo de daño al ADN inducido por bleomicina: se fundamenta en la capacidad del complejo Fe+++-bleomicina para degradar los azúcares del ADN, en presencia de oxígeno y agentes reductores, cualquier compuesto que reduzca este complejo a Fe2+-bleomicina puede causar daños al ADN.11
Determinación del tiempo de autoxidación del pirogalol en presencia del THC: se mezclaron en un TE: 2,8 mL de solución amortiguadora (TRIS-HCl) a pH = 8,20 (50 mM), 100 µL de THC (10 mM y 12 mM), 50 µL de la solución de EDTA (1 mM) y 50 µL de la solución de pirogalol (0,124 mM). Se midió la absorbancia a 420 nm a t=o y cada 10 min por 2 h. Se llevó a un gráfico la absorbancia en función del tiempo de reacción.
Con concentraciones de 10 y 12 mM de THC
Actividad prooxidante del radical peroxinitrito (TH-NOO.) en el modelo de daño al ADN inducido por bleomicina: se expuso el ADN al TH-NOO. formado durante la autoxidación del pirogalol en presencia de TRIS-HCl 8,20 (50mM), 100 µL de muestra, solución EDTA (1 mM) y solución de pirogalol (0,124 mM). Se dejó reaccionar durante 1 ½ h.9,10
Actividad prooxidante del radical nitróxido (TH-NO.) en el modelo de daño al ADN inducido por bleomicina: Se expuso el ADN al TH-NO. previamente formado según la técnica de la 2-desoxi-d-ribosa. En presencia de solución EDTA (100 mM), solución de FeCl3 (100 mM), 100 µL de THC, solución amortiguadora 7,4 (10 mM), peróxido de hidrógeno (2,8 mM) y solución de ácido ascórbico (100 mM). Se dejó reaccionar durante 1 ½ h.12
En todos los casos las determinaciones se hicieron mediante productos reactivos con el ácido tiobarbitúrico (TBA) según describe el procedimiento de Auroma.13
RESULTADOS
En el ensayo de la 2-desoxi-d-ribosa (fig. 1) se encontró que a bajas concentraciones de THC se logra un nivel constante de captación del OH· en presencia de EDTA y que esta reacción aumenta a altas concentraciones. La Ks calculada es de 4,6 ´108 M-1s-1.15 Según muestra la curva sin EDTA el THC exhibe capacidad quelante de Fe, dosis-dependiente, encontrándose el efecto máximo para la protección del azúcar con 10 mM.
Fig. 1. Efecto antioxidante del THC en el ensayo de 2-desoxi-d-ribosa.
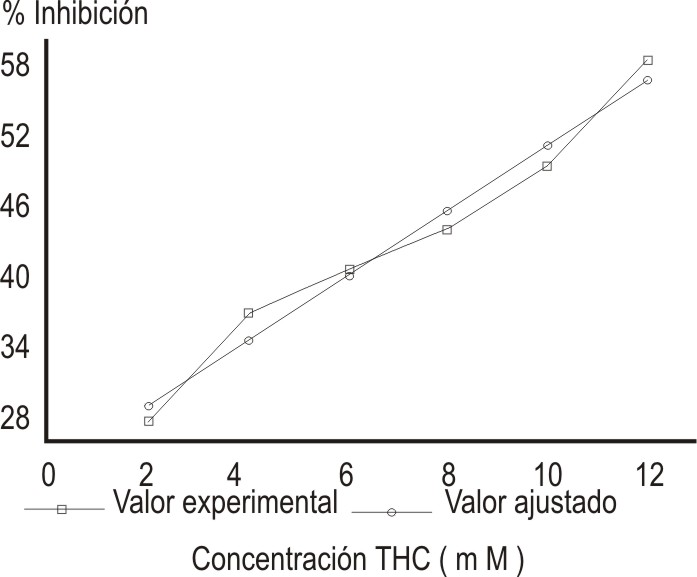
Al realizar el gráfico del porcentaje de inhibición de la autoxidación del pirogalol contra concentración de THC (fig. 2) se observa que existe captación dosis-dependiente del O2·- y la CI50 se alcanza con 10 mM de THC.
Fig. 2. Efecto de la concentración de THC en % Inhibición de autoxidación del pirogalol (re= 0,98; r2e= 0,96; ra= 0,98; r2a = 0,97)
La tabla 1 muestra los resultados en los ensayos de actividad prooxidante en los modelos de daño al ADN inducidos por Cu-fenantrolina y Fe-bleomicina a las concentraciones de 0,1-0,6 mM. En ambos ensayos el valor de absorbancia del blanco representa el daño provocado al ADN por el ión metálico presente en el medio. El control positivo indica el deterioro oxidativo en el ADN por el ácido ascórbico adicionado a las muestras.
Tabla 1. Evaluación de la actividad prooxidante del THC
| Concentración THC (mM) | Cu2+ fenantrolina A (535 nm) | Fe3+ bleomicina A (535nm) |
| 0,1 | 0,191 ± 0,004 a | 0,074 ± 0,003 a |
| 0,2 | 0,177 ± 0,002 a | 0,073 ± 0,002 a |
| 0,3 | 0,172 ± 0,0007 a | 0,063 ± 0,006 a |
| 0,4 | 0,170 ± 0,009 a | 0,058 ± 0,004 a |
| 0,5 | 0,165 ± 0,007 a | 0,056 ± 0,003 a |
| 0,6 | 0,160 ± 0,005 a | 0,044 ± 0,000 b |
| Blanco | 0,147 ± 0,001 b | 0,044 ± 0,003 b |
| Control positivo | 0,232 ± 0,009 c | 0,224 ± 0,005 c |
A: valor promedio de 3 determinaciones ± DE. Letras diferentes representan diferencias (p< 0,05).
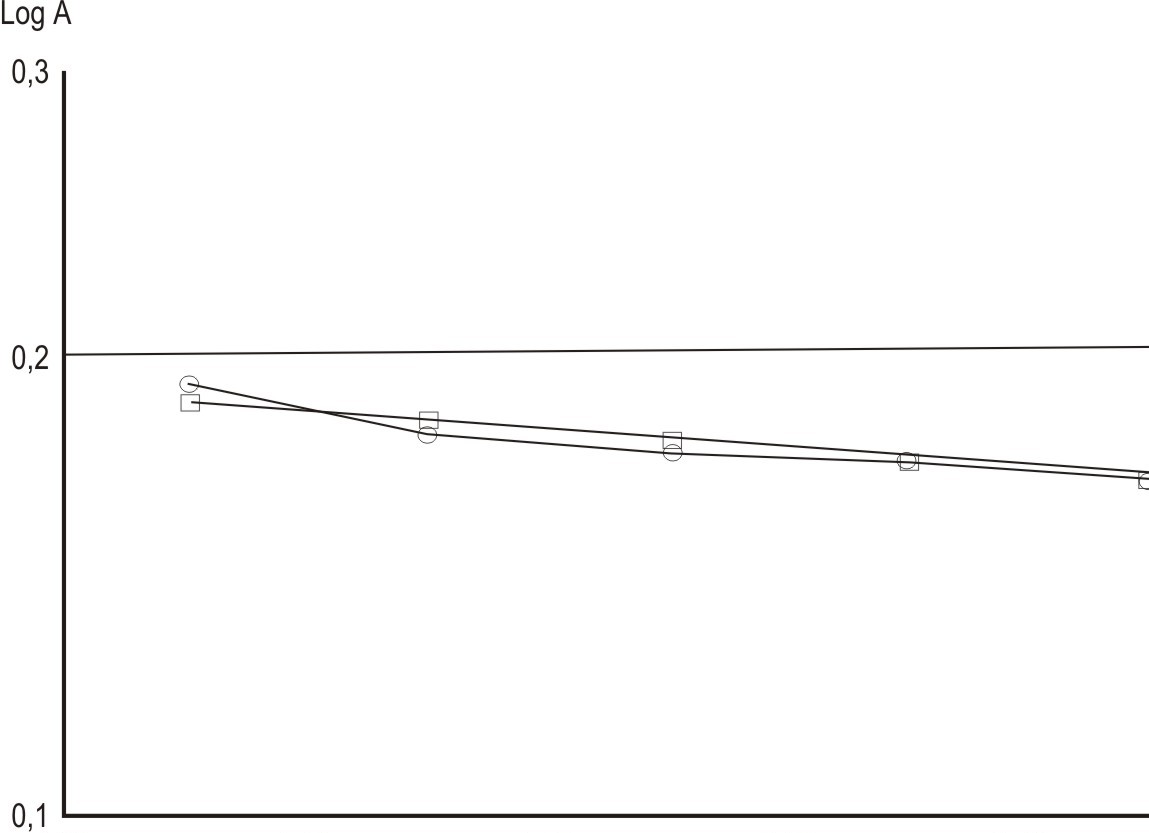
En el ensayo Cu-fenantrolina los valores de absorbancia reportados para el THC son menores que el correspondiente al control positivo, encontrándose diferencias significativas (p< 0,05) entre ellos. También se hallaron diferencias significativas (p< 0,05) con respecto al blanco, lo que indica que el THC en las concentraciones ensayadas produjo efecto oxidativo sobre las bases del ADN, aunque la concentración que ocasionó mayor daño (0,1 mM) no sobrepasó 30 % con respecto al blanco. La disminución en la absorbancia concentración dependiente señala a un posible efecto quelante de iones Cu, lo que puede condicionar el efecto protector del THC sobre la molécula de ADN (fig. 3).
Fig. 3. Ensayo Cu - fenantrolina (re= 0,94; r2e= 0,89; ra= 0,95; r2a= 0.91).
En el ensayo de bleomicina también se encuentran diferencias significativas (p< 0,05) entre los valores de absorbancia para las diferentes concentraciones de THC, el control positivo y el blanco, lo que indica la existencia de un pequeño daño del THC sobre los azúcares del ADN; sin embargo, si se compara el valor de la absorbancia de la concentración de mayor efecto prooxidante (0,1 mM) con el control positivo se puede observar que esta concentración produce solo 16,66 % del daño provocado por el ascorbato.
La figura 4 representa la relación absorbancia contra la concentración de THC en el ensayo de bleomicina. En este caso, al igual que en el ensayo anterior, existió una disminución concentración dependiente del efecto prooxidante en la medida en que aumentó la concentración de THC. Como se observa en la tabla 1 a los valores de 10 a 12 mM se produce efecto protector, inclusive con respecto a los valores del blanco.
Fig. 4. Ensayo de bleomicina (re= 0,94; r2e= 0,88; ra= 0,95; r2a= 0.91).
La actividad de los radicales TH-NOO· y TH-NO· fue evaluada en el modelo de daño al ADN de esperma de salmón inducido por bleomicina. Según se muestra en la tabla 2, las concentraciones de TH-NOO·, que corresponden a las concentraciones de 10 y 12 mM de THC de partida, producen un aumento significativo (p< 0,05) de la absorbancia a 535 nm, con respecto al blanco, que se corresponde con un aumento concentración-dependiente de daño al ADN. En cambio, los valores de absorbancia para iguales concentraciones de THC no superan el reportado para el blanco, mientras que para el TH-NO· los valores de absorbancia no superan los valores encontrados para el blanco; esto demuestra que al igual que el THC, del cual se genera (tabla 2), no ejerce efectos prooxidantes sobre el ADN.
Tabla 2. Evaluación de la actividad prooxidante del THC, TH-NOO· y del TH - NO·
| Concentración (mM) | A ( 535 nm) |
| TH-NOO· (10) TH-NOO· (12) Blanco | 0,312 ± 0,008 a 0,330 ± 0,004 a 0,246 ± 0,001 b |
| TH - NO· (10) H - NO· (12) Blanco | 0,248 ± 0,015 a 0,293 ± 0,015 b 0,303 ± 0,008 b |
| THC (10)T HC (12) Blanco | 0,030 ± 0,004 a 0,020 ± 0,003 a 0,044 ± 0,003 b |
A: valor promedio de 3 determinaciones ± DE. Letras diferentes representan diferencias (p< 0,05).
En el ensayo de actividad antioxidante en la POL espontánea y catalizada por Fe3+/ascorb in vitro la absorbancia del blanco representa 100 % del daño producido sobre los fosfolípidos. En la autoxidación catalizada por Fe3+- ascorbato, el porcentaje Imx (D.O.blanco - D.O.muestra / D.O.blanco x 100) se obtuvo para los 10 mM de THC y fue tan solo de 18,3 %, mientras que para la autooxidación espontánea fue insignificante.
DISCUSIÓN
El ensayo de la 2-desoxi-d-ribosa demostró que el EDTA es más afín por el Fe que con el THC, es por eso que cuando el THC está en presencia de EDTA no puede proteger a esta molécula, porque el quelato EDTA-Fe3 formado permite que el Fe catalice la formación del OH·. Hasta la C=10 mM el efecto protector sobre la molécula de 2-desoxi-d-ribosa es fundamentalmente por acción quelante de Fe, a partir de ese valor, aparece un incremento de la protección por reacción directa con el OH·.
La Ks calculada para el THC (4,6 ´ 108 M-1s-1), resulta de menor magnitud comparada con secuestrantes más efectivos, por ejemplo: fármacos pertenecientes al grupo de los AINE cuyas Ks oscilan entre 109 y 1010 M-1s-1.13,14 El valor de la Ks del THC con el OH· no limita su efecto secuestrante, siempre que se logre acumulación en el sitio de acción.15 De igual forma sucede con la CI50, para el secuestro del radical O2·-, la cual es relativamente alta para un efecto secuestrante in vivo.
Si se toma en cuenta que el THC demostró poseer capacidad quelante para el hierro en el modelo de la 2 desoxi-d-ribosa, se pudiera pensar que las concentraciones más pequeñas de THC no protegen al ADN, sino que probablemente propicien la reducción de los iones metálicos, con lo que se ocasiona el daño. Pero en la medida en que se aumenta su concentración se manifiesta el efecto quelante, que es predominante, de modo que los iones Cu+ y Fe++ no pueden catalizar el daño provocado por las EROs generadas en la reacciones de actividad prooxidante.
El aumento de la absorbancia en presencia de TH-NOO·, con respecto al blanco, se corresponde a un aumento concentración-dependiente de daño al ADN; sin embargo, los valores de absorbancia para iguales concentraciones de THC no superan el reportado para el blanco, lo que demuestra que el THC per se no lesiona al ADN, pero en forma de radical TH-NOO· sí produce daño sobre esta molécula.
Para el TH-NO· se obtuvieron valores similares con respecto al blanco, lo que demuestra que este radical no ejerce efectos prooxidantes sobre el ADN. A pesar de que no se dispone de la técnica de espín electrón para corroborar la presencia del TH - NO·, existen elementos que permiten suponer la presencia del radical. El ensayo de la desoxirribosa demostró que el THC es capaz de secuestrar OH· con una Ks de 4,6 ´ 108 M-1s-1, lo que debe conducir a su transformación en radical NO·,16-19 además compuestos similares como el TEMPONE al reaccionar con el OH· generan radicales NO·.
Como se deriva de la interpretación de los resultados en el ensayo de POL en homogenato de cerebro de ratas, el THC no es capaz de inhibir los procesos de peroxidación lipídica en este ensayo. Los resultados parecen contradictorios con los de 2-desoxi-d-ribosa, donde se encontró efecto protector por secuestro directo de OH· y por efecto quelante de Fe para las concentraciones de THC ensayadas.
La ausencia de efecto en este caso pudiera explicarse porque el radical peroxilo (RO2·),14 causante del daño oxidativo en este ensayo, no fuera efectivamente secuestrado por el THC, o porque la reacción del THC con este radical produjera un compuesto incapaz de quelatar Fe y por tanto disminuir o detener los efectos oxidativos. Por último, el radical formado en esta reacción pudiera a su vez provocar daño sobre los lípidos.
Relación actividad citostática/actividad "antioxidante" del THC
En los últimos años se han demostrado grandes oscilaciones en la actividad de MnSOD de células tumorales, en un grupo de tumores se presenta una alta actividad y en otros se observa el efecto contrario.20 Considerando los estudios farmacocinéticos y de biodistribución15 donde se reporta acumulación del THC en cerebro, cerebelo, hígado y próstata y teniendo en cuenta estos resultados, se puede suponer que para alcanzar el efecto citostático con el THC es necesario que este se acumule en el tejido donde se encuentre el tumor, y lograr así las concentraciones necesarias para que reaccione con las EROs.
Por otra parte si el tumor se caracteriza por presentar baja actividad de MnSOD, como ocurre en los melanomas, esto conduciría a que el status redox tumoral se caracterice por una sobreproducción de O2·-, que trae consigo cambios fisiológicos en la célula, pérdida de la regulación del proceso de diferenciación entre otras alteraciones.
La presencia de THC en el medio y su reacción con O2·- daría lugar a TH-NOO·, este mecanismo podría conducir a la inhibición del crecimiento tumoral por 2 vías: produciendo microlesiones en el ADN que conduzcan a la mutación o a la muerte celular o por reducciones en los niveles de O2·- consecuentemente alterando el balance redox celular, con lo cual alteraría la fisiología celular. El efecto diferenciado del THC sobre diversos tumores pudiera explicarse tanto por el hecho de que no se alcancen en todos los casos las concentraciones precisas en el sitio blanco, así como a las especificidades del balance redox de cada tumor.
El THC mostró capacidad secuestrante de radicales hidroxilo, exhibiendo una Ks de 4,6 ´ 108 M-1s-1 así como capacidad de secuestro de radical anión superóxido, encontrándose un efecto dependiente de la concentración con una CI50 de 10 mM de THC, para la autoxidación del pirogalol. De igual forma se encontró un moderado efecto quelante de iones Fe dependiente de la concentración de THC.
El efecto prooxidante del THC sobre el ADN es concentración dependiente, disminuyendo el daño al aumentar la concentración. El radical THNO· no mostró efecto prooxidante, mientras que el THNOO· produjo daños oxidativos.
La peroxidación lipídica en homogenato de cerebro de rata no fue inhibida por el THC (2-12 mM).
Summary
The antioxidant effects of triacetoneamine hydrochloride (THC) were studied in vitro by a series of assays, in which the sequestering capacity of OH· and the chelating capactiy of Fe were analyzed by the assay of 2 desoxy-d-ribose and the sequestering capacity of O2· by the autooxidation of pyrogalol (2-12 mM THC). The prooxidant activity of THC (0.1-0.6 mM) on DNA induced by Cu-phenanthrolene and Fe-bleomycin was also studied. The prooxidant activity of TH-NO· (10-12 mM) and of THNOO· (10-12 mM), radicals derived from THC, was also assessed. Finally, it was determined the effect of THC on lipid peroxidation in rat's brain. homogenate The results showed that THC has a sequestering capacity of O2· with a behavior depending on the concentration and CI50 of 10 mM of THC. A protective effect on 2 desoxy-d-ribose was found due to the chelating action of Fe and to the direct sequestration of OH· with a ks of 4.6 ´ 108M-1s-1. THC proved to have an effect depending on the concentration to damage DNA, whereas THNO· did not damage this molecule, differently from THNOO· that damaged the assayed concentrations. Lipid peroxidation in rat's brain homogenate was not inhibited.
.
Subject headings: VINCA ALCALOIDS/isolation of purification; ANTIOXIDANTS; ANTINEOPLASTIC AGENTS; MELANOMA, EXPERIMENTAL.
Referencias bibliográficas
- Cuéllar A. Tesis de doctorado: "Contribución al estudio químico y biológico de Catharanthus roseus G. Don que crece en Cuba", 1996.
- Castillo B. Efecto antitumoral de la Vincubina sobre el melanoma de Harding Pasey. Rev Cubana Farm 1977;11:287-92.
- ————. Efecto de la Vincubina sobre el carcinoma de Erlich.Rev Cubana Farm 1977a;11:293-7.
- ————. Efecto del alcaloide Vincubina sobre el carcinoma de testículo de Brown Pearce. Rev Cubana Farm 1977b;11:299-305.
- ————. Espectro antitumoral del alcaloide Vincubina. II parte. Rev Cubana Farm 1979;13:157-61.
- Salim AS. The permissive role of oxygen-derive free radicals in the development of colonic cancer in the rat. A new theory for carcinogenesis. Int J Cancer 1993;53:1031-5.
- Kemp CJ, Wheldon T, Balmain A. p53-deficient mice are extremely susceptible to radiation-induced tumorigenesis. Nature Gen 1994;8:66-9.
- Hussain, S.P.et al.Oxy-radical induced mutagenesis of hotspot codons 248 and 249 of the human p53 gene. Oncogene 1994;9:2277-81.
- Marklund SL. Pyrogalol Autoxidation. En: Handbook of Methods for Oxygen Radical Research CRC 1985:243-7.
- CYTED. Programa Iberoamericano de Ciencia y Tecnología para el desarrollo. Manual de Técnicas de Investigación. Sub programa X. Proyecto x-1, p. 111; 1995.
- Aruoma OI. Nutrition and health aspects of free radicals and antioxidants. Fd Chem Toxic 1994a;32(7):671-83.
- Aruoma OI. Deoxyribose assay for detecting hidroxyl radical. Methods in Enzimology 1994;233:57-66.
- Aruoma OI. The antioxidant action of N-acetylcysteina: its reaction with hydrogen peroxide, hidroxyl radical, superoxide and hypochlorous acid. Free Rad Biol Med 1989;6:593-7.
- Halliwell, B. How characterize a biological antioxidant. Free Rad Res Comms 1990;9(1):1-32.
- Barrios M. Farmacocinética y biodistribución del 14C-THC. Tesis de diploma. IFAL;1996.
- Dikalov S, Skatchkov, M, Bassenge E. Quantification of peroxinitrite, superoxide and peroxyl radicals by a new spintrap hydroxilamine 1-hidroxy-2,2,6,6-tetramethyl-4-oxo-piperidine. Biochem Biophys Res Commun 1997;230(1):54-7.
- Dzwigaj S, Pezerat H. Singlet oxygen trapping reaction as a method of singlet oxygen detection: role of some reducing agents. Free Radic Res 1995;23(2):103-15.
- Madden KP. Characterization of the 4-oxo-2,2,6,6-tetramethyl piperidinooxy dosimeter for in situ radiolysis electron spin resonance studies. Radiat Res 1997;147(3):335-41.
- Hanh SM. Identification of nitroxide radioprotectors. Radiat Res 1992;132(1):87-93.
- Oberley TD, Oberley LW. Antioxidant enzyme levels in cancer. Histol Histopathol 1997;12:525-35.
Recibido: 28 de septiembre de 2001.Aprobado: 15 de octubre de 2002.
Lic. Ivis C. Mendoza Hernández Centro Nacional Coordinador de Ensayos Clínicos. 200 y Avenida 21, Atabey, Ciudad de La Habana, Cuba. Teléf: 218308, 217397