Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.23 n.1 supl.1 Ciudad de la Habana ene.-mar. 2004
Papel de los radicales libres sobre el ADN: carcinogénesis y terapia antioxidante
Lic. Adonis E. Zorrilla García, Lic. Mayté Eirez Izquierdo y Lic. Moreisby Izquierdo Expósito
Resumen
Se realizó una revisión acerca del papel de los radicales libres sobre el ADN. Según datos de incidencia obtenidos por registros de cáncer existentes en el mundo y los datos de mortalidad mundial disponibles, se puede estimar que se producen más de 8 000 000 de casos nuevos de cáncer al año (exceptuando los cánceres de piel diferentes del melanoma). Han sido estas las razones que han convertido al cáncer en un problema sanitario de primer orden, con la paradoja de que tanto su incidencia como su mortalidad aumentan a pesar de los grandes progresos en el diagnóstico y tratamiento alcanzados en los últimos años. De manera general el tratamiento clínico de esta enfermedad consiste en el tratamiento de los síntomas, buscando mejorar la calidad de vida de estos pacientes, y no en las posibles causas, como la generación de radicales libres en el organismo.
DeCS: RADICALES LIBRES; ADN; ESPECIES DE OXIGENO REACTIVO; ANTIOXIDANTES/ uso terapéutico; NEOPLASMAS/ epidemiology; NEOPLASMAS/ mortalidad; NEOPLASMAS/ therapy.
Habitualmente, el oxígeno se encuentra en su forma más estable (O2)2, sin embargo, en determinadas condiciones, principalmente por medio de reacciones bioquímicas redox, por fagocitosis, en una reacción inflamatoria controlada; o por exposición a radiaciones ionizantes, rayos ultravioletas, contaminación ambiental, humo de cigarro, drogas, entre otras; pueden producirse una serie de especies químicas (moléculas o radicales libres) altamente reactivas (Turrens J. Fuentes intracelulares de especies oxidantes en condiciones normales y patológicas. Antioxidantes y calidad de vida. Estrés oxidativo y antioxidantes: de las ciencias básicas a la medicina aplicada; 1994).1
Cuando se produce un desbalance entre la producción de oxidantes y antioxidantes, se está en presencia del estado conocido como estrés oxidativo, donde estas moléculas son capaces de dar lugar a múltiples reacciones con otros compuestos presentes en el organismo, y consecuentemente, llegar a producir daño celular.
El incremento del estrés oxidativo puede resultar de un aumento en la producción de precursores de radicales libres, de un aumento de las especies reactivas del oxígeno (ERO), de un incremento de las catálisis prooxidantes, de una reducción de los sistemas antioxidantes o de una combinación de todos ellos.2
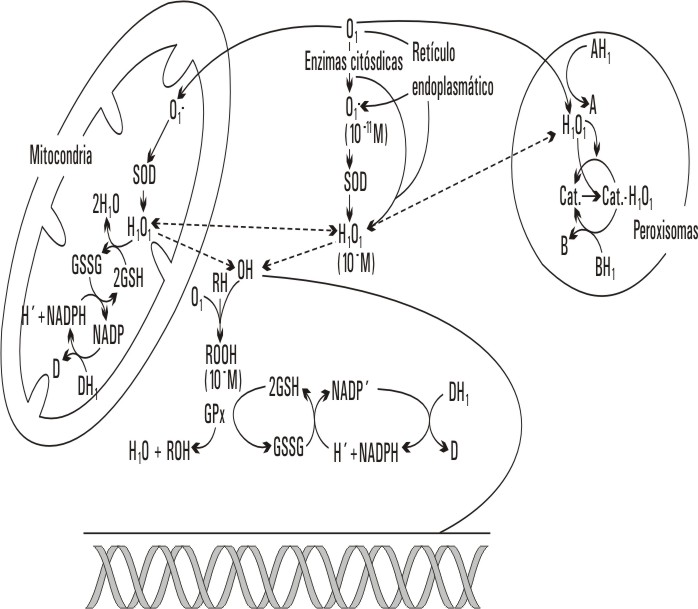
Las ERO presentan una alta reactividad, tanto que son capaces de reaccionar con una amplia gama de estructuras celulares, conociéndose que sus blancos fundamentales son los ácidos grasos insaturados de las membranas fosfolipídicas, las proteínas y los ácidos nucleicos (ADN) (fig.).3
Fig. Producción intracelular de los productos de la reducción parcial del oxígeno. El radical OH· como agente más dañino para el ADN.
Acción de los radicales libres sobre el ADN: carcinogénesis
La molécula de ADN es uno de los principales blancos del ataque por radicales libres en la célula y las modificaciones que sufre como consecuencia de esos ataques son relevantes para la pérdida de la homeostasis celular, pérdida que puede prolongarse como consecuencia de las funciones del ADN como reservorio activo de información. Es por ello que se estudian intensamente los agentes y mecanismos del daño por ERO, porque su esclarecimiento va parejo a la elucidación de la patogenia de enfermedades de gran morbilidad y mortalidad3 como el cáncer.4
En la molécula de ADN, los grupos nucleofílicos de la desoxirribosa y de las bases nitrogenadas quedan expuestos al ataque electrofílico de las especies reactivas del oxígeno (ERO), que llegan al interior del núcleo celular ya sean generadas como consecuencia de un agente externo, así como consecuencia de procesos metabólicos celulares.5
Existen diferentes tipos de daño oxidativo al ADN, entre los que se han reportado: ruptura del esqueleto azúcar fosfato de una o de las 2 hebras, modificación de las bases nitrogenadas (saturación y fragmentación del anillo de timina) y la formación de uniones cruzadas (cross-links) ADN‑ADN ó ADN‑ proteína, a través de diferentes mecanismos (González Hernández Y, Prieto González E. Efectos sobre los ácidos nucleicos. Estrés oxidativo en Biomedicina; 2001):
1. Modificación de las bases de ADN.
2. Generación de sitios AP.
3. Ruptura de una cadena del ADN.
4. Mutaciones.
5. Activación de oncogenes e inactivación de genes supresores.
6. Daño endotelial que favorece la metástasis.
1. Modificación de bases del ADN: se conoce que el daño al ADN por radicales libres (RL) endógenos ocurre de forma espontánea y existe un nivel normal de bases modificadas por ERO en el ADN celular.6,7 La acción del .OH· da lugar a más de 20 modificaciones y entre ellas la más frecuente es la 8-hidroxi-2'-desoxiguanosina (8-OH-dG)6 que tiene un potencial altamente mutagénico al igual que la 5-hidroximetil-2-desoxiuridina.
2. Depurinación de bases del ADN: los sitios apurínicos o apirimidínicos (AP), se generan por ruptura del enlace glicosídico, que puede resultar del ataque al azúcar por parte del OH·.
Estas lesiones presentan adenina insertada preferencialmente opuesta a la lesión. Los oxidantes mutágenos que incluyen radiaciones ionizantes, H2O2, bleomicina, neocarzinos-tatina y complejo Cu-fenantrolina, son capaces de producir sitios AP por oxidación de la desoxirribosa del ADN (García Triana B, Pérez Trueba G. Especies reactivas del oxígeno y cáncer: mecanismos de acción. Estrés oxidativo en Biomedicina; 2001).
3. Rupturas de una cadena del ADN: las rupturas de cadena (RC) se producen por escisión del enlace fosfodiéster. Ocurren frecuentemente por ataque químico o de radicales libres a la porción desoxirribosa del esqueleto del ADN. Se ha demostrado que sustancias carcinógenas, generadoras de ERO, provocan la aparición de rupturas de una cadena en el ADN, además de modificaciones de bases.8
4. Mutaciones: dado que muchos tumores humanos contienen 1 ó más mutaciones independientes, indispensables para el desarrollo del tumor, se ha postulado que son el resultado de un incremento en la velocidad de la mutagénesis endógena. De otra forma se supone que la ocurrencia de malignidad sería extremadamente rara. El efecto del ataque al ADN por ERO desempeña un papel importante en el incremento de estas mutaciones que conducen al cáncer.9.10
5. Activación de oncogenes e inactivación de genes supresores: oxidantes como el H2O2, O2·, oxígeno hiperbárico y el ozono, pueden inducir experimentalmente la activación de oncogenes en células iniciadas y protegidas.4,11 Es posible también que conduzcan a la inactivación de genes supresores. De esta forma se modifica la proliferación celular.
6. Inducción de metástasis: las vías más importantes para la diseminación de las células cancerosas, son los vasos sanguíneos y linfáticos. El ataque por radicales libres a las células endoteliales causa la liberación de proteasas que pueden con posterioridad, degradar la membrana basal. Esta acción se asocia con la generación de compuestos químicos que atraen a las células tumorales.12 En estudios experimentales se ha observado un aumento del número de células tumorales retenidas por la pared vascular y su migración hacia el subendotelio después de la acción de ERO (oxigenación hiperbárica), cuatriplicándose el número de metástasis así obtenidas.13
Papel de las ERO en cada una de las etapas de la carcinogénesis
El cáncer se desarrolla como un proceso microevolutivo que requiere de la acumulación de múltiples eventos que tienen lugar en un clon de células14 y comprenden 3 estadios:
- Inducción de mutación en el ADN de una célula somática (iniciación).
- Estimulación de la expansión tumoral del clon mutado (promoción).
- Malignización del tumor (progresión).
Se ha comprobado que las ERO pueden estimular el desarrollo tumoral en las 3 etapas señaladas.15-19
La angiogénesis constituye uno de los procesos de gran significación en el desarrollo y posterior difusión de las células tumorales. En un estudio realizado en 1998 se destaca el posible papel de las ERO en este evento, donde los breves episodios de hipoxia-reoxigenación, sobre las células del endotelio microvascular humano, causaron la formación de ERO y la activación del factor de transcripción nuclear (NF-Kappa B), acelerando significativamente el grado de morfogénesis tubular o neovascularización que define este proceso.20
ERO en la iniciación tumoral
La iniciación requiere de una modificación permanente del material genético de una célula. Los posibles mecanismos por los que transcurre el daño al ADN inducidos por estrés oxidativo son:
– Formación del. OH·, generado por la interacción del H2O2 con el hierro (Fe2+) o cobre (Cu2+) constitutivos, unidos o cercanos al ADN, o liberados en el interior celular a causa del estrés oxidativo. La reacción del H2O2 con estos iones metálicos reducidos es conocida como reacción de Fenton y es una vía fundamental en la generación de esta especie química.2
– Incremento del calcio (Ca2+) libre intracelular, ya sea producto de la movilización a partir de sus depósitos intracelulares (el retículo endoplasmático y la mitocondria) o a través del influjo extracelular. Esta respuesta es provocada por una sobrecarga de estrés oxidativo que agota las reservas de antioxidantes endógenos, lo que constituye una señal para la liberación de este elemento; que una vez liberado, además de provocar otras respuestas, conduce a la activación de endonucleasas que fragmentan al ADN (proceso que normalmente tiene lugar durante la apoptosis).21 Estos mecanismos no son excluyentes, por lo que pueden tener lugar simultáneamente.
ERO en la promoción tumoral
Las ERO pueden estimular la expansión de clones celulares mutados mediante la modulación temporal de genes relacionados con la proliferación y muerte celular.
En la promoción, las ERO inducen un incremento notable del Ca2+ citosólico, movilizándolo de las reservas intracelulares e incrementando su flujo desde el medio extracelular.22 El efecto del Ca2+ puede tener lugar por vía directa induciendo proto-oncogenes como c-fos o de forma indirecta, modificando la fosforilación de factores transcripcionales por proteína quinasa C dependiente de Ca2+ (PKC), la cual junto con otras quinasas, regula la actividad de factores transcripcionales por múltiples cascadas de fosforilación.
Las ERO pueden estimular la actividad PKC por vía directa mediante la oxidación de sus residuos de cisteína en el dominio regulatorio de la enzima. Pueden ejercer efectos directos sobre la regulación de la actividad de factores transcripcionales como el factor NF-kappa B que tiene bajo su control una gran variedad de genes.23
ERO en la progresión tumoral
El estadio final del cáncer es la malignización tumoral que se caracteriza por un crecimiento acelerado de las células, la evasión de la vigilancia inmunológica y la invasión de otros tejidos.
Muchos de estos cambios involucran lesiones adicionales al ADN, pensándose que la generación elevada de ERO en las células origina un estrés oxidativo persistente que incrementa su inestabilidad genómica, acompañándose de una disminución de las enzimas antioxidantes, lo cual incrementa a su vez la sensibilidad de estas células a las ERO.24
Muchos tipos de tumores pueden originar una respuesta de intensidad variable del sistema inmune. En dependencia de la intensidad de esta respuesta y la susceptibilidad del tumor, las ERO generadas por leucocitos activados pueden:
1. Originar un proceso inflamatorio crónico que lejos de conducir a la eliminación del tumor, incrementa la progresión tumoral.
2. Conducir a la muerte celular por citotoxicidad o inducir la muerte apoptótica.
Las especies oxidantes generadas por neutrófilos y eosinófilos activados desempeñan un papel potencial en la carciogénesis.
El incremento en la generación de ERO en la célula conduce a un incremento de la mutagénesis. La relación entre la concentración de estas y el efecto provocado es compleja, siendo más conveniente para lograr un efecto mutagénico (iniciador) concentraciones intermedias de ERO. Sin embargo, una concentración pequeña de ERO puede causar la muerte celular si el gen blanco de su ataque es esencial para la viabilidad celular y según la magnitud del estrés oxidativo, que a su vez depende de diferentes factores como: especie reactiva de oxígeno involucrada, presencia de carcinógenos y la posición del ciclo celular por el que transcurre la célula en el momento del ataque oxidativo.
Terapia antioxidante
Las hipótesis sobre la participación de las ERO en numerosas patologías, entre ellas el cáncer, ha condicionado que muchos investigadores se propongan el uso de tratamientos antioxidantes. Antes de proceder a un ensayo clínico de esta índole, debe tenerse en consideración los aspectos siguientes:
– Vínculo del daño oxidativo en la fisiopatología de la enfermedad (medición de las concentraciones de moléculas de importancia biológica oxidadas).
– Papel del desbalance oxidativo en el proceso patológico (central o epifenómeno).
– Presencia de fallos en el sistema antioxidante.
– Localización del daño oxidativo.
– Posibilidad de alcanzar concentraciones deseadas en el sitio blanco.
– Impacto del antioxidante seleccionado en el proceso oxidativo.
– Tolerancia y seguridad de las dosis empleadas.
En el tratamiento del cáncer, los mecanismos ejercidos por la mayoría de los agentes quimioterapéuticos y radiaciones ionizantes en la muerte de la célula tumoral, transcurren a través de un incremento en la generación de más radicales libres guiando a un daño tisular irreversible; por lo que el tratamiento con antioxidantes constituye un aprovechamiento terapéutico.25
Existen numerosos estudios clínicos que describen la efectividad del uso terapéutico de altas dosis de vitaminas antioxidantes y antioxidantes naturales en general en el tratamiento del cáncer.26-34 Se han publicado numerosos artículos y revisiones acerca del papel de los antioxidantes, la dieta y las modificaciones del estilo de vida sobre la prevención de la enfermedad. Sin embargo, el papel potencial de estos factores en el control del cáncer humano ha sido ampliamente ignorado. Los antioxidantes mejoran la calidad de vida y la supervivencia de los pacientes cancerosos, por lo que su utilización debe extenderse, no solo dirigido a la prevención, sino a los nuevos esquemas terapéuticos en esta patología.
Summary
A review on the role of free radicals on DNA was made. According to incidence data obtained from cancer registries existing in the world and the available data of world mortality, it can be estimated that every year appear 8 000 000 new cases of cancer (excepting skin cancer different from melanoma). These have been the reasons that have turned cancer into a priority health problem with the paradox that both its incidence and its mortality increase in spite of the great progress attained in its diagnosis and treatment during the last years. In general, the clinical treatment of this disease consists in treating the symptoms in order to improve the quality of life of these patients and not in the possible causes as the generation of free radicals in the organism.
Subject headings: FREE RADICALS; DNA; REACTIVE OXYGEN SPECIES; ANTIOXIDANTS/ therapeutic use; NEOPLAMS/ epidemiology; NEOPLAMS/ mortality; NEOPLAMS/ therapy.Aruoma OI, Kaur H, Halliwell B. Oxigen free radicals and human diseases. J R Soc Health 1991;111(5):172‑7.
Recibido: 20 de noviembre de 2003. Aprobado: 5 de enero de 2004.
Lic. Adonis E. Zorrilla García. Centro Nacional Coordinador de Ensayos Clínicos (CENCEC). Correo electrónico: adonis@cencec.sld.cu