Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.23 n.3 Ciudad de la Habana jul.-sep. 2004
Óxido nítrico, mutagénesis y cáncer
Lic. Dariel Díaz Arce
Resumen
Se realizó una revisión de los posibles mecanismos generadores de mutaciones, mediados por las especies reactivas derivadas del NO (RNOS), y su relación con la carcinogénesis. Las RNOS potencialmente pueden dañar el ADN de forma directa mediante procesos de oxidación, desaminación y metilación de bases; e indirecta inhibiendo la actividad de las enzimas reparadoras. La oxidación de bases conduce fundamentalmente a transversiones y la desaminación a transiciones. La especie reactiva N2O3 puede reaccionar con aminas biógenas generando N-nitrosaminas, reconocidos agentes alquilantes. La inhibición de las enzimas se manifiesta por la reacción de las RNOS con grupos nucleofílicos de aminoácidos críticos para la actividad enzimática. Todos estos mecanismos pudieran favorecer de una u otra forma a la ocurrencia de mutaciones en el ADN, implicadas en la activación de oncogenes o inhibición de genes supresores de tumores, o ambas, favoreciendo así el surgimiento y desarrollo tumoral.
Palabras clave: Óxido nítrico; cáncer; mutagénesis; p53; especies reactivas del óxido nítrico; inflamación.
El óxido nítrico (NO·) es una molécula que desempeña importantes funciones en procesos fisiológicos y patológicos en humanos. Su implicación en el funcionamiento de los sistemas inmune, cardiovascular y nervioso ha sido ampliamente detallada.1-3 Este gas es producido en cantidades abundantes bajo condiciones asociadas a procesos inflamatorios, reconocido factor de riesgo para el surgimiento y desarrollo del cáncer.4
Su síntesis es llevada a cabo por un grupo de enzimas denominadas óxido nítrico sintasas (NOS), cuyo único sustrato fisiológico parece ser el aminoácido L-arginina.2 La presencia y elevada actividad de estas enzimas se ha reportado en algunos tipos de tumores,5,6 y además correlacionada positivamente con daños al ADN.5
Todo lo anterior ha hecho enfocar múltiples investigaciones para desentrañar el verdadero papel de este gas en la carcinogénesis. En esta revisión se pretenden analizar algunas evidencias que relacionan directamente al NO· con el surgimiento de tumores.
Destinos fisiológicos del NO·
Una vez sintetizado el NO, su destino en los sistemas biológicos es regido por los procesos siguientes:
Difusión a células vecinas. La presencia de un electrón no pareado en su molécula le permite interactuar con metales de transición de algunas enzimas y así modular su actividad.7,8 El coeficiente difusional de este gas depende de los lípidos y proteínas que se encuentre a su paso.9
Autoxidación del NO·. Generalmente se produce cuando se incrementan mucho sus concentraciones intracelulares, el cual en presencia del O2 se convierte en trióxido de dinitrógeno (N2O3).10,11 Esta reacción se acelera cuando ocurre en sitios hidrofóbicos como en el interior de las membranas lipídicas o de núcleos proteicos.11,12 El N2O3 es un agente nitrosante poderoso, con gran afinidad por sitios nucleofílicos.8
Reacción con superóxido (O2-) para formar peroxinitrito (ONOO-). Esta reacción presenta una cinética de tipo difusión-limitante, por lo que se plantea que es la que rige el destino del NO en presencia del anión superóxido (O2-).13,14 El producto es altamente oxidante, comparado en algunas ocasiones con el radical OH.
Mecanismos genotóxicos del NO·
Actualmente se considera que el NO· es capaz de generar lesiones en la secuencia primaria del ADN y otras biomoléculas, y de esta forma mediar el surgimiento y desarrollo tumoral. Los mecanismos por los cuales este gas puede producir esos daños son explicados a partir de los efectos deletéreos de las especies reactivas derivadas de él.
Mecanismos de daño directo al ADN por especies reactivas derivadas del NO· (RNOS)
Las N-nitrosaminas son compuestos químicos con potencial carcinogénico reconocido, debido a que pueden ser metabolizadas a fuertes agentes alquilantes.15 Se sintetizan mediante la reacción del agente electrofílico N2O3 con aminas biógenas según la primera reacción representada en la figura 1.
Fig. 1. Desaminación mediada por el N2O3.
La formación endógena de estos compuestos se ha demostrado en líneas celulares de hepatocitos inmortalizados con el virus de los simios SV 40 Tag.16
Desaminación de bases
Las N-nitrosaminas de aminas primarias pueden generar iones diazonium, los que se hidrolizan espontáneamente a alcoholes como se representa en la reacción 2 de la figura 2.
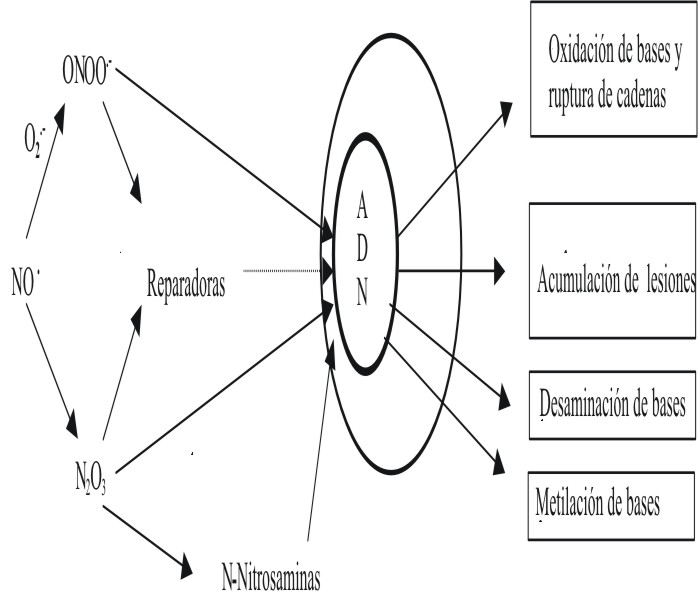
Fig. 2. Mecanismos mutagénicos del NO, mediados por sus especies reactivas (RNOS).
La presencia de este tipo de aminas en la estructura de las bases nitrogenadas indica que estas pueden ser desaminadas por el NO· vía N2O3, generándose alteraciones puntuales con potencial mutagénico.17,18
Experimentos in vitro han aportado evidencias, las cuales sugieren que la desaminación de bases por este mecanismo parece tener un patrón de mutaciones dirigido fundamentalmente a las bases púricas, aunque también se pueden afectar las pirimidínicas.19 Las mutaciones más comunes son las transiciones guanina (G) a adenina (A) y viceversa.18 También es frecuente la formación de bases modificadas como la oxanina, derivada de la guanina, que puede producir entrecruzamientos inespecíficos ADN-proteínas.20,21 De esta manera se afecta la integridad del ADN por 2 mecanismos diferentes: provocar inestabilidad genómica por el entrecruzamiento entre las proteínas-ADN y actuar como un sustrato suicida para enzimas reparadoras de este daño.21
Se ha observado in vitro una mayor frecuencia de alteraciones en simples que en dobles cadenas de oligonucleótidos, eso sugiere que este mecanismo mutagénico se produce cuando las bases se encuentran desprotegidas en eventos celulares como la replicación y la transcripción, en los que la doble hélice se abre.18
Experimentos en macrófagos activados en cultivos celulares muestran daño oxidativo y por desaminación del ADN.7 El análisis del destino del NO en estas células mostró que la mayor parte pasaba a la generación de peroxinitrito (ONOO-); un fuerte agente oxidante.22
El tratamiento de plásmidos de ADN con ONOO- sintético y su inserción en sistemas biológicos para su replicación y posterior análisis, mostraron un espectro de mutaciones puntuales; fundamentalmente transversiones de guanina a timina (T) y de guanina a citosina (C).23
El poder oxidante de esta especie es suficiente también como para dañar directamente al azúcar y provocar sitios sin bases en el ADN,24 además de oxidar y modificar las bases generando especies difíciles de reparar.25 La formación de estas lesiones ocurren con más frecuencia en simples que en dobles cadenas, siendo reparada por la formamidopirimidina-DNA glicosilasa (Fpg).
Modificación indirecta de la secuencia del ADN por las RNOS
Algunos autores han sugerido que tanto la desaminación, oxidación y ruptura de cadenas del ADN por las RNOS requiere de concentraciones muy elevadas, situación que muy raramente se daría en humanos. Además, in vivo los antioxidantes como el ascorbato y el glutatión (GSH) son abundantes, lo que disminuye las posibilidades de acumularse RNOS a concentraciones suficientes como para producir daño al ADN directamente.26 Es por ello que se han sugerido otras hipótesis.
Una hipótesis muy prometedora se basa en la inhibición de los sistemas enzimáticos reparadores de las lesiones en el ADN y de esta manera favorecer el daño indirectamente.
Las RNOS poseen una elevada afinidad por el grupo tiol (-SH) de la cisteína.27 Lo anterior sugiere que aquellas enzimas con cisteínas críticas para su actividad, pueden ser inhibidas por estas especies reactivas. Otros grupos nucleofílicos como el hidroxilo (-OH) de la tirosina28 y el amino (-NH2) de la lisina,13 también son potencialmente modificables.
Jaiswal y otros (2001), observaron que las líneas celulares de colangiocarcinoma y colangiocitos transfectados con el gen de la NOS inducible (iNOS), eran incapaces de reparar la lesión 8-oxo-G.29 Esta lesión es reparada por las enzimas Fpg y 8-oxo-guanina glicosilasa (Ogg1), enzimas que resultaron inhibidas por el NO y sus especies reactivas.30,31 Estas evidencias pudieran explicar los resultados de Jaiswal y otros.29
Otras enzimas inhibidas por el NO resultaron ser las ADN alquiltransferasas reparadoras de los residuos metilados de G y T (O6-metil guanina y O4-metil timina),32 y la enzima ADN ligasa.33 La inhibición de esta última pudiera explicar el hecho de que cuando las células se exponen al NO, se observe un elevado número de rupturas de cadenas de ADN.22
El óxido nítrico en la iniciación y promoción tumoral
Todos los mecanismos hasta ahora expuestos explican, desde diferentes puntos de vista, los efectos mutagénicos del NO (fig. 3). Estas mutaciones bien colocadas pudieran provocar la inactivación de genes supresores de tumores y la activación de oncogenes y de esta forma participar en diferentes etapas del proceso carcinogénico. Quizás el ejemplo más evidente de esto lo constituye el gen para la proteína p53, el cual se encuentra mutado en alrededor de 50 % de todos los tumores humanos.34
Estudios previos presentaron in vitro mutaciones de importancia biológica en el gen p53 inducidas por el NO y la metilación.35 Posteriormente se demostró que en estadios iniciales del carcinoma de pulmón existe una correlación significativa entre la actividad de las NOS y las mutaciones presentes en dicho gen.5
Aunque en estos estudios no se analizó la funcionabilidad del producto génico, la hipótesis es suficiente como para plantear que el NO, en situaciones como la inflamación, puede provocar la inactivación del gen p53 y favorecer al menos de este modo el surgimiento y desarrollo tumoral.
Summary
A review was made on the possible mechanisms generating mutations mediated by the reactive species derived from NO (RNOS) and their connection with carcinogenesis.The RNOS may damage the DNA directly by processes of oxidation, deamination and methylation of bases, and indirectly by inhibiting the activity of the repairing enzimes. The oxidation of bases leads mainly to transversions, whereas deamination leads to transitions. The reactive species N2O3 may react with biogen amines generating N-nitrosamines, known as alkylating agent. The inhibition of the enzimes is manifested by the reaction of the RNOS with nucleophylic groups of critical aminoacids for the enzimatic activity. All these mechanisms may favor in one way or another the occurrence of mutations in the DNA involved in the activation of oncogens and/or inhibitons of tumor-suppressing genes, enabling this way the appearance and development of tumors.
Key words: Nitric oxide; cancer; mutagenesis; p53; reactive nitric oxide species; inflammation.
Biochim Biophys Acta 1996;1288(2):F31-6.
Recibido: 25 de marzo de 2004. Aprobado: 14 de junio de 2004.
Lic. Dariel Díaz Arce. Departamento de Bioquímica, Km 3 ½ Carretera Panamericana, Santa Fé, Municipio Playa. Ciudad de La Habana, Cuba