Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.25 n.3 Ciudad de la Habana jul.-sep. 2006
Trabajos de revisión
Instituto Superior de Ciencias Médicas de La Habana
Facultad de Ciencias Médicas Enrique Cabrera
Algunos aspectos básicos de evolución de virus ARN: importancia médica
Dra. Lucía Ayllón Valdés, Dr. Ángel Valdivia Romero, Lic. Martha Mas García, Dra. Lucrecia Trespalacios Brey y Dra. Girelda Cordero López
Resumen
Se realizó una revisión de los conceptos más importantes relacionados con la evolución de los virus ARN. Los virus con genoma ARN son los parásitos intracelulares más abundantes en la biosfera. Además se resumió el estado actual de conocimientos sobre la estructura de las cuasiespecies virales y sus implicaciones biológicas, lo que permitirá a todos los profesionales, relacionados de una forma u otra con las enfermedades infecciosas, comprender mejor la adaptabilidad de los virus, su poder patogénico y de persistencia, así como el diseño actual y futuro de estrategia para la prevención y el control de las enfermedades que ocasionan.
Palabras clave: Evolución, mutaciones, recombinaciones, intercambio de genes, cuasiespecies, conceptos e implicaciones biológicas.
Los virus con genoma ARN, o los virus que usan el ARN como intermediario replicativo son el grupo de parásitos intracelulares más abundante en la biosfera. Su material genético puede ser ARN de cadena simple o de hebra doble, de una sola cadena o segmentado en varios fragmentos. Su complejidad medida por la longitud de su genoma; está comprendida entre 3 y 30 kilobases (kb).
Ellos infectan animales, plantas y bacterias, y causan severas enfermedades en los humanos como son las hepatitis, fiebre amarilla y las encefalitis virales. Muchas enfermedades nuevas, emergentes y reemergentes virales son causadas por virus ARN y algunos ejemplos más recientes son la pandemia del SIDA que comenzó a mediados de la década de los 80.1 El primer reporte de un brote de síndrome pulmonar por Hantanvirus (SPH) fue en el oeste de los EE. UU. en 1993,2 los primeros casos de Influenza aviar en humanos que se reportaron en 1997 en Hong Kong (Science and Development NetworK. Bird Flu update; 23 December 2005)3,4 y el síndrome respiratorio agudo severo (SRAS) en 2003.5 Otras emergentes como el dengue y su forma severa (dengue hemorrágico) son también producidas por virus ARN.6-8
Los conceptos que se brindan en este artículo serían útiles para la mejor comprensión de los estudios evolutivos, estudios de epidemiología molecular, condiciones que favorecen la aparición de nuevas, emergentes y reemergentes enfermedades virales, respuestas inmunes de los hospederos en condiciones especiales, factores ecológicos y su importante influencia en la aparición de algunas enfermedades, y la marcada virulencia de algunas cepas y en algunos hospederos.
En particular en Cuba es la primera vez que se brinda información (en forma de artículo de revisión), relacionada con esta temática tan novedosa e importante.
Conceptos
Evolución: fenómeno que ocurre en todas las especies en la naturaleza y que enmarca 2 condiciones principales: primero que exista replicación en condiciones más o menos estables y segundo que las características fenotípicas de los ancestros se heredan y se modifican de acuerdo con un proceso de selección.8
El genial Carlos Darwin definió la evolución con 2 palabras: descendientes con modificaciones.
La evolución está relacionada con 2 procesos que marchan en paralelo y que siempre están unidos en el tiempo: selección natural y la variación natural.
Selección natural: este concepto se refiere a un conjunto de fuerzas de sistemas bióticos y abióticos dentro del medio circundante, el cual permite que una especie se reproduzca y persista en la naturaleza. Para esto es necesario que se hereden en las poblaciones descendientes las características fenotípicas más adaptables que permitan que una especie no se extinga con el tiempo. De lo anterior se deriva un término muy utilizado en el vocabulario anglosajón de los evolucionistas y es el de los fitness (partículas virales con mayor eficiencia biológica), este es un parámetro que mide la adaptación de un microorganismo en su medio ambiente. En el caso particular de los virus, las partículas virales con mayor eficiencia biológica son evaluadas mediante la cuantificación de la eficiencia de un virus de producir una progenie viral infecciosa con respecto a un virus de referencia, dentro de la misma población y en un medio con condiciones estables. Es un valor necesariamente relativo que puede medirse mediante experimentos de infección competitiva en cultivos celulares o en vivo. Por tanto los fitness son determinados por la selección natural e incrementada por la adaptación. Más adelante se profundizará en relación con estos conceptos.8
Variación natural: es un proceso más ligado al azar y que incluye 2 factores; el primero son las causas o mecanismos intrínsecos a escala molecular más importantes de la diversidad genética de los virus ARN y el segundo es el tamaño de las poblaciones virales que será explicado más adelante con el concepto de cuaisespecies y sus implicaciones biológicas. La variación natural varía grandemente entre las diferentes familias de virus ARN. De inmediato se explicarran los mecanismos más importantes de la diversidad genética y más adelante se abordará la importancia del tamaño de las poblaciones virales y sus implicaciones biológicas. Los mecanismos de variabilidad genética pudieran ser clasificados en mecanismos de variabilidad genética más frecuentes y mecanismos de variabilidad genética menos frecuentes.8
Mecanismos de variabilidad genética más frecuentes
1. Las mutaciones (delecciones, inserciones y mismatch): estas se producen por errores de las ARN polimerasas, que carecen de actividad correctora exonucleasa 3® 5, como sí se observa en los microorganismos ADN. Una mutación se refiere a la síntesis molecular o modificación de uno o varios cambios nucleotídicos en un gen que lo diferencia de su parental. Las tasas de mutaciones se refieren a la cantidad de errores que ocurren por nucleótido o por genoma y por ronda de síntesis o dicho en otras palabras es la frecuencia con que ocurre una mutación durante la replicación del genoma y es un excelente parámetro para medir el grado de mutabilidad entre los diferentes virus.8
2. Recombinaciones: las recombinaciones pueden ser definidas como un proceso mediante el cual el material genético es intercambiado, resultando en la formación de un ácido nucleico compuesto de 2 ácidos nucleicos parentales o más. Las recombinaciones pueden ocurrir entre genomas virales diferentes o entre un genoma viral y otro genoma no viral (genoma del hospedero, genoma de algún otro parásito que coinfecta el mismo hospedero o de un plásmido). Este proceso más frecuente en virus con genomas no segmentado se considera el principal contribuyente de la llamada divergencia genética rápida. Dicho en otras palabras, mientras las mutaciones necesitarían de millones de generaciones para obtener un gen beneficiado, el mismo efecto se obtendría en un solo evento de recombinación entre el gen donador y el gen receptor en los descendientes.8 En algunos virus como el dengue, estudios más recientes evidencian la importancia de las recombinaciones como mecanismo productor de variabilidad genética y por tanto como una de las más importantes causas de los diferentes grados de severidad de la enfermedad y su potencial de transmisión.9-12
3. Intercambio de genes (reassorment): este proceso ocurre cuando 2 virus de genoma segmentado o más coinfectan una célula y la progenie resultante tendrá genomas segmentados de ambos parentales. Este mecanismo en condiciones naturales brinda la posibilidad de un gran número de combinaciones que ocurren entre virus con genoma segmentado (Orthomyxovirus, Reovirus, Arenavirus, Birnavirus, Bunyanvirus, Nodavirus, Geminivirus y Ribovirus).8 Este mecanismo de variabilidad genética ha sido reservado para los virus ARN segmentado, en los cuales hasta el momento actual no se han comprobado las recombinaciones.8,13 El ejemplo mejor documentado y estudiado es el caso del virus de influenza. Un ejemplo muy conocido fue la pandemia de influenza ocurrida en 1968 en la cual el intercambio de genes ocurrió entre una cepa H2N2 humana y una cepa animal con H3 de hemaglutinina. El resultado fue una cepa pandémica H3N2, donde el gen PB1 y el gen H3 derivaron de la cepa animal y el resto de los genes incluido el gen N2 derivaron de la cepa humana.14,15 Estas sustituciones produjeron un salto antigénico en estas glicoproteínas de superficie que fueron clave para la respuesta de anticuerpos antivirus, por lo que el nuevo virus halló una población humana sin anticuerpos protectores en la que pudo expandirse de forma pandémica.
Por último, se mencionarán algunos aspectos interesantes relacionados con estos virus: uno es que hasta hace poco tiempo y específicamente hasta el surgimiento de los primeros casos de influenza aviar en humanos, no se había comprobado que las cepas de influenza de aves fueran capaces de infectar a los humanos y viceversa; de diferente forma el cerdo puede ser infectado por cepas de influenza de aves y de humanos y se ha planteado que este constituye el reservorio intermediario para el origen de las cepas pandémicas cuando la cepa animal es de origen aviar.16 El otro aspecto es que las aves constituyen como una especie de gran tanque de almacenamiento, donde pueden encontrarse las cepas más antiguas de influenza y esta pudiera ser la fuente y explicación del retorno de algunas cepas que circularon tiempos atrás.17,18 Un ejemplo muy evidente de lo anterior es que los virus ancestrales que causaron la pandemia de 1918 se mantienen circulando en las aves salvajes con poco cambio aminoacídico o ninguno. Este fenómeno ha sido denominado estasis evolutivo.
Una enfermedad nueva producida por los virus de influenza es la influenza aviar que hoy por hoy constituye la mayor preocupación del hombre para el presente siglo. Como se mencionó al principio, los primeros casos ocurrieron en Hong Kong en 1997. Esta enfermedad tiene como característica más importante que es altamente infecciosa, el hospedero natural de este virus son las aves silvestres, su reservorio principal son las aves acuáticas y que afecta pollos, pavos y patos. Esta enfermedad marca un inusual y nuevo comportamiento epidemiológico de los virus de influenza y es que los humanos pueden ser infectados directamente por cepas de influenza aviar (Science and Development NetworK. Bird Flu update; 23 December 2005).3,19,20
Aunque han existido muchos casos en humanos todavía no se ha comprobado la transmisión de humano a humano.
Para que se tenga una idea de la mortalidad de esta enfermedad en humanos causadas por el subtipo H5N1 solo se citarán algunos ejemplos: en Tailandia de 19 casos hubo 13 fallecidos (68 %), en Viet Nam de 91 casos hubo 41 fallecidos (45 %), en Cambodia de 4 casos hubo 4 fallecidos (100 %) y en Indonesia de 7 casos hubo 4 fallecidos (57 %). El porcentaje total de mortalidad de todos estos países es de 51% (Science and Development NetworK. Bird Flu update; 23 December 2005).
Los mecanismos de variabilidad genética menos conocidos son: las mutaciones o sustituciones de nucleótidos que provocan la formación de codones de parada prematuros, las inserciones o delecciones de residuos de adenosina (frame shift) y las sustituciones reiterativas (hipermutaciones).21-23
Cuasiespecies e implicaciones biológicas
Cuasiespecies: en la década de los setenta se obtuvo el primer indicio de que los virus ARN pudieran tener una estructura poblacional distinta de lo que se creía hasta entonces. El indicio tuvo un origen teórico y otro experimental, totalmente independientes. En 1971, Eigen publicó un artículo acerca de la evolución de macromoléculas simples con capacidad replicativa que posteriormente fueron denominadas replicones.
Este tratamiento teórico fusionó conceptos de evolución darwiniana, en particular el de mutación y selección entre formas variantes del replicón inicial, con conceptos de teoría de la información.24
Su objetivo fue entender las bases moleculares de la adaptación de macromoléculas sencillas que probablemente fueron las precursoras de formas más complejas de vida en la Tierra, hace unos cuatromil millones de años. Al profundizar en el origen y la cuantificación de las mutaciones, Eigen y Schuster24 desarrollaron el concepto de cuasiespecies para describir una distribución ordenada y estable de mutantes dominada por un genoma principal, denominado secuencia maestra. Esta puede ser minoritaria en una población de replicones, en cuyo caso la población está formada esencialmente por una nube de mutantes.
El origen experimental del concepto de cuasiespecies procedió de los estudios de Weissmann25 y otros con un bacteriófago que infecta algunas estirpes de Escherichia coli, denominado fago QB, también desarrollado durante la década de los setenta.
Implicaciones biológicas del concepto de cuasiespecies:
a) El espectro de mutantes como reserva de variantes fenotípicas: la más obvia es que este enjambre de mutaciones constituye una poderosa y gran reserva de variantes fenotípicas que en condiciones de un entorno cambiante favorable (presión selectiva) pudieran dirigir a una mayor patogenicidad y virulencia de una enfermedad producida por un virus ARN. Algunos ejemplos pudieran ser variantes con mayor especificidad para la infección de un tejido particular, variantes fenotípicas que puedan ser más resistentes a un determinado antiviral o variantes que sean capaces de evadir el sistema inmune de un individuo o de incluso poblaciones humanas enteras.8
Un creciente número de ejemplos ha demostrado que las variantes presentes en el espectro de mutantes permiten al virus flexibilidad de comportamiento biológico y el escape a presiones selectivas que tienden a limitar su replicación. Así, la presencia de mutantes resistentes a anticuerpos neutralizantes o de mutantes de escape a células T citotóxicas, parece contribuir a la persistencia en organismos de virus tan significativos como el virus de la inmunodeficiencia humana o el virus de la hepatitis C.26,27
Investigadores cubanos han invocado la probable existencia en dengue de mutantes de escape que pudieran explicar la severidad de los cuadros clínicos durante el transcurso de una epidemia (Rosario D. Diagnóstico y caracterización molecular de los virus del dengue [Tesis de Doctor en Ciencias]. Ciudad de La Habana: Instituto de Medicina Tropical Pedro Kourí; 2001) (Rodríguez R. Caracterización molecular de cepas de dengue aisladas en epidemias cubanas [Tesis de Doctor en Ciencias]. Ciudad de La Habana: Instituto de Medicina Tropical Pedro Kourí; 2005).28,29
b) Relativas a su estructura poblacional: resulta a veces difícil comprender que el espectro de mutantes representado en la figura 1 es solo una representación muy relativa de la realidad verdadera con respecto a una población viral determinada. Téngase en cuenta que el método de mayor precisión hasta el momento actual para determinar la estructura primaria de genomas de cualquier microorganismo es la secuencia nucleotídica y esta no expresa la secuencia nucleotídica de una sola molécula, sino una secuencia consenso dentro de una población viral. Tan solo mediante procedimientos de clonaje biológico o molecular es que se podrá saber (y no siempre) el verdadero comportamiento heterogéneo de una población viral a estudiar, además de que es la única forma para acercarse al verdadero espectro de mutantes dentro de una población viral.30
Fig. 1. Los genomas individuales se representan por rayas horizontales y los símbolos sobre las rayas representan mutaciones. La distribución de la izquierda es genéticamente homogénea, mientras que la del centro y la derecha son distribuciones genéticamente heterogéneas, tal como se hallan en las cuasiespecies víricas. Las 3 líneas inferiores, algo separadas del resto de las distribuciones, representan la secuencia promedio o consenso de la población. Observe que, a pesar de su elevada heterogeneidad, la distribución del centro tiene la misma secuencia promedio que la de la izquierda. Al conjunto de mutantes se le denomina espectro de mutantes de las cuasiespecies.
c) Eficacia biológica y adaptación viral: una de las implicaciones de cuasiespecies que actualmente recibe mucha atención es la continua variación de eficacia biológica que caracteriza a los virus. Numerosos estudios han establecido una gran influencia del tamaño poblacional del virus en el mantenimiento, pérdida o ganancia de eficacia biológica.
Así, los cuellos de botellas poblaciones, en los que un solo genoma inicia la infección de modo repetitivo, suelen provocar pérdidas de eficacia biológica. Por el contrario, si en un ambiente constante se permite la multiplicación del virus con tamaños poblacionales altos, suele producir un aumento de eficacia de la población. No obstante, si un virus se halla inicialmente muy debilitado, incluso tamaños pequeños de población son suficientes para mantener o incrementar su eficacia biológica con el tiempo. En cambio, si la eficacia inicial es alta, el tamaño poblacional necesario para mantenerla es también muy alto.31,32
Los fenómenos de cuellos de botellas poblaciones aunque no han sido muy estudiados en la naturaleza la mayoría de los investigadores coinciden que es probable que sea muy frecuente en el ciclo de vida natural de muchos virus ARN. Este concepto muy ligado al de las cuasiespecies se ha observado sobre todo en los virus respiratorios que emplean gotas de saliva como vehículo en la transmisión horizontal de estos. Una gota de saliva que mide aproximadamente menos de 1 a 10 µm de diámetro solo es capaz de llevar un número muy pequeño de partículas virales en la transmisión de un hospedero a otro.33,34
Otro ejemplo del fenómeno de cuello de botella genético en la transmisión horizontal de los virus ARN es lo que usualmente ocurre cuando un nuevo individuo es infectado por el VIH. En este caso el nuevo individuo infectado será a través de células infectadas o directamente a partir de partículas virales. En ambos casos el número de genomas individuales (que pueden ser desde 1 hasta 100) es relativamente muy pequeño con respecto al tamaño de la población de genomas del donador (aproximadamente de 1010). Los efectos del cuello de botella genético durante la transmisión horizontal del VIH son ilustrados comparando la variabilidad genética de los virus del donador y la baja variabilidad genética en el nuevo individuo infectado. De todas formas el incremento de la variabilidad genética de las poblaciones virales en el nuevo hospedero infectado ocurre en períodos de tiempo relativamente cortos.8,30
El resultado del fenómeno es una población relativamente homogénea con respecto a las poblaciones virales típicas. Dicho de otra forma, de las poblaciones virales típicas (altamente heterogéneas) solo quedará una población homogénea con los fitness altamente reducidos.
El más drástico y mejor ejemplo de un cuello de botella genético que pudiera ser obtenido en condiciones artificiales al nivel de laboratorio, sería el aislamiento de la partícula viral que produce una placa, reduciéndose la población viral a una.
Un ejemplo de lo anterior fue un trabajo realizado en Cuba en 1998, en el cual se concluyó un estudio de epidemiología molecular del virus sincitial respiratorio humano (virus ARN de simple cadena y de polaridad negativa), que incluyó 3 brotes consecutivos en Ciudad de La Habana (1994/1995, 1995/1996, 1996/1997). De manera sorprendente y de acuerdo con lo reportado en la literatura, las cepas aisladas en los 3 brotes fueron idénticas, tanto antigénica como genéticamente y más asombroso aún fue que tenían un gran parentesco con la cepa Long (cepa de referencia aislada en 1958 en EE. UU.). Como probables factores externos que pudieron contribuir directa o indirectamente en la reducción del tamaño de las poblaciones virales en condiciones naturales planteamos los siguientes: a) la baja densidad poblacional de la población cubana con respecto a la de los países desarrollados, b) el carácter insular del país, lo que constituye sin duda una barrera natural para la importación de cepas desde el exterior, c) el escaso número de vuelos aéreos hacia afuera y hacia adentro en Cuba con respecto al resto del mundo, d) la drástica disminución del movimiento de las poblaciones humanas a través de todo tipo de medios de transporte dentro del propio país, producto de la escasez de combustible en estos años. Todos estos factores externos y dependientes básicamente del hombre influyeron quizá en la aparición del fenómeno de cuello de botella (Valdivia A. Diagnóstico molecular y antigénico del virus sincitial respiratorio humano y su comportamiento epidemiológico inusual [Tesis de Doctor en Ciencias Médicas] Ciudad de La Habana. Instituto de Medicina Tropical Pedro Kourí; 2001) (Valdés O. Caracterización antigénica y molecular del virus sincitial respiratorio humano, Cuba [1994-2000] [Tesis de Doctor en Ciencias de la Salud]. Ciudad de La Habana. Instituto de Medicina Tropical Pedro Kourí; 2004).35-37
La frecuencia en que ocurre este fenómeno en organismos superiores es muy difícil de determinar pues dependería de fenómenos impredecibles como son los desastres masivos (incendios, inundaciones, volcanes en erupción, epidemias, etc.).
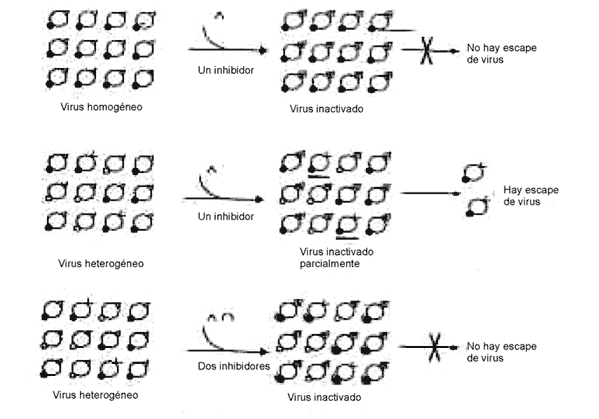
d) Estrategias para el control de enfermedades víricas: por lo descrito anteriormente podría parecer que cuasiespecie es un concepto con interés académico, algo así como un refinamiento en el modo de entender poblaciones víricas, pero con poca relevancia para la práctica médica o veterinaria; y nada más lejos de la realidad. Si no se diera una estructura poblacional de los virus RNA como la descrita en los párrafos anteriores, bastaría una elevada intensidad inhibitoria de la replicación viral, sea en forma de anticuerpos o de inhibidores, para detener la infección de modo eficiente y permitir al sistema inmune la resolución de esta. Si la diana del inhibidor potente es susceptible de variación de modo que las variantes víricas muestren una menor afinidad por el inhibidor, entonces se producirá el escape del virus por la heterogeneidad poblacional. Si, por el contrario, se emplean 2 inhibidores dirigidos a dianas independientes, la probabilidad de escape es menor porque el escape está condicionado a la variación simultánea de las 2 dianas (fig. 2). Obviamente, durante las infecciones víricas reales la situación es más compleja, porque el número de partículas víricas implicadas es muchísimo mayor (a veces hasta un total de 1012) y existen varias formas variantes de las dianas de unión a inhibidores que modifican su sensibilidad a estos en distintos grados. El gran potencial de variación y adaptación de las cuasiespecies virales, condiciona también las estrategias de vacunación frente a diferentes enfermedades causadas por virus ARN. De esta manera, las vacunas atenuadas por acumulación de cambios genéticos presentan una probabilidad de reversión a formas patógenas, que puede variar en función del sistema viral y del número de mutaciones implicadas en la atenuación.30
Fig. 2. Representación esquemática del efecto de la heterogeneidad viral en la supervivencia de un virus sometido a la acción de un inhibidor, sea una droga o un anticuerpo neutralizante. Arriba a la izquierda se representa una población homogénea de virus (círculos grandes) con 2 dianas (triangulo blanco y punto negro), idénticas en cada partícula. En este caso un inhibidor potente puede ser suficiente para inactivar el virus y evitar su replicación (mutante de escape). En la fila del medio, se produce escape de virus. La última fila ilustra que la misma distribución que la anterior puede ser inactivada completamente usando 2 inhibidores de manera simultánea. Esto es lo que justifica el empleo de vacunas polivalentes y terapia de combinación en virus que siguen una dinámica de cuasiespecies.
Por otra parte, la eficacia de vacunas sintéticas basadas en subunidades virales, que presentan una serie de ventajas potenciales importantes frente a las convencionales, se ve también afectada por las características de las cuasiespecies virales. Recientes estudios han puesto en evidencia que la selección de variantes antigénicos virales, capaces de escapar a la neutralización por los anticuerpos o el reconocimiento por linfocitos citotóxicos, puede contribuir a la limitada protección conferida por estas vacunas. Este escape viral se da con mucho menor frecuencia cuando son empleados virus completos como vacuna, debido, probablemente a que la respuesta inducida por los péptidos e inmunógenos sencillos estimula un repertorio considerablemente más restringido de mecanismos inmunes en el hospedador, lo que hace más probable la selección de variantes virales dentro de las cuasiespecies.30
Dada la heterogeneidad y continua producción de variantes durante la multiplicación de virus RNA, las vacunas deben ser multivalentes y las terapias con agentes antivirales deben ser terapias de combinación.30,38,39
Otra tendencia muy reciente que se encuentra en curso de investigación y que ha sido ensayada en algunos virus como el VEV, poliovirus y el virus de la inmunodeficiencia humana es la llamada catástrofe de error. Lo anterior consiste en el uso combinado de diferentes mutágenos químicos que incrementan las tasas de error por encima de las basales durante la replicación viral, produciendo una acentuada pérdida de la infectividad viral y entrada del virus en la llamada catástrofe de error. En fin, la dinámica de las poblaciones virales en forma de cuasiespecies abre la posibilidad de ensayar nuevas estrategias antivirales, como la entrada de un virus en catástrofe de error, actualmente en curso de investigación.30,40-42
e) Aspectos ecológicos y evolutivos: las emergencias y reemergencias de enfermedades víricas tienen comúnmente un origen multifactorial, en el que pueden intervenir influencias ecológicas, ambientales y demográficas. En los últimos 15 años se han descrito 40 virus humanos emergentes, varios con un origen zoonótico, además de un número parecido de virus emergentes que afectan a animales y plantas.30
Existe creciente evidencia de que la dinámica evolutiva de los virus puede desempeñar un papel importante en estas emergencias, en conjunción con los factores ambientales que pueden facilitar contactos entre organismos infectados y nuevas especies de hospedadores potenciales.
Algunos ejemplos de lo anterior son los siguientes: la aparición de la encefalitis equina epizoótica en algunas regiones de la América del Sur, la aparición de varios brotes de gripe humana tipo A (ya fue explicado antes), la aparición del parvovirus canino debido a un cambio genético en un virus circulante; esto ocurrió en los años 1970 como resultado de unas pocas sustituciones de aminoácidos en la cápside de un parvovirus felino, sin que en este caso mediasen, aparentemente, circunstancias externas especiales de tipo ambiental u otras.30
Todos estos ejemplos indican la importancia con respecto al peligro de emergencia de nuevas enfermedades víricas por expansión del rango de hospedador.
Por último y no menos importante quisiéramos enfatizar en el uso no conveniente de algunos virus RNA patógenos, para limitar el tamaño poblacional de una especie animal presente como plaga en una zona geográfica determinada. Algunos ejemplos son el uso de los baculovirus33 para aniquilar ciertas especies de insectos o el virus de la mixomatosis para controlar las especies de conejos en Australia. Recientemente esta práctica se ha extendido al virus de la enfermedad hemorrágica del conejo30 para disminuir las poblaciones de este mamífero en Australia y Nueva Zelanda.
Los cambios de hospedador son acontecimientos aleatorios e impredecibles. Concluyendo por todo lo recogido en la literatura especializada actual no es recomendable utilizar un virus RNA patógeno para eliminar o disminuir la existencia de una especie animal o planta en una región geográfica determinada.
Conclusiones
Aunque puede ser algo contradictorio concluir con preguntas, quisiéramos enfatizar que a pesar de todo lo adelantado en este campo de la ciencia y en especial lo que concierne a evolución de virus, al final de este artículo quedarán muchas interrogantes sin respuesta para muchos investigadores como por ejemplo:
¿Qué determina las grandes variaciones en niveles de heterogeneidad genética entre unos virus y otros?
¿Qué relevancia tiene la variabilidad genética en patogenia viral?
Otras preguntas que al nivel de laboratorio se realizarán algunos investigadores son:
¿Qué cambios de aminoácidos pueden conferir resistencia a anticuerpos neutralizantes o a células T citotóxicas?
¿Qué cambios genéticos en los virus pueden propiciar aumento de la eficacia biológica y qué cambios producen su pérdida?
Otras preguntas mucho más serias y que están relacionadas con la supervivencia de la especie humana en el planeta serían:
¿No pudieran surgir otras enfermedades nuevas virales de mayor morbilidad y mortalidad que el propio SIDA?
¿Qué pudiera pasar en un futuro no muy lejano si los virus de influenza aviar se adaptaran mejor y pudieran transmitir la enfermedad de humano a humano?
La realidad es que hasta hace pocos años los resultados del mundo científico apuntaban a que las enfermedades de etiología bacteriana estaban en vía de erradicación y las virales solo dependían de la creación de algunos agentes antivirales y nuevas vacunas más efectivas, pero la realidad actual es completamente distinta y, al menos en parte, ello se debe a la dinámica evolutiva del mundo microbiano.
Some basic aspects on the evolution of the RNA virus: medical importance
Summary
A review of the most important concepts related to the evolution of the RNA virus was made. The viruses with RNA genome are the most abundant intracellular parasites in the biosphere. The current state of the knowledge about the structure of the viral quasispecies and their biological implications was also summarized, allowing all the professionals connected in one way or another with the infectious diseases to understand better the adaptability of the viruses, their pathogenic and persistence power, as well as the present and future design of the strategy for the prevention and control of the diseases they cause.
Key words: Evolution, mutations, recombinations, gene exchange / concepts; quasispecies /concepts and biological implications
Referencias bibliográficas
1. Gallo RC, Salahudding SZ, Papovic M, Shearer GM, Kaplan M, Haynes BF, et al: Frequent detection and isolation of cytopathic retrovirus (HTLV- III) from patients with AIDS and risk for AIDS. Science 1984;244:500-6.
2. Morse SS. Hantaviruses and the Hantavirus outbreak in the
3. Y Guan, JS Peiris, AS Lipatov, TM Ellis, KC Dyrting, S Krauss, et al: Emergence of multiple genotypes of H5N1 avian influenza viruses in Hong Kong SAR. PNA 2002;99(13):8950-5.
4. Webster RG. Influenza: an emergence disease. Emerg Infect Dis 1998;436-41.
5. Zhang NS, Zheng BJ, Li YM. Epidemiological and a etiological studies of patients with severe acute respiratory syndrome (SARS) from
6. Kilbourne ED. New viruses and new diseases: mutation, evolution and ecology. Curr Opin Immuno 1991;l3:518-21.
7. Guzmán MG, Kourí G, Pelegrino JL. Enfermedades virales emergentes. Rev Cubana Med Trop 2001;53(1):5-15.
8. De Filippis VR, Villareal LP. Virus evolution. En: Virology. Vol.1.
9. Holmes EC, Borch S. The causes and consequence of genetic variation in dengue virus. Trens Microbiol 2000;2:74-7.
10. Craig Scott, Thu HM, Lowry K, Wang XF, Holmes EC, Aaskou J. Diverse dengue type 2 virus populations centain recombinant and both parenteral virus in a single mosquito host. J Virol 2003;77:4463-7.
11. Wang WK, Lin SR, Lee CM, King CC, Chan SC. Dengue type 3 virus in plasma in a population of closely related genomes:quasispecies. J Virol 2002;76:4662-5.
12. Wittke VT, Robb HL, Jhu A, Nisalaks S, Nimmannitya S, Kalayanrooj DW, et al. Extinction and rapid emergence of strains of dengue 3 virus during an interepidemic period. Virol 2002;301:148-56.
13. Ball LA, Pringle CR, Flanagan B. Phenotypic consequences of rearranging the P, M, and G genes of vesicular stomatitis virus. J Virol 1999;73:4705-12.
14. Bean WJ, Schell M, Katz J, Kawaoka Y, Naeve C, Gorman O, et al. Evolution of the H3 influenza virus hemagglutinin from human nonhuman host. J Virol 1992;66:1129-38.
15. Kida H, Kawaoka Y, Naeve CW, Webster RG. Antigenic and genetic conservation of H3 influenza virus in wild ducks. Virology 1987;159:109-19.
16. Kida H, Ito Yasuda J, Shimizu Y, Itakura C, Shortridge KF, Kawaota Y, et al. Potential for transmission of avian influenza viruses to pigs. J Gen Virol 1994;75:2183-8.
17. Murphy B, Robert G. Orthomixoviruses: Influenza. In: Fields BN, Knipe DM, Howley P. Fields Virology. Vol 1. New York: Lippincott-Raven; 1996.
18. Fumarola A. Historia de las Pandemias de Gripe. PHATOS 1981;11(22):15-28.
19. Avian-Influenza. Disponible en: WWW.WHO.INT/mediacentre/avian-influenza. January 15, 2004.
20. Grannecchini S, Campitalli L, Calzoletti L, De Marco MA, Assi A, Donatelli I. Comparison of in vitro replication features of H7N3 influenza viruses from wild ducks and turkeys: Potential implications for interespecies transmission. J Gen Virol 2006;171-5.
21. Johnson PR, Spriggs MK, Olmsted RA, Collins PL. The G glycoprotein of human respiratory syncytial virus of subgroup A and B: Extensive sequence divergence between antigenically related proteins. Proc Natl Acad Sci
22. Sullender WM, Mufson MA, Anderson LJ, Wertz GW. Genetic diversity of the attachment protein of subgroup B respiratory syncytial viruses. J Virol 1991;65:5425-34.
23. Bass BL, Weintraub H, Cattaneo R, Billeter MA. Biased hypermutation of viral RNA genomes could be due to unwinding/modification of double-stranded RNA. Cell 1989;56:331.
24. Eigen M. Self organization of matter and evolution of biological macromolecules. Naturwisseschaften 1971;58:465-526.
25. Domingo E, Sabo D, Taginuchi T, Weissman C. Molecular bases of virus evolution. Cell 1978;13:735. Domingo E,
26. Marcus PI, Sekelliak MJ. Interferon induction by viruses.XV. Biological characteristics of interferon induction-supressing particles of C virus Hepatitis. J Interferon Res 1981;7:269-84.
27. Guzmán MG, Kourí G, Halstead SB. Do escape mutants. Explain rapid increases in dengue cases-fatallty rates within epidemics? Lancet 2000;355:1902-3.
28. Rodríguez-Roche R, Álvarez M, Gritsun T, Holmes EC, Halstead S, Kouri G, et al. Virus evolution during a severe dengue epidemia in Cuba, 1997. Virology 2005; 334(2):154-9.
29. Domingo E, Baranowski E, Nuñez JI, Ruiz-Jarabo CM, Sierra S, Molina N, et al. Cuasiespecies y evolución molecular de virus. Rev Sci Tech Off Int Epiz 2000;19(1):55-63.
30. Knopf CW. Evolution of viral DNA-dependent DNA polymerases. Virus genes 1998;16:47-58.
31. Domingo E, Davila M, Ortin J. Nucleotide sequence heterogeneity of the RNA from a natural population of foot-and-mouth-diseases. Virus 1980;1:333-46.
32. Novella I,
33. Chao I. Fitness of RNA virus decreased by Mullers ratchet. Nature1990;348.451-5.
34. Valdivia A, Chacón D, Goyenechea A, Savón C, Oropesa S, Sarmiento L, et al. Molecular characterization of an outbreak of respiratory syncytial virus (Subgroup A) in
35. Valdivia A, González G, Chacón D, Savón C, Otero A, Valdés O, et al. Antigenic and genetic characterization of twenty-six strains of human respiratory syncytial virus (Subgroup A) isolated during three consecutive outbreaks in
36. Valdés O, Martínez I, Valdivia A, Cancio R, Savón C, Goyenechea A, et al. Unusual antigenic and genetic characteristics of human respiratory syncytial viruses isolated in Cuba. J Virol. 1998;72:7589-92.
37. Arnedo-Valero M, Plana M, Mas A, Guila M, Gil C, Castro P, et al: Similar HIV-1 evolution and immunological responses al 10 years despite several therapeutic strategies and host HLA Types. J Med Virol 2004;4:495-01.
38. Pariente N, Pernas M, de la Rosa R, Gómez Mariano G, Fernando G, Rubio A, et al: Long-term suppression of plasma viremia with highly active antiretroviral therapy despite virus evolution and very limited selection of drug-resistant genotypes J Med Virol 2004;3:350-61.
39. Arias A, Agudo R, Ferrer Orta C, Pérez-Luque R, Airaksinen A, Bracchi E, et al: Mutant viral polymerase in the transition of virus to error catastrophe identifies a critical site for RNA binding. J Mol Biol 2005;3(5):1021-32.
40. González-López E, Gómez-MarianoG, Escarmis C, Domingo E. Invariant aphthovirus consensus nucleotide sequences in the transition to error catastrophe. Infect Genet Evol 2005,5(4):366-74.
41. Tapia N, Fernández G, Parera M, Gómez Marrero G, Cloter B, Quiñones Mateu M, et al. Combination of a mutagenic agent with a reverse transcriptase inhibitor results in systematic inhibition of HIV-1 infection. Virology 2005;38(1):1-8.
Recibido: 2 de marzo de 2006. Aprobado: 24 de junio de 2006.
Dra. Lucía Ayllón Valdés: Calle 19 No. 1015 Apto 10 entre 10 y 12. El Vedado. Ciudad de La Habana. Teléf.: 8339082. Correo electrónico: layllon@infomed.sld.cu