Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.27 n.1 Ciudad de la Habana ene.-mar. 2008
INVESTIGACIÓN
Evolución electrofisiológica de un grupo de pacientes con Polineuropatía Desmielinizante Inflamatoria Crónica primaria y secundaria
Electrophysiological evolution of a group of patients with primary and secondary CIPD
Aymeé Hernández Hernández
Departamento de Neurofisiología Clínica. Hospital Universitario Carlos J. Finlay. Cuba.
RESUMEN
Introducción: La Polineuropatía Desmielinizante Inflamatoria Crónica (CIDP) es tiene diferentes formas clínicas de presentación; la forma idiopática y la relacionada con enfermedades concurrentes. Los estudios neurofisiológicos juegan un papel determinante en el diagnóstico. Objetivos: Nos propusimos comparar la evolución electrofisiológica a través del análisis de las variables evaluadas a través del estudio de conducción nerviosa de un grupo de pacientes con CIDP primaria y secundaria en dos momentos evolutivos de la enfermedad. Metodos: Se estudiaron 9 pacientes con CIDP primaria 6 con CIDP relacionada con diabetes mellitus, esclerosis múltiple y adenocarcinoma. Se les realizó estudio de conducción nerviosa de los nervios de extremidades, en el momento del diagnóstico de la enfermedad y al año de tratamiento. Se compararon las variables electrofisiológicas en ambos momentos utilizando técnicas de estadística no paramétricas. Resultados: Los pacientes con CIDP primaria mostraron mejoría evolutiva de las variables electrofisiológicas, con normalización del estudio en dos casos. Mientras que en los pacientes con CIDP secundaria existió empeoramiento. Conclusiones: Concluimos que los pacientes con CIDP secundaria muestran una evolución electrofisiológica tórpida con pronóstico reservado.Palabras claves: CIDP primaria. CIDP secundaria. estudios neurofisiológicos. estudio de conducción nerviosa. evolución electrofisiológica. polirradiculopatía inflamatoria crónica.
SUMMARY
Introduction: Chronic Inflammatory Demyelinating Polyneuropathy (CIDP) has different forms of presentation; the idiopathic form and that related to concurrent diseases. The neurophysiological studies play a fundamental role in the diagnosis. Objetives: We proposed to compare the electrophysiological evolution by analyzing the variables evaluated through the nervous conduction study of a group of patients with primary and secondary CIDP at two evolutive moments of the disease. Methods: 9 patients with primary CIDP and 6 with CIDP related to diabetes mellitus, multiple sclerosis and adenocarcinoma were studied. A nervous conduction study of the nerves of the extremities was performed at the moment of the diagnosis of the disease and a year after treatment. The electrophysiological variables were compared in both moments by using nonparametric statistical techniques. Results: The patients with primary CIDP showed evolutive improvement of the electrophysiological variables with normalization of the study in two cases. Patients with secondary CIDP got worse. Conclusions: It was concluded that patients with secondary CIDP showed a torpid electrophysiological evolution with reserved prognosis.
Key words: Primary CIDP, secondary CIDP, neurophysiological studies, nervous conduction study, electrophysiological evolution, chronic inflammatory polyradiculopathy.
INTRODUCCIÓN
La Polineurorradiculopatía Desmielinizante Inflamatoria Crónica (CIDP por sus siglas en inglés) es una polineurorradiculopatía mixta predominantemente motora, desmielinizante, inflamatoria, de comienzo insidioso, evolución crónica y etiología autoinmune. Tiene una incidencia de 0.15 por 100 000 habitantes a nivel mundial, la prevalecía es de 1 a 1.9 por 100 000 habitantes a nivel mundial, con una mortalidad del 3%, dejando secuelas en el 60% de los casos, siendo el 20% de estas de tipo invalidantes. 1, 2
Puede aparecer a cualquier edad, aunque es más frecuente entre los 30 y los 50 años. Se han reportado casos con inicio en la infancia e incluso formas congénitas con remisión espontánea, aunque es poco frecuente. La proporción hombre /mujer es de 2:1.
El comienzo es insidioso con debilidad muscular simétrica, fundamentalmente proximal, calambres, parestesias, dolor en las extremidades con predominio de las inferiores por donde suelen comenzar los síntomas. Es infrecuente la toma de pares craneales, siendo el séptimo par el más afectado. Puede existir atrofia muscular, fasciculaciones, hay disminución o pérdida de los reflejos osteotendinosos, engrosamiento de nervios y temblor intencional.
Los estudios neurofisiológicos son uno de los pilares en el diagnóstico de la CIDP, específicamente el estudio de conducción nerviosa periférica (ECNP) y la onda F (OF), los cuales permiten:
1. Establecer el diagnóstico, incluso desde etapas subclínicas, la extensión del proceso.
2. Ayudan a esclarecer la forma de presentación de que se trata, fundamentalmente en ocasiones en que el cuadro clínico es poco florido.
3. Determinar el grado de compromiso mielínico y/o axonal del nervio, teniendo una idea más exacta de la intensidad de la lesión, lo que permite predecir la posible evolución y el pronóstico, así como la imposición del tratamiento lo más precozmente posible, tratando de lograr la máxima recuperación e incorporación del paciente a sus actividades habituales.
4. Ayudan a establecer el diagnóstico diferencial con otras enfermedades del sistema nervioso periférico, tales como enfermedad de motoneurona, de la unión neuromuscular, afecciones del músculo, etc. 3-10
Los criterios electrofisiológicos postulados por la Academia Americana de Neurología en 1991 son los siguientes:
• Velocidad de conducción nerviosa disminuida en al menos 2 nervios motores menor al 70-80% del límite inferior de normalidad.
• Latencia distal prolongada en 2 o más nervios mayor al 125-150% del limite superior de normalidad.
• Bloqueo parcial de conducción: aumento de la caída de amplitud pico-pico mayor al 20% con dispersión menor al 15% o dispersión temporal anormal en uno o más nervios (aumento de la caída de amplitud pico-pico mayor 20% con dispersión menor 15%).
• Alteración de la onda F: Ausencia o prolongación en 2 o más nervios mayor al 120-150% del limite superior de normalidad.
• Enlentecimiento de la velocidad de conducción nerviosa sensitiva menor al 80% del límite inferior de normalidad.
• Ausencia de reflejo H. 11
La CIDP puede ser idiopática, cuando no se relaciona con otras enfermedades o secundaria cuando se asocia a determinadas enfermedades como: Infección por virus de inmunodeficiencia humana (VIH), linfoma, mieloma osteoesclerótico, síndrome de Evans, ganmapatías monoclonales, hepatitis crónica activa, enfermedad inflamatoria intestinal, enfermedad del tejido conectivo, transplante de órganos y de médula ósea, desmielinización del sistema nervioso central (SNC), síndrome nefrótico, diabetes mellitus (DM), neuropatías hereditarias, tirotoxicosis, pénfigo vulgar, neoplasias, entre otras. 1, 2 ,12-14 Muchos han sido los estudios que derriben las características clínicas y algunos aspectos de la respuesta al tratamiento en los casos en que la CIDP se relaciona con otras enfermedades, pero en realidad han sido muy pocos los que se refieren a los aspectos neurofisiológicos de estos casos, así como a la intensidad de la afectación del nervio. 12-16 Estos aspectos han motivado la realización de nuestra investigación, ya que con ello se define la posible evolución y el pronóstico de los pacientes afectados con CIDP secundaria, que generalmente están destinado a un grado variable de incapacidad y de modificación de sus estilos de vida.
Objetivos
- Comparar la evolución electrofisiológica a través de ECNP de los pacientes con CIDP primaria y secundaria.
- Determinar la intensidad de afectación nerviosa a través del análisis de la afectación de las variables neurofisiológicas evaluadas a través del ECNP en ambas formas de presentación de la CIDP.
MATERIALES Y MÉTODOS
Se estudiaron 9 pacientes con CIDP primaria, de ellos 8 hombres y una mujer, con edades entre 20 y 69 años, con media de 37.4 años y un tiempo de evolución entre 2 meses y 6 años, para una media de 1.23 años; así como 6 pacientes con CIDP secundaria o relacionada con: diabetes mellitus, esclerosis múltiple y adenocarcinoma de vejiga, de ellos 4 hombres y 2 mujeres, con edades entre 30- 80 años, media 66.1 años, con tiempo de evolución entre 2 meses y 7 años, media 2.1 años.
A ellos se les realizó ECNP motora por tramos de los nervios mediano, cubital peroneo profundo y tibial posterior, así como estudio sensitivo de los nervios mediano, cubital y sural de forma bilateral en dos momentos: sin comenzar el tratamiento inmunosupresor y al año de tratamiento. Se estudiaron 18 nervios de pacientes con CIDP primaria y 12 de pacientes con CIDP secundaria. En esta evaluación utilizamos los parámetros técnicos convencionales para este tipo de estudios. 3-10
Las variables electrofisiológicas analizadas fueron: latencia, amplitud, velocidad de conducción nerviosa (VCN) y por ciento de caída de amplitud (CAM) en el estudio motor, así como: latencia, amplitud y VCN en el estudio sensitivo. 3-10
Para incluir los pacientes en el estudio se aplicaron los criterios clínicos, electrofisiológicos y anatomó-patológicos de la Academia Americana de Neurología de 1991. 11
Se comparó el estudio inicial (sin tratamiento) con el estudio al año de tratamiento en cada grupo de enfermedad y entre ellos, para el análisis estadístico se utilizaron métodos de estadística no paramétrica, entre ellos: los tests de Wilcoxon y la U- de Mann Whitney.
RESULTADOS
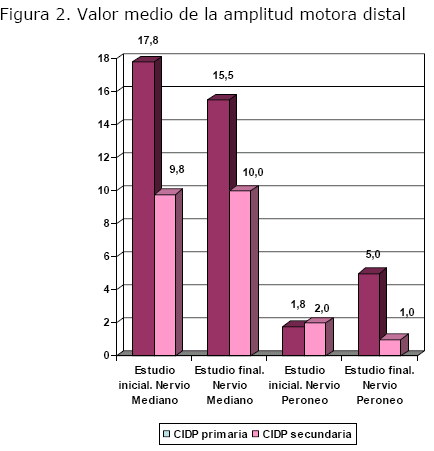
En el estudio motor de los pacientes con CIDP primaria existió mejoría evolutiva desde el punto de vista electrofisiológico del estudio final con respecto al inicial: las latencias de las respuestas motoras se acortaron (p=0.00) (figura 1), la amplitud aumentó (p=0.00) (figura 2), la VCN se hizo más rápida (p=0.00) y disminuyó la caída de amplitud o sea se recuperó el bloqueo (p=0.00).
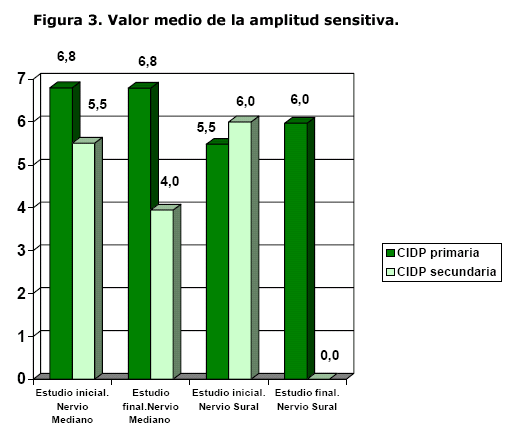
En el estudio sensitivo existió mejoría evolutiva: la latencia se acortó (p=0.00), la amplitud aumentó (p=0.00) (figura 3) y la VCN se hizo más rápida (p=0.00). Los estudios electrofisiológicos se normalizaron en 2 pacientes.
En el caso de los pacientes con CIDP secundaria en el estudio motor existió empeoramiento evolutivo: prolongación de la latencia (p=0.00) (figura 1), disminución de la amplitud (p=0.00) (figura 2), enlentecimiento de la VCN (p=0.00), mientras que la caída de amplitud disminuyó (p=0.00).
En el estudio sensitivo también existió empeoramiento: la latencia se prolongó (p=0.00), la amplitud disminuyó (p=0.00) (figura 3) y la VCN se hizo más lenta (p=0.00).
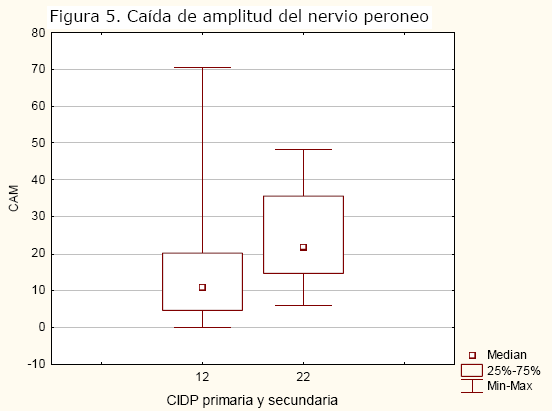
Al comparar evolutivamente los estudios motores de los pacientes con CIDP primaria y secundaria, los pacientes con CIDP secundaria presentaron mayor intensidad de afectación electrofisiológica: menor amplitud (p=0.00), VCN más lenta (p=0.00) (figura 4), mayor CAM (p=0.04). (figura 5).
El estudio sensitivo evolutivo del nervio mediano de los pacientes con CIDP secundaria presentó disminución de la amplitud de las respuestas (p=0.04). Mientras que no existió diferencias estadísticamente significativas para ninguna de las variables en el estudio del nervio sural.
DISCUSIÓN
Se observó diferencias estadísticamente significativas en los estudios electrofisiológicos de pacientes con CIDP primaria y secundaria; desde el punto de vista evolutivo los pacientes con CIDP primaria presentaron mejoría evolutiva de los estudios electrofisiológicos (menor latencia, recuperación de la amplitud, del bloqueo de conducción y de la VCN, tanto motora como sensitiva), mientras que los pacientes con CIDP secundaria presentaron empeoramiento evolutivo del ECN (prolongación de la latencia, disminución de la amplitud, enlentecimiento de la VCN, profundización del bloqueo de conducción). Lo que indica un daño mielínico progresivo que no mejora con el tratamiento inmunosupresor.
Hay pocos reportes de comparación de pacientes con CIDP primaria y secundaria, de ellos el mejor estudiado es el grupo de CIDP y DM. Cocito reportó nueve casos de CIDP asociada a DM a los cuales se le impuso tratamiento con inmunoglobulina humana, hubo mejoría clínica con poca mejoría electrofisiológica. 15 Gorson en su estudio de 14 pacientes con CIDP asociado a DM comparado con 60 pacientes con CIDP primaria plantea que clínicamente no hay diferencias evidentes pero que los pacientes con CIDP secundaria tienen mayor evidencia electrofisiológica e histopatológica de afectación axonal y menor respuesta al tratamiento inmunosupresor, las alteraciones electrofisiológicas observadas en dicho estudio, en los pacientes con CIDP asociado a DM fueron: menor amplitud de la respuesta motora del nervio cubital, mayor % de ausencia de respuesta sensitiva en el nervio sural, reflejando el efecto sobreimpuesto de la PNP diabética en los pacientes que desarrollan CIDP. El resto de la bibliografía consultada solo hace descripciones de casos con enfermedades asociadas a la CIDP, sin tocar las diferencias entre los estudios electrofisiológicos de estos pacientes con el de la CIDP clásica. 16 De hecho se conoce poco sobre el mecanismo de producción de la CIDP secundaria, quizás cuando este mecanismo se aclare pueda comprenderse mejor el efecto sobre las variables electrofisiológicas. En realidad no se conoce si el efecto de la enfermedad asociada se suma a las consecuencias de la CIDP clásica o si se trata de una entidad con fisiopatología diferente donde el ataque inmunológico pudiese estar dirigido a otros antígenos presentes en el SNP y esta reacción ser más intensa.
La CIDP con DM y la PNP diabética tienen algunas diferencias: La CIDP con DM tiene como tipicidad la presencia de bloqueo parcial de la conducción motora, así como otros signos de desmielinización primaria, en ella predomina la afección de fibras motora. Al ser una PNP desmielinizante predominantemente motora; estos signos no se observan en la PNP diabética que es una PNP axono-mielínica y predominantemente sensitiva en su forma más frecuente de aparición. En nuestros casos los pacientes con CIDP DM presentaron mayor intensidad de la lesión y pobre recuperación al año de tratamiento inmunosupresor. Se plantea que los efectos de la DM se añaden al efecto inmunológico de la CIDP sobre el nervio periférico. 14
La CIDP y la PNP paraneoplásica pudiesen confundirse, pero la última afecta tanto a fibras motoras como a sensitivas y presenta signos de daño axonal primario, hay otras formas de PNP paraneoplásica que afecta solo a las fibras sensitivas, siempre con signos de daño axonal primario. En ambas se postulan mecanismos inmunológicos para su desarrollo. 12,13
En los casos de CIDP primaria estudiada los hallazgos de los estudios neurofisiológicos se corresponden con lo planteado por otros autores. 17,18 Las diferencias observadas entre los estudios electrofisiológicos de pacientes con CIDP primaria y secundaria tiene gran relevancia en la práctica diaria ya que en presencia de un estudio con las alteraciones anteriormente descritas debe sospecharse la posibilidad de que la enfermedad polineuropática se asocie a otro tipo de afección. Los pacientes con CIDP secundaria tienen una evolución menos favorable, el pronóstico es reservado y la respuesta al tratamiento es menor. En teoría mientras no se resuelva la afección asociada hay elementos que hacen que la CIDP se mantenga a pesar del tratamiento.
Conclusiones
• Los pacientes con CIDP primaria tienen mejoría electrofisiológica con el tratamiento inmunosupresor adecuado con respecto a los pacientes con CIDP secundaria.
• Los pacientes con CIDP secundaria presentaron empeoramiento evolutivo indicando que persiste un daño mielínico a pesar del tratamiento inmunosupresor, lo cual pudiese estar en relación con la asociación con la enfermedad asociada a la CIDP.
REFERENCIAS BIBLIOGRÁFICAS
1. Pascual Pascual SL. Aspectos actuales de las neuropatías inflamatorias agudas y crónicas. Sindrome de Guillain-Barré y polineuritis crónica inflamatoria desmielinizante. Rev Neurol. 2002; 35 (3): 269-76.
2. Serradel AP. Neuropatías disinmunes adquiridas. Sintomatología clínica y clasificación. Rev Neurol 2000; 30(6): 501-14.
3. Gutiérrez Rivas E, Jiménez MD, Pardo J, Romer J, eds. Manual de Electromiografía Clínica. Barcelona, España: Prus Science, 2000.
4. Santos Anzorandia CM. El Abecé de la Electroneuromiografía clínica. La Habana : Ciencia Médicas, 2000.
5. Stalberg E, Falck B. Clinical motor nerve conduction studies. Methods in Clinical Neurophysiology 1993; 4: 61-80.
6. Oh SJ. Clinical Electromiography: Nerve conduction studies. 1ed. 1984; 22-80.
7. Albers J, Shields RW, Wimourn AJ. Sensory nerve conduction study workshop. Cleveland Clinical Foundation. Cleveland 1995; 1-19.
8. Aminoff MJ. Electrodiagnosis in Clinical Neurology. 3 ed. New York. Churchill, Livingstone, 1992: 283-327.
9. Binnie CD, Cooper R, Fowler CD, Prior PF. Clinical neurophysiology. EMG, nerve conduction and evoked potentials. 1ed. London: Hernemann LTD, 1996: 139-56.
10. Kimura J. Electrodiagnosis in diseases of nerve and muscle: Principles and Practice. Philadelphia, 1983.
11. Cornblath DR , Asbury AK , Albers JW. Ad hoc subcommittee of AAN AIDS task force: Research criteria for diagnosis of chronic inflammatory demyelinating polineuropathy. Neurology 1991; 41: 617-18.
12. Ramírez Moreno JM, González Dorrego F. Polirradiculoneuropatía desmielinizante inflamatoria crónica asociada a adenocarcinoma prostático. Rev Neurol 1999; 28 (4): 394-6.
13. Scherle Matamoros CE, Negrin Exposito A, Maya Entenza C, Gutierrez Gil J, Pérez Nallar J. Asociación entre la neuropatía desmielinizante inflamatoria crónica predominantemente de los brazos y el pénfigo vulgaris. Rev Neurol 2001; 33 (8): 796-7.
14. Negrín Expósito A, Scherle Matamoros CE, Maya Entenza C, Gutiérrez Gil J, Pérez Nellar J. Asociación entre CIDP y diabetes mellitus. Presentación de un caso. Rev Neurol 2001; 33 (12): 1197-1198.
15. Cocito D, Ciaramitaro P, Isoardo G, Barbero P, Migliaretti G, et. al. Intravenous immunoglobulin as first treatment in diabetics with concomitant distal symmetric axonal polyneuropathy and CIDP. J. Neurology 2002; 249 (6): 719-722.
16. Gorson KC, Romper AH, Adelman LS, Weinberg DH. Influence of diabetes mellitus on CIDP. Muscle Nerve 2000; 23: 37-43.
17. Cabrera Lima AV, Estrada R, Santiago Luis R, Alfaro I, González A, Galararga Inza J. Polineuropatía crónica desmielinizante inflamatoria: una contribución a la caracaterización de la enfermedad. Rev Neurol 1999; 28 (8): 772-8.
18. Cabrera Lima AV, Gutierrez J, Estrada R. Perfil electrofisiológico en la polineuropatía crónica desmielinizante inflamatoria. Rev Neurol 1999; 28 (4): 353-7.
Recibido: 8 de octubre del 2007.
Aprobado: 25 de octubre del 2007.
Dra. Aymeé Hernández Hernández. Hospital “Carlos J. Finlay”..Dirección: Ave: 43 #12228 (altos) e/ 122 A y 124. Marianao. Ciudad de la Habana. Cuba. Teléfono: (53-7)-261-06-59. E mail: babyhdez@infomed.sld.cu














